Факторы риска болезней системы кровообращения
1. Биологические (немодифицируемые) факторы:
Пожилой возраст, мужской пол, генетические факторы, способствующие возникновению дислипидемии, гипертензии, толерантности к глюкозе, сахарному диабету и ожирению
2. Анатомические, физиологические и метаболические особенности:
Артериальная гипертензия, дислипидемия, ожирение и характер распределения жира в организме, сахарный диабет
3. Поведенческие факторы:
Пищевые привычки, курение, двигательная активность, употребление алкоголя, подверженность стрессам. Наличие даже одного из факторов риска увеличивает смертность мужчин в возрасте 50-69 лет в 3,5 раза, а сочетанное действие нескольких факторов – в 5-7 раз.
По данным ВОЗ, наибольший вклад в риск внезапной смерти вносят три основных фактора риска: артериальная гипертензия, гиперхолестеринемия (дислипидемия) и курение.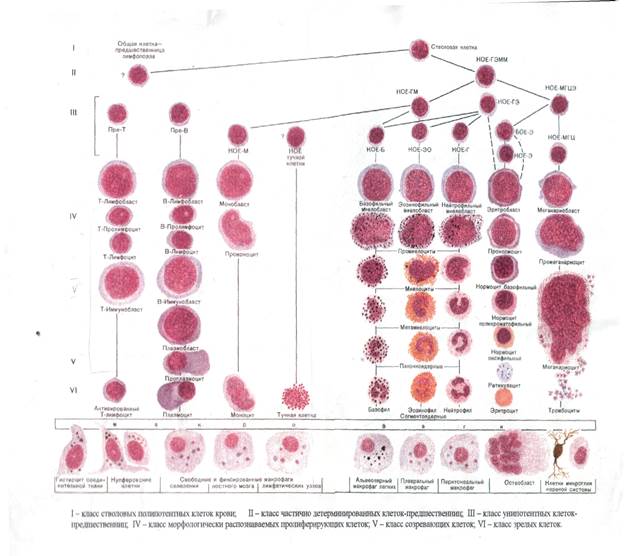
Артериальную гипертензию (АГ) часто называют «таинственным и молчаливым убийцей». Таинственным – потому, что в большинстве случаев причины развития заболевания остаются неизвестными, молчаливым – потому, что у многих больных заболевание протекает бессимптомно и они не знают о наличии у них повышенного артериального давления (АД), пока не разовьется какое-либо осложнение.
Дислипидемия — дисбаланс содержания в крови «плохих» и «хороших» жировых фракций в сторону увеличения «плохих» и/или снижения «хороших» жиров. К «плохим» жирам относятся холестерин, липиды низкой и очень низкой плотности, триглицериды.
К «хорошим» жирам, т.е. предотвращающим развитие БСК, относятся липиды высокой плотности. Уровень холестерина, как правило, связан с неправильным питанием. Рациональное питание – это сбалансированное, регулярное (не реже 4 раз в день) питание с ограничением потребления соли. Избыточная масса тела повышает риск развития болезней системы кровообращения и других заболеваний, связанных с атеросклерозом.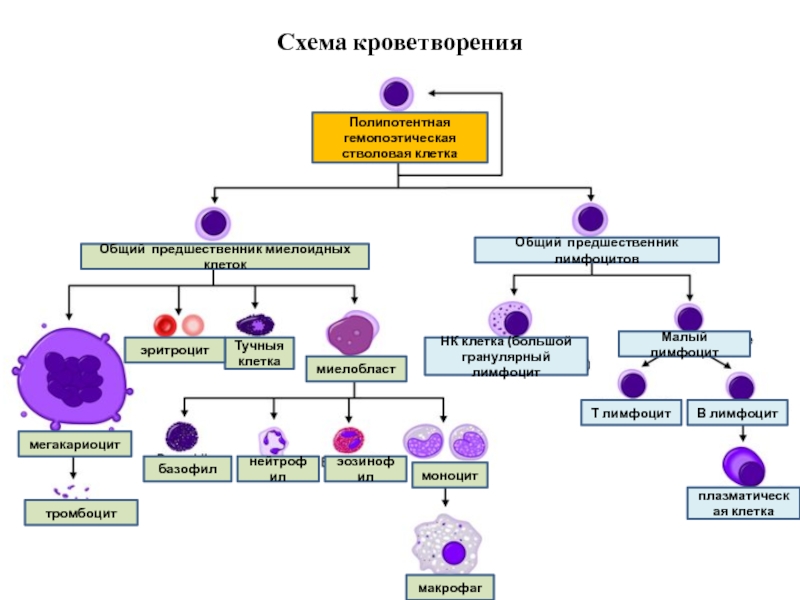 Для оценки своего веса используйте простую формулу определения индекса массы тела (вес (кг) /рост (м2 ) = индекс массы тела). Наиболее распространенными причинами избыточного веса являются переедание, диета с высоким содержанием жиров и углеводов, а также недостаточная физическая активность.
Для оценки своего веса используйте простую формулу определения индекса массы тела (вес (кг) /рост (м2 ) = индекс массы тела). Наиболее распространенными причинами избыточного веса являются переедание, диета с высоким содержанием жиров и углеводов, а также недостаточная физическая активность.
Курение – один из основных факторов риска. Одна сигарета повышает давление на 15 минут, а при постоянном курении повышается тонус сосудов, снижается эффективность лекарственных препаратов Внезапная смерть среди лиц, выкуривающих в течение дня пачку сигарет и больше, наблюдается в 5 раз чаще, чем среди некурящих. Среди бросивших курить риск возникновения ИБС значительно снижается и через 5 лет становится таким же, как и у тех, кто никогда не курил.
Низкая физическая активность способствует развитию БСК в 1,5-2 раза чаще, чем у людей, ведущих физически активный образ жизни. Для профилактики ССЗ и укрепления здоровья наиболее подходят физические упражнения, предусматривающие регулярные ритмические сокращения больших групп мышц: быстрая ходьба, бег трусцой, езда на велосипеде, плавание, ходьба на лыжах и др.
Комитетом Европейского общества кардиологов разработаны основные задачи профилактики БСК у здорового человека:
- систолическое артериальное давление ниже 140 мм рт.ст.
- отсутствие употребления табака — уровень общего холестерина ниже 5 ммоль/л
- ходьба по 3 км в день или 30 минут любой другой умеренной физической активности
- ежедневное использование не менее 5 штук фруктов и овощей
- избегать ожирения и сахарного диабета.
Диагностика заболеваний крови, гематологические исследования — Цены в Беларуси
Гематология – это раздел медицины, изучающий кровь, органы кроветворения и заболевания крови. К большому сожалению, процент заболеваний крови увеличился в последние годы.
Современные методы, применяемые в Республиканском центре гематологии и пересадки костного мозга, позволяют провести комплексное обследование пациентов, страдающих заболеваниями крови.
Поскольку кровь состоит из плазмы крови и форменных элементов крови, то заболевания крови могут быть вызваны: а) изменениями свойств плазмы крови; б) нарушением функции клеток крови, спровоцированных патологическим изменением их количества и/или строения. Очевидно, что заболевания крови крайне разнородны, поэтому их диагностика требует от врачей высокого профессионализма.
Методы диагностики заболеваний системы крови
Анализ информации о пациенте и развитии его болезни начинается со сбора анамнеза, а по сути – с общения врача с человеком, обратившимся за помощью.
Анамнез
Для постановки предварительного диагноза врачу необходимо расспросить пациента о жалобах на самочувствие, об образе жизни и перенесенных болезнях.
Наиболее часто при болезнях крови пациенты жалуются на слабость, нехватку воздуха, повышение температуры, потерю аппетита, неприятные ощущения в области головы и сердца. Это может сопровождаться бледностью кожи, обмороками, болями в костях, частыми инфекциями, отмечается кровоточивость, нарушение работы внутренних органов.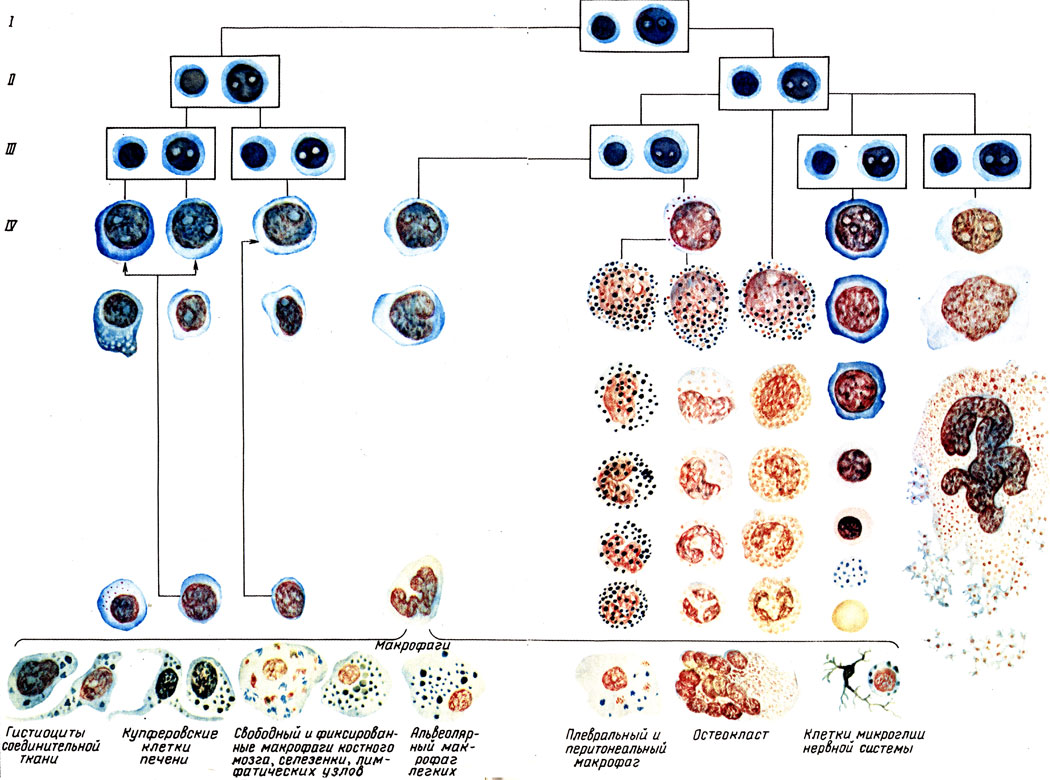 Врач также выясняет, есть ли отягощенная наследственность, какие препараты и методы лечения применялись прежде, интересуется характером питания, профессиональной деятельности и т. д. Осматривает кожу и слизистые оболочки. Осуществляет пальпацию лимфатических узлов, селезенки и печени.
Врач также выясняет, есть ли отягощенная наследственность, какие препараты и методы лечения применялись прежде, интересуется характером питания, профессиональной деятельности и т. д. Осматривает кожу и слизистые оболочки. Осуществляет пальпацию лимфатических узлов, селезенки и печени.
Гематологические исследования
Гематологические исследования – это наиболее точный метод диагностики заболеваний крови. Комплекс исследований, как правило, включает:
- Общий (или клинический) анализ крови, включая лейкоцитарную формулу Проводится забор венозной крови. Осуществляется количественный подсчет и описание морфологических особенностей форменных элементов крови: эритроцитов, лейкоцитов, тромбоцитов. Результаты исследования не могут быть сформулированы односложно. Но для пациента важно понимать, что от скрупулезности исследователя зависит точность диагноза, а, следовательно, и выбор схемы лечения. Поэтому трактовать результаты анализа могут лишь специалисты. А для примера укажем, что, допустим, низкий уровень эритроцитов (а, значит, и гемоглобина) часто указывает на развитие одного из видов анемий.

- Оценка гемолиза.
Это оценка локализации и причин разрушения эритроцитов. Различают физиологический гемолиз (норма) и патологический гемолиз, который характерен, например, для гемолитических анемий. - Оценка динамики свертывания крови
Это исследование всех фаз свертывания крови необходимо для уточнения причин кровотечений, а также для оценки способности крови к образованию сгустков – тромбов. - Миелограмма костного мозга
Под местной анестезией берется пункция костного мозга, мазок изучается под микроскопом. Оценивается состояние кроветворения, поражение костного мозга. Миелограмма позволяет выявить лейкозные инфильтраты, раковые метастазы и другие атипичные структуры.
Помимо названных гематологических исследований, могут быть назначены рентгенография, сцинтиграфия, компьютерная томография, УЗИ и др. виды исследований, которые помогут в диагностике заболеваний крови.
виды исследований, которые помогут в диагностике заболеваний крови.
Диагностика заболеваний крови в Беларуси
В Республиканском центре гематологии и пересадки костного мозга используется современная, высокоточная модель гематологического анализатора – это сложная аналитическая система, позволяющая свести к минимуму влияние человеческого фактора на результаты анализа. Она идеально подходит не только для скрининговых исследований, но и для динамического наблюдения за состоянием крови пациентов.
В нашем центре используются самые современные методы диагностики заболеваний крови:
- проточная цитофлуориметрия;
- цитогенетическое исследование клеток костного мозга с использованием FISH;
- молекулярно-генетические исследования.
Впрочем, необходимо подчеркнуть, что полностью заменить человека при гематологических исследованиях невозможно. Опытный врач лабораторной диагностики с помощью высококачественного микроскопа контролирует результаты исследований.
Витамин С (аскорбиновая кислота) выполняет в организме множество важных функций: участвует в окислительно-восстановительных процессах в тканях, повышает эластичность и прочность кровеносных сосудов, защищает организм от инфекций, блокирует токсичные вещества в крови, влияет на процессы заживления тканей организма, поврежденных в результате травм или болезней. Витамин С необходим также для укрепления зубов и десен. Даже при нормальном состоянии здоровья в различные дни содержание витамина С значительно варьируется. Присутствие
бактерий в организме, инфекционные заболевания, воспалительные и многие другие процессы снижают количество витамина С. Следует
учитывать, что организм не накапливает витамин С, поэтому его надо принимать регулярно. Витамином С богаты: шиповник сухой и свежий, перец сладкий красный и зеленый, петрушка, укроп, капуста цветная и белокочанная, щавель, шпинат, брюква, лук зеленый, горошек зеленый, помидоры, редис, картофель молодой, салат, капуста квашеная, кабачки, печень, апельсины, клубника, лимоны, смородина, рябина, дыня, мандарины, крыжовник, морошка, кизил, малина, вишня, айва, брусника, черешня, клюква. | Витамин А (ретинол) оказывает многостороннее действие на организм человека. Недостаточность витамина А ведет к нарушениям во многих
органах и системах, в основе которых лежит поражение кожи и слизистых оболочек — сухость, ороговение, предрасположенность
к гнойничковым процессам, фурункулезу, склонность к насморку, воспалительным процессам в гортани и трахее,
бронхитам, пневмонии, расстройства пищеварения, нарушение желудочной секреции, склонность к гастритам, колитам, к воспалению
почек, мочевого пузыря. Снижается устойчивость к инфекциям. Витамином А богаты: печень говяжья, свиная и тресковая, масло сливочное, яйца, икра кетовая, сметана и сливки 20%-й жирности, сыр, творог жирный, почки, палтус, шпроты (консервы), икра осетровых рыб. | Витамин В1 (тиамин) имеет важноe значение для процессов энергетического обмена и нервной регуляции Витамином В1 богаты: горох, фасоль, крупы овсяная, гречневая, ячневая, кукурузная, перловая, манная, пшено, горошек зеленый, хлеб из муки 2-го сорта, свинина мясная, печень говяжья и свиная, сардельки свиные, телятина, мясо кролика, ставрида, карп, хек, макароны, картофель, капуста цветная. Витамин В2 (рибофлавин) — обеспечивает
регенерацию (обновления) тканевых структур организма. Витамином В2 богаты: яйца, сыр, творог, кефир, говядина, свинина, мясо кролика, печень говяжья, мясо кур, колбасы вареные, крупы гречневая, горошек зеленый, шпинат, капуста цветная, лук зеленый, перец сладкий, укроп, молоко, сметана, крупа овсяная, хлеб из муки 2-го сорта, сельдь, треска, скумбрия хек, камбала. Витамин В6 (пиридоксин) очень важен для белкового и жирового обмена. Пиридоксин необходим также мышцам, так как вместе с кальцием способствует их нормальному функционированию и эффективному расслаблению. Витамином В6 богаты: печень, скумбрия,
фасоль, сухие пивные дрожжи, говядина, мясо кур, почки, телятина, свинина, баранина, яйца, икра, сельдь, палтус, кета, молоко,
сыр, хлеб из муки 2-го сорта, рис цельный, крупы гречневая, ячневая, перловая, пшено, кукуруза, соя, горох, картофель, лук
сухой, морковь, шпинат, салат, свекла, персики, груша, виноград. Витамин В12 (цианкобаламин) участвует в кроветворении, регулируют углеродный и жировой обмен в организме. Эти два витамина группы В обеспечивают высокую скорость развития, созревания и функциональную активность эритроцитарных клеток костного мозга. Поэтому гипо- и авитаминозы В12 и фолиевой кислоты характеризуются нарушением кроветворения (анемии), поражением нервной системы и пищеварительных органов. Витамином В12 богаты: печень говяжья, почки, сердце, говядина, сельдь, яйца. | Никотиновая кислота (витамин РР)
обеспечивает энергетический обмен в организме. При недостаточности никотиновой кислоты развивается пеллагра —
тяжелое заболевание, связанное с поражением центральной нервной системы, желудочно-кишечного тракта и кожи. Со стороны
центральной нервной системы отмечаются раздражительность, нарушение чувствительности кожных покровов, снижение двигательной
активности (адинамия), потеря устойчивости при ходьбе (атаксия), психозы и психическая депрессия. Никотиновой кислотой богаты: говяжья печень, почки, язык, мясо кур и кроликов, телятина, говядина, баранина, крупа рис, пшено, крупы гречневая, овсяная, кукурузная, манная, рис, пшено, макароны, кофе, сельдь, ставрида, хек, судак, морковь, хлеб пшеничный из муки высшего сорта. |
Плацента человека как источник гемопоэтических стволовых клеток
В настоящее время лишь часть пациентов, нуждающихся в трансплантации гемопоэтических стволовьх клеток, имеет возможность получить иммунологически совместимый материал. Источниками гемопоэтических стволовьх клеток являются костный мозг, периферическая и пуповинная кровь. Хотя гемопоэтические стволовые клетки пуповиной крови имеют много преимуществ, их количество в доступном объеме пуповинной крови недостаточно для трансплантации взрослому человеку. В данной работе мы сообщаем, что ткань зрелой плаценты человека содержит большое количество гемопоэтических стволовых клеток, которые не связаны непосредственно с кровообращением плода или матери. Количество этих гемопоэтических стволовых клеток в целой плаценте в 10 раз превышает их количество в доступном объеме пуповинной крови. Гемопоэтические стволовые клетки, полученные из свежей или криоконсер-вированной плаценты, дифференцируются в клетки эритроидного и миелоидного ростков как in vitro, так и in vivo при трансплантации иммунодефицитным мышам. Таким образом, криоконсервирован-ная плацента может служить потенциальным источником для замещения пула гемопопоэтических стволовых клеток у человека.
В данной работе мы сообщаем, что ткань зрелой плаценты человека содержит большое количество гемопоэтических стволовых клеток, которые не связаны непосредственно с кровообращением плода или матери. Количество этих гемопоэтических стволовых клеток в целой плаценте в 10 раз превышает их количество в доступном объеме пуповинной крови. Гемопоэтические стволовые клетки, полученные из свежей или криоконсер-вированной плаценты, дифференцируются в клетки эритроидного и миелоидного ростков как in vitro, так и in vivo при трансплантации иммунодефицитным мышам. Таким образом, криоконсервирован-ная плацента может служить потенциальным источником для замещения пула гемопопоэтических стволовых клеток у человека.
Введение
Плацента — провизорный орган, осуществляющий связь между организмом матери и плодом в процессе внутриутробного развития. Помимо выполнения известных фундаментальных функций, плацента млекопитающих представляет собой богатый резервуар гемопоэтических стволовых клеток (ГСК). В процессе онтогенеза происходит миграция очагов гемопоэза. К настоящему времени наиболее детально исследованы процессы плацентарного гемопоэза у мышей, который во многих отношениях может служить моделью кроветворения у человека.
У мыши эмбриональный гемопоэз начинается после гаст-руляции, когда группа специализированных мезодермальных клеток-предшественников (гемангиобластов) коммитируется на путь гемопоэза. Первые кроветворные предшественники мигрируют в стенку желточного мешка и инициируют продукцию эмбриональных «красных кровяных телец». Существуют данные, что дефинитивные ГСК, возможно, происходят из другой группы мезодермальных клеток [1]. Множество исследований свидетельствует о том, что мезенхима участка эмбриона, обозначаемого как «аорта-го-нады-мезонефрос» (АГМ), который ограничен дорзальной аортой и урогенитальными гребнями, является источником ГСК [2-5]. Дополнительно ГСК формируются в пуповинной и вителлиновой артериях [6]. Эти ГСК, вероятно, колонизируют развивающуюся печень, которая служит основным органом кроветворения уже в плодном периоде. Несмотря на прогресс в идентификации ГСК в зародышевых органах, до сих пор мало известно о происхождении различных пулов ГСК и их относительном вкладе в гемопоэз. Так, до 2003 года оставалось не выясненным, являются ли клетки АГМ единственным источником быстро растущего пула ГСК фетальной печени [7]. Новые перспективы в решении этого вопроса появились в связи с обнаружением в мышиной плаценте на средних сроках гестации многочисленных мульти-потентных клеток-предшественников и ГСК, что указывает на важную роль плаценты в становлении гемопоэза [8-10]. Еще в 70-е годы XX века было показано, что предшественники В-клеток появляются в плаценте мыши перед тем как попасть в печень [11]. Клетки, обладающие способностью генерировать В-лимфоциты, обнаруживались в плаценте на стадии Э9.5, их число достигало максимума на Э12.5 и затем снижалось, аналогичную кинетику демонстрировала и популяция ГСК [9]. Так, к концу внутриутробного развития количество ГСК в плаценте у мышей снижается, что, возможно, является отражением процесса миграции плацентарных ГСК в печень и другие развивающиеся кроветворные органы плода [тимус, селезенку и костный мозг). Накопленные данные позволяют предположить, что плацента может функционировать как орган лимфо- и миелопоэза.
Цель нашего исследования состояла в оценке человеческой плаценты как потенциально возможного источника ГСК в процессе естественного гемопоэза.
Материал и методы
Зрелые плаценты человека были получены в Госпитале Альта Бэйтс (Бэркли, Калифорния, США) с согласия доноров. Иммуногистохимические исследования тканей плаценты на присутствие CD34 и других маркеров ГСК -CD90, CD38, CD133 проводили на срезах с парафиновых блоков, методом иммунофлюоресценции после обработки протеиназой К. На первом этапе проводили перфузию плацент через артерии и вену пупочного канатика раствором антикоагулянта и сосудорасширяющего агента. Далее, для выделения клеток, в артериальное русло вводили 50 мл физиологического раствора на фосфатном буфере с антибиотиками [пенициллин, стрептомицин и фунгизон), протеазами (дис-паза (2,5 ед./мл), трипсин (0,5 мг/мл)) и ЭДТА. Образцы тканей плаценты измельчали и помещали в буфер с колла-геназой I (0,1%) и диспазой (2,5 ед./мл) на 30 мин при 37°C. Полученные таким образом образцы перемешивали и фильтровали через фильтр с размером пор 100 мкм в течение 5 мин.
Для получения мезенхимальных стволовых клеток (МСК), тканевый лизат центрифугировали при 400g в течение 1 5 мин., удаляли супернатант. Культивирование проводили в соответствии с ранее описанным протоколом [12].
Часть плацент криоконсервировали по следующей схеме. Плаценты промывали 250 мл буферного раствора (см. выше), затем проводили перфузию раствором смеси криоконсервантов (пропилен гликоль (15%), DMSO (14%), Formamide (14%) и др. в течение 40 мин. Затем плаценты замораживали в морозильной камере (-80°С) в течение 12 часов, после чего помещали в жидкий азот.
Количество CD34+ клеток в гомогенахы тканей определяли с помощью проточного цитофлюориметра FACScaliber (BD Bioscences, San Jose, CA) с использованием Procount Progenitor Cell Enumeration Kit (BD Bioscences). Выделяли CD34/CD45 положительную популяцию клеток. Жизнеспособность клеток определяли с помощью ядерно-цитоплазматического окрашивания To-Pro.
Дифференцировочный потенциал клеток оценивали с использованием полной среды MethoCult® на основе ме-тилцеллюлозы (Stem Cell Technologies, Canada). Присутствие клеток-инициаторов долговременно поддерживающихся культур определяли с использованием фидерного слоя из стромальных клеток плацентарного происхождения от того же донора. Для инактивации фидера культуру обрабатывали раствором митомицина С (10 мкг/мл) (Sigma, St.Louis, MO) в течение 2 часов.
В экспериментах с трансплантацией полученных клеток использовали иммунодефицитных мышей двух линий (Jaxon Laboratories, Bar Harbor, Maine): необлученных NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (JaxLab Cat. № 005557) и целиком облученных (2,5 Gy) NOD.Cg-Rag1tm1Mom Prf1tm1Sdz/Sz (JaxLab Cat. № 004848). Всем мышам внутрибрюшинно вводили 106 ядросодержащих клеток, выделенных из плацентарных тканей. Через 2-3 мес. после трансплантации животных выводили из опыта и производили иммуноокрашивание клеток крови, костного мозга и селезенки антителами к человеческим CD45 (общий лейкоцитарный маркер), CD3 (лимфоцитарный маркер), CD25 (лимфоцитарно/моноци-тарный маркер) и CD51/CD61 (маркеры тромбоцитов/ мегакариоцитов). Подсчет клеток проводили с помощью проточной цитометрии с использованием соответствующих негативных (мыши без трансплантации) и позитивных конт-ролей (человеческая кровь).
Результаты
В исследовании мы уделили основное внимание двум классическим маркерам человеческих ГСК: CD133 и CD34. Известно, что примитивные ГСК, гемопоэтические клетки-предшественники и гемангиобласты экспрессируют CD133. CD133+ клетки костного мозга эффективно заселяются в ткани иммунодефицитных мышей, и эта популяция CD133+ ГСК содержит предшественники гранулоцитов/макрофагов. Популяция CD133+ в костном мозге и крови коэкспрессирует CD34. У человека колониеформирующая активность характерна для популяции CD34+ клеток, которые способны к колонизации и репопуляции кроветворных органов иммуннодефицитных мышей. Популяция CD34+ клеток костного мозга содержит ГСК, которые поддерживают гемопоэз в течение всей жизни организма.
Иммуногистохимическое исследование тканей плаценты показало присутствие многочисленных кластеров CD34+ клеток, не связанных с микроциркуляторным руслом, локализованных в свободной соединительной ткани (рис. 1). Количество CD34+ клеток составляло 0,2±0,03% всех клеток плаценты, их общее число в среднем составляло 2,5х107 клеток на плаценту. Была отмечена колокализация CD34 и других классических маркеров ГСК — CD90, CD38, CD133 (см. рис. 1).
Сравнительный анализ пуповинной крови и препаратов, полученных после обработки плаценты протеолитическими ферментами, показал гораздо более высокий выход живых, CD45dimCD34+ клеток из плаценты. Общее количество ГСК, доступных в препарате плаценты, по сравнению с общим объемом пуповинной крови из этого же источника, было в среднем в 10-12 раз выше (см. рис. 1).
Иммуногистохимическое исследование также показало присутствие многочисленных кластеров CD133+ клеток, локализованных в свободной соединительной ткани (рис. 2). Cреди этих кластеров выявлялись очаги эритро-поза.
Гистологические и цитометрические данные свидетельствуют о том, что плацента является очень богатым источником CD34+ и CD133+ ГСК. Для того, чтобы убедиться в жизнеспособности и дифференцировке ГСК после обработки ткани протеиназами, мы оценили способность клеток к дифференцировке в клетки крови, используя стандартные тесты на колониеобразование, включая СFU-E, BFU-E, CFU-GM, CFU-GEMM, результаты сравнивались с такими же тестами в отношении ГСК пуповинной крови. Между числом колоний, образованных одинаковым количеством клеток плаценты или клеток пуповинной крови из той же плаценты, не было выявлено статистически значимой разницы. Клетки, растущие в MethoCult® в течение 14 дней, были позитивны в отношении гемоглобина, CD45, CD25, CD31 (маркера В-лимфоцитов, моноцитов и тромбоцитов), CD11b (маркера моноцитов и гранулоцитов) и CD69 (маркера макрофагов) (рис. 3).
Для того, чтобы показать присутствие среди первичных плацентарных клеток клеток-иниицирующих долговременную гемопоэтическую культуру, первичные плацентарные клетки культивировали в течение 6 нед. на фидерном слое из стромальных клеток, выделенных из тех же образцов плаценты. В этом случае ГСК активно дифференцировались в среде MethoCult®, что доказывало присутствие клеток-инициаторов долговременной культуры среди первичных плацентарных клеток.
У иммунодефицитных мышей NOD/SCID, получивших сублетальную дозу облучения, введение плацентарных CD34+ ГСК приводило к появлению в костном мозге, селезенке и периферической крови CD45+CD3+ лимфоцитов. Химеризм (присутствие человеческих клеток крови) достигал 9-12%, составляя в среднем 3±1%. Наблюдалось присутствие CD45+CD29+ клеток, а также CD45+CD51+/ CD69+ клеток.
Аналогичные исследования после криоконсервации плацент и хранения в течение 1-3 мес. показали сходные результаты. Удалось получить такое же количество жизнеспособных CD34+ клеток, сохранивших способность к дифференцировке.
Обсуждение
Полученные результаты показывают, что плацента человека содержит чрезвычайно большое количество гемопоэ-тических клеток-предшественников. Из плацентарных тканей человека можно получить большее количество CD34+ ГСК, чем из пуповинной крови. Эти клетки сохраняют свои способности к прогрессивной дифференцировке по пути лимфо- и миелопоэза после криоконсервации.
В некоторых исследованиях на мышах показано, что плацента в 2-4 раза богаче ГСК, чем даже фетальная печень [8, 13]. На стадии Э9 и Э10 в плаценте уже присутствовали ГСК, в то время как в печени их еще не было.
Особенностью плацентарных ГСК является быстрое увеличение их численности в период между Э11.5 и Э12.5 [9]. В результате чего в этот период содержание ГСК в плаценте более чем в 15 раз превышает численность ГСК в АГМ или в желточном мешке, что, возможно, говорит об уникальном кроветворном микроокружении, которое существует в плаценте. Увеличение пула ГСК в период Э11.5-Э12.5 было более выраженным, чем увеличение соответствующего пула клоногенных клеток-предшественников, что свидетельствует о том, что плацентарное микроокружение способствует поддержанию ГСК без одновременной дифференцировки в последующие кроветворные классы [9]. Количество гемо-поэтических клеток в плаценте на средних сроках гестации (соответствующих примерно 1-2 месяцам гестационного возраста человеческого эмбриона) во много раз превосходит их количество в зрелой плаценте, пуповинной крови и циркулирующей крови in toto. Данные результаты показывают, что плацента является ранее недооцененным источником ГСК.
В настоящее время основными источниками ГСК для трансплантации в клинической практике служат костный мозг, периферическая и пуповинная кровь. Но потребность в HLA-совместимых стволовых и прогениторных кроветворных клетках превышает возможность по их заготовке. Менее чем 30% потенциальных реципиентов имеют HLA-идентичных родственников, в связи с чем широко распространенной является пересадка аллогенных ГСК костного мозга, которая часто приводит к неблагоприятным реакциям со стороны иммунной системы. Кроме того, не следует забывать и о главном ограничении использования человеческой пуповинной крови для трансплантации — низкое содержание в ней ГСК, недостаточное для обеспечения адекватного восстановления гемопоэза у взрослых реципиентов [14].
Результаты нашей работы с очевидностью показывают, что криоконсервирование плаценты с помощью перфузии и последующего замораживания может являться альтернативным и эффективным способом сохранения аутогенных кроветворных стволовых клеток в количестве, достаточном для реконституции гемопоэза взрослых пациентов.
Роль минеральных веществ в обменных процессах и их влияние на здоровье человека
Минеральные вещества оказывают многообразное воздействие на жизнедеятельность организма. Они входят в состав ферментов и гормонов, участвуют во всех видах обмена веществ, активизируют действие витаминов, используются в качестве пластического материала в опорных тканях (костях, хрящах, зубах), участвуют в процессах кроветворения и свертывания крови, в регуляции вводно-солевого обмена, обеспечивают нормальное функционирование мышечной, сердечно-сосудистой и пищеварительной систем.
Минеральные вещества, встречающиеся в пищевых продуктах, можно разделить на две группы.
Макроэлементы — минеральные вещества, содержащиеся в пищевых продуктах в значительных количествах. Основными макроэлементами в продуктах питания человека являются кальций, фосфор, магний, натрий, хлор, калий, сера.
Микроэлементы — минеральные вещества, содержащиеся в пищевых продуктах в очень малых количествах. К ним относятся: железо, кобальт, медь, йод, фтор, цинк, марганец, бром, алюминий, силиций, хром, никель, литий и др.
Высокое содержание в продуктах кальция, калия и натрия определяет их щелочную ориентацию (молочные продукты, овощи, фрукты, ягоды, бобовые), а мясо, рыба, яйца, хлеб, крупы, содержащие фосфор, серу и хлор -кислую.
В зависимости от содержания минеральных веществ в организме человека и потребности в них также различают микроэлементы и макроэлементы. За исключением кальция, фосфора, железа и йода организм человека не располагает запасами минеральных элементов. Эти элементы незаменимы, так как не образуются в организме.
Каждый из минеральных элементов имеет определенное функциональное значение.
Макроэлементы
Кальций входит в состав минерального компонента костной ткани — оксиапатита, микрокристаллы которого образуют жесткую структуру костной ткани, выполняющей защитно-опорную функцию. Кальций придает стабильность клеточным мембранам — наружной оболочке клеток; обеспечивает прочность межклеточных связей. Кальций необходим для нормальной возбудимости нервной системы и сократимости мышц, является важнейшим компонентом свертывающей системы крови.
Всасывание кальция происходит в тонкой кишке с участием особых транспортных механизмов, обеспечивающих возможность его переноса из просвета кишечника в кровоток. При этом всасывание кальция зависит от обеспеченности организма витамином D, который необходим для нормального функционирования систем транспорта кальция в тонкой кишке.
Кальций относится к трудноусвояемым минеральным элементам, что обусловлено его содержанием в пищевых продуктах совместно с другими минеральными компонентами — фосфором, магнием, а также с белками и жирами. Всасыванию кальция способствуют белки пищи, лимонная кислота и лактоза (молочный сахар). К факторам, затрудняющим всасывание кальция и способным нарушить его утилизацию, относится избыточное содержание в пище фитиновой кислоты (ею богаты рожь, пшеница, овес и пищевые продукты, полученные из этих злаков), фосфатов (продукты с очень высоким содержанием фосфора: шоколад, икра, мясо, рыба морская), жиров, щавелевой кислоты (некоторые овощи, фрукты).
Основными источниками кальция являются молоко и молочные продукты, яичные желтки, овощи, фрукты.
Фосфор участвует в построении всех клеточных элементов организма человека, особенно костной и мозговой тканей, участвует в процессах обмена белков, жиров и углеводов. Фосфор незаменим в деятельности мозга, скелетной и сердечной мускулатуры, в образовании ряда гормонов и ферментов.
Основными источниками фосфора служат молочные продукты, особенно сыры, а также яйца, рыба, мясо, бобовые.
Магний принимает участие в процессах углеводного, белкового и фосфорного обмена. Соединения магния обладают антиспастическими и сосудорасширяющими свойствами, понижают возбудимость центральной нервной системы, а также усиливают желчеотделение и моторную деятельность кишечника.
Основными источниками магния в питании являются хлеб (особенно грубого помола), крупы, бобовые.
Натрий необходим для протекания процессов внутриклеточного и межклеточного обмена, для обеспечения электролитного и кислотно-щелочного равновесия. Известно, что увеличение содержания в пище хлористого натрия (поваренной соли) ведет к задержке воды в организме и отекам. Пищевые продукты, особенно растительные, бедны натрием. Поступление натрия в организм в основном осуществляется за счет поваренной соли, добавляемой к пище.
Хлор играет важную роль в жизнедеятельности человеческого организма, особенно в регуляции водного обмена. Хлориды являются источником образования железами желудка соляной кислоты. В пищевых продуктах, особенно растительных, хлор содержится в незначительных количествах. У человека потребность в хлоридах удовлетворяется в основном за счет поваренной соли, добавляемой к пище.
Калий участвует в ферментативных процессах организма. Калий является преимущественно внутриклеточным ионом. Взаимодействие его с внеклеточными ионами натрия имеет большое значение в регуляции водного обмена. Организм очень чувствителен к уменьшению концентрации калия в крови (гипокалиемия). Оно вызывает сонливость, мышечную слабость, потерю аппетита, тошноту, рвоту, уменьшение мочеотделения, расширение сердца, нарушение сердечного ритма, снижение кровяного давления и другие изменения. Источником калия в пище являются в основном продукты растительного происхождения: хлеб, бобовые, картофель, капуста, морковь, фрукты. Максимальное содержание калия — в кондитерских изделиях, какао, миндале, земляных орехах (арахисе), изюме, кураге, черносливе.
Сера входит в состав некоторых аминокислот — основного структурного материала для синтеза белков, ферментов, гормонов (инсулина), витаминов (В1). Она играет важную роль в процессах окисления и восстановления, а также в обезвреживании токсических продуктов обмена путем образования с ними в печени неядовитых химических соединений. Источником серы в пище служат мясо, рыба, сыры, яйца, бобовые, хлеб, крупы.
Микроэлементы
Железо является составной частью гемоглобина, сложных железо-белковых комплексов и ряда ферментов, усиливающих процессы дыхания в клетках. Железо стимулирует кроветворение.
Основным источником железа служат зерновые продукты, бобовые, яйца, творог, печень. В овощах, фруктах, ягодах железа сравнительно мало, но они служат ценным источником этого минерала, так как содержащееся в них железо легко усваивается организмом человека.
Всасыванию железа из пищевых продуктов способствуют лимонная и аскорбиновая кислоты и фруктоза, которые содержатся во фруктах, ягодах, соках. Так, при питье фруктового сока увеличивается усвоение железа из яиц и хлеба. В зерновых и бобовых продуктах и некоторых овощах содержатся фосфаты, фитины и щавелевая кислота, препятствующие всасыванию железа. При добавлении мяса или рыбы к этим продуктам усвоение железа улучшается, при добавлении молочных продуктов — не меняется, при добавлении яиц — ухудшается. Подавляет усвоение железа крепкий чай.
Кобальт — неизменная составляющая растительных и животных организмов. Он оказывает существенное влияние на процессы кроветворения. Это воздействие кобальта наиболее ярко выражено при достаточно высоком содержании в организме железа и меди. Кобальт активирует ряд ферментов, усиливает синтез белков, участвует в выработке витамина В12 и в образовании инсулина. Содержание кобальта в различных пищевых продуктах незначительно. Однако обычно смешанные пищевые рационы вполне удовлетворяют потребность организма в кобальте. Кобальт содержится в незначительных количествах в мясе, рыбе, яйцах, молочных продуктах, картофеле, воде. Более богаты кобальтом печень, почки, свекла, горох, земляника, клубника.
Медь входит в состав окислительных ферментов, участвующих в тканевом дыхании, в обмене белков, жиров и углеводов. Она влияет на функциональное состояние печени, щитовидной и других эндокринных желез, на иммунные процессы.
Йод участвует в образовании гормона щитовидной железы — тироксина. При недостаточном поступлении в организм йода нарушаются функции щитовидной железы, а впоследствии меняется и ее структура — вплоть до развития так называемого эндемического зоба. В организм йод поступает с пищей, водой и воздухом, однако он присутствует в них в очень небольших количествах. Больше всего йода содержится в морской воде, в растительных и животных продуктах моря.
Фтор – участвует в костеобразовании, формировании твердых тканей зубов и зубной эмали. Фтор поступает в организм человека в основном с питьевой водой. Оптимальной концентрацией фтора в питьевой воде является 0,5-1,2 мг на литр. При значительном снижении его уровня в воде (менее 0,5 мг на литр) развиваются явления недостаточности фтора, выражающиеся в резком учащении заболеваний зубным кариесом. В целях профилактики в соответствующих случаях фторирование питьевой воды с доведением содержания в ней фтора до 0,7-1,2мг на литр.
Цинк содержится во всех органах и тканях человека. Наибольшая его концентрация выявлена в клетках поджелудочной железы, вырабатывающих гормон инсулин. Цинк участвует также в жировом, белковом и витаминном обмене, в процессах кроветворения и синтезе ряда гормонов.
Обычный набор пищевых продуктов, включающий достаточное количество овощей, фруктов, хлеба и молока, удовлетворяет потребности организма человека во всех необходимых ему минеральных веществах.
Органы кроветворения и иммунной защиты (часть 1)
Слушать (7 122 Кб):
Часть первая – общая характеристика, классификация; красный костный мозг
К системе органов кроветворения и иммунной защиты относят красный костный мозг, тимус (вилочковая железа), селезенку, лимфатические узлы, а также лимфатические узелки в составе слизистых оболочек (например, пищеварительного тракта — миндалины, лимфатические узелки кишечника, и других органов). Это совокупность органов, поддерживающих гомеостаз системы крови и иммунокомпетентных клеток.
Различают центральные и периферические органы кроветворения и иммунной защиты.
К центральным органам кроветворения и иммунной защиты у человека относятся красный костный мозг и тимус. В красном костном мозге образуются эритроциты, тромбоциты, гранулоциты и предшественники лимфоцитов. Тимус — центральный орган лимфопоэза.
В периферических кроветворных органах (селезенка, лимфатические узлы, гемолимфатические узлы) происходят размножение приносимых сюда из центральных органов Т- и В-лимфоцитов и специализация их под влиянием антигенов в эффекторные клетки, осуществляющие иммунную защиту, и клетки памяти (КП). Кроме того, здесь погибают клетки крови, завершившие свой жизненный цикл.
Органы кроветворения функционируют содружественно и обеспечивают поддержание морфологического состава крови и иммунного гомеостаза в организме. Координация и регуляция деятельности всех органов кроветворения осуществляются посредством гуморальных и нервных факторов организма, а также внутриорганных влияний, обусловленных микроокружением.
Несмотря на различия в специализации органов гемопоэза, все они имеют сходные структурно-функциональные признаки. В основе большинства их лежит ретикулярная соединительная ткань, которая образует строму органов и выполняет роль специфического микроокружения для развивающихся гемопоэтических клеток и лимфоцитов. В этих органах происходят размножение кроветворных клеток, временное депонирование крови или лимфы. Кроветворные органы благодаря наличию в них специальных фагоцитирующих и иммунокомпетентных клеток осуществляют также защитную функцию и способны очищать кровь или лимфу от инородных частиц, бактерий и остатков погибших клеток.
Костный мозг
Костный мозг (medulla osseum, bone marrow) — центральный кроветворный орган, в котором находится самоподдерживающаяся популяция стволовых кроветворных клеток (СКК) и образуются клетки как миелоидного, так и лимфоидного ряда.
Развитие
Костный мозг у человека появляется впервые на 2-м месяце внутриутробного периода в ключице эмбриона, затем на 3-4 -м месяце он образуется в развивающихся плоских костях, а также в трубчатых костях конечностей — лопатках, тазовых костях, затылочной кости, ребрах, грудине, костях основания черепа и позвонках, а в начале 4-го месяца развивается также в трубчатых костях конечностей. До 11-й недели это остеобластический костный мозг, который выполняет остеогенную функцию. В данный период костный мозг накапливает стволовые клетки, а клетки стромы с остеогенными потенциями создают микросреду, необходимую для дифференцировки стволовых кроветворных клеток. У 12—14-недельного эмбриона человека происходят развитие и дифференцировка вокруг кровеносных сосудов гемопоэтических клеток. У 20—28-недельного плода человека в связи с интенсивным разрастанием костного мозга отмечается усиленная резорбция костных перекладин остеокластами, в результате чего образуется костномозговой канал, а красный костный мозг получает возможность расти в направлении эпифизов. К этому времени костный мозг начинает функционировать как основной кроветворный орган, причем большая часть образующихся в нем клеток относится к эритроидному ряду гемопоэза.
У зародыша 36 нед развития в костном мозге диафиза трубчатых костей обнаруживаются жировые клетки. Одновременно появляются очаги кроветворения в эпифизах.
Строение
Во взрослом организме человека различают красный и желтый костный мозг.
Красный костный мозг
Красный костный мозг (medulla ossium rubra) является кроветворной частью костного мозга. Он заполняет губчатое вещество плоских и трубчатых костей и во взрослом организме составляет в среднем около 4 – 5% общей массы тела. Красный костный мозг имеет темно-красный цвет и полужидкую консистенцию, что позволяет легко приготовить из него тонкие мазки на стекле. Он содержит стволовые кроветворные клетки (СКК) и диффероны гемопоэтических клеток эритроидного, гранулоцитарного и мегакариоцитарного ряда, а также предшественники В- и Т-лимфоцитов. Стромой костного мозга является ретикулярная соединительная ткань, образующая микроокружение для кроветворных клеток. В настоящее время к элементам микроокружения относят также остеогенные, жировые, адвентициальные, эндотелиальные клетки и макрофаги.
Ретикулярные клетки благодаря своей отростчатой форме выполняют механическую функцию, секретируют компоненты основного вещества — преколлаген, гликозаминогликаны, проэластин и микрофибриллярный белок и участвуют в создании кроветворного микроокружения, специфического для определенных направлений развивающихся гемопоэтических клеток, выделяя ростовые факторы.
Остеогенными клетками называют стволовые клетки опорных тканей, остеобласты и их предшественники. Остеогенные клетки входят в состав эндоста и могут быть в костномозговых полостях. Остеогенные клетки также способны вырабатывать ростовые факторы, индуцировать родоначальные гемопоэтические клетки в местах своего расположения к пролиферации и дифференцировке. Наиболее интенсивно кроветворение происходит вблизи эндоста, где концентрация стволовых клеток примерно в 3 раза больше, чем в центре костномозговой полости.
Адипоциты (жировые клетки) являются постоянными элементами костного мозга.
Адвентициальные клетки сопровождают кровеносные сосуды и покрывают более 50% наружной поверхности синусоидных капилляров. Под влиянием гемопоэтинов (эритропоэтин) и других факторов они способны сокращаться, что способствует миграции клеток в кровоток.
Эндотелиальные клетки сосудов костного мозга принимают участие в организации стромы и процессов кроветворения, синтезируют коллаген IV типа, гемопоэтины. Эндотелиоциты, образующие стенки синусоидных капилляров, непосредственно контактируют с гемопоэтическими и стромальными клетками благодаря прерывистой базальной мембране. Эндотелиоциты способны к сократительным движениям, которые способствуют выталкиванию клеток крови в синусоидные капилляры. После прохождения клеток в кровоток поры в эндотелии закрываются. Эндотелиоциты выделяют колониестимулирующие факторы (КСФ) и белок фибронектин, обеспечивающий прилипание клеток друг к другу и субстрату.
Макрофаги в костном мозге представлены неоднородными по структуре и функциональным свойствам клетками, но всегда богатыми лизосомами и фагосомами. Некоторые из популяций макрофагов секретируют ряд биологически активных веществ (эритропоэтин, колониестимулирующие факторы, интерлейкины, простагландины, интерферон и др.). Макрофаги при помощи своих отростков, проникающих через стенки синусов, улавливают из кровотока железосодержащее соединение (трансферрин) и далее передают его развивающимся эритроидным клеткам для построения геминовой части гемоглобина.
Межклеточное вещество — В костном мозге это вещество содержит коллаген II, III и IV типа, гликопротеины, протеогликаны и др.
Гемопоэтические клетки или кроветворные диффероны составляют паренхиму красного костного мозга.
Рассмотрим подребнее образование эритроцитов, гранулоцитов и тромбоцитов в красном костном мозге.
Эритроцитопоэз
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эритробластических островков.
Эритробластический островок состоит из макрофага, окруженного эритроидными клетками.
Эритроидные клетки развиваются из колониеобразующей эритроидной клетки (КОЕ-Э), вступившей в контакт с макрофагом костного мозга. КОЕэ и образующиеся из нее клетки — от проэритробласта до ретикулоцита — удерживаются в контакте с макрофагом его рецепторами — сиалоадгезинами.
Макрофаги служат своего рода «кормильцами» для эритробластов, способствуют накоплению в непосредственной близости от эритробластов и поступлению в них эритропоэтина, витаминов кроветворения (витамина D3), молекул ферритина. Макрофаги островков фагоцитируют ядра, вытолкнутые эритробластами при их созревании и способны повторно присоединять КОЕэ и формировать вокруг себя новый очаг эритропоэза.
По мере созревания эритробласты отделяются от островков и после удаления ядра (энуклеации) проникают через стенку венозных синусов в кровоток. Стенки синусов состоят из эндотелиальных уплощенных клеток, пронизанных щелевидными отверстиями, или порами, в которые проникают форменные элементы крови и плазма. Среди эндотелиальных клеток есть фиксированные макрофаги.
Гранулоцитопоэз
Гранулоцитопоэтические клетки также образуют островки, главным образом по периферии костномозговой полости. Незрелые клетки гранулоцитарных рядов окружены протеогликанами. В процессе созревания гранулоциты депонируются в красном костном мозге, где их насчитывается примерно в 3 раза больше, чем эритроцитов, и в 20 раз больше, чем гранулоцитов в периферической крови.
Тромбоцитопоэз
«Гиганты красного костного мозга дают карликов крови» — Мегакариобласты и мегакариоциты располагаются в тесном контакте с синусами так, что периферическая часть их цитоплазмы проникает в просвет сосуда через поры. Отделение фрагментов цитоплазмы в виде тромбоцитов (кровяных пластинок) происходит непосредственно в кровяное русло.
Лимфоцитопоэз и моноцитопоэз
Среди островков клеток миелоидного ряда встречаются небольшие скопления костномозговых лимфоцитов и моноцитов, которые окружают кровеносный сосуд.
В обычных физиологических условиях через стенку синусов костного мозга проникают лишь созревшие форменные элементы крови. Миелоциты и эритробласты попадают в кровь только при патологических состояниях организма. Причины такой избирательной проницаемости стенки сосудов остаются недостаточно ясными, но факт проникновения незрелых клеток в кровяное русло всегда служит верным признаком расстройства костномозгового кроветворения.
Желтый костный мозг
Желтый костный мозг (medulla ossium flava) у взрослых находится в диафизах трубчатых костей. В его составе находятся многочисленные жировые клетки (адипоциты).
Благодаря наличию в жировых клетках пигментов типа липохромов костный мозг в диафизах имеет желтый цвет, что и определяет его название. В обычных условиях желтый костный мозг не осуществляет кроветворной функции, но в случае больших кровопотерь или при некоторых патологических состояниях организма в нем появляются очаги миелопоэза за счет дифференцировки приносимых сюда с кровью стволовых и полустволовых клеток крови.
Резкой границы между желтым и красным костным мозгом не существует. Небольшое количество адипоцитов постоянно встречается и в красном костном мозге. Соотношение желтого и красного костного мозга может меняться в зависимости от возраста, условий питания, нервных, эндокринных и других факторов.
Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
Васкуляризация. Костный мозг снабжается кровью посредством сосудов, проникающих через надкостницу в специальные отверстия в компактном веществе кости. Войдя в костный мозг, артерии разветвляются на восходящую и нисходящую ветви, от которых радиально отходят артериолы. Сначала они переходят в узкие капилляры (2—4 мкм), а затем в области эндоста продолжаются в широкие тонкостенные с щелевидными порами синусы (диаметром 10—14 мкм). Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиальном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере контакта с костной тканью кровь обогащается минеральными солями и регуляторами кроветворения.
Кровеносные сосуды составляют половину (50%) массы костного мозга, из них 30% приходится на синусы. В костном мозге разных костей человека артерии имеют толстую среднюю и адвентициальную оболочки, многочисленные тонкостенные вены, причем артерии и вены редко идут вместе, чаще врозь. Капилляры бывают двух типов: узкие 6—20 мкм и широкие синусоидные (или синусы) диаметром 200—500 мкм. Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране.
Иннервация. В иннервации участвуют нервы сосудистых сплетений, нервы мышц и специальные нервные проводники к костному мозгу. Нервы проникают в костный мозг вместе с кровеносными сосудами через костные каналы. Далее покидают их и продолжаются как самостоятельные веточки в паренхиме в пределах ячеек губчатого вещества кости. Они ветвятся на тонкие волоконца, которые либо вновь вступают в контакт с костномозговыми сосудами и оканчиваются на их стенках, либо заканчиваются свободно среди клеток костного мозга.
Возрастные изменения. Красный костный мозг в детском возрасте заполняет эпифизы и диафизы трубчатых костей и находится в губчатом веществе плоских костей. Примерно в 12—18 лет красный костный мозг в диафизах замещается желтым. В старческом возрасте костный мозг (желтый и красный) приобретает слизистую консистенцию и тогда называется желатинозным костным мозгом. Следует отметить, что этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Регенерация. Красный костный мозг обладает высокой физиологической и репаративной регенерационной способностью. Источником образования гемопоэтических клеток являются стволовые клетки, находящиеся в тесном взаимодействии с ретикулярной стромальной тканью. Скорость регенерации костного мозга в значительной мере связана с микроокружением и специальными ростстимулирующими факторами гемопоэза.
Некоторые термины из практической медицины:
- миелограмма (миело- + греч. gramma запись) — выраженный в форме таблицы или диаграммы результат микроскопии мазка пунктата костного мозга, отражающий качественный и количественный состав ядросодержащих клеток миелоидной ткани.;
- миелоидная реакция (миело- + греч. —eides подобный) — появление в периферической крови малодифференцированных клеток, относящихся к грануло- и эритропоэтическому ряду; наблюдается при метастазах злокачественной опухоли в костный мозг, а также при сепсисе, туберкулезе и некоторых других болезнях;
- остеомиелит (osteomyelitis; остео- + греч. myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
Лечение Рака Крови в Израиле — Виды и Способоы Лечения
«Рак крови» — термин, которым часто называют сразу несколько онкологических заболеваний систем кроветворения и кровоснабжения. Существует множество видов рака крови, от разновидности которых зависят симптомы и особенности терапии.
Лечение рака крови в Тель-Авивском медицинском центре Сураски (Ихилов) у детей и взрослых проходит в отделении гематоонкологии. В клинике осуществляют самые современные схемы лечения, которые включают, в том числе, трансплантацию костного мозга, щадящее радиационное лечение, биологическую терапию и другие виды лечения.
Лечение рака крови в Израиле. Особенности и преимущества
Химиотерапия. При различных разновидностях «рака крови» химиотерапия является оптимальным способом лечения. Препараты и схемы лечения всегда подбираются индивидуально в зависимости от возраста и состояния пациента. Химиотерапия может проходить различными способами. Например, доктора могут назначить введение препарата непосредственно в спинномозговую жидкость.
Пересадка костного мозга Для успешного восстановления пациента после лечения, израильские доктора нередко прибегают к пересадке костного мозга. Так организм больного быстрее начинает производить здоровые клетки крови. Иногда пациентам трансплантируют собственные клетки, которые были сохранены до начала лечения. В других случаях предоставить свои клетки может однояйцевый близнец человека с «раком крови» или максимально подходящий донор из базы. Клиника оборудована уникальными стерильными боксами со специальной системой очистки воздуха, которые необходимы больным после трансплантации.
Радиотерапия. Воздействие на патологические клетки радиоактивным излучением помогает бороться с различными типами «рака крови». Медицинский центр Сураски (Ихилов) оборудован современными линейными ускорителями, которые воздействуют на опухоль, а не на весь организм. При этом количество и длительность сеансов подбирается строго индивидуально, а аппараты реагируют на дыхание и движение тела человека.
Таргетная (целевая) терапия. Израильские врачи предлагают пациенту специальные препараты, которые воздействуют только на раковые клетки. Подобное лечение помогает бороться с болезнью и не наносит вреда организму.
Прогноз при «раке крови»
Лечение рака крови в Израиле дает высокие шансы на длительную ремиссию или полное выздоровление. В Тель-Авивском медицинском центре Сураски (Ихилов) опытные врачи предлагают терапию с использованием новейших медицинских разработок. При этом схема лечения всегда подбирается индивидуально.
Обратиться в отдел медицинского туризма больницы Ихилов можно несколькими способами: отправив заявку на почту [email protected] или оставить заявку на официальном сайте больницы Ихилов. После получения заявки врачи больницы проведут ревизию результатов диагностических исследований, проведенных на родине, и в течении 24, максимум 48 часов, дадут ответ, можем ли мы помочь пациенту в условиях пандемии и предоставят предварительный прайс-лист, чтобы заранее понимать стоимость обследования/лечения.
Это позволяет избежать ненужных проверок по приезде, а также существенно экономит время и деньги пациента, прибывшего на лечение.
[Ранний онтогенез кроветворной системы человека]
Иммуногистохимия использовалась для обнаружения маркеров сосудистых, стромальных и гематопоэтических клеточных компартментов у человеческого эмбриона и раннего плода на сроках от 3 до 15 недель беременности. Экспрессия CD34 постоянно наблюдалась на поверхности сосудистых эндотелиальных клеток с самых ранних тестируемых стадий, за единственным исключением кровеносных сосудов эмбриональной печени. Кроветворение желточного мешка было очень преходящим и ограничивалось примитивным эритропоэзом.Кластеры эритробластов, моноцитов и гранулоцитов появились на сроке от 4 до 5 недель беременности в зачатке печени. Раннее развитие костного мозга было отмечено быстрой инвазией, на 8 неделе, в хрящевые зачатки длинных костей предшественниками остеокластов CD68 +, эндотелиальными клетками CD34 + и преостеобластами, что привело к развитию крупных сосудистых синусов между окостеневшими трабекулами. Эндогенный эритро- и гранулопоэз развивался с 11-й недели у первичных ложек, всегда организованных вокруг артериолы, в рыхлой мезенхимальной сети стромы, установленной между средой этих артериол и эндотелием пазухи.Круглые кроветворные клетки CD34 + иногда наблюдались в кровеносных сосудах желточного мешка. В печени они были редкими и смешивались как отдельные клетки в тяжах гепатоцитов; Поразительно, что гематопоэтические клетки CD34 + редко обнаруживаются в развивающемся костном мозге. Напротив, на 5-й неделе развития были обнаружены компактные скопления неэндотелиальных круглых гематопоэтических клеток CD34 + CD45 + в тесной связи с вентральной стенкой дорсальной аорты. Эти клетки проявляют фенотипические и функциональные характеристики очень примитивных гематопоэтических предшественников.Это наблюдение находится в поразительной корреляции с данными, накопленными на животных моделях, о том, что стволовые клетки поздних эмбриональных и взрослых кроветворных систем развиваются внутри эмбриона как такового, в непосредственной близости от дорсальной аорты. Таким образом, мы предполагаем, что эти ассоциированные с аортой CD34 + клетки, которые демонстрируют анатомическую локализацию, аналогичную таковой внутриэмбриональных стволовых клеток, идентифицированных в эмбрионах птиц и мышей, являются настоящим стволом кроветворения человека.
Понимание пути развития гемопоэтических стволовых клеток человека
Поверхность гемопоэтических стволовых клеток (HSC) во время эмбриогенеза приводит к возникновению кроветворной системы, которая имеет жизненно важное значение для иммунной функции, баланса гомеостаза и воспалительных реакций в организме человека.Гемопоэз — это процесс образования клеток крови, который инициируется гемопоэтическими стволовыми клетками / клетками-предшественниками (HSPC) и отвечает за образование всех клеток крови взрослого человека. Благодаря своим самообновляющимся и плюрипотентным свойствам плюрипотентные стволовые клетки человека (чПСК) предоставляют беспрецедентную возможность создать моделей дифференцировки in vitro , которые революционизируют наше понимание развития человека, особенно системы крови человека. Использование hPSC обеспечивает новые подходы к изучению происхождения заболеваний клеток крови человека и созданию популяций предшественников для лечения на основе клеток.Текущая нехватка наших знаний о взрослых HSC и молекулярных механизмах, которые контролируют развитие кроветворения в физиологических и патологических состояниях, может быть решена путем лучшего понимания регуляторных сетей, участвующих в кроветворении, их влияния на экспрессию генов и дальнейшего повышения нашей способности разрабатывать новые стратегии. клинического значения. В этом обзоре мы углубляемся в недавние достижения в понимании различных клеточных и молекулярных путей, которые приводят к развитию крови из hPSCs, и исследуем современные знания о развитии кроветворения человека.Мы также рассматриваем, как in vitro дифференцировка hPSCs может претерпевать гематопоэтический переход и спецификацию, включая основные подтипы, и рассматриваем методы и протоколы, которые облегчают генерацию гемопоэтических стволовых клеток.
1. Введение
Терапия трансплантацией гемопоэтических стволовых клеток (ТГСК) широко используется и считается перспективным методом лечения различных заболеваний крови [1]. HSC — это взрослые стволовые клетки, которые могут дифференцироваться в специализированные клетки крови, которые контролируют иммунную функцию, баланс гомеостаза и реакцию на микроорганизмы и воспаление [2].Первоначально они были обнаружены, когда клетки костного мозга мыши были трансплантированы облученным мышам, что привело к развитию колонии гемопоэтических клеток, которые, как было установлено, происходят из дифференцированных HSC [3, 4]. Эта важная идентификация Тилля и Маккаллоха подтолкнула дальнейшие исследования по изучению характеристик, развития и культивирования HSC. HSC могут быть получены из периферической крови, костной ткани и пуповинной крови [5]. HSC могут быть использованы в методах трансплантации и эффективных методах лечения гематологических заболеваний; однако в настоящее время невозможно создать терапевтически жизнеспособные HSC для пациентов-людей [6, 7].Отсутствие подходящих доноров человеческого лейкоцитарного антигена (HLA) затрудняет использование клинических преимуществ HSCT [8, 9]. Даже тогда спрос на HSCT вряд ли снизится, поскольку были предприняты синергетические усилия для пополнения других источников HSCs [10]. В нескольких исследованиях сообщается об успешном расширении популяций HSC, в то время как многие другие сосредоточены на создании HSC из индуцированных плюрипотентных стволовых клеток (ИПСК).
Успешное создание линии hESC группой Томсона в 1998 году [11] и линии hiPSC группой Яманаки в 2007 году [12] вызвало огромный интерес и усилия по использованию hPSC в качестве постоянного источника для создания неограниченного количества клеток крови для терапевтических целей.Благодаря развитию in vitro HSC из hPSC, текущая нехватка доноров крови может быть преодолена с помощью более клеточного лечения. В последние годы был достигнут значительный прогресс в разработке систем гемопоэтической дифференцировки и продуцировании различных клонов клеток крови, включая лимфоидную и миелоидную спецификацию из hPSCs [13-15]. Однако создание HSC, которое было желанной целью многих современных исследователей в области исследований HSC, было ограниченным и безуспешным.Это в основном может быть засвидетельствовано значительной сложностью эмбриональной системы кроветворения и отсутствием знаний о конкретных маркерах для различения различных стадий развития эмбриональных клеток крови. Для преодоления этого ограничения жизненно важно понимание и идентификация последовательных предшественников и молекулярных механизмов, которые приводят к образованию определенных кровных линий. В этом обзоре мы начнем с описания нашего нынешнего понимания эмбрионального гематопоэза, его структуры и того, как это важно в качестве основы для исследований дифференцировки hPSC.Мы фокусируемся на новом прогрессе, достигнутом в идентификации и понимании сигнальных путей, которые формируют и направляют гематопоэтическую спецификацию от hPSCs, и далее обсуждаем важные подходы в производстве приживляемых клеток крови. В нашем заключительном разделе мы обсуждаем использование дифференцировки hPSC в развитии HSC и текущие ограничения, которые необходимо преодолеть для достижения этой цели.
2. Развитие
Во время развития кроветворение происходит в желточном мешке и собственно эмбрионе [16].Однако, в отличие от твердых тканей, клетки кроветворной системы разбросаны в организме в разных местах [17]. Насколько известно, HSCs обнаруживаются на последних стадиях эмбриогенеза в основных артериях эмбриона, включая пупочную и желточную артерии и дорсальную аорту [18]. Полностью развитые HSC также позже могут быть обнаружены в желточном мешке и плаценте [19]. Клетки CD34 + можно обнаружить уже на 5 неделе беременности [20], а большинство зрелых HSC обычно можно обнаружить на 9 неделе беременности [21, 22].Как только эмбрион полностью развивается, HSCs затем мигрируют в печень плода и расширяются в костном мозге для будущего производства и самообновления во взрослой жизни [23]. Поскольку большинство компонентов эмбрионального гематопоэза были сохранены у многих видов, была создана общая модель сложного развития гематопоэтической системы. У раннего эмбриона многие волны кроветворения инициируются и организуются пространственно, временным и функциональным образом. Первоначально первичные волны кроветворения были описаны как примитивные и окончательные кроветворные волны (рис. 1).Классификация этих программ исторически основывалась на типе создаваемых ими эритробластов. Эритробласты, которые были рано появившимися, большими и зародившимися, были названы «примитивными», тогда как последние эритробласты в развитии, которые подверглись энуклеации, были названы «дефинитивными». Однако недавно было обнаружено наличие предшественников эритроидов, мегакариоцитов и тучных клеток, которые известны как предшественники эритромиелоидов (EMP), а также предшественников B-клеток и T-клеток, которые известны как мультипотентные предшественники с лимфоидным примированием (LMPP), перед тем, как выявлено появление ГСК и начало кровообращения [24–27].Несмотря на то, что присутствие EMP и LMPP еще не сообщалось в гемопоэзе человека, обнаружение популяций EMP и LMPP наблюдали на ст. E8.25 в желточном мешке эмбриона мыши после появления примитивных гематопоэтических предшественников и до обнаружения. ГСК [25]. Однако группа Келлера предположила, что эти популяции предшественников скорее генерируются независимыми программами, которые запускаются в желточном мешке и уникальны для примитивного и дефинитивного гематопоэза [25].LMPP-гематопоэз включает лимфоидное развитие предшественников B- и T-клеток, которое происходит в желточном мешке, а также перекрывается с EMP-гематопоэзом [28, 29]. С помощью этих отдельных программ можно признать, что желточный мешок имеет различные формы кроветворения во время развития. Улучшенное понимание инициации и регуляции эмбрионального гематопоэза будет необходимо для идентификации клонов, которые являются HSC-зависимыми и независимыми.
2.1. Примитивный гематопоэз
Примитивный гематопоэз происходит в желточном мешке и более ограничен, генерируя клетки только эритроидных, макрофагальных и мегакариоцитарных клонов [30].Примитивный гемопоэз также можно определить как все линии крови, кроме HSC, эритроцитов и Т-клеток [31]. Он более специфичен и инициируется на островках крови у эмбриона мыши (7-й день, E7) и человеческого эмбриона (18-20-й день) в течение начального периода беременности [30] (Рисунок 1). Эритробласты, полученные из примитивной программы, имеют тенденцию быть больше по размеру, сохраняют свои ядра и окружены эндотелиальными клетками [30, 32, 33]. Примитивные эритроидные клетки в первую очередь экспрессируют эмбриональные гены глобина, которые имеют более высокое сродство к кислороду, чем дефинитивные эритроидные клетки, которые характеризуются исключительной экспрессией взрослых форм β -глобина [33, 34].Макрофаги и мегакариоциты, полученные на этой стадии, также обладают свойствами, отличными от свойств, полученных на окончательной стадии. Примитивные макрофаги имеют быстрое созревание без стадии моноцитов во время развития [35, 36], а мегакариоциты лишены обилия тромбоцитов и имеют более низкую плоидность [37, 38]. Более того, понимание примитивного гематопоэза, к сожалению, сталкивается с проблемами при идентификации in vitro дифференцировки ESCs и iPSCs только с примитивными предшественниками эритроидов, доступными для полной идентификации [23].
2.2. Окончательный гематопоэз
С другой стороны, дефинитивный гематопоэз происходит после примитивного гематопоэза и может генерировать HSCs в различных участках сосудистой сети. Definitive описывает появление гематопоэтических предшественников, которые продуцируют миелоидные, лимфоидные, эритроидные клоны и долгоживущие HSCs во взрослом организме [39, 40]. Это обычно происходит в дорсальной аорте в области аорта-гонад-мезонефрос (AGM) собственно эмбриона, которая включает аорту, гонады и мезонефрос [40, 41].Область AGM у эмбриона является основным местом дефинитивного гематопоэза во время средней стадии беременности [42–45]. HSCs также можно обнаружить в желточном мешке, плаценте и голове, что наблюдалось на моделях мышей [44]. У человека HSC можно обнаружить с помощью экспрессии сосудистых и гемопоэтических маркеров, таких как CD34, VE-кадгерин, CD117, CD90, CD45 и CD105 [46]. In vitro , HSC, которые способны к приживлению, могут быть получены из предшественников AGM VE-cadherin + в сокультуре со стромальными клетками OP9 или эндотелиальными клетками [47–50].Интересно, что в области AGM внутриаортальные гематопоэтические кластеры (IAHCs) могут быть обнаружены на вентральной стенке, что означает начало дефинитивного гематопоэза у эмбриона [51]. Эти IAHCs покрывают эндотелиальную выстилку дорсальной аорты и дают начало гематопоэтическим клеткам посредством перехода плоских эндотелиальных клеток аорты в круглые гематопоэтические клетки. Предполагается, что специализированный гемогенный эндотелий в вентральной стенке дорсальной аорты претерпевает эндотелиально-гемопоэтический переход (EHT), приводя к образованию HSC.Следовательно, это предполагает, что создание гемопоэтических клеток с помощью эндотелиальных промежуточных продуктов является критическим шагом во время развития кроветворной системы. Кроме того, процесс EHT сохраняется у позвоночных, включая людей, мышей и рыбок данио [39, 52, 53]. В настоящее время выдвинута гипотеза, что артериальная спецификация является важной предпосылкой для запуска программы HSC, и это открытие поможет в идентификации и усилении лимфомиелоидных гемопоэтических предшественников и в конечном итоге приведет к генерации приживляемых HSC из культур hPSC [15, 54].Ранее Во и др. предположили, что раннее развитие кроветворения во время эмбриогенеза ингибируется эпигенетическим молчанием [55]. Они сообщили, что белок EZh2 группы Polycomb увеличивает пролиферацию лимфоидных клеток из HSCs, а его дефицит у мышей приводит к раннему появлению дефинитивных HSC у эмбриона in vivo [55].
3. Гемангиобласты
В конце 19 -го века эмбриологи наблюдали тесную взаимосвязь между эндотелиальными и гемопоэтическими линиями, а позже, в 1917 году, Флоренс Сабин пришла к выводу о существовании уникальных бипотенциальных клеток, которые дают начало крови и эндотелиальным клеткам ее эксперимент с желточным мешком куриного эмбриона [56].Термин гемангиобласт был введен 15 годами позже Мюрреем в отношении большой массы клеток, определяемой как мезенхима желточного мешка, из которой развиваются эндотелиальные и гематопоэтические клетки [57]. Гемангиобласты, которые развиваются из мезодермы во время раннего эмбрионального развития, обладают эндотелиальными и гематопоэтическими свойствами и идентифицированы как клональные предшественники, которые могут давать как клетки крови, так и эндотелиальные клетки [58, 59]. Впоследствии гемангиобласты были обнаружены и наблюдались в эмбрионе мыши [60], у рыбок данио [61] и в in vitro, дифференцирующих ЭСК человека [62, 63].Гемангиобласты более прослежены до примитивной дифференцировки, преимущественно характеризующейся коэкспрессией рецепторной тирозинкиназы Fl-1 / KDR (VEGFR2), фактора транскрипции примитивной полоски Brachyury , а также его способностью развивать сосудистые и гематопоэтические клоны [60].
4. Гемогенный эндотелий (HE)
Во время гемопоэза и развития HSC было замечено, что клетки крови происходят из предшественников, которые проявляют эндотелиальные свойства. Отмечено, что эти специализированные эндотелиальные предшественники, известные как гемогенный эндотелий (HE), вызывают образование клеток крови посредством перехода от эндотелия к гемопоэзу (EHT), а не через асимметричное деление [64].HE участвует в дефинитивном гематопоэзе, и гематопоэтические клетки генерируются вновь из этой субпопуляции HE [34, 65], что было показано с помощью отслеживания клонов [66] и покадровой визуализации [39, 62, 64, 67]. HE более локализован и характеризуется специфичными для эндотелия маркерами и морфологией и может быть обнаружен в эндотелиальных слоях внутри кровеносных сосудов. HE экспрессирует эндотелиальные маркеры VE-кадгерин, CD31 [68], c-KIT [69] и факторы транскрипции Runx1 [70] и GATA2 [71].
HE признан важным источником зрелых клеток крови взрослого типа, которые продуцируются во внеэмбриональной сосудистой сети, включая желточную, пупочную [72, 73], плацентарную [19] и желточную [74–76] сосудистую сеть.Хотя EHT во внеэмбриональных участках может наблюдаться из HE, выстилающего артериальные, венозные и капиллярные сосуды [72, 75, 77, 78], потенциал HSC локализован только в артериальных сосудах [72]. Большинство эндотелиальных клеток, участвующих в развитии гематопоэтических предшественников и HSCs, в основном происходят из эндотелиального слоя аорты и могут быть отслежены с помощью экспрессии KDR (также известного как FLK1) [51, 79]. При переходе в HSCs они начинают экспрессировать CD45 в гематопоэтических кластерах и сильно зависят от передачи сигналов Runx1 [80, 81].Эти ранее упомянутые наблюдения показывают, что образование крови через эндотелиальные промежуточные соединения является критическим процессом в гематопоэтической системе и что артериальная спецификация по сравнению с неартериальной спецификацией HE может улучшаться и обеспечивать развитие гемогенного и гематопоэтического потомства. Это наблюдение доказало, что спецификация артерий является существенной предпосылкой для запуска окончательной гематопоэтической программы [82].
5. Успехи в дифференцировке гемопоэтических клеток от hPSC
Появление ИПСК предоставило нам замечательный доступ для исследования раннего развития крови человека и бесконечный источник клеток, имеющих клиническое значение, которые можно использовать для иммунотерапии.Кроме того, получение HSC и HE на основе ИПСК от пациентов с генетическими нарушениями может позволить моделировать жизненно важные заболевания и получить доступ к новым терапевтическим методам посредством высокопроизводительного скрининга лекарств. Дифференциация hPSCs с гемопоэтическими клетками была достигнута с использованием нескольких стратегий, которые включают однослойную культуру hPSCs, дифференцировку трехмерных кластеров в виде эмбриоидных тел (EB) или в системе сокультивирования, зависимой от питателя (рис. 2). Были получены многочисленные гематопоэтические клоны, которые включают эритроциты, мегакариоциты и тромбоциты, макрофаги, дендритные клетки и лимфоидные клетки из hPSC [83], и они внесли значительный вклад в разработку модели развития гематоэндотелия человека из hPSC.
5.1. Система дифференцировки кокультуры
Система включает совместное культивирование недифференцированных hPSC со стромальными клетками костного мозга мыши в присутствии среды, содержащей сыворотку [84–86]. Система сокультивирования hPSC / OP9 представляет собой широко используемый подход к гемопоэтической дифференцировке, который обеспечивает большое преимущество, поскольку эффективная гемопоэтическая дифференциация от hESCs может быть достигнута в течение короткого промежутка времени (8-9 дней) с использованием специфической фетальной телячьей сыворотки (FBS) и действительно не требуют дополнительных цитокинов [87].Водяник и др. показали, что из различных испытанных стромальных клеток костного мозга мышей линия клеток OP9 является наиболее эффективной в индукции гематопоэтического перехода [88]. Совместное культивирование OP9 может быть использовано для получения мультипотентных гематопоэтических клеток-предшественников и зрелых клеток, включая Т [89, 90] и В-лимфоциты [88, 91] и мегакариоциты [92]. Однако система сокультивирования стромальных клеток имеет несколько ограничений. Плотность клеток OP9, размер колонии hPSC и партии FBS являются наиболее важными факторами, чрезвычайно важными для эффективности дифференцировки hPSC в системе сокультивирования OP9.Эти ограничения создают проблему для понимания сигнальных путей, участвующих в гематоэндотелиальном переходе во время дифференцировки hPSC. Кроме того, использование ксеногенного материала в системе ограничивает терапевтические преимущества системы. Несмотря на создание культуры hPSC, не содержащей ксеногенов, производные hPSC гемопоэтические клетки, имеющие клиническое значение, должны быть созданы с использованием определенных методов дифференцировки. Кроме того, исследования также показали, что тератомный гематопоэз ИПСК значительно улучшился при совместной инъекции со стромальными клетками OP9 по сравнению с одним ИПСК.Эти исследования показали, что выделение и повторная инъекция гематопоэтических предшественников из тератом, происходящих от hPSC, продемонстрировали потенциал многолинейного приживления [93, 94]. Несмотря на то, что количество HSC было меньше и после вторичной трансплантации наблюдалась тенденция к миелоидному происхождению, эти результаты продемонстрировали, что hPSC обладают потенциалом дифференцироваться в HSC.
5.2. Система прямой дифференцировки
Другой метод дифференциации — прямая дифференциация hPSCs путем их культивирования в среде определенного химического состава с последовательным добавлением специфических морфогенов, цитокинов и малых молекул, чтобы способствовать дифференцировке гематоэндотелия [95].Направленная дифференциация была проведена с использованием эмбриоидных телец (ЭТ), которые представляют собой трехмерные агрегаты, или путем культивирования в однослойной двухмерной системе hPSC. Хотя эти протоколы основаны на использовании сыворотки в среде [11], недавно были разработаны бессывороточные среды для использования в этих протоколах [96–98]. Использование различных сигнальных путей с использованием агонистов Wnt и костного морфогенетического белка 4 (BMP4) в культурах для индукции эффективной мезодермы, VEGF для улучшения ангиогенеза и коктейлей гематопоэтических цитокинов для усиления гематопоэза были полезны для повышения эффективности гематопоэтической дифференцировки EB, производных от hPSC. [25, 31, 97, 99].Система дифференциации на основе EB также имеет несколько ограничений из-за сложной природы EB, вариаций между каждым EB и ее относительно медленной дифференциации, которая ограничивает использование этой системы [31, 100].
С другой стороны, двумерный метод (однослойная культура) включает прямую дифференциацию на планшетах, покрытых ECM. В то время как некоторые группы использовали матригель ЕСМ, полученный из линии клеток саркомы мыши, для клеток пластинки, другие открыли использование человеческого коллагена IV, ламинина и фибронектина в качестве эффективных матриц для поддержки индукции мезодермы и дифференцировки гематоэндотелия [101-104 ].Кроме того, Uenishi et al. разработали методику, которая может генерировать HSC из монослоя hPSC. Посредством исследований молекулярного профилирования они обнаружили, что тенасцин С высоко экспрессируется в конфлюэнтных стромальных клетках OP9 с более высокой гемато-индуцирующей активностью, и продемонстрировали способность тенасцина С способствовать развитию гематоэндотелиальных предшественников [105]. Этот двумерный метод, который включает в себя добавление факторов роста, малых молекул и цитокинов в зависимости от стадии, уменьшает время дифференцировки, но увеличивает эффективность гематоэндотелиальной дифференцировки, что делает его высокоэффективным методом, который полностью химически определен [103–105].
5.3. Система дифференцировки, опосредованная транскрипционным фактором
Возникновение EHT и HSC в AGM контролируется комбинаторным взаимодействием факторов транскрипции. В конверсии, опосредованной факторами транскрипции, конкретная клеточная судьба активируется усиленной экспрессией ключевых факторов транскрипции. При использовании факторов транскрипции, которые жизненно важны для дифференцировки гемопоэза, недавно были описаны подходы к множественной конверсии с участием hPSCs [106–110]. Во время переходного периода от мезодермальных к гематопоэтическим линиям транскрипционный фактор Scl играет важную роль в раннем гематопоэтическом развитии [111].Sandler et al. продемонстрировал, что в системе человека сверхэкспрессия факторов транскрипции, таких как RUNX1, FOSB, SPI1 и GFI1, в HUVECs или эндотелиальных клетках микрососудов взрослой кожи с последующим совместным культивированием с AKT-активированными эндотелиальными клетками индуцировала окончательное гематопоэтическое развитие или программу HSC [112]. Szabo et al. сообщил, что человеческие фибробласты, сверхэкспрессирующие один фактор транскрипции OCT4 при трансплантации реципиентам NSG, продуцировали миелоидное приживление, совместимое с клетками CD34 + пуповинной крови и эритроидными колониями, экспрессирующими β -гемоглобин взрослых и лишенными эмбрионального ε -гемоглобина [113] .
В моделях культуры ES-клеток RUNX1 признан главным регулятором EHT, и его экспрессия в предшественниках желточного мешка также показала развитие HE в дорсальной аорте и даже в определенном количестве HSCs [114, 115]. Баланс между RUNX1 и HOXA3 важен для развития стадии HE [116]. HoxA3 также активирует транскрипционный фактор Sox17, который играет важную роль в спецификации появления артериальных клеток и HSC [116–118]. Ранее была разработана система скрининга прироста функции для определения важных транскрипционных регуляторов образования HE из человеческих PSCs [107].На основе этой системы было обнаружено, что усиление экспрессии различных комбинаций факторов транскрипции превращает hPSCs в различные гематопоэтические предшественники; ни один из факторов не может вызвать кроветворение при использовании отдельно. Комбинация фактора транскрипции ETV2 и GATA2 привела к индукции клеток крови CD43 + с панмиелоидным потенциалом, тогда как комбинация TAL1 и GATA2 наделила клетки эритромегакариоцитарным потенциалом, который включал промежуточную стадию HE [107].Гемопоэтические предшественники, производные hPSC, генерировали зрелые колонии в анализах на основе метилцеллюлозы, но не могли приживаться в течение длительного времени in vivo [107]. Интересно, что Suknuntha et al. использовали modRNA, экспрессирующую ETV2 или ETV2 и GATA2, для генерации эндотелиальных и CD34 + CD43 + гематопоэтических клеток-предшественников из HPSCs и нечеловеческих NHP, соответственно [119].
Недавно было показано, что мультипотентность плюрипотентных стволовых клеток и дифференцировка в различные типы тканей во время эмбриогенеза можно контролировать путем последовательного воздействия морфогенов.Sugimura et al. провели модифицированную морфоген-направленную дифференцировку плюрипотентных стволовых клеток для создания клеток CD34 + , происходящих из hPSC, которые затем принудительно экспрессировали семь общих факторов транскрипции (ERG, HOXA5, HOXA9, HOXA10, LCOR, RUNX1 и SPI1), которые являются обычно обнаруживается в популяциях миелоидных, В- и Т-клеток [110, 120, 121]. Чтобы определить их потребность в кроветворении, они трансдуцировали HE с помощью этих семи факторов и прививали их облученным мышам. Наблюдалось эффективное восстановление кроветворения у мышей и развитие функциональных миелоидных популяций В- и Т-клеток [110].Хотя приживление трансплантата было возможно с этими генетически модифицированными клетками, они обладали противоположными функциональными и молекулярными характеристиками по сравнению с HSC, полученными из пуповинной крови. Из этих результатов ясно, что контролируемая экспрессия определенных факторов может генерировать HSC-подобные клетки, которые не являются полностью функциональными, что проливает свет на важность изучения механизмов, которым молекулярные регуляторы подвергаются в опосредовании дефинитивного гематопоэза. Тем не менее, есть многообещающие доказательства того, что прямое преобразование соматических клеток в HSC может быть возможным вариантом для будущих клинических применений.
6. Различные стадии развития HSC во время дифференцировки hPSC
Важное значение имеет доскональное знание различных стадий развития кроветворения и механизмов, лежащих в основе регуляции индукции и спецификации кроветворных предшественников из hPSC. В настоящее время обширная модель развития гематоэндотелия с помощью hPSCs включает использование сокультивирования стромальных клеток OP9 и прямую дифференцировку [31, 62, 105].
6.1. Стадия мезодермы
Индукция примитивной мезодермы — это первая стадия дифференцировки hPSC, которая может быть идентифицирована по экспрессии мезодермального маркера APLNR и KDR и отсутствию экспрессии типичных эндотелиальных (CD31, VE-кадгерин), эндотелиальных / мезенхимальных (CD73) , CD105) и гемопоэтических (CD43, CD45) маркеров [63, 122].Гематоэндотелиальные клоны, которые возникают из мезодермы, были конкретно описаны как экспрессирующие KDR + , APLNR + (Flk-1, VEGFR2 и CD309) и PDGFRa + (CD140a) [31, 62, 104] (Рисунок 3 ). Несколько исследований с использованием метода дифференцировки EB показали, что появление первичной полоски и появление популяций мезодермы зависят от костного морфогенетического белка 4 (BMP4), фактора роста фибробластов 2 (bFGF), а также от Nodal и WNT- β сигнальных путей катенина [83, 97].Несколько других исследований показали, что ингибирование GSK3 β (ингибитор передачи сигналов Wnt) может индуцировать образование мезодермы в PSCs от человека и нечеловеческих приматов [123, 124]. Sturgeon et al. продемонстрировали, что ранние манипуляции с передачей сигналов WNT- β -catenin могут определять отдельные первичные и дефинитивные волны гематопоэза, которые развиваются из разных популяций мезодермы [31].
На мезодермальной стадии развития образуются три разных клоногенных предшественника с различным эндотелиальным потенциалом.Первая форма — это мезенхимоангиобласт (MB), который определяется как предшественник эндотелиальных и мезенхимальных клеток [122, 125, 126] (Рисунок 3). Второй клоногенный предшественник отмечен появлением бластных CFC (BL-CFC) [62, 63, 122] (Рисунок 3). BL-CFC обычно называют гемангиобластами (HB), потому что они состоят из сосудистых и гематопоэтических предшественников. И MB, и HB возникают в сокультуре с OP9 или системой прямой дифференцировки на 2 и 3 дни дифференцировки [62, 89, 105].Оба потенциала MB и HB могут быть обнаружены с помощью анализа образования колоний в бессывороточной клоногенной среде с добавлением FGF2 [122] (рис. 3). Недавно сообщалось, что избыточная экспрессия ETS1 во время мезодермальной стадии развития резко усиливает образование HE артериального типа, которые экспрессируют DLL4 и CXCR4 [127]. Последний — сердечно-сосудистые предшественники, обладающие потенциалом эндотелия и кардиомиоцитов [128].
6.2. Hematovascular Mesoderm Precursor (HVMP) Stage
Следующий этап более продвинутой мезодермальной приверженности связан с образованием латеральных пластинчатых клеток мезодермы, которые известны как гематоваскулярные предшественники мезодермы (HVMPs) [62].HVMPs возникают в сокультуре с OP9 или в системе прямой дифференцировки на 4 день дифференцировки [62, 89, 105, 122]. Возникновение HVMP может быть обнаружено на основе высокой экспрессии KDR и низкой или отсутствующей экспрессии PDGFR α в EMH lin — APLNR + клетках, т. Е. EMH lin — KDR bright APLNR + PDGFRa low / — фенотип . Развитию стадии HVMP в основном способствует продолжающаяся активация сигнального пути Wnt [101].Во время стадии HVMP экспрессия генов TAL1 , HHEX , LMO2 , GATA2 и ETV2 , связанных с ангиогематопоэтическим развитием, повышается (Рисунок 3). HVMPs не обладают потенциалом BL-CFC, но в изобилии присутствуют в бипотенциальных клетках, которые могут образовывать гематоэндотелиальные кластеры при совместном культивировании на OP9 и, следовательно, могут продуцировать все миелоидные предшественники [62]. Вместе эти результаты предполагают, что примитивный гематопоэтический потенциал может быть обнаружен в незрелых клетках задней мезодермы, тогда как более зрелые и развивающиеся HVMPs генерируют клетки крови с определенными характеристиками.В той же линии недавно мы продемонстрировали, что HVMP с дефинитивным гематопоэтическим потенциалом продуцируют наибольшее количество Т-клеток при культивировании на OP9-DLL4 по сравнению с другими предшественниками [89].
6.3. Стадия предшественников гемогенного эндотелия (HEP)
Производство популяций HEP из hPSC считается жизненно важным шагом на пути к генезу предшественников крови, и эту популяцию можно идентифицировать по экспрессии типичного эндотелиального маркера VE-кадгерина, CD31 и CD34. отсутствие пангематопоэтического маркера CD43 [62, 99, 129].Клетки VEC + представляют собой гетерогенную популяцию, которую можно разделить на 3 независимые популяции: HE, не-HE и AHP (рис. 3). Клетки HE можно легко отличить от клеток, не относящихся к HE, на основании отсутствия экспрессии CD73 в клетках HE [62, 129]. Эти клетки лишены гематопоэтического потенциала CFC, но могут образовывать популяции крови после культивирования со стромальными клетками [62]. HEP, дифференцированные от hPSC, представляют фенотип CD144 + CD31 + CD73 — CD43 — .Не-HE клетки идентифицируются путем прямой активации CD73 [62], а при передаче сигналов NOTCH HEP специфицируется в DLL + артериального HE и DLL4 — неартериального HE [54]. Некоторые исследования показали, что в зависимости от местоположения популяция не-HE клеток может быть далее разделена на популяции CD73 med CD184 +/- DLL4 + артериальных и CD73 hi CD184 – венозных эндотелиальных популяций. Это разделение между артериальным и венозным HE может быть вызвано изменением различных сигнальных путей, таких как пути митоген-активируемой протеинкиназы (MAPK), NOTCH и фосфоинозитид-3-киназы (PI3K) [130, 131].Помимо этих двух популяций, третья популяция, названная популяцией ангиогенных гематопоэтических предшественников (AHP), идентифицирована по фенотипу CD144 + CD31 + CD73 — CD43 + (фиг. 3). Эти гемопоэтические предшественники могут развиваться в гемопоэтические колонии в FGF2-содержащей культуре метилцеллюлозы, а также образовывать эндотелиальные листы в эндотелиально-специфической культуре, проявляя свой ангиогенный потенциал [62, 132]. Культивирование этих эндотелиальных субпопуляций в артериальных, венозных и лимфатических условиях показало, что AHP смещены в сторону лимфатических, HEP в сторону артериальных, а не-HEP в сторону венозной дифференцировки in vitro .Эти находки предполагают, что отбор и усиление продукции конкретной субпопуляции EC может помочь в создании желаемых популяций EC с артериальными, венозными или лимфатическими свойствами из hPSCs [132].
6.4. Стадия мультипотентного гематопоэтического предшественника (MHP)
За последние два десятилетия был достигнут значительный прогресс в понимании развития крови из hPSC. CD43 (лейкосиалин), как сообщается, является исходным маркером, который определяет гематопоэтических предшественников из эндотелия в культурах дифференцировки hPSC [88], однако спорят о том, что гематопоэтические предшественники, экспрессирующие CD43, могут быть примитивного происхождения [31].Эта проблема проложила путь к точному отделению гематопоэтических клеток CD43 + от предшествующих предшественников VE-кадгерина (VEC) + CD43 — HEP. В настоящее время на этой стадии считается, что продвинутое развитие кроветворения происходит из-за EHT, что связано с повышением экспрессии CD43 и когда все гемопоэтические CFCs разделяются на фракции CD43 + [88, 99]. Подмножества CD43 + включают lin-CD34 + CD43 + CD41 + CD235a + эритромегакариоцитарный предшественник (E-MkP) и lin — CD34 + CD43 + CD45 +/- мультипотентных гематопоэтических предшественников (MHP) [88, 90, 99, 133] (Рисунок 3).Клетки CD235a + CD41a + содержат высокоэффективные эритромегакариоцитарные предшественники, у которых отсутствует эндотелиальная способность. Вскоре после появления клеток CD235a + CD41a + в культурах hPSC могут быть обнаружены предшественники с широкой лимфомиелоидной способностью и фенотипом lin-CD34 + CD43 + CD45 —. Приобретение фенотипа CD45 клетками lin — можно проследить по постепенному вовлечению миелоида [88]. E-MKP практически не обладали потенциалом Т-клеток [89].lin — CD34 + CD43 + CD45 +/- MHP-клетки можно охарактеризовать по миелолимфоидному многолинейному потенциалу и способности сохраняться и увеличиваться в культуре. MHP обладают колониеобразующим потенциалом гранулоцитов-эритроид-макрофагов-мегакариоцитов (CFC-GEMM) и Т-лимфоидным потенциалом. MHP могут генерировать энуклеированные эритроциты с γ — и также с ограниченной экспрессией β -глобина. При специальном лечении или добавлении интерлейкина-3 (IL-3), интерлейкина-6 (IL-6), фактора стволовых клеток (SCF) и тромбопоэтина (TPO) [62, 86–88], эритропоэтина (EPO), Flt -3 лиганд (FLT3L), интерлейкин-11 (IL-11), фактор роста эпителия (EGF), инсулиноподобный фактор роста 1 (IGF-I) и инсулиноподобный фактор роста 2 (IGF-II) могут способствовать развитию HP поддержание и расширение в заданном состоянии [31, 130].
7. Передача сигналов NOTCH как главный регулятор гематопоэза
Четкое понимание путей, задействованных во время гематопоэза, необходимо для четкого различия между примитивным и дефинитивным гематопоэзом. Сигнальные пути играют жизненно важную роль в развитии и спецификации клеток, что также в основном определяется регуляцией генов [134]. Хотя было продемонстрировано, что большинство клеточных сигнальных путей необходимы для образования HSC, спецификация HSC требует сигнальных путей, которые не являются существенными для других гематопоэтических волн.На основании исследований было замечено, что для появления HSC необходимы WNT [31, 135], передача сигналов BMP4 [136, 137], NOTCH [15, 47, 54, 130, 138], VEGF [139], SCF [49, 140] и Hedgehog [141] сигнализация. Среди всего прочего, путь передачи сигналов NOTCH был тщательно изучен и, как было показано, имеет решающее значение во время начала дефинитивного гематопоэза [54, 130, 138, 142]. Передача сигналов Notch участвует в клональной фиксации, латеральном ингибировании между соседними клетками и поддержании гомеостаза [143].У млекопитающих ключевые белки, участвующие в передаче сигналов NOTCH, включают четыре трансмембранных рецептора NOTCH (Notch 1-4), которые состоят из внеклеточного домена (NECD) и внутриклеточного домена (NICD), связанных с ними Jagged1-2 / Delta-подобных (DLL1, DLL3 и DLL4) лиганды, количество которых различается у разных видов [138]. Он также включает ферменты, которые модифицируют лиганды Notch во время активации (Mindbomb), и протеазы, которые расщепляют активированные рецепторы (гамма-секретаза / ADAM TACE) в сайте 2 (S2) и сайте 3 (S3) для удаления NECD из остальной части рецептора и освобождают NICD от мембраны соответственно.После транслокации NICD в ядро он взаимодействует с комплексом факторов транскрипции, CSL (CBF-1 / RBPjk, SuH и LAG-1), чтобы изгнать корепрессоры и помочь руководителю коактиватора запустить транскрипцию генов-мишеней NOTCH [143, 144 ]. In vitro передача сигналов Notch может быть активирована путем сокультивирования клеток со стромальными клетками OP9, которые экспрессируют лиганды Notch, или путем нанесения иммобилизованных лигандов Notch на планшеты для культивирования клеток [54, 83, 145].
Недавние доказательства подтверждают, что передача сигналов NOTCH явно необходима на стадии развития EHT и зависимость NOTCH является отличительной чертой дефинитивного гематопоэза [54, 130].Передача сигналов Notch играет важную роль на разных стадиях развития HE, от артериальной спецификации [131] до развития Т-лимфоцитов [146]. Посредством нескольких исследований на трансгенных мышах было доказано, что первичная волна гематопоэза не зависит от NOTCH [31, 99, 147], тогда как дефинитивная волна гематопоэза специфически зависит от NOTCH [147-149]. Также с помощью нокаутных исследований на мышах было показано, что активация Notch важна для артериальной спецификации эндотелиальных клеток во время васкулогенеза [150, 151].Недавние исследования показали, что активация передачи сигналов Notch на ранней стадии HE указывает на их VEC + CD43 — CD73 — DLL4 + HE артериального типа, который зависит от NOTCH для EHT и продуцирует дефинитивный лимфомиелоид и эритроид. клетки [15, 54]. Идея, что Notch опосредованная артериализация HE является важной стадией для установления окончательной гематопоэтической программы, которая проливает свет на зависимую от артериальных спецификаций модель дефинитивного гематопоэтического развития [15].
8. Перспективы и заключительные замечания
Благодаря значительным достижениям в понимании эмбрионального гематопоэтического развития, было много подходов к моделированию развивающихся систем гематопоэтической дифференцировки. Принимая во внимание, что первые HSC, hESC и iPSC были получены или открыты в 1961, 1998 и 2007 годах, соответственно, были достигнуты значительные успехи в вовлечении стволовых клеток в гематопоэтические исследования. С пониманием гематопоэтического перехода и различных клонов, чЭСК и ИПСК были успешно использованы для получения почти всех типов зрелых клеток крови, хотя для этого достижения желательны более последовательные и эффективные модели.Кроме того, важное понимание того, что HE и EHT имеют жизненно важное значение для развития кроветворения, и наблюдение HE при развитии культур hPSC важно для дальнейшего улучшения наших моделей и протоколов для окончательного гематопоэза.
Несмотря на то, что большая часть ступенчатого процесса гемопоэтической дифференцировки в целом понятна, все еще существуют недостатки в знании определенных сигнальных путей и условий определенных этапов, ведущих к различным типам клеток крови. Хотя с четкими доказательствами гематопоэтической спецификации, происходящей от линии EHT или HE, определение и установление этих условий в моделях hPSC дает возможность дифференцировать hPSCs в HSCs и зрелые клетки крови с долгосрочным приживлением и потенциалом самообновления.Эти достижения действительно могут приблизить нас к работе с клиническими приложениями и применению таких методов разработки и приживления HSC или различных популяций крови, полученных из hPSC, для лечения заболеваний, связанных с кровью.
Продолжая дальше, еще in vivo исследований с различными модельными организмами по развитию гематоэндотелия в интересующих участках, которые включают AGM, желточный мешок или артериальные и неартериальные участки, проложат путь к уточнению наших текущих знаний о гематопоэтическом переходе и разработке идеальные условия окружающей среды для создания эффективных моделей in vitro hPSC гемопоэтической дифференцировки.Похвальные исследования были выполнены с момента открытия как примитивных, так и окончательных волн кроветворения.
Лечение заболеваний произвело революцию благодаря клиническим преимуществам трансплантации стволовых клеток. Дальнейшее понимание кроветворения и воспроизведение процесса развития in vivo может революционизировать будущее регенеративной медицины.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы выражают благодарность проф.Игорю И. Слуквину (Национальный исследовательский центр приматов штата Висконсин, Университет Висконсин-Мэдисон) за ценные комментарии и рекомендации по написанию этой рукописи.
Кроветворение — обзор | Темы ScienceDirect
Введение
Гематопоэз — это продолжающийся всю жизнь процесс непрерывного образования и обновления клеток крови для удовлетворения повседневных потребностей, а также в ответ на повышенный спрос, например, травмы или инфекции. В среднем взрослые люди производят приблизительно один триллион клеток крови каждый день, включая 200 миллиардов эритроцитов (красных кровяных телец (эритроцитов)) и 70 миллиардов нейтрофилов.Поддержание кроветворения регулируется как стохастическими, так и инструктивными механизмами. В этой статье будет представлен краткий обзор основных результатов, которые способствовали пониманию способности к производству крови в течение всей жизни, с акцентом на основополагающие открытия, определяющие систему кроветворения.
Гемопоэтические стволовые клетки (HSC) находятся на вершине гемопоэза и определяются двумя фундаментальными характеристиками: способностью к самообновлению, делением, которое приводит к двум HSC, и способностью к мультипотентной дифференцировке во все зрелые линии крови. , то есть эритроциты, тромбоциты, лимфоциты, моноциты / макрофаги и гранулоциты.Ключевые исследования в начале 1950-х годов показали, что кроветворение у облученных животных можно восстановить с помощью клеток селезенки и / или костного мозга (КМ). Позже было показано, что аллогенные кожные трансплантаты переносятся смертельно облученными мышами, получившими гемопоэтический трансплантат, что привело к концепции химеризма, то есть восстановления хозяина донорскими клетками. В 1960-х Till, McCulloch и его коллеги опубликовали революционные исследования, показавшие, что отдельные клоногенные клетки в BM могут самообновляться и восстанавливать кроветворение, постулируя существование in vivo HSC.Они показали, что селезенка смертельно облученных мышей, которым вводили гемопоэтические клетки, образовывали макроскопические узелки пропорционально количеству введенных клеток ВМ, и предположили, что эти колонии селезенки (колониеобразующие единицы — селезенка (КОЕ-С)) произошли от одной клетки , что они позже продемонстрировали анализом хромосомных маркеров. Эти исследования также заложили основу для клинической трансплантации кроветворения.
Первоначально считалось, что анализ CFU-S предназначен для измерения HSC, и он до сих пор используется в качестве суррогатного анализа HSC.Однако единственной истинной мерой функции HSC является способность полностью повторно заселить смертельно облученного хозяина. Хотя «присутствие» HSC может быть определено путем мониторинга выживаемости смертельно облученных реципиентов трансплантата, этот строгий метод «выживаемости» не позволяет количественно оценить количество или функцию HSC или сравнить трансплантаты HSC. Для решения этой проблемы были разработаны анализы долгосрочной репопуляции, которые оценивают и количественно определяют клетки с долгосрочным репопуляцией (LTRC), синоним HSC, которые позволяют сравнивать трансплантаты.В стандартном формате донорский трансплантат HSC смешивают с конкурирующим трансплантатом BM от конгенной мыши дикого типа, и смесь трансплантируют смертельно облученному реципиенту. Маркеры, отличные для донорского трансплантата и конкурирующего трансплантата, используются для различения продукции крови из каждого источника клеток, что позволяет сравнить их способность к репопуляции. В анализе используются мышь C57Bl / 6 (CD45.2) и мышь B6.SJL-PtrcAPep3B / BoyJ (BOYJ) (CD45.1), которые различаются только по антигену CD45, и их можно различить с помощью специфических моноклональных антител, что позволяет оценка химеризма у животных-реципиентов.
Хотя тесты конгенной конкурентной репопуляции подходят для HSC мышей, они не позволяют анализировать HSC человека. Вместо этого человеческие гемопоэтические клетки анализировали у мышей с ослабленным иммунитетом, а HSC анализировали в модели, аналогичной конкурентному анализу репопуляции, путем трансплантации сублетально облученным иммунодефицитным мышам, что позволяет оценить химеризм и продукцию нескольких линий человеческих клеток крови. Приживление человеческого HSC in utero у эмбриона овцы также используется в качестве экспериментальной модели кроветворения человека.
Сравнительный транскриптомный анализ кроветворной системы человека и мыши с помощью Microwell-seq
Классическая модель гематопоэза представляет собой разветвленное дерево, уходящее корнями из долгосрочных гемопоэтических стволовых клеток (LT-HSC), за которым следуют стадии мультипотентных, олигопотентных и унипотентных предшественников 1,2 . Однако в очень ограниченных исследованиях использовались системные методы для изучения неоднородности этой популяции 3 .Межвидовое сравнение гемопоэтической иерархии также отсутствует. Здесь, с помощью Microwell-seq, высокопроизводительной и недорогой платформы scRNA-seq 4 и вычислительной стратегии канонического корреляционного анализа 5 , мы провели сравнительный транскриптомный анализ гемопоэтической иерархии у человека и мыши. Мы обнаружили, что компартмент гемопоэтических стволовых и предшественников (HSPC) у двух видов состоит из субпопуляций, характеризующихся клон-специфическими регуляторами, а гематопоэтические клоны и транскрипционное профилирование гемопоэза хорошо сохраняются у человека и мыши, что указывает на эволюционное сходство в генах. их кроветворные системы.
Используя Microwell-seq 4 , мы построили одноклеточный транскриптомный атлас HSPCs человека и мыши, имеющий общее количество 71 729 отдельных клеток, которые сгруппированы в 39 субпопуляций (44 914, 26 815 клеток и 20, 19 субпопуляции были от человека и мыши соответственно) с помощью компьютерного анализа (рис. 1a, b). Эти субпопуляции далее идентифицируются как недифференцированные HSPC в примированном состоянии или как специфические гематопоэтические клоны по характерным генам (дополнительный рис.S1, таблицы S1 и S2).
Рис. 1: Сравнительный анализ геномики кроветворной системы.a Тепловая карта экспрессии гена, показывающая дифференциальную экспрессию гена для каждого кластера клеток в данных о человеческих единичных гемопоэтических стволовых и клетках-предшественниках (HSPC). Ряды соответствуют отдельным генам, которые, как было обнаружено, избирательно активируются в отдельных кластерах; столбцы — это отдельные ячейки, упорядоченные по кластерам. Желтый соответствует высокому уровню экспрессии; фиолетовый и черный соответствуют низкому уровню экспрессии.b Тепловая карта экспрессии гена, показывающая дифференциальную экспрессию гена для каждого кластера клеток в данных одиночного HSPC мыши. Цветовая гамма и макет образца такие же, как на рис. 1а. c Фракция клеток в каждом кластере человека была отнесена к каждому кластеру мыши на основе ортологичных генов. Красный цвет соответствует высокому уровню корреляции; белый цвет соответствует низкому уровню корреляции. d t-Распределенное стохастическое соседнее встраивание (t-SNE) анализ данных компартментов HSPC человека и мыши.Клетки окрашены экспериментальными образцами (слева). Ячейки окрашены кластером типов ячеек (справа). e Таблица, показывающая подтверждения и символы генов 16 типов клеток. f Полоса, показывающая соотношение клеток человека и мыши по всем предшественникам. г t-SNE анализ человеческих CD45 + CD34 + клеток. Клетки CD34 + периферической крови человека трансплантировали сублетально облученным мышам NCG, а клетки CD45 + CD34 + человека были отсортированы из костного мозга мыши через 2 месяца после трансплантации.Ячейки раскрашены кластером типов ячеек. Примированные клонами предшественники, такие как про-нейтрофилы, промегакариоциты, про-T и про-B в клетках CD45 + CD34 + , были визуализированы на карте t-SNE. h Тепловая карта экспрессии гена, показывающая дифференциальную экспрессию гена для каждого кластера клеток в данных клеток CD45 + CD34 + человека. Желтый соответствует высокому уровню экспрессии; фиолетовый и черный соответствуют низкому уровню экспрессии. i Процесс дифференциации нейтрофилов и предшественников нейтрофилов из наборов данных мышей и людей был нанесен на двумерное пространство с помощью Monocle. j Схема стробирования определенных предшественников нейтрофилов (CD114 + / CD177 + ) и предшественников эритроцитов (CD71 + ) из MPP (CD34 + CD38 — Thy1 — CD45RA — CD49f — ) ячеек. Клетки MPP были отсортированы из мобилизованных клеток периферической крови (mPB), клеток костного мозга (BM) с помощью FACS. k Процент различных типов колоний в колониеобразующем анализе от CD71 + и CD71 – MPP-mPB, CD114 + и CD114 – MPP (mPB и BM).Результаты показали средний процент из трех независимых экспериментов. 1 Одноклеточная КПЦР использовалась для обнаружения экспрессии маркеров эритроцитов и нейтрофилов в клетках с помощью анализа образования колоний. Оси и означают процент единичных клеток, экспрессирующих маркеры эритроцитов из клонов CD71 + и CD71 —; или процент одиночных клеток, экспрессирующих маркеры нейтрофилов из клонов CD114 + и CD114 –
Кроме того, мы исследовали сходства и различия HSPCs между двумя видами.Чтобы получить подробное представление о клеточной эволюции от мыши к человеку в системе HSPC, мы сначала переключили гены мыши на ортологичные гены человека. Доля клеток в каждом кластере человека была отнесена к каждому кластеру мыши на основе ортологичных генов, и уровень корреляции показан на рис. 1c. Межвидовая корреляция ортологичных генов показывает сохранение экспрессии генов в одном и том же типе клеток разных видов. Кроме того, был проведен сравнительный транскриптомный анализ кроветворной системы.Мы использовали алгоритм канонического корреляционного анализа (CCA) для выполнения комплексного анализа компартмента HSPC человека и мыши 5 (рис. 1d). Алгоритм CCA — это многомерный статистический метод для поиска линейных связей между двумя наборами переменных, которые имеют максимальную корреляцию. В анализе scRNA-seq алгоритм CCA может обнаруживать статистические общие факторы среди двух матриц цифровой экспрессии генов (DGE), которые отличаются друг от друга из-за пакетных эффектов или различных методов, используемых в процедурах нормализации.
С помощью вычислительного алгоритма CCA мы идентифицировали 16 субпопуляций в смешанном континууме HSPC человека и мыши (рис. 1d). В кластере 1 (C1), C2, C11 и C14 преобладали HSPC человека, тогда как C3-5, C8 и C15-C16 были заняты HSPCs мыши (Fig. 1e). Шесть клонов (C6, C7, C9, C10, C12, C13) содержат HSPC как человека, так и мыши (рис. 1f). Все кластеры отличались четко описанными модулями дифференциальной экспрессии генов 3,6,7,8 . В дополнительной таблице S3 показана подробная экспрессия генов всех кластеров, включая известные маркерные гены и новые факторы транскрипции.
Кластеры с преобладанием HSPC человека состояли из мультипотентного предшественника, экспрессирующего SOX4 и CD34 , предшественника нейтрофилов, экспрессирующего CD177 , CSF3R и S100A9 , а также предшественника дендритных клеток 9-0007 9-0007, демонстрирующего высокую экспрессию MHC74 9II8000. родственные гены (дополнительная таблица S3) 6,9 . В клонах с доминированием HSPC мышей мы обнаружили три кластера предшественников нейтрофилов, два кластера предшественников моноцитов и кластер гемопоэтических стволовых клеток.Три предшественника нейтрофилов характеризовались высокой экспрессией CAMP , LCN2 , S100A8 и CEBPE 3,6,8 . Оба кластера предшественников моноцитов показали высокую экспрессию маркера моноцитов PRTN3 . Один предшественник моноцитов имел высокую экспрессию ELANE , MPO , CSTG и CD63 , тогда как другой предшественник характеризовался высокой экспрессией F13A1 , IRF8 и LY6E 6 .Кластер гемопоэтических стволовых клеток характеризуется высокой экспрессией GATA2 , FOS , LMO4 , JUN и ALOX5 .
Интересно, что среди кластеров, содержащих HSPC как человека, так и мыши, мы идентифицировали субпопуляции предшественников эритроидов, предшественников В-клеток, предшественников макрофагов и предшественников мегакариоцитов, которые экспрессируют соответствующие известные клон-специфичные маркеры, соответственно. Считалось, что кластер представляет собой общие предшественники эозинофилов, базофилов и тучных клеток (эозин / базо / тучные клетки) с экспрессией маркеров эозина / базо / тучных клеток.Мы также обнаружили субпопуляции, демонстрирующие комбинированную экспрессию генов гемопоэтических стволовых клеток и эритроидных генов (HSC / Early-ERY). Между тем, клетки человека и мыши в одних и тех же кластерах по-прежнему демонстрировали дифференциальную экспрессию модулей ортологичных генов (дополнительный рис. S2). Например, SOX4 и MYC экспрессировались в 100 раз выше в человеческих HSC / ранних эритроидных клетках-предшественниках, а CDK4 экспрессировались выше в мышиных HSC / ранних эритроидных клетках-предшественниках.
Чтобы проверить стабильность модели гемопоэтической дифференцировки in vivo, мы выполнили эксперимент по ксенотрансплантации, чтобы проверить модель гемопоэтической иерархии, выявленную с помощью нашего компьютерного анализа. Мы трансплантировали 1 × 10 5 клеток мобилизованной периферической крови (mPB) CD34 + сублетально облученной мыши NCG через полость бедра. Через два месяца после трансплантации человеческие клетки CD45 + CD34 + бедренной и большеберцовой кости мыши были отсортированы с помощью FACS.Мы обнаружили, что иерархия от мультипотентности к унипотентности в гематопоэтической системе человека в значительной степени выявляется в эксперименте с ксенотрансплантатом (Fig. 1g, h). Посредством анализа ГО в данных scRNA-seq этих человеческих клеток CD45 + CD34 + мы обнаружили, что человеческие HSPC изменили свои пути после эксперимента с ксенотрансплантатом (дополнительный рисунок S3). Эритроидный предшественник стимулировал метаболизм, связанный с метаболизмом углерода. Человеческие HSPC находятся в определенных нишах, которые предоставляют различные поучительные сигналы, регулирующие их самообновление и развитие.Suda et al. 10 предположили, что ниша может улучшать метаболическую регуляцию кроветворной системы. Эритроцитарная клетка является самым быстрым самообновляющимся типом клеток (кроветворная система генерирует 2 × 10 11 эритроцитов в день), различные пути метаболизма могут влиять на способность эритроцитов к самообновлению.
Наше исследование также определяет траекторию созревания от нейтрофилов-предшественников к зрелым клонам нейтрофилов у человека и мыши (Рис. 1i). Было установлено, что псевдотремя от другого унипотентного предка до зрелых клонов демонстрирует унипотентный предок точно раньше, чем зрелые клоны (дополнительный рис.S4).
Для дальнейшей проверки предшественников, примированных клонами, и их паттерна ранней дифференцировки, мы провели поиск маркеров клеточной поверхности, которые могут характеризовать различные кластеры. Мы использовали CD41, TFRC (CD71), CSF3R (CD114), CSF1R (CD115) и MHCII для обнаружения ранних мегакариоцитарных, эритроидных, нейтрофильных, моноцитарных и дендритных предшественников соответственно. С помощью специфических маркеров мы могли отделить по крайней мере пять видов предшественников с клонированием от клеток MPP человека (CD34 + CD38 — Thy1 — CD45RA — CD49f — ), HSC (D34 + CD38 — Thy1 + CD45RA — CD49f + ) и клетки CMP (CD34 + CD38 + CD45RA — ) соответственно (дополнительный рис.S5).
Филогенетическое дерево показало, что предшественники нейтрофилов были высококонсервативными у человека и мыши (дополнительный рисунок S6). Следовательно, мы выбрали нейтрофил в качестве кандидата и использовали анализы образования колоний и количественную ПЦР на одной клетке (qPCR), чтобы подтвердить наши вычислительные наблюдения. Мы также выбрали эритроцит в качестве кандидата из-за его хороших характеристик в анализе образования колоний. Схема стробирования определяла предшественников нейтрофилов (CD114 + / CD177 + ) и предшественников эритроцитов (CD71 + ) из клеток MPP, отсортированных из клеток периферической крови и клеток костного мозга (BM) (рис.1j). Анализ одноклеточного колониеобразования показал, что селекция CD71 + значительно обогатила клетки, генерирующие КОЕ-Е. Сорок один процент клонов, генерированных CD71 + MPP-mPB, были CFU-E, что в три раза больше, чем у CD71 — MPP-mPB. Между тем, селекция CD114 + обогащала клетки, генерирующие CFU-G. Процент клеток, генерирующих CFU-G, в CD114 + MPP-mPB в три раза больше, чем в CD114 — MPP-mPB. Мы нашли аналогичные результаты клонирования в MPP-BM (рис.1к). Анализ одноклеточной кПЦР предполагает, что CD71 и CD114 способны обогащать примированный эритроидом предшественник и предшественник, примированный нейтрофилами, со стадии MPP, соответственно (фиг. 11, дополнительная таблица S4 и фиг. S7).
В заключение, наш сравнительный транскриптомный анализ кроветворной системы выявил эволюционную консервацию в гемопоэтической иерархии у человека и мыши. Эксперименты по ксенотрансплантации на иммунодефицитных мышах помогли нам понять, что ниши могут играть роль в видоспецифичных клеточных фенотипах.Платформа Microwell-seq и метод сравнительного анализа одноклеточного транскриптома должны быть широко применимы к другим системам.
Доступ к данным
Необработанные данные секвенирования и данные DGE доступны через код доступа GSE92274 Омнибуса экспрессии генов (GEO).
Ссылки
- 1.
Оркин С. Х. и Зон Л. И. Гематопоэз: развивающаяся парадигма биологии стволовых клеток. Cell 132 , 631–644 (2008).
Артикул PubMed PubMed Central CAS Google Scholar
- 2.
Доулатов, С., Нотта, Ф., Лауренти, Э. и Дик, Дж. Э. Гематопоэз: взгляд человека. Стволовая клетка 10 , 120–136 (2012).
Артикул PubMed CAS Google Scholar
- 3.
Velten, L. et al. Компенсация клонов гемопоэтических стволовых клеток человека — это непрерывный процесс. Нац. Cell Biol. 19 , 271–281 (2017).
Артикул PubMed PubMed Central CAS Google Scholar
- 4.
Han, X. et al. Составление атласа клеток мыши с помощью Microwell-Seq. Ячейка 172 , 1091–1107 (2018).
Артикул PubMed CAS Google Scholar
- 5.
Батлер, А., Хоффман, П., Смиберт, П., Папалекси, Э. и Сатия, Р. Комплексный анализ транскриптомных данных отдельных клеток в разных условиях, технологиях и видах. Нац. Biotechnol. 36 , 411–420 (2018).
Артикул PubMed CAS Google Scholar
- 6.
Paul, F. et al. Транскрипционная гетерогенность и предопределенность клонов у миелоидных предшественников. Ячейка 163 , 1663–1677 (2015).
Артикул PubMed CAS Google Scholar
- 7.
Jaitin, D. A. et al. Массивно-параллельная одноклеточная последовательность РНК для безмаркерного разложения тканей на типы клеток. Наука 343 , 776–779 (2014).
Артикул PubMed PubMed Central CAS Google Scholar
- 8.
Novershtern, N. et al. Плотно связанные между собой транскрипционные цепи контролируют состояние клеток в кроветворении человека. Ячейка 144 , 296–309 (2011).
Артикул PubMed PubMed Central CAS Google Scholar
- 9.
Notta, F. et al. Четкие пути развития клонов меняют иерархию крови человека в онтогенезе. Наука 351 , aab2116 (2016).
Артикул PubMed CAS Google Scholar
- 10.
Суда, Т., Такубо, К. и Семенца, Г. Л. Метаболическая регуляция гемопоэтических стволовых клеток в гипоксической нише. Cell Stem Cell 9 , 298–310 (2011).
Артикул PubMed CAS Google Scholar
Скачать ссылки
Благодарности
Мы благодарим L. Shen, S. Ying, B. Liu, F. Tang, S. Quake, G. Fan, X. Li, X. Yu, L. Sun за помощь с этой работой. Мы благодарим G-BIO, Annoroad, VeritasGenetics и Novogen за эксперименты по глубокому секвенированию и Vazyme за предоставление индивидуальных ферментов для исследования.Эта работа была поддержана Национальным фондом естественных наук Китая (81770188, 31722027 и 31701290), фондами фундаментальных исследований для центральных университетов, Национальной ключевой программой исследований стволовых клеток и трансляционных исследований (2017YFA0103401) и Национальной программой фундаментальных исследований Китая ( 973; 2015CB964900).
Информация об авторе
Заметки автораЭти авторы внесли одинаковый вклад: Шуцзин Лай, Вентао Хуан, Ян Сю, Мэнмэн Цзян, Хайде Чен.
Филиалы
Центр стволовых клеток и регенеративной медицины, Медицинский факультет Чжэцзянского университета, Ханчжоу, Чжэцзян, 310058, Китай
Шуцзин Лай, Вентао Хуанг, Мэнмэн Цзян, Хайде Чено, Чэнь Го и Чэнь Го Сяопин Хан
Институт стволовых клеток, Университет Чжэцзян, Ханчжоу, Чжэцзян, 310058, Китай
Шуцзин Лай, Мэнмэн Цзян, Гоцзи Го и Сяопин Хань
UT-ORNL Высшая технологическая школа Университета генома Теннесси, Ноксвилл, Теннесси, 37996, США
Ян Сюй
Колледж зоотехники, Университет Чжэцзян, Ханчжоу, Чжэцзян, 310058, Китай
Хайде Чен
Больница интенсивной терапии, Первый филиал Медицинский университет Вэньчжоу, Вэньчжоу, Чжэцзян, 325000, Китай
Yingru Lu
Первая дочерняя больница, Zhejiang Uni Медицинская школа Versity, Ханчжоу, Чжэцзян, 310003, Китай
Хэ Хуан
Институт гематологии, Чжэцзянский университет, Ханчжоу, Чжэцзян, 310058, Китай
Хэ Хуан, Гоцзи Го и Сяопин Хан
Атлас клеток крови, Тяньцзинь, Китай
Хэ Хуан, Гоцзи Го и Сяопин Хан
Вклады
г.G., X.H. и H.H. разработали проект. S.L., M.J., H.C. и X.H. провел все эксперименты. Y.X., C.C., W.H. и S.L. проанализировали данные. S.L., W.H., G.G. и Y.L. написал газету.
Авторы-корреспонденты
Переписка на Хэ Хуан, Гоцзи Го или Сяопин Хань.
Декларации этики
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Дополнительная информация
Примечание издателя: Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий на опубликованных картах и институциональной принадлежности.
Дополнительные электронные материалы
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или любом формате при условии, что вы надлежащим образом укажете автора (авторов) и источник, укажите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие материалы третьих лиц в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной линии для материала.Если материал не включен в лицензию Creative Commons для статьи и ваше предполагаемое использование не разрешено законодательными актами или превышает разрешенное использование, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатки и разрешения
Об этой статье
Цитируйте эту статью
Лай, С., Хуанг, В., Сюй, Ю. et al. Сравнительный транскриптомный анализ кроветворной системы человека и мыши с помощью Microwell-seq. Cell Discov 4, 34 (2018). https://doi.org/10.1038/s41421-018-0038-x
Скачать цитату
Дополнительная литература
Сравнительный транскриптомный анализ кроветворной системы человека и мыши с помощью секвенирования одноклеточной РНК
- Шоугуо Гао
- , Чжицзе Ву
- , Джирти Каннан
- , Лиза Мэтьюз
- , Синмин Фэн
- , Сатико Каджигая
- и Нил С.Молодой
Ячейки (2021 год)
Передача сигналов фосфатидилинозитол-3 киназы контролирует выживаемость и стволовость гемопоэтических стволовых и клеток-предшественников
- Sasja Blokzijl-Franke
- , Bas Ponsioen
- , Stefan Schulte-Merker
- , Philippe Herbomel
- , Karima Kissa
- , Suma Choorapoikayil
- & Jerog
0 den Онкоген (2021 год)
Комплексное сетевое моделирование на основе секвенирования одноклеточной РНК человека и мыши показывает хорошо законсервированную регуляцию транскрипции гемопоэза.
- Шоуго Гао
- , Чжицзе Ву
- , Синмин Фэн
- , Сатико Кадзигая
- , Сюйцзин Ван
- и Нил С.Молодой
BMC Genomics (2020)
Десятилетие секвенирования всего экзома в гематологии
- Маркус К. Хансен
- , Торстен Хаферлах
- и Шарлотта Г. Ниволд
Британский гематологический журнал (2020)
Анализ отдельных клеток и машинное обучение определяют гематопоэтические клетки-предшественники и HSC-подобные клетки, полученные из человеческих PSC.
- Антонелла Фиданза
- , Патрик С.Стампф
- , Пракаш Рамачандран
- , Сара Таманьо
- , Энн Бэбти
- , Марта Лопес-Иригойен
- , А. Хелен Тейлор
- , Дженнифер Истербрук
- , Ричард Э. К. Хендерсон
- , Александр Медвинский
- , Катрин Оттерсбах
- , Никола Романо
- и Лесли М. Форрестер
Кровь (2020)
Набор для измерения потока гемопоэтических стволовых клеток человека (FMC019): R&D Systems
Многоцветный проточный набор для гемопоэтических клеток-предшественников человека, сводка
Обзор комплекта
Для проверки мультипотентности гематопоэтических клеток-предшественников с помощью 4-цветной проточной цитометрии.
Почему важно проверять идентичность гематопоэтических клеток-предшественников с помощью нескольких установленных маркеров?
Гематопоэтические стволовые клетки — это мультипотентные, самообновляющиеся клетки-предшественники, из которых в процессе кроветворения возникают все дифференцированные типы клеток крови. Использование нескольких маркеров для характеристики гематопоэтических предшественников повышает уверенность в идентичности клеток за счет четкого и последовательного определения популяции клеток-мишеней. См. Подробности
Кроме того, уникальная комбинация отрицательных и положительных маркеров, включенная в этот набор, снижает экспериментальные вариации в идентификации гемопоэтических клеток-предшественников, что приводит к оптимизированной исходной популяции клеток для вашего исследования.
- Использует комбинацию положительных и отрицательных маркеров клеточной поверхности для проверки идентичности клеток-предшественников
- Проверяет здоровую мультипотентную исходную популяцию клеток-предшественников для повышения согласованности исследований и уменьшения нежелательной экспериментальной изменчивости
- Не требует использования вторичных антител
Состав комплекта
Этот набор для проточной цитометрии содержит четыре первичных антитела, конъюгированных с флуорохромом, и соответствующие контроли изотипа, которые можно использовать для одноэтапного окрашивания гематопоэтических клеток-предшественников человека.В этот набор входят реагенты, достаточные для проведения 25 тестов. См. Подробности
Положительных маркеров:
- APC-конъюгированные мышиные антитела к человеческому CD34 (клон QBEnd10; мышиный IgG 1 )
- PE-конъюгированные мышиные антитела против SCF человека R / CD117 (клон 47233; мышиный IgG 1 )
Отрицательные маркеры:
- PerCP-конъюгированные мышиные антитела к человеческому CD38 (клон 240742; мышиный IgG 2A )
- Мышиные антитела против CD11b человека, конъюгированные с CFS (клон 238446, IgG 2B )
Положительные контроли изотипов
- APC-конъюгированный IgG мыши 1 Изотипический контроль (клон 11711)
- Мышиный IgG, конъюгированный с PE 1 Изотипический контроль (клон 11711)
Отрицательные контроли изотипа
- Мышиный IgG, конъюгированный с PerCP 2A Изотипический контроль (клон 20102)
- Мышиный IgG, конъюгированный с CFS 2B Изотип-контроль (клон 133303)
Окончательная система кроветворения состоит из всех типов взрослых клеток крови, включая мегакариоциты, эритроциты и клетки миелоидного и лимфоидного происхождения.Все эти клетки происходят из мультипотентных гемопоэтических стволовых клеток (HSC) через последовательность предшественников с прогрессивно ограниченным потенциалом. Гемопоэтические стволовые клетки — это тканеспецифические стволовые клетки, которые демонстрируют замечательную способность к самообновлению и отвечают за поддержание кроветворной системы в течение всей жизни. HSC — это редкие клетки, которые находятся во взрослом костном мозге, где постоянно происходит кроветворение. Их также можно найти в пуповинной крови, печени плода, селезенке взрослого человека и периферической крови.R&D Systems предлагает несколько продуктов для изучения гемопоэтических клеток, в том числе бессывороточные среды, антитела и наборы для истощения клонов, а также реагенты для проведения анализов колониеобразующих клеток (CFC).
Условия доставки
Товар поставляется в полярной упаковке.После получения немедленно храните его при температуре, рекомендованной ниже.
Хранилище
Храните неоткрытый продукт при температуре 2–8 ° C. Не используйте просроченный срок годности.
Пример данных
Идентификация гемопоэтических клеток-предшественников человека с помощью многоцветной проточной цитометрии.Клетки пуповинной крови человека окрашивали с использованием реагентов, поставляемых в этом наборе. Одновременно клетки анализировали на экспрессию маркеров мультипотентности. Клетки, отрицательные по CD11b и отрицательные / низкие по CD38 (область в рамке в A), отбирались и оценивались на позитивную экспрессию CD34 и SCF R / CD117 (верхний правый квадрант в B). Квадранты были установлены на основе контроля изотипа.
Идентификация гемопоэтических клеток-предшественников человека с помощью многоцветной проточной цитометрии.Клетки пуповинной крови человека окрашивали указанными антителами, включенными в этот набор. Репрезентативная экспрессия каждого аналита в общей популяции клеток пуповинной крови (закрашенная гистограмма) по сравнению с контролем изотипа (открытая гистограмма).
Процедура анализа
Полную информацию о продукте см. В техническом описании продукта.
Вкратце, гемопоэтические клетки-предшественники идентифицируют проточной цитометрией с использованием следующей процедуры:
- Приостановить клетки в буфере для окрашивания проточной цитометрии
- Инкубируйте клетки с антителами, конъюгированными с флуорохромом, или с контролями изотипа
- Мойка ячеек
- Ресуспендировать в буфере для проточной цитометрии
- Анализ проточной цитометрией
Реагенты предоставлены
Реагенты, входящие в состав многоцветного проточного набора для гемопоэтических клеток-предшественников человека (Каталожный номер FMC019)
- APC-конъюгированные мышиные антитела к человеческому CD34 (клон QBEnd10; мышиный IgG 1 )
- PE-конъюгированные мышиные антитела против SCF человека R / CD117 (клон 47233; мышиный IgG 1 )
- Мышиные антитела против CD38 человека, конъюгированные с PerCP (клон 240742; мышиный IgG 2A )
- Мышиные антитела против CD11b человека, конъюгированные с CFS (клон 238446, IgG 2B )
- APC-конъюгированный IgG мыши 1 Изотипический контроль (клон 11711)
- Мышиный IgG, конъюгированный с PE 1 Изотипический контроль (клон 11711)
- Мышиный IgG, конъюгированный с PerCP 2A Изотип-контроль (клон 20102)
- Мышиный IgG, конъюгированный с CFS 2B Изотип-контроль (клон 133303)
- Буфер для проточной цитометрии для окрашивания
Требуются другие расходные материалы
Реактивы
- Реагенты, блокирующие рецептор Fc
Материалы
- Пробирки для проточной цитометрии / FACS ™ (полистирольные пробирки с круглым дном 5 мл)
- Наконечники для дозаторов и дозаторы
Оборудование
Обзор процедуры
- Ресуспендируйте клеток в буфере для окрашивания проточной цитометрии из расчета 1 x 10 5 клеток / 100 мкл.
- Добавьте реагентов, блокирующих рецептор Fc. При использовании избыточного преиммунного IgG для блокирования рецептора Fc избыток IgG не нужно вымывать из клеток после периода инкубации.
- Перенесите примерно 100 мкл клеток, блокированных рецептором Fc (примерно 1 x 10 5 клеток) в 5 мл проточную цитометрическую пробирку.
- Добавьте 10 мкл каждого антитела или каждого соответствующего контрольного антитела изотипа.
- Инкубируйте смесь в течение 30-45 минут при комнатной температуре в темноте.
- Центрифуга образцов при 300 x g в течение 5 минут.
- Вымойте клетки 2 мл окрашивающего буфера для проточной цитометрии.
- Ресуспендируйте осадок клеток в 200–400 мкл окрашивающего буфера для проточной цитометрии.
- Анализируйте экспрессию маркеров гемопоэтических клеток-предшественников одновременно с помощью проточной цитометрии.
методов JoVE | Инженерные подходы к расшифровке кроветворной системы человека при здоровье и болезнях
Только началось
Коллекции методов
Инженерные подходы к расшифровке кроветворной системы человека при здоровье и болезнях
Отправить рукопись Связаться с редактором Отправить аннотацию
Приглашенные редакторы
Поль БурджинЛундский университет
Поль Бургин изучал биотехнологию в Высшей школе биотехнологии Страсбурга (Франция), где он…
Обзор коллекции
У людей наше понимание кроветворного процесса и его регуляции средой костного мозга остается неуловимым.Дальнейшее понимание представляется важным как с фундаментальной точки зрения, так и в свете потенциально огромных трансляционных последствий: от определения факторов, управляющих целевым производством крови и производства крови по требованию, до понимания образования рака крови и последующего уточнения клинических методов лечения. . В настоящее время наши знания в основном основаны на моделях животных, которые доказали свою важную роль в нашем прогрессивном понимании гематопоэтической системы. Однако животные и люди демонстрируют важные молекулярные и клеточные различия, что требует разработки более актуальных моделей человека.
В этом сборнике мы стремимся собрать статьи, описывающие методологии in vitro или in vivo, позволяющие изучать кроветворение человека в здоровых и злокачественных условиях. Это в значительной степени включает в себя (i) разработку 2D или 3D среды костного мозга для расшифровки организации / взаимодействия компонентов кроветворных клеток, (ii) разработку инновационных систем / условий культивирования, способствующих поддержанию или дифференцировке гемопоэтических клеток человека, и (iii) ) подходы к моделированию злокачественных новообразований крови и тестовой терапии.Цель этого сборника — осветить последние методологические разработки в этой области и способствовать сбору информации, специфической для человека.
Узнать больше
Набор для проточной цитометрии гематопоэтических клеток-предшественников человека (FMC019-NOV): Novus Biologicals
Краткое описание набора для проточной цитометрии клеток-предшественников гемопоэза человека
Описание Этот продукт разработан для одностадийного проточного цитометрического анализа HPC человека с использованием четырех антител, конъюгированных с флуорохромом. Характеристики - Проверяет идентичность гемопоэтических клеток-предшественников человека в течение 2 часов
- Экономичный набор обеспечивает оптимизированную комбинацию антител
- Множественные маркеры клеточной поверхности снижают экспериментальную изменчивость
- Определяет начальную популяцию клеток
Комплект Тип Набор для проточной цитометрии
Упаковка, хранение и составы
Хранение Магазин на 4С.Не мерзни.
Компоненты комплекта
Компоненты - Положительный маркер: 250 мкл мышиного IgG1 CD34-APC; Клон QBEnd10
- Положительный маркер: 250 мкл мышиного IgG1 SCF R / CD117-PE; Клон 47233
- Положительный изотипический контроль: 250 мкл мышиного IgG1-APC; Клон 11711
- Положительный изотипический контроль: 250 мкл мышиного IgG1-PE; Клон 11711
- Отрицательный маркер: 250 мкл мышиного IgG2B CD11b-CFS; Клон 238446
- Отрицательный маркер: 250 мкл мышиного IgG2A CD38-PerCP; Клон 240742
- Отрицательный изотипический контроль: 250 мкл мышиного IgG2A-PerCP; Clone 20102
- Отрицательный изотипический контроль: 250 мкл мышиного IgG2B-CFS; Клон 133303
- 100 мл 1X буфера для окрашивания
Фон
Окончательная система кроветворения состоит из всех типов взрослых клеток крови, включая мегакариоциты, эритроциты и клетки миелоидного и лимфоидного происхождения.Все эти клетки происходят из мультипотентных гемопоэтических стволовых клеток (HSC) через последовательность предшественников с прогрессивно ограниченным потенциалом. Гемопоэтические стволовые клетки — это тканеспецифические стволовые клетки, которые демонстрируют замечательную способность к самообновлению и отвечают за поддержание кроветворной системы в течение всей жизни. HSC — это редкие клетки, которые находятся во взрослом костном мозге, где постоянно происходит кроветворение. Их также можно найти в пуповинной крови, печени плода, селезенке взрослого человека и периферической крови.
Ограничения
Этот продукт предназначен только для исследовательского использования и не одобрен для использования на людях или для клинической диагностики. Гарантия на комплекты составляет 6 месяцев с момента получения.Публикации по набору гематопоэтических клеток-предшественников человека (FMC019-NOV) (0)
Публикаций по набору гематопоэтических клеток-предшественников человека (FMC019-NOV) нет.
Отправляя информацию о публикации, зарабатывайте подарочные карты и скидки для будущих покупок.
Отзывы о наборе гемопоэтических клеток-предшественников человека (FMC019-NOV) (0)
Нет обзоров для Набор для гемопоэтических клеток-предшественников человека (FMC019-NOV). Отправив отзыв, вы получите электронную подарочную карту Amazon или скидку на продукцию Novus.- Обзор без изображения — 10 долларов / 7 евро / 6 фунтов стерлингов / 10 канадских долларов / 70 юаней / 1110 йен
- Обзор с изображением — 25 долларов / 18 евро / 15 фунтов стерлингов / 25 канадских долларов / 150 юаней / 2500 иен
Общие протоколы продукта
Найдите общую поддержку по приложениям, включая протоколы, устранение неполадок, иллюстрированные анализы, видео и вебинары.Часто задаваемые вопросы по набору гематопоэтических клеток-предшественников человека (FMC019-NOV) (0)
Другие доступные форматы
Дополнительные продукты гемопоэтических клеток-предшественников человека
Блоги о гемопоэтических клетках-предшественниках человека
.
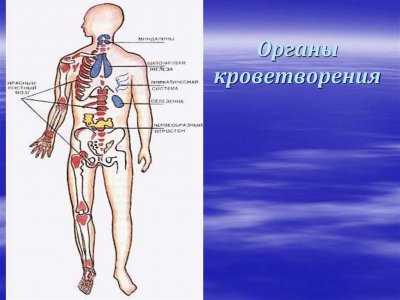
 виды исследований, которые помогут в диагностике заболеваний крови.
виды исследований, которые помогут в диагностике заболеваний крови. Но, тем не менее, следует избегать
передозировки витамина. Хотя аскорбиновая кислота нетоксична и ее избыток выводится из организма, все же потребление ее в
слишком больших количествах может вызвать аллергическую реакцию. При гиповитаминозе С отмечаются нарушения общего состояния
организма (снижение работоспособности, быстрая утомляемость, слабость, раздражительность), склонность к кровоточивости десен,
железодефицитная анемия.
Но, тем не менее, следует избегать
передозировки витамина. Хотя аскорбиновая кислота нетоксична и ее избыток выводится из организма, все же потребление ее в
слишком больших количествах может вызвать аллергическую реакцию. При гиповитаминозе С отмечаются нарушения общего состояния
организма (снижение работоспособности, быстрая утомляемость, слабость, раздражительность), склонность к кровоточивости десен,
железодефицитная анемия.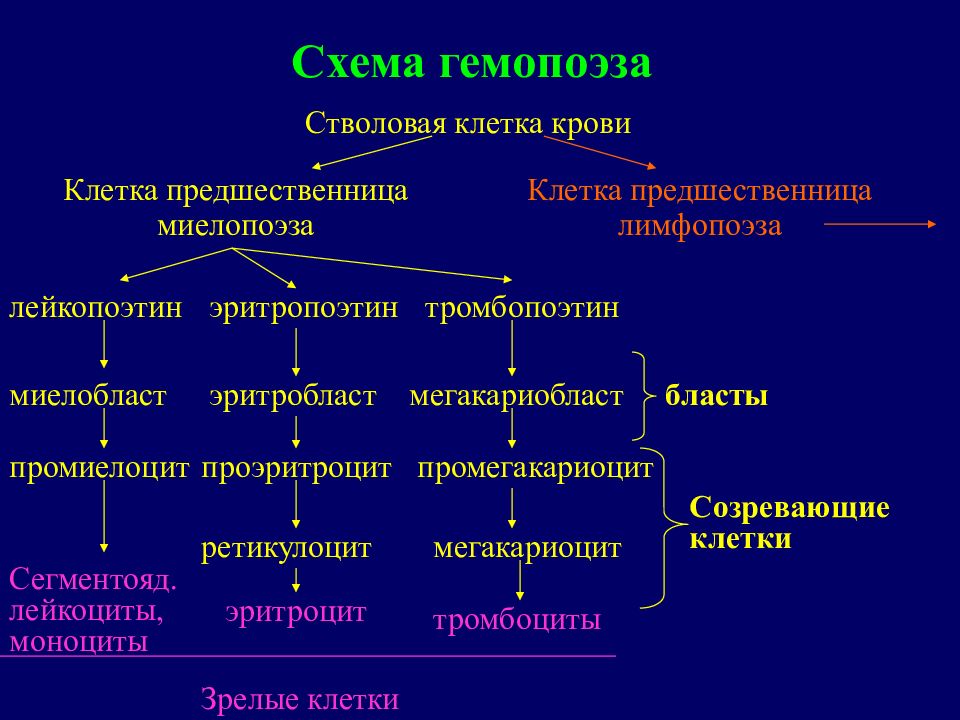 Он необходим для роста, развития и обновления (регенерации) тканей, поддержания активности иммунной зашиты, предохранения
от поражений кожи и слизистых оболочек, для обеспечения зрения. От витамина А зависит защитная способность организма, его
покровных тканей — кожи, слизистых оболочек. Поэтому нередко этот витамин называют «первой линией обороны
против болезней».
Он необходим для роста, развития и обновления (регенерации) тканей, поддержания активности иммунной зашиты, предохранения
от поражений кожи и слизистых оболочек, для обеспечения зрения. От витамина А зависит защитная способность организма, его
покровных тканей — кожи, слизистых оболочек. Поэтому нередко этот витамин называют «первой линией обороны
против болезней». Страдают также органы зрения — теряется способность
видеть в сумерках, развиваются явления конъюнктивита и сухость роговицы.
Страдают также органы зрения — теряется способность
видеть в сумерках, развиваются явления конъюнктивита и сухость роговицы. 
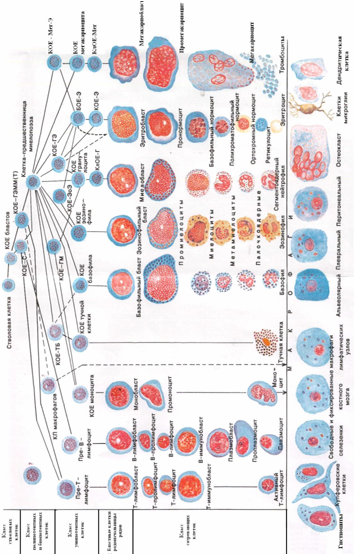
 Возникает также глоссит
(воспаление языка), нарушается секреция желудочного сока, раз��иваются упорные поносы. Поражение кожи характеризуется симметричным
воспалением (дерматитом) лица и открытых частей тела.
Возникает также глоссит
(воспаление языка), нарушается секреция желудочного сока, раз��иваются упорные поносы. Поражение кожи характеризуется симметричным
воспалением (дерматитом) лица и открытых частей тела.