Дисметаболическая нефропатия у детей — причины, симптомы, диагностика и лечение

Дисметаболическая нефропатия у детей – структурные и функциональные изменения почек, развивающиеся на фоне нарушения обмена веществ, сопровождающегося кристаллурией. Дисметаболическая нефропатия у детей клинически может проявляться аллергией и зудом кожи, отеками, болями в пояснице, гипотонией, выделением мутной мочи. У детей дисметаболическая нефропатия обычно впервые диагностируется при исследовании общего анализа мочи; расширенная диагностика включает УЗИ почек, биохимический анализ мочи. Лечение дисметаболической нефропатии у детей проводится с учетом ее вида и включает диету, медикаментозную коррекцию метаболических нарушений и физико-химических свойств мочи, фитотерапию.
Общие сведения
Дисметаболическая нефропатия у детей – группа обменных нарушений, сопровождающихся повышенной экскрецией с мочой различных солей (оксалатов, уратов, фосфатов) и как следствие — повреждением почечных структур. В детской урологии дисметаболические нефропатии составляют около 27-64% всех заболеваний мочевыделительной системы у детей; в практике педиатрии признаки обменных нарушений в моче встречаются практически у каждого третьего ребенка. Дети с дисметаболическими нефропатиями относятся к группе высокого риска по развитию интерстициального нефрита, пиелонефрита, мочекаменной болезни.
Классификация дисметаболической нефропатии у детей
- оксалатно-кальциевой кристаллурией (85-90%)
- фосфатной кристаллурией (3–10%)
- уратной кристаллурией (5%)
- цистиновой кристаллурией (3%)
- смешанной (оксалатно/фосфатно-уратной) кристаллурией
С учетом причин возникновения выделяют первичные и вторичные дисметаболические нефропатии у детей. Первичные нефропатии – это наследственно обусловленные заболевания, имеющее прогрессирующее течение и рано приводящие к нефролитазу и хронической почечной недостаточности. К группе вторичных нефропатий у детей относятся различные дисметаболические расстройства, протекающие с кристаллурией и развивающиеся на фоне поражения других органов.
Причины дисметаболической нефропатии у детей
Дисметаболическая нефропатия у детей – полиэтиологичный синдром, возникающий при участии множества факторов. Общими причинами могут выступать отравления и интоксикации, тяжелые физические нагрузки, длительный прием лекарственных веществ, монодефицитные диеты. Отмечено частое развитие дисметаболической нефропатии у детей, рожденных от беременности, протекавшей с поздним токсикозом и гипоксией плода, а также детей с нервно-артритическим диатезом. Первичные нефропатии могут быть обусловлены метаболическими нарушениями у родственников ребенка либо накопленными мутациями, вызывающими дисбаланс регуляторных клеточных механизмов у него самого.
Кроме общих причин, в возникновении того или иного вида дисметаболической нефропатии у детей имеет значение воздействие частных факторов.
Оксалатная дисметаболическая нефропатия у детей (оксалурия) патогенетически связана с нарушением обмена кальция и солей щавелевой кислоты (оксалатов). Определенную роль в ее развитии играет дефицит витаминов А, В6, Е, магния, калия; передозировка витамина D в процессе лечения рахита; повышенное поступление оксалатов с пищей. Оксалатная дисметаболическая нефропатия часто встречается у детей с болезнью Крона, энтеритом, колитом, хроническим панкреатитом, дискинезией желчевыводящих путей, сахарным диабетом, пиелонефритом.
Уратная дисметаболическая нефропатия у детей характеризуется выделением с мочой и отложением в почках уратов — натриевой соли мочевой кислоты. Первичная (наследственная) уратурия чаще всего встречается у детей с синдромом Леша-Найхана. Вторичные нефропатии сопровождают течение эритремии, гемолитической анемии у детей, миеломной болезни, пиелонефрита. Возможно развитие уратной дисметаболической нефропатии у детей, получающих лечение цитостатиками, тиазидовыми диуретиками, салицилатами, циклоспорином А и др.
Причинами фосфатурии могут выступать хроническая мочевая инфекция, первичный и вторичный гиперпаратиреоз, заболевания ЦНС. Цистинурия развивается при системном нарушении обмена цистина – цистинозе, характеризующемся внутриклеточным и внеклеточным накоплением кристаллов цистина в интерстиции и канальцах почек, селезенке, печени, лимфоузлах, клетках крови, костном мозге, нервной и мышечной ткани. Вторичная цистиновая дисметаболическая нефропатия у детей обычно связана с пиелонефритом или тубулярным интерстициальным нефритом.
Симптомы дисметаболической нефропатии у детей
Признаки оксалатной дисметаболической нефропатии у ребенка могут манифестировать уже в период новорожденности, однако в большинстве случаев заболевание длительное время протекает латентно. В родословной детей с дисметаболической нефропатией отмечаются артропатии, подагра, спондилез, мочекаменная болезнь, желчнокаменная болезнь, сахарный диабет.
Чаще всего кристаллурия обнаруживается у детей 5-7 лет случайно, при исследовании общего анализа мочи. Внимательные родители могут заметить, что на вид моча ребенка мутная, с осадком, нередко образует на стенках горшка трудно смываемый налет.
При дисметаболической нефропатии у детей отмечается склонность к аллергическим кожным реакциям, вегето-сосудистой дистонии, гипотонии, головным болям, артралгиям, ожирению. Дети могут испытывать повышенную утомляемость, колющие боли в пояснице, частые и болезненные мочеиспускания, энурез, покраснение и зуд в области наружных половых органов, мышечную гипотонию, субфебрилитет, диспепсии, вздутие живота.
Обострение и прогрессирование заболевания отмечается в пубертатном периоде в связи с гормональной перестройкой. Дисметаболическая нефропатия у детей выступает риск-фактором образования камней в почках и мочевом пузыре, развития хронического пиелонефрита и хронической почечной недостаточности.
Диагностика дисметаболической нефропатии у детей
Кроме педиатра, в диагностике дисметаболической нефропатии у детей обязательно должен участвовать детский нефролог или детский уролог.
Общий анализ мочи выявляет кристаллурию, протеинурию, гематурию, абактериальную лейкоцитурию, цилиндрурию. При биохимическом исследовании мочи определяется повышенная концентрация тех или иных солей (оксалатов, фосфатов, уратов и др.). В комплексе лабораторной диагностики проводятся функциональные пробы мочи по Зимницкому, Аддису–Каковскому, Нечипоренко, определение рН мочи. При наслоении вторичной бактериальной инфекции необходимо бактериологическое исследование мочи на микрофлору.
УЗИ почек и мочевого пузыря у детей с дисметаболической нефропатией может обнаруживать кристаллические включения, указывающие на наличие песка или конкрементов. Дисметаболическую нефропатию у детей следует отличать от транзиторной кристаллурии, связанной с ОРВИ, обильным приемом некоторых продуктов.
Лечение дисметаболической нефропатии у детей
К основным принципам лечения дисметаболической нефропатии у детей относятся: соблюдение рациональной диеты, нормализация обменных процессов, устранение условий для кристаллообразования и усиление выведения солей.
При оксалатной дисметаболической нефропатии у детей из рациона исключаются мясные бульоны, шпинат, щавель, клюква, морковь, свекла, какао, шоколад; предпочтение отдается картофельно-капустной диете. Медикаментозная терапия проводится мембранотропными препаратами (витамин В6, А, диметилоксобутилфосфонилдиметил) и антиоксидантами (витамин Е).
Диета при уратной дисметаболической нефропатии у детей не должна содержать продукты, богатые пуриновыми основаниями (почки, печень, мясные бульоны, фасоль, горох, какао и др.). Основу рациона составляют молочные и растительные продукты. Для снижения синтеза мочевой кислоты назначается аллопуринол, никотинамид, фитосборы и др.
При фосфатной дисметаболической нефропатии у детей рекомендуется ограничение продуктов, богатых фосфором (сыров, печени, бобовых, курицы, шоколада). Необходимо подкисление мочи за счет употребления минеральных вод и лекарственных препаратов (аскорбиновой кислоты, настойки корня марены красильной).
Лечение цистиноза включает диету с исключением из питания ребенка продуктов, богатых серосодержащими аминокислотами и метионином (рыбы, творога, яиц и др.). Важно обязательное подщелачивание мочи с помощью цитратной смеси, раствора гидрокарбоната натрия, щелочных минеральных вод. С целью предупреждения кристаллизации цистина назначается прием пеницилламина.
При любом виде дисметаболической нефропатии у детей важна достаточная водная нагрузка, способствующая уменьшению концентрации солей в моче, соблюдение ребенком режима принудительного мочеиспускания (через каждые 1,5-2 ч). В качестве альтернативной коррекции метаболических процессов может проводиться гомеопатическое лечение под контролем детского гомеопата.
Прогноз и профилактика дисметаболической нефропатии у детей
При соблюдении диеты и лекарственной терапии прогноз дисметаболической нефропатии у детей благоприятен: происходит стойкая нормализация биохимических показателей в моче. В случае несоблюдения общего и терапевтического режима естественным исходом нефропатии является пиелонефрит и мочекаменная болезнь. При цистинозе больные, как правило, нуждаются в трансплантации почки, однако выпадение кристаллов цистина со временем развивается и в трансплантате, приводя к гибели детей в возрасте 15–19 лет.
Диспансерное наблюдение детей с дисметаболической нефропатией проводится педиатром и детским нефрологом. Профилактика дисметаболической нефропатии у детей требует соблюдения детьми питьевого режима, исключение действия предрасполагающих факторов, лечение сопутствующей патологии, обследование детей из групп риска.
Дисметаболическая нефропатия: виды, симптомы, лечение
Дисметаболические нефропатии – группа заболеваний, которые характеризуются поражением почек вследствие нарушения обмена веществ.
В зависимости от причины развития выделяют первичные и вторичные дисметаболические нефропатии.
Первичные являются наследственно обусловленными заболеваниями, характеризуются прогрессирующим течением, ранним развитием мочекаменной болезни и хронической почечной недостаточности.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их обмена в связи с поражением других органов и систем (например желудочно-кишечного тракта), лекарственной терапией и др.
Подавляющее большинство дисметаболических нефропатий связаны с нарушением обмена кальция (от 70 до 90%), около 85–90% из них – с избытком солей щавелевой кислоты, оксалатов (в виде оксалата кальция), остальные с избытком фосфатов (фосфаты кальция – 3–10%) или являются смешанными – оксалатно/фосфатно-уратными.
Первичные дисметаболические нефропатии встречаются редко.
Проявления дисметаболических нефропатий
Она наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением как обмена кальция, так и обмена оксалатов (солей щавелевой кислоты).
Оксалаты попадают в организм с пищей или синтезируются самим организмом.
Причины образования оксалатов:
- Повышенное поступление оксалатов с пищей
- Заболевания кишечника – болезнь Крона, язвенный колит, кишечные анастомозы
- Повышенная выработка оксалатов организмом.
Оксалатная нефропатия
Это многофакторное заболевание. По данным различных авторов, доля наследственности в развитии оксалатной нефропатии составляет до 70–75%. Помимо генетических, большую роль играют внешние факторы: питание, стресс, экологическая нагрузка и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности.
Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи.
Общее развитие детей с оксалатной нефропатией, как правило, не страдает; но для них характерны аллергии, ожирение, вегетативно-сосудистая дистония со склонностью к понижению артериального давления (гипотонии), головными болями.
Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни, развитию воспаления почек при наслоении бактериальной инфекции.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы.
Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Нарушения обмена мочевой кислоты (уратная нефропатия)
За сутки в организме образуется 570–1000 мг мочевой кислоты, одна треть количества которой секретируется в кишечник и разрушается там бактериями.
Остальные две трети фильтруются в почках, большая часть всасывается обратно, и только 6–12% от профильтровавшегося количества выделяется с мочой.
Первичные уратные нефропатии обусловлены наследственными нарушениями обмена мочевой кислоты.
Вторичные возникают как осложнения других заболеваний (эритремии, миеломной болезни, хронической гемолитической анемии и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например).
Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
А в общем анализе мочи обнаруживают ураты, небольшое количество белка и эритроцитов. При наличии большого количества уратов моча приобретает кирпичный цвет.
Нарушения обмена цистина
Цистин является продуктом обмена аминокислоты метионина.Можно выделить две основные причины повышения концентрации цистина в моче:
- избыточное накопление цистина в клетках почки
- нарушение обратного всасывания цистина в почечных канальцах.
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом.
Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах.
Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Диагностика
Лабораторно-инструментальная диагностика дисметаболической нефропатии основывается на
- выявлении кристаллов солей в общем анализе мочи,
- повышении концентрации тех или иных солей в биохимическом исследовании мочи,
- исследовании антикристаллообразующей способности мочи (АКОСМ),
- проведении тестов на кальцифилаксию и перекиси в моче,
- УЗИ почек.
Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза дисметаболической нефропатии. Следует иметь в виду, что выделение кристаллов с мочой у детей часто бывает преходящим и оказывается не связанным с нарушением обмена веществ.
Для подтверждения диагноза дисметаболической нефропатии при выявлении кристаллов солей в общем анализе мочи проводится биохимическое исследование мочи.
Тест на кальцифилаксию позволяет выявить нарушения клеточного обмена кальция. Тест на перекиси в моче отражает активность процессов перекисного окисления клеточных мембран.
Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микрокамешков или включений.
Лечение дисметаболических нефропатий
Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
- нормализация образа жизни;
- правильный питьевой режим;
- диета;
- специфические методы терапии.
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение кристаллообразования, выведение солей, нормализацию обменных процессов.
Лечение оксалатной нефропатии
Рекомендации по питанию
- При лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на почки.
- Необходимо исключить холодец, крепкие мясные бульоны, щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад.
- Рекомендуется ввести в рацион курагу, чернослив, груши.
- Из минеральных вод используются такие, как славяновская и смирновская, по 3–5 мл/кг/сут. в 3 приема курсом 1 месяц 2–3 раза в год.
Медикаментозная терапия
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным.
- Пиридоксин (витамин В6) назначается в дозе 1–3 мг/кг/сут. в течение 1 месяца ежеквартально.
- Витамин В6 оказывает мембраностабилизирующее действие за счет участия в обмене жиров в качестве антиоксиданта и обмене аминокислот. Целесообразно также назначение препарата магне В6 из расчета 5–10 мг/кг/сут. курсом в течение 2 месяцев 3 раза в год.
- Мембраностабилизирующее действие оказывает витамин А, который нормализует взаимодействие белков и липидов мембраны клетки. Суточная доза витамина А 1000 МЕ на год жизни ребенка, курсом – 1 месяц ежеквартально.
- Токоферола ацетат (витамин Е) является мощным антиоксидантом, который поступает в организм извне и вырабатывается самим организмом. Необходимо помнить, что избыточное введение витамина Е с пищей может тормозить его внутреннюю продукцию по механизму отрицательной обратной связи. Витамин Е укрепляет белково-липидные связи клеточных мембран. Назначается с витамином А в дозе 1–1,5 мг/кг массы в сутки.
В качестве мембраностабилизаторов используются димефосфон и ксидифон.
Димефосфон применяется в дозе 1 мл 15% раствора на каждые 5 кг веса, 3 приема в сутки. Курс – 1 месяц, 3 раза в год.
Ксидифон предупреждает отложение нерастворимых солей кальция. Назначается в дозе 10 мг/кг/сут. 2% раствора в 3 приема. Курс – 1 месяц, 2 раза в год.
Высокую эффективность имеет цистон, особенно при кристаллурии. Цистон назначается в дозе 1–2 таблетки 2–3 раза в день курсом от 3 до 6 месяцев.
Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов, в дозе 0,15–0,2 г/сут.
Лечение уратной нефропатии
Диета
- При лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печени, почек, мясных бульонов, гороха, фасоли, орехов, какао и др.).
- Преимущество должно отдаваться продуктам молочного и растительного происхождения.
- Важным условием успешной терапии является достаточное употребление жидкости – от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер, спорыш и др.), отвару овса.
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси (уралит-У, блемарен, магурлит, солимок и др.).
При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты – аллопуринол, никотинамид.
Применение в педиатрии аллопуринола ограничено из-за возможных осложнений со стороны кожи, печени, крови.
Под строгим контролем аллопуринол назначают в дозе 0,2–0,3 г/сут. в 2–3 приема в течение 2–3 недель, затем доза снижается. Длительность общего курса – до 6 месяцев.
Никотинамид является более слабым препаратом, чем аллопуринол, но лучше переносится; назначается в дозе 0,005–0,025 г 2–3 раза в сутки по 1–2 месяца повторными курсами.
Мочевую кислоту выводят также оротовая кислота, цистон, этамид, цистенал, фитолизин и др.
Лечение фосфатной нефропатии
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение цистиноза
Лечение цистиноза и цистинурии включает диету, высокожидкостный режим и медикаментозную терапию, направленную на подщелачивание мочи и повышение растворимости цистина.
Цель диетотерапии – предотвратить избыточное поступление в организм ребенка предшественника цистина – метионина и других серосодержащих кислот.
Для этого также исключают (или резко ограничивают) из рациона питания ребенка богатые метионином и серосодержащими аминокислотами продукты – творог, рыбу, яйца, мясо и др.
Поскольку метионин необходим организму ребенка для роста, длительное применение строгой диеты невозможно, поэтому через 4 недели от начала диетотерапии рацион ребенка расширяется и приближается к обычному, но характеризуется строгим исключением рыбы, творога и яиц.
Количество жидкости должно быть не менее 2 л/сут., особенно важно принимать жидкость перед сном.
Для подщелачивания мочи используется цитратная смесь, растворы гидрокарбоната натрия, блемарен, щелочные минеральные воды.
Для повышения растворимости цистина и предупреждения кристаллизации назначается пеницилламин. Он обладает некоторой токсичностью, поэтому в начале терапии назначаются невысокие дозы препарата – 10 мг/кг/сут. в 4–5 приемов, далее доза увеличивается в течение недели до 30 мг/кг/сут., а при цистинозе – до 50 мг/кг/сут.
Лечение пеницилламином должно проводиться под контролем содержания цистина в лейкоцитах и/или цианиднитропруссидного теста (проба на цистин в моче, где концентрация цистина должна составлять до 150–200 мг/л). При достижении этих показателей доза пеницилламина снижается до 10–12 мг/кг/сут.
Лечение пеницилламином проводится длительно, годами. Поскольку пеницилламин инактивирует пиридоксин, параллельно назначается витамин В6 (пиридоксин) в дозе 1–3 мг/кг/сут. в течение 2–3 месяцев с повторными курсами.
Для стабилизации мембран почечных канальцев назначаются витамин А (6600 МЕ/сут) и витамин Е (токоферол, 1 капля на 1 год жизни 5% раствора в сутки) в течение 4–5 недель с повторными курсами.
Имеются данные о положительном эффекте применения вместо пеницилламина менее токсичного его аналога – купренила в уменьшенной дозе в сочетании с ксидифоном и другими мембраностабилизаторами.
Антибактериальная терапия показана при присоединении инфекции.
При цистинозе успешно используется трансплантация почки, которая проводится до развития терминальной стадии хронической почечной недостаточности. Трансплантация почки позволяет значительно увеличить срок жизни больных – до 15–19 лет, однако отложение кристаллов цистина наблюдается и в трансплантате, что в конечном итоге приводит к поражению и пересаженной почки.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен.
В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче.
В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Дисметаболические нефропатии в практике педиатра | #01/19
Диcметаболические нефропатии (ДН) — гетерогенная группа заболеваний с различной этиологией и патогенезом, которые характеризуются поражением тубулоинтерстициального аппарата почек вследствие нарушения обмена веществ [1, 2, 9].
Проблема ДН является достаточно актуальной в педиатрии и детской нефрологии. Это обусловлено высокой частотой ДН в популяции, а также возможностью их прогрессирования вплоть до развития мочекаменной болезни и/или тубулоинтерстициального нефрита. В структуре заболеваемости мочевыделительной системы у детей ДН составляет от 27% до 64%, а в повседневной практике врача-педиатра синдром обменных нарушений в моче встречается практически у каждого третьего больного [8]. Параллельно отмечается увеличение частоты мочекаменной болезни (МКБ) в популяции в целом, которая в возрастной группе 65–69 лет у мужчин достигает 8,8%, у женщин — 5,6%, а в более молодом возрасте — 3,7% у мужчин и 2,8% у женщин [11]. Одной из причин повсеместного роста частоты МКБ является реализация во взрослом возрасте обменных нарушений, возникших в детстве. По данным эпидемиологического исследования, проведенного V. Romero (2010), частота уролитиаза в таких странах, как США, Италия, Германия, Испания, Япония, за последние 20 лет удвоилась, а в последние годы наблюдается наиболее драматический рост этого показателя [14].
В зависимости от причины выделяют первичные и вторичные ДН. Первичные ДН развиваются в рамках системных наследственно-обусловленных нарушений обмена, характеризуются прогрессирующим течением, ранним развитием уролитиаза и хронической почечной недостаточности. К ним относятся первичная наследственная гипероксалурия (оксалоз), синдром Леша–Нихана, цистиноз, цистинурия и некоторые другие заболевания. Первичные дефекты обмена встречаются достаточно редко, поэтому в данной статье в основном речь пойдет о вторичных ДН.
Вторичные ДН представляют собой вторичные тубулярные синдромы, иначе называемые дисметаболическими расстройствами (диатезами) с кристаллуриями, которые могут быть полигенно-наследуемыми или мультифакториальными. Тубулопатии с кристаллуриями, развивающиеся вследствие генетической предрасположенности, М. С. Игнатовой и Ю. Е. Вельтищевым (1992) были объединены термином «дисметаболические диатезы и нефропатии». Однако причиной вторичных ДН может быть также повышенное поступление определенных веществ в организм, нарушение их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), лекарственной терапией, нестабильностью цитомембран канальцев, дегидратацией и др. [1, 2, 8, 9, 11, 14].
В зависимости от типа нарушений обмена при дисметаболических диатезах выделяют оксалатный (щавелевокислый), уратный (мочекислый), цистиновый и другие диатезы.
Любые ДН, вне зависимости от причины, характеризуются мочевым синдромом в виде кристаллурии. В большинстве случаев именно первичная нестабильность мембран канальцевого эпителия является одной из причин кристаллурии. Вследствие генетической предрасположенности или токсического и гипоксического воздействия нарушаются процессы перекисного окисления липидов с образованием свободных радикалов, токсических форм кислорода, что приводит к накоплению вторичных токсических продуктов перекисного окисления липидов, в частности, малонового диальдегида. Параллельно активации процессов перекисного окисления липидов отмечается снижение активности ферментов антиоксидантных защитных систем, в том числе супероксиддисмутазы, активность которой может снижаться до четырех раз. Активное течение свободно-радикальных реакций на мембранах клеток в условиях снижения антиоксидантной защиты приводит к канальцевой мембранопатии, клеточной деструкции, вторичной кристаллурии.
Течение мембранопатологических процессов с развитием иммунного воспаления, циркуляторных нарушений может привести к формированию метаболического тубулоинтерстициального нефрита, представляющего собой острое или хроническое неспецифическое, абактериальное, недеструктивное воспаление интерстициальной ткани почек, сопровождающееся вовлечением в патологический процесс канальцев, кровеносных и лимфатических сосудов почечной стромы.
Персистирующая кристаллурия также может приводить к отложению кристаллов в ткани почки, а также к их адгезии, «слипанию» друг с другом, что служит основой формирования камня и развитию МКБ [12].
Наиболее часто в основе кристаллурии и МКБ лежат нарушения обмена кальция, щавелевой кислоты (оксалатов), мочевой кислоты (уратов), фосфатов, цистина и др. Подавляющее большинство кристаллурий и выявляемых камней связано с кальцием (от 70 до 90%), около 85–90% из них — с оксалатами (в виде оксалата кальция), остальные с фосфатами (фосфаты кальция — 3–10%) или являются смешанными — оксалатно-(фосфатно)-уратными. Уратная кристаллурия и литиаз составляют около 5%, цистиновая — до 3%. В 5–15% выявляются трипельфосфаты — фосфатные кристаллы, содержащие ион аммония, магний и кальций.
На кристаллообразование влияют три основных фактора: 1) перенасыщение канальцевой жидкости сверх пределов ее стабильности; 2) снижение активности ингибиторов перенасыщения; 3) активаторы преципитации.
Для образования кристалла необходимо наличие ионной пары — аниона и катиона (например, иона кальция и иона оксалата). Перенасыщение мочи различными видами ионов в конечном итоге приводит к их преципитации в виде кристаллов, к последующему их росту, кульминацией чего является образование камня [5, 6].
Кроме степени насыщения на растворимость ионов влияет ионная сила, способность к комплексообразованию, рН мочи и скорость ее тока. рН мочи также является важным фактором растворимости. Например, при кислых значениях рН мочевая кислота практически не диссоциирует и легко преципитирует; тогда как фосфатные соли (фосфат кальция), наоборот, малорастворимы при щелочных значениях рН мочи. Нарушение тока мочи также будет способствовать выпадению кристаллов, свидетельством чему является повторное образование камней в условиях частичной обструкции на фоне аномалий развития.
Довольно часто при перенасыщении мочи не выявляется кристаллурии. По всей видимости, это связано с действием ингибиторов перенасыщения — веществ, которые повышают способность мочи удерживать кристаллоиды в растворенном состоянии. Важными ингибиторами образования фосфатно-кальциевых кристаллов и камней являются пирофосфаты, цитрат, магний и низкомолекулярные вещества, а оксалатно-кальциевых — пирофосфаты и высокомолекулярные вещества.
Важными активаторами кристаллообразования является инфекция мочевой системы и рН мочи. Так, трипельфосфаты образуются только вследствие действия уреазоактивной флоры и являются свидетельством инфекции мочевой системы. Стойкое изменение рН мочи вследствие тех или иных заболеваний также может провоцировать кристаллообразование и рост камней. Например, при некоторых заболеваниях желудочно-кишечного тракта (ЖКТ) рН мочи постоянно сдвинут в кислую сторону, что приводит к образованию мочекислых камней из-за снижения растворимости мочевой кислоты в кислой среде [5, 6, 12].
Следует отметить, что понятия «дисметаболическая нефропатия» и «кристаллурия» не являются синонимами. Кристаллурия может носить транзиторный характер, выявляясь, например, на фоне интеркуррентных заболеваний, таких как респираторные вирусные инфекции. Дисметаболическая нефропатия, в свою очередь, не всегда сопровождается кристаллурией (например, после курса терапии и/или на фоне соблюдения диеты).
Оксалатно-кальциевая кристаллурия
Одной из наиболее распространенных кристаллурий в детском возрасте к настоящему времени остается оксалатно-кальциевая кристаллурия.
У большинства больных с оксалатно-кальциевой кристаллурией нет выраженного нарушения метаболизма оксалатов или повышения их экскреции с мочой, но выявляется гиперкальциурия. Однако кристаллы оксалата кальция могут образовываться и при нормальном уровне кальция в моче, вследствие повышения содержания оксалатов. Таким образом, патогенез оксалатно-кальциевой кристаллурии может быть связан как с нарушением обмена кальция, так и с нарушением обмена оксалатов. Так как все оксалатные кристаллы содержат кальций, термины «оксалатная нефропатия» и «оксалатно-кальциевая нефропатия» употребляются как синонимы.
Оксалаты являются конечным метаболическим продуктом в организме, поэтому все они должны экскретироваться. Оксалаты попадают в организм экзогенно с пищей и всасываются в кишечнике или образуются эндогенно. Оксалаты полностью фильтруются в клубочках, затем реабсорбируются и секретируются в канальцах. Даже при небольшом повышении количества оксалатов в моче вследствие их высокой ионной силы высока вероятность выпадения кристаллов оксалата кальция, которые практически нерастворимы.
Гипероксалурические состояния возникают при увеличении всасывания оксалатов в кишечнике либо при повышении их эндогенного образования (табл.).
Избыточное всасывание оксалата в кишечнике при питании продуктами, содержащими большие количества щавелевой кислоты (ревень, шпинат, шоколад, крепкий чай, избыток аскорбиновой кислоты и др.) может возникать при увеличенном потреблении с пищей предшественников оксалата, таких как аскорбиновая кислота и этиленгликоль, либо при авитаминозе В6, что означает недостаточность пиридоксина, то есть коэнзима, участвующего в превращении глиоксилата в глицин. Приобретенной гипероксалурии способствуют нарушения функции желудочно-кишечного тракта, сопровождающиеся усиленным всасыванием оксалата. Они возникают при региональном энтерите, синдроме слепой кишки, хроническом панкреатите, хроническом гастрите, неотропическом спру, а также после панкреоэктомии или резекции части кишки. Этот тип гипероксалурии возникает при хирургических вмешательствах, связанных с созданием желудочно-кишечного обхода, когда при интактной толстой кишке создаются условия для движения пищи в обход дистального отдела тонкой кишки и наблюдается избыточное всасывание оксалатов, поступивших с пищей. У таких пациентов развивается стеаторея и затем гипероксалурия. Эти нарушения обусловлены повышением содержания в содержимом толстой кишки жирных кислот. Следует отметить, что жирные и желчные кислоты увеличивают проницаемость толстой кишки для органических веществ, подобных оксалату [7]. Одним из важных факторов нормального обмена оксалатов в кишечнике является Oxalobacter formigenes (O. formigenes), который относится к обычным представителям кишечной микрофлоры и обеспечивает утилизацию около 40–45% оксалатов в полости кишечника. При стойком нарушении кишечного биоценоза число O. formigenes снижается и соответственно увеличивается количество всасываемого оксалата. В целом следует отметить, что роль нарушений ЖКТ в развитии оксалатно-кальциевой кристаллурии настолько велика, что обнаружение оксалатной нефропатии требует обязательной консультации гастроэнтеролога и соответствующего обследования [13, 15].
В генезе гипероксалурий играет важную роль нарушение почечных цитомембран. Причины мембранопатий разнообразны. Лабильность фосфолипидного слоя цитомембран может приводить к кальцифилаксии — нарушению гомеостаза внутриклеточного кальция, приводящего к патологической кальцификации. Нестабильность цитомембран может быть результатом повышенной активности процессов перекисного окисления липидов, как вследствие окислительного стресса, так и снижения факторов антиоксидантной защиты. Все это будет приводить к ускоренному метаболизму мембранных фосфолипидов, вследствие активации фосфолипаз, и высвобождению компонентов липидной оболочки — фосфатидилэтаноламина, фосфатидилсерина, которые через этаноламин и серин будут метаболизироваться в оксалат [3, 5, 6].
Первые симптомы заболевания могут проявиться в любом возрасте, однако чаще отмечаются у детей 5–7 лет в виде лабораторных изменений. Клинически, как правило, данное заболевание себя никак не проявляет. Ввиду отсутствия специфических признаков самочувствие детей, как и общее состояние, чаще всего не страдают. Как правило, это дети, склонные к аллергическим реакциям, к ожирению, дети с синдромом вегетативной дистонии по симпатико-тоническому типу [16]. Иногда отмечаются жалобы на дизурические явления, особенно при присоединении инфекции мочевой системы.
Что касается лабораторных изменений, то мочевой синдром представлен оксалатно-кальциевой или фосфатно-кальциевой кристаллурией, гематурией разной степени выраженности, незначительной протеинурией, абактериальной лейкоцитурией. Также отмечено снижение антикристаллообразующей способности мочи, выявляется фосфолипидурия и повышение фосфолипазной активности мочи. Характерна гиперстенурия.
Морфологически выявляется деструкция апикальных поверхностей эпителия канальцев почек, лимфогистиоцитарная инфильтрация интерстиция. В просветах канальцев и интерстиции обнаруживаются кристаллы оксалата кальция. При прогрессировании заболевания отмечаются явления склероза, вовлечение гломерул.
В случае прогрессирующего течения заболевания, учитывая особенности патогенеза, возможно развитие тубулоинтерстициального нефрита, мочекаменной болезни, рецидивирующего течения пиелонефрита.
Фосфатная кристаллурия
Чаще всего фосфатурия встречается при хроническом течении инфекции мочевой системы, что является основной причиной фосфатурии. Особенное значение для этого имеют микроорганизмы с уреазной активностью. Уреаза разлагает мочевину с ощелачиванием мочи, что приводит к перенасыщению мочи фосфатами магния и аммония (струвит). Соединение струвита с углекислым аппатитом в различных количествах приводит к образованию трипельфосфатных кристаллов. Для кристаллизации трипельфосфатов и дальнейшего формирования камней необходима щелочная реакция мочи. Истинная фосфатурия (или первичная) встречается при заболеваниях центральной нервной системы.
Часто фосфатно-кальциевая кристаллурия сопровождает оксалатно-кальциевую, но выражена при этом в меньшей степени. Фосфатурия также может развиваться вследствие нарушения кальциевого обмена при гиперкальциуриях, при этом кристаллы будут представлены в основном фосфатом кальция.
Нарушения обмена мочевой кислоты
Уратная (подагрическая) нефропатия — патология почек, возникающая вследствие нарушения обмена пуринов или избыточного выведения солей мочевой кислоты почками, приводящая в уратному нефролитиазу или тубулоинтерстициальному нефриту.
Уратные нефропатии в зависимости от происхождения могут быть первичными и вторичными. Первичные уратные нефропатии обусловлены наследственными нарушениями метаболизма мочевой кислоты (подагра, синдром Леша–Нигана). Вторичные возникают как осложнения других заболеваний (эритремии, миеломной болезни, хронической гемолитической анемии, алкоголизма и др.), являются следствием применения некоторых препаратов (тиазидные диуретики, цитостатики, салицилаты, циклоспорин А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при пиелонефрите, тубулоинтерстициальном нефрите и др.) [1, 2, 4, 9].
Мочевая кислота (урат) является конечным продуктом обмена пуринов. Следовательно, количество образующейся мочевой кислоты определяется количеством пуринов, поступивших с пищей, эндогенной продукцией и интенсивностью их перехода в мочевую кислоту. Большинство свободных пуриновых оснований утилизируется для ресинтеза пуриновых нуклеотидов.
На кристаллизацию мочевой кислоты влияют рН мочи, суточная экскреция мочевой кислоты и объем мочи. При повышении рН мочи растворимость мочевой кислоты резко возрастает (при изменении рН от 5 до 6 концентрация недиссоциированной формы снижается в 6 раз). В ночное время суток (во время сна) повышается экскреция уратов, снижается количество мочи, а также отсутствует подщелачивание мочи, что усугубляет риск выпадения кристаллов уратов [5, 12].
У больных с уратной нефропатией выявляется дефект почечной экскреции аммония, приводящий к избыточной экскреции титруемых кислот и снижению рН мочи. Причинами экскреции постоянно кислой мочи могут быть заболевания ЖКТ, сопровождающиеся диареей, вследствие дегидратации и/или потери бикарбонатов, а также при илеостоме, лекарственно-индуцированной ацидификации.
Уратурия, как причина, обусловившая поражение почек, выявляется у 14–26% больных. Уратные нефропатии (интерстициальный нефрит на фоне уратурии) представляют собой хронически протекающие заболевания, характеризующиеся умеренной протеинурией, микрогематурией и мочекислой кристаллурией. Результаты обследования детей с уратурией и их родственников выявили обменные нарушения, носящие семейный характер. Очень информативным оказался генеалогический анализ родословных, что позволяет выявлять определенный спектр почечной и внепочечной патологии среди родственников. Так, развитие уратной нефропатии на фоне ожирения, гиперлипидемиии, инсулинрезистентного сахарного диабета рассматривается как клиническое проявление метаболического синдрома, который носит семейный характер. Первые проявления синдрома отмечаются уже в подростковом возрасте. Другая причина развития гиперурикозурии — медикаментозная (диуретики, анальгетики, цитостатики). Экскреция мочевой кислоты с мочой считается превышающей норму при уровне более 1 мг на 1 мл, когда возникает опасность повреждения интерстициальной ткани почек, сосудов и камнеобразования. Что касается клинических проявлений, то при уратной нефропатии могут появиться жалобы на дизурические явления, рецидивирующие боли в животе, боли в поясничной области, в случае уролитиаза (у 5–41%) развивается почечная колика, в тяжелых случаях появляются клинические проявления подагры [4].
Нарушения обмена цистина
Цистин является продуктом метаболизма метионина и представляет собой наименее растворимую из встречаемых в природе аминокислот. Кристаллы цистина выпадают при превышении порога растворимости (более 400 мг/л) и при кислой реакции мочи [1, 2, 5, 9].
Можно выделить две основные причины повышения концентрации цистина в моче: избыточное накопление цистина в клетках почки и нарушение обратного всасывания цистина в почечных канальцах.
Однако наиболее часто кристаллы цистина выявляются при нефропатиях с преимущественным поражением канальцевого аппарата почек (пиелонефрит, тубулоинтерстициальный нефрит), и такая цистинурия носит вторичный характер. Если кристаллы оксалатов, уратов, фосфатов могут появляться эпизодически и при различных колебаниях в диете, то наличие цистина в моче — всегда признак патологии.
Диагноз цистинурии может быть заподозрен у любого пациента при наличии в анамнезе камней в почках, с текущими явлениями уролитиаза, отягощенным семейным анамнезом по мочекаменной болезни и специфическим янтарным окрасом камней.
Диагностические критерии ДН у детей
Постановка диагноза ДН включает в себя комплексную оценку образа жизни ребенка, характер его питания, генеалогический анамнез, результаты лабораторно-инструментальных методов исследования. Скудность клинических проявлений компенсируется характерными лабораторными и инструментальными признаками заболеваний.
Лабораторно-инструментальная диагностика ДН основывается на выявлении кристаллурии в общем анализе мочи, повышении концентрации тех или иных солей в биохимическом исследовании мочи, исследовании антикристаллобразующей способности мочи (АКОСМ) и тестов на кальцифилаксию и перекиси в моче, ультразвуковом исследовании (УЗИ) почек и мочевыводящих путей.
Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза ДН. Следует иметь в виду, что кристаллурия у детей часто бывает транзиторной и не связанной с патологией обмена и нестабильностью почечных цитомембран. Особенно это касается кристаллурии, выявляемой на высоте лихорадки, после перенесенных инфекций, диареи, а также у детей в периоде новорожденности при развитии «мочекислого инфаркта».
Для подтверждения диагноза ДН при выявлении кристаллурии в общем анализе мочи проводится биохимическое исследование мочи, где следует обратить внимание на концентрацию солей (оксалаты, мочевая кислота, кальций, фосфор и др.) и показатели функции канальцев (глюкоза, титруемая кислотность, аммиак, рН и др.), что позволяет выявить не только повышение экскреции тех или иных веществ, но и оценить условия для кристаллообразования, степень вовлеченности тубулярного аппарата в патологический процесс.
Повышение экскреции солей по данным биохимического исследования мочи при нормальных общих анализах мочи и отсутствии изменений при УЗИ почек также не может в полной мере свидетельствовать о ДН у ребенка, однако позволяет вынести полученные изменения в диагноз, например: гипероксалурия, гиперуратурия и т. д.
При подозрении на ДН отсутствие кристаллурии и повышенной экскреции солей с мочой у ребенка в данный момент не позволяет достоверно исключить этот диагноз. Нормальные показатели в общем и биохимическом анализах мочи могут быть обусловлены, например, правильной диетой и режимом жизни ребенка в данный период, тогда как предпосылки к тем или иным обменным нарушениям сохраняются.
Поэтому важно определить способность мочи растворять различные соли. Для этой цели проводится анализ на АКОСМ к оксалатам кальция, фосфатам кальция и трипельфосфатам, наиболее часто встречаемым при кристаллуриях у детей. В нормальной моче способность растворять эти соли и предотвращать кристаллообразование сохранна за счет наличия ингибиторов кристаллообразования и отсутствия или малой активности активаторов (промоторов) кристаллообразования. При ДН АКОСМ снижена в различной степени за счет повышения концентрации этих солей в растворенном виде и/или нарушения баланса ингибиторов и активаторов.
Тест на кальфилаксию позволят выявить нарушение клеточного гомеостаза кальция, приводящее к патологической кальцификации клеток и тканей. Тест на перекиси в моче отражает активность процессов перекисного окисления липидов цитомембран, повышение уровня перекисей будет являться признаком нестабильности цитомембран.
Ценность методов исследования мочи на АКОСМ, кальцифилаксию и перекиси заключается в возможности доклинического выявления патологии даже при отсутствии каких-либо других лабораторных признаков и в использовании их для контроля эффективности проводимой терапии [3].
Изменения, выявляемые при ультразвуковом исследовании почек, как правило, малоспецифичны и заключаются в очаговом или диффузном повышении эхогенности паренхимы почек за счет отложения кристаллов. Показанием к проведению более углубленного, в частности рентгенологического обследования, является обнаружение в почке при проведении УЗИ микролитов или включений, дающих эффект эхонегативной дорожки.
Общие подходы к лечению ДН
С учетом особенностей этиопатогенеза комплексное лечение ДН предполагает проведение мероприятий неспецифического (нормализация образа жизни, исключение гиподинамии, повышенный питьевой режим) и специфического характера (диета, коррекция метаболических нарушений медикаментозной терапией).
Нормализация образа жизни, физическое и психическое здоровье являются важным условием для достижения положительного эффекта в терапии ДН. Выраженные и длительные нарушения этих составляющих в конечном счете реализуются в микроциркуляторных отклонениях, ведущих к гипоксии, и/или в непосредственном повреждающем воздействии на клетки. Все это активизирует и/или усугубляет нарушения клеточного обмена, интенсивность перекисного окисления липидов мембран, их нестабильность и т. д.
Прием большого количества жидкости является универсальным способом лечения любой ДН, так как способствует уменьшению концентрации растворимых веществ в моче. Также важно время приема жидкости, особенно в периоды максимальной суточной концентрации мочи, т. е. во время сна. Поэтому одной из целей лечения является никтурия, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде, поскольку длительный прием жидкостей, например, подкисляющих мочу или содержащих углеводы, может вызвать увеличение экскреции кальция [5].
Диета позволяет в значительной степени снизить метаболическую нагрузку на тубулярный аппарат.
При лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на тубулярный аппарат. Применение картофельно-капустной диеты в течение 2–3 недель сопровождается статистически достоверным снижением экскреции оксалатов, что сочетается с улучшением мочевого синдрома. Картофельно-капустная диета назначается на 3 недели с трехнедельными перерывами, во время которых ребенок получает диету № 5 по Певзнеру.
Также необходимо исключить экстрактивные мясные блюда, богатые оксалатами щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад и др. «Подщелачивающий» эффект оказывают курага, чернослив, груши.
Из минеральных вод используются такие, как «Славяновская» и «Смирновская», по 3–5 мл/кг/сут в 3 приема курсом 1 мес 2–3 раза в год.
При лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печень, почки, мясные бульоны, горох, фасоль, орехи, какао и др.). Преимущество должно отдаваться продуктам молочного и растительного происхождения. Важным условием успешной терапии является достаточное употребление жидкости — от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер пашенный, спорыш и др.), отвару овса. Для поддержания рН мочи в пределах 6,2–6,6 можно использовать цитратные смеси (Уралит-У, Блемарен, Магурлит, Солимок и др.), которые обладают значительной буферной емкостью [1, 4, 5, 9, 10].
Специфическая терапия должна быть направлена на предупреждение кристаллообразования, выведение солей, нормализацию обменных и энергетических процессов. Поскольку в большинстве случаев мембранопатия у детей является одним из звеньев патогенеза ДН, основной акцент делается на антиоксидантную и мембраностабилизирующую терапию.
Медикаментозная терапия включает мембранотропные препараты и антиоксиданты [5, 6, 9]. Лечение должно быть длительным и курсовым для достижения пролонгированного эффекта.
Пиридоксин (витамин В6) назначается в дозе 1–3 мг/кг/сут (до 400 мг/сут) в течение 1 мес ежеквартально. Витамин В6 оказывает мембраностабилизирующее действие за счет участия в обмене жиров в качестве антиоксиданта и обмене аминокислот. Целесообразно также назначение препарата Магне В6 из расчета 5–10 мг/кг/сут курсом в течение 2 мес 3 раза в год.
Мембраностабилизирующее действие оказывает витамин А, который встраивается в билипидный слой и нормализует взаимодействие белков и липидов мембраны. Суточная доза витамина А 1000 МЕ на год жизни ребенка, курсом 1 мес ежеквартально.
Токоферола ацетат (витамин Е) является мощным антиоксидантом, который поступает в организм извне и вырабатывается эндогенно. Необходимо помнить, что экзогенное введение витамина Е может тормозить его эндогенную продукцию по механизму отрицательной обратной связи. Витамин Е укрепляет белково-липидные связи клеточных мембран, участвует в процессах акцепции электронов при свободно-радикальных реакциях на мембранах. Назначается с витамином А в дозе 1–1,5 мг/кг массы в сутки.
В качестве мембраностабилизаторов также используются Димефосфон и Ксидифон. Димефосфон восстанавливает связь между окислением и фосфорилированием в клеточном дыхании, разобщенность которого наблюдается при нестабильности митохондриальных мембран, прерывая каскадные процессы перекисного окисления липидов. Применяется в дозе 1 мл 15% раствора на каждые 5 кг веса, 3 приема в сутки. Курс — 1 мес, 3 раза в год.
Ксидифон является комплексообразующим препаратом, который облегчает включение кальция в митохондрии и предупреждает отложение его нерастворимых солей. Назначается в дозе 10 мг/кг/сут 2% раствора в 3 приема. Курс — 1 мес, 2 раза в год.
В лечении детей с оксалатно-кальциевой кристаллурией широко применяется фитотерапия. Из комбинированных фитопрепаратов рекомендуется применение Цистона, Фитолизина и Канефрона. Цистон назначается в дозе 1–2 таблетки 2–3 раза в день курсом от 3 до 6 мес. Канефрон у взрослых применяется в форме драже и капель: по 2 драже 3 раза в день (или по 50 капель 3 раза в день). Для детей доза уменьшается в 2–3 раза в зависимости от возраста: по 11–25 капель или по 1 драже 3 раза в день в течение 6–8 недель [3].
Помимо этого, назначается окись магния, особенно при первичной гипероксалурии, в дозе 0,15–0,2 г/сут. При первичной гипероксалурии следует иметь в виду, что любая терапия является паллиативной. Радикальным методом лечения оксалоза является трансплантация печени, что устраняет дефект отсутствия аланин-глиоксилаттрансферазы и восстанавливает нормальный обмен оксалатов.
При гиперурикемии важно уменьшить концентрацию мочевой кислоты до 6 мг/100 мл и менее. Для этого используются средства, снижающие синтез мочевой кислоты, — ингибиторы ксантиноксидазы. Применение в педиатрии аллопуринола ограничено из-за возможных осложнений — гепатит, эпидермальный некроз, алопеция, лейко- и тромбоцитопения, повышение уровня ксантина в крови. Под строгим контролем аллопуринол назначают в дозе 0,2–0,3 г/сут в 2–3 приема в течение 2–3 нед, затем доза снижается. Длительность общего курса — до 6 мес. Никотинамид является более слабым ингибитором активности ксантиноксидазы, чем аллопуринол, но лучше переносится; назначается в дозе 0,005–0,025 г 2–3 раза в сутки по 1–2 мес повторными курсами. Колхицин снижает транспорт пуриновых оснований и скорость их обмена. Назначается в дозе 0,5–2 мг/сут сроком от 18 мес до нескольких лет.
Урикозурическим эффектом также обладают оротовая кислота, Цистон, Этомид, Цистенал, Фитолизин и др. Калия оротата таблетки назначаются в дозе 10 мг/кг в сут в 2–3 приема в течение 1 мес. Урикозурическим и урикозостатическим действием обладает также бензбромарон, который применяют по 50–100 мг/сут 2–3 раза в сочетании с салуретиками и цитратом натрия [5, 6, 9].
Лечение при фосфатной кристаллурии должно быть направлено на подкисление мочи (минеральные воды: «Нарзан», «Арзни», «Дзау-суар» и др.; препараты: Цистенал, аскорбиновая кислота, метионин). Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.). При выраженной экскреции фосфата кальция необходимо добиться снижения всасывания фосфора и кальция в кишечнике (например, назначением Альмагеля). Обязательным компонентом лечения при наличии трипельфосфатов является антибактериальная терапия и санация хронической инфекции мочевой системы [9].
Лечение цистиноза и цистинурии включает диету, высокожидкостный режим и медикаментозную терапию, направленную на подщелачивание мочи и повышение растворимости цистина [2, 4–6].
Цель диетотерапии — предотвратить избыточное поступление в организм ребенка предшественника цистина — метионина и других серосодержащих кислот. Для этого также исключают (или резко ограничивают) из рациона питания ребенка богатые метионином и серосодержащими аминокислотами продукты — творог, рыбу, яйца, мясо и др. Поступление метионина при таких диетических мероприятиях сокращается до 0,7 г/сут. Поскольку метионин необходим растущему организму ребенка для пластических процессов, длительное применение строгой диеты невозможно, поэтому через 4 нед от начала диетотерапии рацион ребенка расширяется и приближается к обычному, но характеризуется строгим исключением рыбы, творога и яиц.
Количество жидкости, употребляемой ребенком, должно быть не менее 2 л/сут, особенно важно принимать жидкость перед сном. Для подщелачивания мочи используется цитратная смесь, растворы гидрокарбоната натрия, Блемарен, щелочные минеральные воды. Это позволяет добиться повышения рН мочи до 7,5–8,0. Снижению концентрации цистина и повышению рН мочи будут также способствовать ингибиторы карбоангидразы (Диакарб) и Гипотиазид.
Для повышения растворимости цистина и предупреждения кристаллизации назначается пеницилламин, с целью активации тиолзависимых ферментов. Пеницилламин обладает некоторой токсичностью и антиметаболическим действием на пиридоксин, поэтому в начале терапии назначаются невысокие дозы препарата — 10 мг/кг/сут в 4–5 приемов, далее доза увеличивается в течение недели до 30 мг/кг/сут, а при цистинозе — до 50 мг/кг/сут. Лечение пеницилламином должно проводиться под контролем содержания цистина в лейкоцитах и/или цианиднитропруссидного теста (проба на цистин в моче, где концентрация цистина долж
Нарушения минерального обмена в почках (дисметаболические нефропатии)
Дисметаболические нефропатии (наршения минерального обмена почек — НМО) представляют собой группу заболеваний, характеризующихся поражением почек вследствие нарушения обмена веществ и приводящим к развитию мочекаменной болезни (МКБ), воспалению почек (пиелонефрит), которые могут осложниться хронической почечной недостаточностью (ХПН).
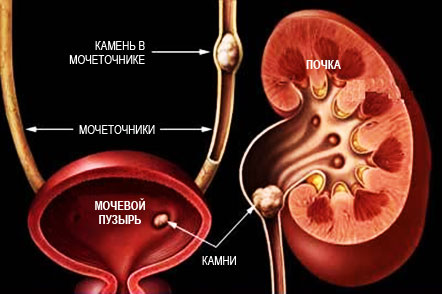
В зависимости от причины развития выделяют первичные и вторичные НМО.
Первичные нарушения представляют собой наследственно обусловленные формы заболеваний, характеризующихся прогрессирующим течением, ранним развитием мочекаменной болезни (МКБ) и хронической почечной недостаточности (ХПН). Первичные дисметаболические нефропатии встречаются редко и начало клинических проявлений развивается уже в детском возрасте.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), применением ряда лекарственных средств и др.
Подавляющее большинство (от 70 до 90%) дисметаболических нефропатий связаны с нарушением обмена кальция, при этом около 85–90% из них обусловлены избытком солей щавелевой кислоты в виде оксалата кальция — оксалатов, 3–10% — перегрузкой фосфатами (фосфаты кальция), существуют смешанный вариант нарушений – оксалатно/фосфатно-уратные.
Оскалатно-кальциевая нефропатия
Оксалатно-кальциевая нефропатия наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением обмена кальция или оксалатов (солей щавелевой кислоты).
Причины образования оксалатов:
- повышенное поступление оксалатов с пищей
- заболевания кишечника – воспалительные заболевания кишечника (болезнь Крона, язвенный колит), кишечные анастомозы при проведении оперативных вмешательств на кишечнике
- повышенная выработка оксалатов самим организмом
Оксалатная нефропатия представляет собой многофакторный патологический процесс. Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности. Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни, развитию воспаления почек — пиелонефриту при наслоении бактериальной инфекции.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы. Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Уратная нефропатия (нарушения обмена мочевой кислоты)
Эта группа обменных нарушений наиболее часто встречается у взрослых. Первичные уратные нефропатииобусловлены наследственными нарушениями обмена мочевой кислоты. Вторичные возникают как осложнениядругих заболеваний (болезней крови и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
Цистиновая нефропатия
Цистин является продуктом обмена аминокислоты метионина. Можно выделить две основные причины повышения концентрации цистина в моче:
- избыточное накопление цистина в клетках почки
- нарушение обратного всасывания цистина в почечных канальцах.
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах. Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Симптомы НМО
НМО почек, как правило, клинически течет бессимптомно до формирования мочекаменной болезни или пиелонефрита, но в ряде случаев могут проявляться следующими симптомами:
- дискомфорт при мочеиспускании
- учащенное мочеиспускание
- ноющая боль или дискомфорт, локализующиеся преимущественно в поясничной области или животе
- приступообразная («почечная колика») или постоянная боль, отдающая в. подвздошную или паховую область, на внутреннюю поверхность бедра, в половые органы
- боль над лоном может развиваться при отложении солей или наличии камней в мочевом пузыре
Диагностика НМО
Необходимое комплексное обследование включает лабораторные и инструментальные методы.
Лабораторная диагностика
- Общий анализ мочи, в котором выявляются кристаллы солей той или иной кислоты. Однако данное исследование не позволяет с полной уверенностью утверждать о присутствии дисметаболической нефропатии. Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза дисметаболической нефропатии. Следует иметь в виду, что выделение кристаллов с мочой часто бывает преходящим и оказывается не связанным с нарушением обмена веществ. Поэтому для уточнения диагноза прибегают ко второму этапу исследования – проведению биохимического исследования мочи.
- Биохимический анализ мочи позволяет оценить концентрации тех или иных солей в порции мочи. Метод является более точным и чувствительным для определения количественного уровня оксалатов, фосфатов, уратов и других кристаллов солей.
- АКОСМ — определение антикристаллобразующей способности мочи. Метод достаточно сложный, проводится не в каждом лечебном заведении.
- Ряд тестов на перекиси в моче и кальцифилаксию. Данная методика позволяет выявить нарушения кальциевого обмена и оценить степень активности перекисного окисления мембран клеток почечной ткани, что является важным звеном в процессах развития дисметаболических нефропатий.
Инструментальная диагностика
УЗИ органов брюшной полости. Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микролитов или «песка» (включений). УЗИ почек, как правило, является неспецифичным методом диагностики, однако в ряде случаев позволяет отследить формирование мелких камней и, таким образом, зафиксировать время возникновения мочекаменной болезни.
Лечение
Рекомендации по питанию являются основой терапии как в детском, так и во взрослом состоянии.
| Вид нефропатии | Запрещенные продукты |
| Оксалатная нефропатия | Мясные блюда, щавель, шпинат, клюква, свекла, морковь, какао, шоколад |
| Уратная нефропатия | Печень, почки, мясные бульоны, горох, фасоль, орехи, какао, алкогольные напитки |
| Фосфатная нефропатия | Сыр, печень, икра, курица, бобовые, шоколад |
| Цистиновая нефропатия | Творог, рыба, яйца, мясо |
Лечение оксалатной нефропатии
Диета
- при лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на почки
- необходимо исключить холодец, крепкие мясные бульоны, щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад
- рекомендуется ввести в рацион курагу, чернослив, груши
- из минеральных вод используются такие, как славяновская и смирновская, по 3–5 мл/кг/сут. в 3 приема курсом 1 месяц 2–3 раза в год
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным. Применяются витамины группы В, А, Е. Назначаются специальные препараты при кристаллурии. Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов.
Лечение уратной нефропатии
Диета
- при лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печени, почек, мясных бульонов, гороха, фасоли, орехов, какао и др.)
- преимущество должно отдаваться продуктам молочного и растительного происхождения
- важным условием успешной терапии является достаточное употребление жидкости – от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер, спорыш и др.), отвару овса
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси. При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
Лечение фосфатной нефропатии
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
При любой степени тяжести заболевания необходимо незамедлительно обратиться к врачу нефрологу или урологу за помощью, так как длительно текущие, в целом обратимые, нарушения обмена при отсутствии лечения могут привести к развитию мочекаменной болезни с последующим оперативным вмешательством и хронической почечной недостаточности. Самолечение не допустимо!
Все виды лекарственной терапии должен назначать и обязательно контролировать врач нефролог или уролог, так как:
- эти лекарства имеют серьезные побочные эффекты на другие органы и системы
- у части пациентов отмечается изначальная невосприимчивость или постепенно развивается устойчивость к препаратам
На первом этапе лечения составляется план лечения. Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
- нормализация образа жизни
- правильный питьевой режим
- диета
- специфические методы терапии
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение конкретного кристаллообразования, выведение солей, нормализацию обменных процессов.
На втором этапе терапии производится оценка эффективности диеты, проводятся контрольные УЗ-исследования и анализы.
Третий этап лечения осуществляется после достижения стойкой ремиссии. Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Даже после достижения долгожданной ремиссии пациенту рекомендуется быть внимательным к себе и регулярно наблюдаться у врача нефролога или уролога, так как высок риск рецидива заболеваний.
Практически всем пациентам необходимо принимать рекомендованные врачом средства противорецидивной терапии или придерживаться ранее разработанной диеты для предотвращения формирования или прогрессирования МКБ, воспаления почек.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Если вы обнаружили у себя какие-либо из перечисленных выше симптомов (нарушение мочеотделения, изменения свойств мочи, боли), необходимо в ближайшее время обратиться к врачу за помощью.
Помните, что очень важно начать лечение на ранних стадиях болезни, так как НМО в почках является преимущественно обратимым состоянием, а в случае отсутвтия лечения итогом является развитие мочекаменной болезни, пиелонефрита.
Рекомендации
Для профилактики развития заболевания, а так же рецидива, необходимо придерживаться правильного, сбалансированного и регулярного питания – избегать острой пищи, маринадов и пр. В период обострения пациентам рекомендуется щадящая диета, соответствующая требованиям биохимического вида нефропатии (оксалатная, уратная и пр.).
С целью профилактики рецидивов всем пациентам рекомендуется один раз в квартал консультация врача нефролога или уролога для необходимой коррекции медикаментозной терапии и пищевых рекомендаций.
Пациенты, длительно страдающие НМО в почках, относятся к группе повышенного риска по МКБ. Поэтому в период ремиссии им необходимо ежегодно проходить по назначению врача контрольные обследования (общий анализ мочи, биохимия мочи, УЗИ почек, мочеточников, мочевого пузыря) мочевыводящей системы.
Часто задаваемые вопросы
Излечимы ли НМО?
НМО часто обусловлено наследственными нарушениями обмена, что требует постоянного соблюдения как минимум диетических рекомендаций.
Из-за чего возникает заболевание?
НМО может быть связано с наследственной предрасположенностью, а также с заболеваниями внутренних органов (желудочно-кишечные проблемы, заболевания крови и пр.), применением определенных групп лекарственных препаратов (мочегонные средства, цитостатики и пр.).
Является ли заболевание противопоказанием к беременности?
Само НМО в почках требует наблюдения весь период беременности с соблюдением диетических рекомендаций.
При развитии МКБ, пиелонефрита и их осложнений в виде ХПН, возможность беременности и ее сохранения зависит от обострения процесса и стадии осложнений и решается в каждом конкретном случае.
Может ли заболевание почек проявляться снижением потенции?
Непосредственно НМО конечно не влияет на потенцию, но в случае развития осложнений МКБ, воспаления почек или развития ХПН снижение потенции может появиться как реакция на хроническое заболевание.
Увеличивается ли риск заболеть, если близкий родственник страдает данным заболеванием?
Да, существует группа первичных обменных нефропатий (НМО в почках), имеющая наследственную предрасположенность.
Дисметаболические нефропатии в педиатрической практике | #08/10
Синдром обменной нефропатии является одной из актуальных и спорных проблем современной педиатрии. Причем сегодня, по статистическим данным, отмечается повсеместный рост обменных нарушений в почках. Так, обменная нефропатия составляет от 27% до 64% в структуре заболеваемости мочевыделительной системы у детей, а в повседневной практике врача-педиатра синдром обменных нарушений в моче отмечается практически у каждого третьего больного. Необходимо отметить, что дисметаболическая или обменная нефропатия не является отдельной нозологической единицей, а по своей сути — это синдромальное состояние и включает в себя большую группу нефропатий различной этиологии и патогенеза (Е79 — нарушение обмена пуринов, Е74.8 — оксалоз, оксалурия, Е83.8 — другие нарушения минерального обмена), объединенных тем, что их развитие связано с различными нарушениями обмена веществ, приводящих к появлению кристаллического осадка в моче и как следствие этого к повреждению почечных структур и других уровней мочевыделительной системы.
Хорошо известно, что моча в норме представляет собой перенасыщенный солевой раствор, находящийся в состоянии динамического равновесия за счет веществ, которые способствуют растворению или дисперсии составных частей мочи. Процесс образования кристаллов в мочевых путях представляет процесс, в основе которого лежат нарушения коллоидного равновесия в тканях организма и в почечной паренхиме. То есть можно говорить о нарушении равновесия между повреждающими (предрасполагающими) и защитными факторами.
Предрасполагающие факторы делятся на две большие группы — экзогенные и эндогенные. К экзогенным относятся: климатические (сухой и жаркий климат), особенности состава питьевой воды (высокая жесткость), уровень солнечной радиации, содержание микро- и макроэлементов во внешней среде (недостаток магния, йода, избыток кальция, стронция), особенности пищевого режима (дефицит витаминов А, В6, РР, гипервитаминоз D, избыточное употребление продуктов, богатых белком, пуринами, щавелевой кислотой, недостаточное употребление продуктов, содержащих ненасыщенные жирные кислоты), недостаточность питьевого режима, частое посещение сауны, прием алкоголя, лекарственные воздействия (сульфаниламиды, диуретики, цитостатики). Эндогенные факторы: врожденные аномалии почек и мочевыводящих путей, особенно с нарушением оттока мочи, воспалительные процессы в почках и по ходу мочевых путей, нарушение водно-солевого обмена при гиперпаратиреозе, повышенные потери воды при экстраренальных потерях, интенсивных мышечных нагрузках, нарушение обмена кальция (вымывание кальция из костей в кровь) при длительном постельном режиме или иммобилизации, увеличение всасывания кальция и оксалатов при повышенной проницаемости кишечной стенки (пищевая аллергия, воспалительные процессы в кишечнике), наследственные варианты нарушения обмена веществ.
Защитные факторы
К защитным факторам относятся вещества, которые удерживают соли в растворенном состоянии, зачастую они называются защитными коллоидами. Эти вещества частично представлены в плазме крови, фильтруются в первичную и окончательную мочу, секретируются канальциевым эпителием. Кроме того, размеры коллоидных частиц мочи определяются биологически активными веществами — трипсином, пепсином, катепсинами и другими. Их действие опосредуется через рН-среды, влиянием активаторов и ингибиторов. Таким образом, при недостаточности факторов защиты, превалировании предрасполагающих факторов и на фоне разрешающего воздействия (инфекции, травмы, прием лекарств, дефицит жидкости и т. п.) начинается процесс кристаллообразования и как крайняя степень выраженности — процесс камнеобразования.
Типичными морфологическими изменениями при обменных нефропатиях является отложение кристаллов в собирательных трубочках, канальцах и интерстиции почек. В ответ на отложение кристаллов первоначально развивается неспецифический воспалительный процесс, в последующем возможно развитие иммунокомплексного воспалительного процесса с вторичным поражением различных отделов нефрона. В зависимости от уровня поражения нефрона обменная нефропатия может протекать по следующим клиническим вариантам: острая почечная недостаточность, тубуло-интерстициальный нефрит, уролитиаз, мочекислый диатез, бессимптомное течение.
Вне зависимости от варианта клинического течения длительное существование дисметаболических нарушений приводит к фиброзу интерстиция, снижению канальциевых функций и, как следствие этого, к нарушению концентрационной функции почек.
Чаще всего в клинической практике встречаются дисметаболические нефропатии, связанные с нарушением обмена оксалатов (солей щавелевой кислоты) и уратов. Все варианты обменных нефропатий вне зависимости от клинического варианта течения можно разделить на две большие группы: связанные с наследственным или врожденным нарушением обмена веществ и вторичные дисметаболические нефропатии.
Первичная оксалурия встречается редко. Педиатры имеют дело со вторичной оксалурией. Большинство оксалатов, выводимых с мочой, образуются в процессе обмена веществ из аминокислот — серина, глицина, оксипролина и частично из аскорбиновой кислоты. Незначительное количество поступает из кишечника при приеме с пищей оксалогенных продуктов. В обычной диете содержится от 97 до 930 мг оксалатов (в зависимости от времени года), но только от 2% до 5% из них всасываются в кишечнике. В физиологических условиях 10% экскретируемых с мочой оксалатов образуются из аскорбиновой кислоты и 40% из глицина. Поступление глицина в организм обусловлено его содержанием в пищевых продуктах, но возможно и ятрогенное развитие оксалурии при назначении глицина. Глицин® — лекарственный препарат на основе аминокислоты глицина, применяется в неврологической практике с целью улучшения обменных процессов в головном мозге. Причем в аннотации к препарату указано, что он не обладает побочными действиями, что не противоречит истине, но, к сожалению, аннотация составлена без учета метаболизма препарата.
Возможно локальное образование оксалатов в почках в связи с разрушением фосфолипидов клеточных мембран, вследствие чего образуются предшественники оксалатов, с которыми кальций образует нерастворимые соли. Причинами распада мембран являются бактериальные фосфолипазы при воспалительных процессах в почках, воздействие мембранотоксических соединений, например сульфаниламидных препаратов, ишемия почек и др., при этом морфологически выявляют выраженную деструкцию щеточных каемок проксимальных и дистальных канальцев, заполнение просветов канальцев кристаллами, выраженную лимфогистиоцитарную инфильтрацию интерстиция. В последние годы получены интересные данные о том, что при оксалуриях снижено число вставочных клеток в собирательных трубочках, секретирующих Н+-ионы, т. е. оксалурия может быть отнесена к тубулопатиям — дистальному почечному ацидозу.
Специфических симптомов оксалатной нефропатии нет. Чаще всего выявляются рецидивирующие боли в животе, при мочеиспускании может возникать чувство жжения, иногда развивается воспаление гениталий за счет постоянного раздражения кожи и слизистой, возможно появление других дизурических расстройств. При визуальной оценке мочи отмечается ее насыщенный характер, возможно спонтанное образование осадка. Ведущим признаком патологии почек является мочевой синдром; повышение удельного веса мочи, микрогематурия, протеинурия, лейкоцитурия, оксалурия.
У детей с оксалурией отмечается снижение антикристаллообразующей способности мочи. В большинстве случаев оксалатная нефропатия обнаруживается случайно, иногда на фоне провоцирующих интеркуррентных заболеваний. Дебют заболевания приходится на младший возраст — 1–6 лет, а обострения чаще отмечаются в периоды интенсивного роста 7–8 лет и 10–14 лет.
Первичная урикозурия. К первичной гиперурикемической нефропатии относится подагра. Распространенность гиперурикемии колеблется от 3,3% в Англии до 40% в Новой Зеландии, встречаясь в среднем у 8–13% населения. Заболевание наследуется аутосомно-доминантным путем. В основе развития болезни лежит генетический дефект, приводящий к изменению активности ряда ферментов (глюкозо-6-фосфатазы, частичный дефицит гипоксантин-гуанинфосфорибозилтрансферазы) и повышение каталитической активности фосфорибозилпирофосфатсинтетазы, что приводит к повышению эндогенной продукции пуриновых соединений. В условиях гиперпродукции мочевой кислоты гиперурикемии предшествует повышенная экскреция мочевой кислоты (гиперуратурия). У взрослого человека в нормальных условиях через клубочки почек за сутки фильтруется 5–10 г мочевой кислоты, из которых около 1 г реабсорбируется, а остальное выделяется с мочой. При нарушении обмена количество профильтрованной и выделенной мочевой кислоты увеличивается в 3–4 раза. До 5–6% уратов в организме могут быть связаны с белками плазмы, т. е. не все ураты способны свободно фильтроваться в клубочках, при подагре значительно возрастает количество уратов, прочно связанных с белком.
Подагру считают полиорганным заболеванием, что подтверждается поражением не только почек, но и нервной системы, сердца, практически постоянно подагре сопутствуют ожирение, артериальная гипертензия, мигрень, суставной синдром, аллергия (бронхиальная астма, крапивница, нейродермит и др.). По данным эпидемиологических исследований гиперурикемия является фактором риска ишемической болезни сердца (ИБС), инфаркта, диабета, мочекаменной болезни. Считается, что подагрой болеют после 40 лет, однако трудно себе представить на протяжении столь длительного времени совершенно здорового человека с наследственным дефектом ферментных систем. Одним из первых проявлений подагры в детском возрасте и является дисметаболическая урикозурическая нефропатия.
Вторичная урикозурическая нефропатия. Повышение концентрации мочевой кислоты может отмечаться при ряде заболеваний, что позволяет говорить о вторичном характере процесса. Это заболевания крови — гемолитические анемии, лейкозы, новообразования, гипопаратиреоз, лекарственные воздействия; прием цитостатиков, сульфаниламидных препаратов, глюкокортикоидов, антибиотиков широкого спектра действия. Специфических отличий в клинической симптоматике и характере мочевого синдрома, за исключением кристаллурии, вторичная оксалурическая и урикозурические нефропатии практически не имеют.
Вне зависимости от механизма образования, вида кристаллурии, повышенное содержание кристаллов в моче на фоне нарушения коллоидного равновесия мочи приводит к отложению кристаллов в канальцах, собирательных трубочках почек с последующим нарушением пассажа мочи. Тем самым создаются условия для присоединения инфекции и развития пиелонефрита, тубулоинтерстициального нефрита, мочекаменной болезни. Итак, диагностика обменных нефропатий базируется на анализе: генеалогического анамнеза, учете факторов риска, жалобах пациента, клинической симптоматике, характерных изменениях в анализах мочи, характеристике салуреза (в норме за сутки выделяется с мочой до 40 мг оксалатов, в детской практике обязателен пересчет на единицу веса — не более 1 мг/кг/сут, уратов 5,5–6,0 ммоль/сут, не более 0,1 ммоль/кг/сут), определении уровня мочевой кислоты в крови, данных ультразвукового исследования почек — гиперэхогенные включения в чашечно-лоханочный комплекс, обызвествление кончиков пирамидок, в тяжелых случаях обызвествление всех пирамидок, данных рентгенологического исследования почек — выявление конкрементов, врожденных пороков развития. Нужно отметить, что диагноз обменной нефропатии ставится только на основании сочетания клинических и лабораторных данных. Постановка диагноза обменной нефропатии только по изолированным лабораторно-инструментальным признакам является ошибочной и приводит к нерациональной терапии и ограничению жизнедеятельности детей и подростков.
Лечение
Тактика лечения зависит от варианта клинического течения и вида кристаллурии. В тяжелой форме, с развитием острой почечной недостаточности (ОПН), тубуло-интерстициального нефрита 2–3 степени активности, дисметаболическая нефропатия встречается редко, как правило, в случаях первичных врожденных нарушений обмена веществ, подобные больные госпитализируются в специализированное нефрологическое отделение. При среднетяжелом течении заболевания пациенты могут направляться как в специализированное нефрологическое отделение, так и получать лечение в условиях соматического стационара. В остальных случаях дисметаболической нефропатии с оксалурией и/или уратурией, протекающей с минимальными клинико-лабораторными изменениями, лечение проводится амбулаторно.
Основой лечения любой формы дисметаболической нефропатии является обеспечение дополнительной водной нагрузки, до 500–1000 мл по отношению к возрастной потребности. Так, например, средняя физиологическая потребность детей в воде в зависимости от возраста следующая: 1–2 года — 1300–1500 мл, 4–6 лет 1800–2000, от 10 лет и старше 2000–2500 мл в день. Необходимо понимать, что жидкость ребенок и взрослый человек получает не только с питьем (чай, соки, супы и т. д.), но и со всеми продуктами питания. Нужно отметить, что ребенок первого и второго года жизни получает достаточное количество жидкости за счет контроля со стороны педиатров и родителей за объемом питания. К сожалению, дети старшего возраста при превалирующем нерегулярном питании вместе с продуктами получает в среднем за сутки 1500–1700 мл воды, что приводит к нарушению обменных процессов на уровне всего организма.
Другим базисным компонентом терапии является диетическая коррекция. При оксалурии исключаются из питания продукты с высоким и средним содержанием щавелевой кислоты. Продукты с высоким содержанием щавелевой кислоты (от 10 до 1 г/кг веса продукта): какао, шоколад, свекла, сельдерей, шпинат, щавель, петрушка, ревень. Продукты со средним содержанием щавелевой кислоты (от 1,0 до 0,3 г/кг веса продукта): морковь, цикорий, зеленая фасоль, лук, помидоры, чай. Разрешаются продуты со средним и низким содержанием щавелевой кислоты: белокочанная капуста, абрикосы, бананы, картофель, грибы, баклажаны, кабачки, горох, огурцы, тыква. Ограничиваются продукты, богатые витамином С: шиповник, перец сладкий, смородина, облепиха, капуста брюссельская, цветная, рябина, апельсины. При построении диеты необходимо помнить, что аскорбиновая кислота в человеческом организме не синтезируется и является жизненно необходимым элементом питания, поэтому нельзя полностью элиминировать продукты, содержащие витамин С, из рациона питания.
На фоне диетических мероприятий экскреция оксалатов с мочой уменьшается на 40% и более. Экскреция оксалатов может быть уменьшена в результате изменения метаболизма глицина при введении в организм бензоата натрия, который блокирует эндогенный синтез оксалатов из глицина, то есть при введении в рацион (дополнительное питье) клюквы и брусники. Уменьшение выделения оксалатов на фоне дачи бензоата натрия происходит благодаря превращению глицина в гиппуровую кислоту.
При урикозурических нефропатиях рекомендована диета с ограничением пуриновых веществ. Продукты с высоким содержанием пуринов: сардины, сельдь, скумбрия, субпродукты. Среднее содержание пуринов: чечевица, говядина, свинина, кролик, речная и озерная рыба.
С учетом того, что кристаллы оксалатов и уратов осаждаются в кислой среде, необходимо следить за соотношением кислых и щелочных валентностей в пище, кислые валентности содержатся в продуктах животного происхождения и злаковых, щелочные во фруктах и овощах, то есть ориентироваться на молочно-растительный (из разрешенного перечня) стереотип питания.
Кроме того, с ощелачивающей целью назначаются щелочные минеральные воды типа «Боржоми», «Нарзан», «Ессентуки» и т. п., средней минерализации в возрастных дозах, курсами по 2–3 недели.
К методам диетической коррекции также можно отнести прием растительных масел как поставщиков полиненасыщенных жирных кислот по 5,0–15,0 мл 1–3 раза в день. Растительные масла логично использовать в качестве заправок для овощных салатов, пюре или каши.
Медикаментозное лечение
Основу медикаментозного лечения любой формы дисметаболических нефропатий составляет метаболическая и мембранопротекторная терапия.
При оксалозе рекомендовано назначение витаминов В1 и В6 с целью активизации метаболизма глицина, назначают витамины per os в высоких дозах от 20–60 мг/сут до 100 мг/сут в утренние и дневные часы, курс 2–3 недели. При оксалозе можно применять и комплексные препараты, содержащие витамины В1 и В6.
Магне В6 содержит пиридоксин и магний. Разрешен к применению у детей старше 12 лет. Принимается по 1–2 таблетки 3 раза в день. Курс 2–3 недели.
Мульти-табс В-Комплекс. Содержит: витамин В1 (тиамина нитрат) — 15 мг, витамин В2 (рибофлавин) — 15 мг, витамин В6 (пиридоксина гидрохлорид) — 15 мг, витамин В12 (цианокобаламин) 5 мкг, никотинамид — 60 мг, пантотеновую кислоту (кальция пантотенат) — 30 мг, фолиевую кислоту — 200 мкг. Применять по 1–2 таблетки в день, курс 2–3 месяца.
При оксалурии и уратурии показаны курсы метаболической терапии и мембранопротекторов, витамины А, Е, Аевит в возрастных дозах.
Димефосфон (15% раствор). Является антигипоксантом и антиоксидантом, регулятором водно-электролитного баланса и кислотно-щелочного состояния. Применяют внутрь, запивая водой, в виде раствора, взрослым и детям по 30–50 мг/кг (или из расчета 1 мл 15% раствора на 5 кг массы тела), 1–4 раза в сутки, длительность приема 3 недели — 2 месяца. Обладает горьким вкусом, поэтому для облегчения приема детям рекомендуется запивать молоком, фруктовым соком или сладким чаем.
Элькар (L-карнитин) — 20% водный раствор для перорального применения, содержащий 200 мг действующего вещества в 1 мл раствора. Препарат относится к фармакологической группе «Метаболические средства» и выпускается во флаконах по 25, 50 и 100 мл. Элькар представляет собой прозрачную бесцветную жидкость без запаха, содержащую L-карнитин, по химической структуре и биологической активности идентичный природному. Участвует в процессах обмена веществ. Нормализует структуру и функцию митохондрий, оптимизирует энергетический обмен в клетках. После приема внутрь хорошо всасывается в кишечнике, концентрация в плазме крови достигает максимума через 3 ч и сохраняется в терапевтическом диапазоне в течение 9 ч, выводится почками. Препарат разрешен к применению у детей с первого года жизни. Легко дозируется, можно применять в качестве питья или в виде добавки к сладким блюдам. До 3 лет 5–10 капель на прием, от 3 до 6 лет — по 0,1 г (14 капель) 2–3 раза в день (суточная доза — 0,2–0,3 г), от 6 до 12 лет — по 0,2–0,3 г (28–42 капли) 2–3 раза в день (суточная доза — 0,4–0,9 г). Курс лечения — 1 мес. Противопоказаний для назначения препарата нет.
Эссенциале форте Н. Содержит эссенциальные фосфолипиды (EPL) из соевых бобов, содержащие 76% (3-sn-фосфатидил) холина, сочетающиеся с природными эндогенными фосфолипидами по химической структуре, нормализуют метаболизм липидов и белков, способствуют активации и защите фосфолипидзависимых ферментных систем, восстанавливают клеточную структуру, улучшают регенерацию. Ежедневный прием — по 2 капсулы 2–3 раза в день, во время еды, проглатывая целиком, запивая небольшим количеством воды.
Эссливер форте. Выпускается в капсулах. Содержит эссенциальные фосфолипиды (фосфатидилхолин — 29%, фосфатидилэтаноламин и др.) — 300 мг, витамин B1 — 6 мг, витамин В2 — 6 мг, витамин В6 — 6 мг, витамин В12 — 6 мкг, токоферола ацетат — 6 мг, никотинамид — 30 мг. Регулирует проницаемость биомембран, активность мембраносвязанных ферментов, обеспечивая физиологическую норму процессов окислительного фосфорилирования в клеточном метаболизме. Восстанавливает мембраны путем структурной регенерации и методом конкурентного ингибирования перекисных процессов. Применяется внутрь по 2 капсулы 3 раза в день во время еды. У детей до 12 лет применяется с осторожностью.
Фосфоглив. Комплексный препарат, содержащий фосфатидилхолин растительного происхождения и тринатриевую соль глицирризиновой кислоты из корня солодки. Фосфатидилхолин является основным компонентом фосфолипидного биослоя биологических мембран. При пероральном введении в организм фосфатидилхолин восстанавливает целостность клеточных мембран. Глицирризиновая кислота обладает противовоспалительными свойствами. Форма выпуска — капсулы. По 1–2 капсулы 3 раза в день в течение 30 дней регулярно. Высшая разовая доза — 4 капсулы, суточная — 12 капсул. Разрешен к применению у взрослых.
Тыквеол. Формы выпуска: капсулы, масло для приема внутрь, свечи ректальные. Содержит комплекс биологически активных веществ из семян тыквы (каротиноиды, токоферолы — не менее 4%, фосфолипиды, стерины, фосфатиды, флавоноиды, витамины B1, B2, C, PP, насыщенные, ненасыщенные и полиненасыщенные жирные кислоты — пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Оказывает выраженное антиоксидантное действие, угнетающее процессы перекисного окисления липидов в биологических мембранах. Эссенциальные фосфолипиды — структурные элементы клеточных мембран и мембран органелл, регулируют проницаемость мембран и процессы окислительного фосфорилирования, способствуют восстановлению структуры и функции мембран. Применяется внутрь, по 1 чайной ложке экстракта за 30 мин до еды или по 2–4 капсулы, во время или после еды 3–4 раза в сутки.
Длительность курса протекторной терапии 2–3 недели, проводится 3–4 раза в год.
Помимо мембранопротекторной терапии широко используются комбинированные препараты на основе лекарственных трав и эфирных масел.
Фитотерапия традиционно популярна для лечения самых разных заболеваний почек. В целом, надо отметить, что при дисметаболической нефропатии целесообразно использовать лекарственные травы с диуретическими и мембраностабилизирующими свойствами и избегать трав с высоким содержанием оксалатов и аскорбиновой кислоты при оксалурии. Несмотря на большой выбор лекарственных растений и их препаратов, важно выделять те из них, в отношении которых имеются научные данные в плане эффективности лечения и безопасности. Одним из наиболее популярных в лечении дисметаболических нефропатий препаратов является растительный лекарственный препарат Канефрон Н. В исследованиях показано мочегонное, уросептическое, мембраностабилизирующее и антиоксидантное действие Канефрона Н при различных инфекционно-воспалительных и обменных заболеваниях почек. Препарат может использоваться как в лечебном комплексе, так и отдельно длительным курсом у детей с дисметаболическими нефропатиями.
Канефрон Н. Выпускается в виде водно-спиртового раствора и в драже. В состав лекарственного препарата растительного происхождения входят: травы золототысячника (Centaurii herba), корня любистока (Levistici radix), листьев розмарина (Rosmarini folia). Фармакологическое действие: диуретическое, спазмолитическое, противовоспалительное, антибактериальное. Способ применения и дозы: внутрь, грудным детям — по 10 капель 3 раза в сутки; детям дошкольного возраста — по 15 капель 3 раза в сутки; детям школьного возраста — по 25 капель или по 1 драже 3 раза в сутки. Курс 2–4 недели. При необходимости (для улучшения вкуса) капли можно принимать вместе с другими жидкостями. Драже следует принимать не разжевывая, запивая небольшим количеством воды.
Олиметин. Комплексный препарат, содержащий масло мяты перечной, масло терпентинное очищенное, масло аира, масло оливковое, серу очищенную. Оказывает спазмолитическое, желчегонное, мочегонное и противовоспалительное действие. Форма выпуска — капсулы. Применяют по 1–2 капсулы 3 раза в день до еды. Курс 2–3 недели. С профилактической целью применяют по 1 капсуле в день длительным курсом.
Фитолизин. Препарат — паста мягкой консистенции, зелено-коричневого цвета со специфическим ароматом. Содержит экстракты растений: корня петрушки, корневища пырея, травы полевого хвоща, листьев березы, травы горца птичьего и др., а также масла — мятное, шалфейное, сосновое, апельсиновое и ванилин. Оказывает мочегонное, противовоспалительное, спазмолитическое действие. Применяют для разрыхления и удаления мочевых конкрементов и облегчения их выведения с мочой. Принимают по 1 чайной ложке в 1/2 стакана теплой подслащенной воды 3 раза в день после еды. Форма выпуска: в тубах по 100 г.
Цистон. За счет комбинированного состава препарат нормализует коллоидное равновесие мочи, обладает противовоспалительным, антисептическим и спазмолитическим, диуретическим действием, что позволяет его использовать в качестве одного из основных средств лечения дисметаболической нефропатии, причем длительным курсом до 6 месяцев, в возрастных дозах.
Уролесан. Форма выпуска — капли. Состав: масла пихтовое, масло перечной мяты, масло касторовое, экстракт семян моркови дикой, экстракт шишек хмеля, экстракт травы душицы обыкновенной. Применяют при мочекаменной и желчнокаменной болезни. Препарат оказывает спазмолитическое и противовоспалительное действие. Принимают внутрь по 8–10 капель перед едой. Курс лечения 3–4 недели.
Фитотерапия. При выборе лекарственных растений учитывается наличие мочегонного действия, зависящего от содержания эфирных масел, сапонинов, силикатов (можжевельник, петрушка, листья березы, хвощ полевой), противовоспалительного действия, связанного с присутствием танинов и арбутина (листья брусники, толокнянка), антисептического, обусловленного фитонцидами (ромашка, зверобой, тысячелистник, пол-пола), и литолитического эффекта (почечный чай, василек, марена красильная, пол-пола).
При интеркуррентных заболеваниях назначается постельный режим, обильное питье, обязательно мембранопротекторная или фитотерапия, при необходимости тщательно подбираются антибактериальные препараты, не обладающие нефротоксическим действием, сдаются контрольные анализы мочи при выздоровлении и через 10–14 дней.
Диспансерное наблюдение проводится индивидуально в зависимости от клинического варианта течения дисметаболической нефропатии.
Литература
Эрман М. В. Нефрология детского возраста в схемах и таблицах, С.-Пб: Специальная литература, 1997, с. 182–203, 319–339.
Игнатова М. С., Вельтищев Ю. Е. Детская нефрология. М.: Медицина, 1989, с. 276–293.
Шулутко Б. И. Болезни печени и почек. С.-Пб: Ренкор, 1995, с. 399–408.
Нефрология. Под ред. Тареевой И. Е. М.: Медицина, 1995, с. 312–321.
Регистр лекарственных средств России-2007.
Химический состав пищевых продуктов. Справочные таблицы содержания основных пищевых веществ и энергетической ценности пищевых продуктов. Под ред. Покровского А. А. М.: Пищевая промышленность, 1976, 227 с.
С. В. Рычкова, доктор медицинских наук, доцент
СПб МАПО, Санкт-Петербург
Контактная информация об авторе для переписки: [email protected]
Купить номер с этой статьей в pdf
Дисметаболическая нефропатия — цены на лечение нефропатии почек в Москве
Дисметаболическая нефропатия подразделяется на первичную и вторичную:
- первичная – имеет врожденный характер;
- вторичная – возникает вследствие неправильного питания, длительного применения широкого ряда лекарственных средств, радиационного поражения.
Предрасполагающими к образованию дисметаболических нефропатий факторами являются плохая экология, чрезмерные психоэмоциональные нагрузки, постоянные стрессы, вредные привычки и т. д. Люди, страдающие дисметаболическими нефропатиями, входят в группу высокого риска по развитию мочекаменной и почечнокаменной болезни пиелонефрита, интерстициального нефрита. Первичные дисметаболические нефропатии, к счастью, встречаются крайне редко.
Причины дисметаболических нефропатий
Дисметаболическая нефропатия – полиэтиологичное заболевание, развивающееся при участии многих факторов. Причинами развития такой патологии могут выступать интоксикации и отравления организма, тяжелые физнагрузки, продолжительный прием некоторых лекарств, монодиеты. Но основной причиной дисметаболических нефропатий являются нарушения метаболических процессов в организме, связанных с отклонениями в других органах и системах.
Подавляющее число дисметаболических нефропатий (около 85%) связаны с нарушением кальциевого обмена, избытком оксалатов и фосфатов или имеют сочетанный характер – оксалатно-фосфатно-уратные. Причинами фосфатурии выступают хроническая инфекция мочевой системы, гиперпаратиреоз, некоторые болезни ЦНС. Цистиновая нефропатия возникает на фоне пиелонефрита или тубулярного интерстициального нефрита.
Симптомы дисметаболической нефропатии
Каких-либо специфических признаков заболевание не имеет и чаще всего обнаруживается случайно. «Оксалаты в моче» – такую небрежную надпись многие могли наблюдать в результатах анализа мочи. Но редко кто ей придает серьезное значение, особенно если наличие оксалатов или уратов было единичным.
Но если при проведении повторных анализов выявляется стойкое появление в моче кристаллов оксалата кальция, нужно задуматься о комплексном обследовании, поскольку кристаллурия является одним из первых макропризнаков серьезных нарушений в работе почек.
В пользу нефропатии свидетельствует и присоединение таких симптомов:
- головокружение, раздражительность;
- головная боль, тошнота;
- неприятный «аммиачный» запаха изо рта;
- отеки;
- артериальная гипертензия;
- склонность к аллергическим реакциям;
- болезненные ощущения в поясничной области.
При дальнейшем прогрессирования патологии возникают симптомы мочекаменной болезни, а если к дисметаболической нефропатии присоединяется инфекция, развивается клиническая картина воспаления почек.
Диагностика нефропатии
Основными методами диагностирования дисметаболической нефропатии являются лабораторные анализы мочи и ряд инструментальных исследований:
- рентгеноскопические исследования;
- УЗИ почек;
- измерение антикристаллообразующей способности мочи (АКОСМ).
Только обнаружение солевых отложений в общем анализе мочи является мотивом для установления диагноза дисметаболическая нефропатия не является. Выделение кристаллов нередко связано с погрешностями в питании и бывает преходящим.
Для подтверждения диагноза обязательно проводится биохимический анализ мочи, тест на кальцифилаксию и проба на перекиси в моче, показывающая интенсивность процесса перекисной оксидации мембран клеток. Как и любой иной тип нефропатии, данная патология без своевременного обнаружения и проведения эффективного лечения может спровоцировать развитие тяжелой функциональной почечной недостаточности.
Лечение дисметаболической нефропатии
Лечение дисметаболической нефропатии предполагает комплексный подход и кроме медикаментозной терапии включает ряд режимных мероприятий: соблюдение диеты и питьевого режима. Терапевтическая схема подбирается в зависимости от типа заболевания, общего состояния пациента, выраженности симптомов, стадии поражения почек и наличия сопутствующих патологий.
Все терапевтические мероприятия направлены в первую очередь на ликвидацию причины нефропатии, предупреждение кристаллообразования, нормализацию метаболических процессов и выведение солей из организма. При тщательном соблюдении врачебных рекомендаций и назначений, соблюдении диеты и питьевого режима прогноз болезни очень благоприятный. Игнорирование рекомендаций нефролога приведет к развитию воспаления тканей почек и возникновению мочекаменной болезни.
Лечением нефропатии в Клинике Современной Медицины занимаются опытные нефрологи, врачи высшей категории, успешно комбинирующие традиционные и современные терапевтические методики, что обеспечивает наилучший результат лечения.
Наш медицинский центр оказывает самый широкий спектр услуг. Вы всегда можете обратится к нам по вопросам лечения нефрологических заболеваний. Мы готовы оказать вам услуги лечения гематурии (кровь в моче) и лечения гипертонической болезни в сочетании с почечной патологией.
что это, признаки и симптомы, лечение нефротичесого синдрома
Помимо распространенных детских заболеваний, встречаются и те, которые регистрируются у малышей довольно нечасто. Одной из таких патологий является дисметаболическая нефропатия. С этим состоянием чаще всего встречаются нефрологи, чем педиатры.
Что это такое?
Дисметаболическая нефропатия — это патологическое состояние, которое приводит к нарушенной работе почек. Этот клинический симптомокомплекс – совсем не отдельное заболевание. К развитию данного неблагоприятного и даже опасного состояния у ребенка могут приводить различные заболевания.
Если доктор выявляет у малыша дисметаболическую нефропатию, то это говорит о наличии целого комплекса нарушений в мочевыводящих органах и почках.
По статистике, у каждого третьего малыша встречаются клинические признаки данного состояния. Дисметаболическая нефропатия — это совсем не диагноз и даже не приговор. При устранении причин, которые способствовали ее развитию, она полностью исчезает. Для этого требуется своевременная диагностика и проведение соответствующего лечения основного заболевания.
Обычно признаки дисметаболической нефропатии встречаются у детей внепланово. При проведении скрининга мочи врачи выявляют в ней изменения, которые являются клиническими признаками функциональных нарушений в работе почек. Данное патологическое состояние может развиться в разном возрасте. Длительное течение дисметаболических нефропатий приводит к развитию у ребенка нефротического синдрома.
Это состояние проявляется стойкими отеками, которые преимущественно располагаются на лице и верхней половине тела. Нефротический синдром обычно регистрируется у 13-16 из 100 000 малышей. Существуют популяционные особенности в заболеваемости.
Для устранения данного патологического состояния требуется назначение комплексного лечения, которое обычно составляется детским нефрологом.
Причины
Дисметаболическая нефропатия у детей это, прежде всего, нарушенный обмен веществ. Стойкие изменения приводят к тому, что в моче малыша появляются различные кристаллы солей. По своему составу они могут быть разными. Это в большей степени определяется химическим составом камней.
К развитию дисметаболической нефропатии у малышей приводят множественные причины. В некоторых случаях установить их достаточно сложно. Нередко патологическое состояние работы почек развивается в результате сразу нескольких причинных факторов одновременно. К развитию выраженного нарушения в работе почек приводят:
- различные интоксикации химическими веществами;
- сильные отравления различными промышленными продуктами;
- неправильное и нерациональное питание;
- анатомические дефекты, возникшие сразу после рождения ребенка.
Также ученые говорят о наличии врожденных форм заболевания. В этом случае изменения в работе почек наблюдаются уже в течение первых месяцев после рождения ребенка. Приводит к этому состоянию, как правило, осложненное течение беременности. Если во время вынашивания плода у будущей мамы развивается тяжелый гестоз или токсикоз на поздних сроках, то это существенно увеличивает риск появления функциональных нарушений мочевыделительных органов у ребенка.
Также к врожденной форме дисметаболической нефропатии приводят внутриутробные состояния, при которых возникает гипоксия плода. Если кислородное голодание тканей возникло на ранних стадиях беременности, то это способствует нарушению органогенеза. При этом закладка и внутриутробное развитие почек нарушается. Впоследствии у ребенка могут возникнуть различные заболевания мочевыводящих путей: острый гломерулонефрит с нефротическим синдромом, пиелонефриты и другие. Нефротическая форма гломерулонефрита у маленького ребенка – достаточно опасная болезнь, которая требует обязательной консультации с нефрологом и назначения специального лечения. В некоторых случаях терапия пожизненная.
Многие исследователи говорят о наследственной предрасположенности. Если у родителей или близких родственников есть склонность к мочекаменной болезни, то часто и у ребенка появляются характерные изменения.
Некоторые генетические мутации также способны провоцировать нарушения в работе почек. Такие случаи встречаются достаточно редко.
Идиопатический вариант дисметаболической нефропатии также регистрируется в детской практике. Это клиническое состояние устанавливается методом исключения. Обычно для этого врачи проводят расширенную дифференциальную диагностику, исключающую все возможные альтернативные причины, которые могли бы вызвать нарушения в работе почек у ребенка. Встречается идиопатическая нефропатия у малышей раннего возраста.
Классификация
В основе любой дисметаболической нефропатии лежат выраженные нарушения обмена. Это проявляется отклонениями в нормальном химическом составе мочи и появлении различных кристаллов солей. В зависимости от входящих в их состав веществ выделяют несколько вариантов данного состояния.
С учетом химического состава кристаллов выделяют следующие клинические варианты:
- Оксалатурия — состояние, при котором в моче появляется большое количество оксалатов. Этот патологический процесс обусловлен системными нарушениями кальциевого обмена в организме. Избыточное образование щавелевой кислоты приводит к появлению в моче ее кристаллов (оксалатов). Данное состояние может быть разной степени выраженности. Самые незначительные признаки появляются при 1 степени оксалатурии.
- Уратурия. Характеризуется появлением в остатке мочи уратных кристаллов. Данная патология может быть первичной и вторичной. Синдром Леша — Найхана считается основной наследственной причиной появления большого количества уратных скоплений в моче у детей. Различные виды гемолитической анемии, эритремия, миеломная болезнь, пиелонефрит — являются самыми распространенными заболеваниями, приводящими к появлению уратной дисметаболической нефропатии у детей.
- Фосфатурия. Характеризуется появлением в общем анализе мочи большого количества фосфатных кристаллов. Часто к данному патологическому нарушению приводят различные инфекционные заболевания, развивающиеся в почках. Болезни ЦНС, а также различные патологии паращитовидных желез приводят к нарушению фосфорного обмена в детском организме. Существуют также лекарственные формы фосфатной дисметаболической нефропатии, вызванные длительным приемом противоопухолевых препаратов, тиазидных мочегонных, салицилатов, а также циклоспорина А.
- Цистиновая форма. Возникает у малышей при нарушении в обмене цистина. Это вещество является основным продуктом обмена метионина. Избытки кристаллов цистина начинают откладываться в почечных канальцах, интерстициальной ткани почек, селезенке и печени, лимфатических узлах, кровяных тельцах, спинном мозге. Вторичная цистиновая дисметаболическая нефропатия может развиться при некоторых вариантах пиелонефрита или тубулярном интерстициальном нефрите.
- Смешанная. Характеризуется появлением различных видов кристаллов. Может быть врожденной и приобретенной. Вторичные формы смешанной дисметаболической нефропатии встречаются при различных хронических заболеваниях почек и мочевыводящих путей. Регистрируется у малышей любого возраста.
Симптомы
Многие формы дисметаболической нефропатии протекают бессимптомно. Малыша может ничего не беспокоить. Поведение и самочувствие ребенка при этом никак не изменяется. Выявляются патологические нарушения в почках, как правило, во время сдачи общего анализа мочи. Появившиеся в нем различные кристаллы, свидетельствует о наличии у малыша проблем с обменными процессами.
В некоторых случаях же нефропатия протекает с появлением различных неблагоприятных признаков. Обычно они бывают системными. Так, у малышей, имеющих врожденную оксалатурию, имеются также признаки артропатий, подагры, спондилеза, мочекаменной болезни, сахарного диабета. Это сочетанные патологические состояния. Они возникают в результате исходного нарушения в обмене веществ в организме на разных уровнях.
Нарушения обмена веществ наблюдаются при всех клинических вариантах дисметаболической нефропатии.
Малыши, имеющие обменные функциональные нарушения почек, также часто страдают ожирением, аллергическими патологиями, гипотонией. У них возникают проблемы с мочеиспусканием, может появиться небольшое жжение или болезненность при мочеиспускании. Симптомы дисметаболической нефропатии — весьма не специфические и во многом зависят от основного заболевания.
Диагностика
Обнаружить нефропатию самостоятельно в домашних условиях — довольно трудная и порой просто невыполнимая задача. В некоторых случаях кристаллы можно обнаружить при сливании из детского горшка мочи. Она становится достаточно мутной и имеет выраженный белый осадок. В норме моча имеет соломенно-желтую окраску и довольно прозрачна. Появление мутности или осадка обязательно должно насторожить родителей и мотивировать их на обращение за консультацией к врачу.
В установлении диагноза дисметаболической нефропатии обязательно участвует детский уролог или нефролог. Эти специалисты обладают необходимыми знаниями, а, главное, опытом лечения таких патологических состояний у детей. После проведения клинического осмотра и обследования они порекомендуют несколько дополнительных анализов, которые помогут уточнить диагноз.
К базовой диагностике дисметаболической нефропатии относится обязательное проведение общего анализа крови. Этот простой и доступный лабораторный тест позволяет выявить различные кристаллы солей в мочевом остатке, определить плотность и удельный вес мочи, а также распознать белок. Количество лейкоцитов и эритроцитов в данном анализе устанавливает присутствие у ребенка каких-либо заболеваний почек и мочевыводящих путей, которые могли бы стать причиной появления у него метаболической нефропатии. В ряде сложных диагностических случаев врачи прибегают к назначению более специфических анализов мочи. Анализ мочи по Нечипоренко помогает выявить некоторые латентные формы пиелонефрита и гломерулонефрита, которые часто приводят к развитию нарушений обмена в почках у малышей.
Если причиной заболевания почек стала бактериальная инфекция, то тогда уместным будет проведение бактериологического исследования мочи с определением чувствительности к антибиотикам.
Обычно этот анализ выполняется в течение недели и дает точное описание о том, какая патогенная микрофлора находится в моче. Этот тест дает врачам больше возможностей назначить адекватное и правильное лечение.
Для выявления камней в почках, а также для установления различных структурных патологий назначается ультразвуковое исследование с допплер-картированием. Для каждого заболевания мочевыводящих путей характерны свои специфичные эхопризнаки. С помощью высокоточного обследования можно выявить различные патологии почек даже на самых ранних стадиях. Метод — безопасный и может применяться даже у самых маленьких пациентов.
Для детей более старшего возраста в некоторых случаях применяют обзорную урографию. С помощью введения специального контраста оценивается работа почек, и выявляются функциональные нарушения, связанные с патологиями выведения мочи. Фото с изображением результата обзорной урографии дает специалистам полноценную картину об имеющихся патологиях почек и мочевыводящих путей.
Лечение
Терапия дисметаболической нефропатии индивидуальна для каждого ребенка. Многообразие клинических вариантов болезни обуславливает применение различных тактик для устранения неблагоприятных последствий нарушенного обмена веществ. Выбор лечения остается за детским урологом или нефрологом.
Доктор устанавливает длительность и интенсивность терапии исходя из физиологических особенностей ребенка и наличия у него сопутствующих хронических заболеваний.
Для лечения нарушенного обмена веществ в почках применяют:
- Диету. Питание малышей должно быть калорийным и соответствовать возрастным нормам по всем необходимым нутриентам. Из детского меню исключаются все наваристые и крепкие мясные бульоны, которые содержат довольно много различных экстрактивных веществ. При склонности к образованию оксалатов следует ограничить в питании употребление клюквы, брусники, щавеля, свеклы, моркови, свежей зелени. Также ограничению подлежат кондитерские сладости, содержащие в своем составе какао-бобы.
- Уход. Если дисметаболическая нефропатия имеет вторичное происхождение и ее появлению у ребенка способствовало какое-то заболевание почек, то следует максимально внимательно следить за самочувствием малыша. При появлении первых признаков обострения хронической патологии мочевыводящих путей следует обязательно показать малыша врачу. Весь острый период заболевания ребенок должен оставаться дома. Малыши с высокой температурой тела должны находиться на постельном режиме.
- Медикаментозная терапия. Заключается в назначении лекарственных средств для лечения основного заболевания и симптоматического лечения различных нарушений обмена веществ. Для улучшения работы почек в детском возрасте применяются различные антиоксидантные средства и поливитаминные комплексы. При нарушениях мочевыведения назначаются диуретические (мочегонные) средства.
Длительность и кратность, а также дозировки лекарственных препаратов обсуждаются индивидуально с лечащим врачом.
- Фитотерапия. Успешно применяется для нормализации химического состава мочи у малышей уже на протяжении многих лет. Давно замечено, что некоторые лекарственные травы обладают уросептическим действием и нормализуют работу почек. Применять их можно в качестве чая или добавлять в еду.
- Достаточный питьевой режим. Для того чтобы в почках не застаивались кристаллы, и не наступила мочекаменная болезнь следует употреблять достаточное количество воды за сутки. В среднем, школьник должен выпивать не менее 1-1,5 литров жидкости. Поступающая в организм вода обеспечивает нормальную работу почек и снижает риск развития дисметаболической нефропатии.
Еще больше информации о нефропатии смотрите в следующем выпуске программы «Медицинский Вестник».
Нефрит: типы, причины и симптомы
Нефрит — это состояние, при котором воспаляются нефроны, функциональные единицы почек. Это воспаление, известное также как гломерулонефрит, может отрицательно сказаться на функции почек.
Почки — это органы в форме бобов, которые фильтруют циркулирующую в организме кровь, удаляя из нее лишнюю воду и продукты жизнедеятельности.
Существует много типов нефрита с различными причинами. В то время как некоторые типы возникают внезапно, другие развиваются как часть хронического состояния и требуют постоянного лечения.
В этой статье рассматриваются типы, причины и симптомы нефрита, а также варианты лечения.
Существует несколько различных типов нефрита, в том числе:
Острый гломерулонефрит: Эта форма нефрита может развиться внезапно после тяжелой инфекции, такой как ангина, гепатит или ВИЧ.
Волчанка и более редкие заболевания, такие как васкулиты и гранулематоз с полиангиитом (ГПА), также могут привести к острому воспалению почек.Человеку с этими состояниями потребуется немедленная медицинская помощь во время обострения, чтобы уменьшить повреждение почек.
Волчанка-нефрит: Волчанка — это аутоиммунное заболевание, которое означает, что иммунная система по ошибке атакует здоровые ткани организма.
Более половины всех людей с диагнозом волчанка в конечном итоге заболевают волчаночным нефритом. Это происходит, когда иммунная система атакует почки.
Симптомы волчаночного нефрита включают:
Люди могут также замечать симптомы в других частях тела.Эти симптомы могут включать проблемы с суставами, жар и сыпь.
Тяжесть волчанки может различаться у разных пациентов. Хотя болезнь иногда переходит в ремиссию, состояние может стать серьезным. Каждому, кто испытывает симптомы волчаночного нефрита, жизненно важно немедленно обратиться за медицинской помощью, чтобы ограничить дальнейшее повреждение почек.
Синдром Альпорта, или наследственный нефрит: Это заболевание может привести к почечной недостаточности, а также к проблемам со зрением и слухом. Синдром Альпорта передается по наследству, и у мужчин он обычно протекает тяжелее.
Хронический гломерулонефрит: Эта форма нефрита развивается медленно и вызывает мало симптомов на ранних стадиях. Как и в случае острого гломерулонефрита, это состояние может вызвать тяжелое поражение почек и почечную недостаточность. Он может передаваться по наследству или развиваться после внезапного заболевания.
IgA нефропатия: Это одна из наиболее распространенных форм нефрита. Он развивается, когда отложения антител IgA накапливаются в почках и вызывают воспаление.
Иммунная система вырабатывает антитела для борьбы с вредными веществами и организмами, попадающими в организм.Люди с невропатией IgA имеют дефектные антитела IgA.
Врачи не часто обнаруживают IgA-нефропатию у молодых людей, поскольку первые симптомы легко не заметить. Люди могут лечить это состояние с помощью лекарств от кровяного давления.
Интерстициальный нефрит: Эта форма нефрита, которая часто развивается очень быстро, обычно возникает из-за инфекции или приема определенных лекарств. Это влияет на часть почек, называемую интерстицией, которая представляет собой пространство, заполненное жидкостью.
Если врач быстро отменит пациенту проблемное лекарство, полное выздоровление возможно через несколько недель.Однако иногда повреждение может накапливаться до почечной недостаточности.
Есть много разных причин нефрита. В некоторых случаях причина может быть неясной.
Нефрит и заболевание почек часто передаются по наследству, что предполагает возможный генетический компонент. Некоторые инфекции, такие как ВИЧ и гепатит B или C, также могут вызывать нефрит.
В некоторых случаях повреждение почек может возникнуть в результате приема лекарств, например, антибиотиков. Это повреждение может привести к нефриту.Прием слишком большого количества болеутоляющих, нестероидных противовоспалительных препаратов (НПВП) или мочегонных таблеток также может вызвать это состояние.
Две почки — это органы размером с кулак, напоминающие боб, которые располагаются прямо под ребрами по обе стороны от позвоночника. Они удаляют загрязнения и лишнюю воду из крови, фильтруя около 150 литров крови в день.
Каждая почка состоит из тысяч структур, называемых нефронами, в которых происходит фильтрация крови. В каждом нефроне в процессе двухэтапной очистки необходимые питательные вещества отделяются от отходов.
Фильтр, называемый клубочком, улавливает клетки крови и белок, отправляя воду и отходы во второй фильтр, называемый канальцем. Канальец захватывает минералы и дополнительный белок. После этого отходы покидают организм с мочой.
У людей с нефритом воспаляются как канальцы, так и близлежащие ткани, что может привести к повреждению почек.
Поврежденные почки не могут работать на полную мощность. Накапливаются отходы, вызывающие серьезные проблемы со здоровьем. Если состояние тяжелое или достаточно стойкое, это может привести к почечной недостаточности.
Факторы риска
Наиболее важными факторами риска заболевания почек являются:
Симптомы нефрита редко бывают серьезными на ранних стадиях. Следующие признаки могут указывать на то, что человек страдает этим заболеванием:
- изменения в мочеиспускании
- опухоль в любом месте тела, особенно на руках, ногах, лодыжках и лице
- изменение цвета мочи
- пенистая моча
- кровь в моче
Когда обратиться к врачу
Моча, содержащая кровь, будет коричневой или розовой.Любой человек с этим признаком должен как можно скорее обратиться к врачу.
Также лучше обратиться за медицинской помощью при любых других симптомах, связанных с мочеиспусканием. Раннее лечение может предотвратить необратимое повреждение почек и более серьезные осложнения нефрита.
В некоторых случаях врач может обнаружить нефрит во время обычного анализа крови или мочи.
Обнаружение белка в моче может указывать на неправильную работу почек. Анализ крови, который измеряет содержание в крови продукта жизнедеятельности, называемого креатинином, также может предоставить информацию о здоровье почек.
Однако биопсия — лучший способ проверить наличие нефрита. Для этой процедуры врач удалит кусочек почки иглой и отправит его в лабораторию на анализ.
Поделиться на PinterestЛекарства могут помочь в тех случаях, когда инфекция почек не проходит без лечения.Лечение нефрита может варьироваться в зависимости от причины и типа.
Острый нефрит иногда проходит без лечения. Однако обычно для этого требуются лекарства и специальные процедуры, которые удаляют лишнюю жидкость и опасные белки.
Лечение хронического нефрита обычно включает регулярные осмотры почек и мониторинг артериального давления. Врачи могут назначить водные таблетки для контроля артериального давления и уменьшения отеков.
В некоторых случаях также могут быть полезны лекарства, предотвращающие атаку иммунной системы почек.
Врачи могут также направить человека с почечной инфекцией к диетологу, который посоветует ему, что нужно есть для защиты почек. Подходящая диета обычно будет с низким содержанием белка, соли и калия.
Профилактика
Хотя не всегда можно предотвратить нефрит, определенные методы образа жизни могут снизить риск для многих людей. Эти методы включают:
- поддержание здорового веса
- отказ от курения
- поддержание артериального давления и уровня сахара в крови в пределах нормы
- регулярные физические упражнения
Питательная, сбалансированная диета также может помочь защитить здоровье почек.
Острые эпизоды нефрита часто хорошо поддаются лечению, но иногда спустя годы у людей может развиться хронический гломерулонефрит.
Хотя нефрит не всегда поддается лечению, правильное лечение может сдержать его состояние и защитить почки.
Чтобы предотвратить и ограничить повреждение почек, необходимо тщательно следовать инструкциям врача.
При возникновении почечной недостаточности человеку может потребоваться диализ или трансплантация почки. Диализ — это медицинская процедура, которая поддерживает безопасный уровень химических веществ в крови, имитируя способ, которым здоровые почки удаляют из нее отходы и лишнюю жидкость.
Нефрит — это воспаление почек. Он имеет ряд причин и может быть острым или хроническим. Ранние симптомы могут включать изменение цвета мочи и отек рук и ног.
Любой, кто замечает изменения в моче, должен посетить врача, чтобы проверить, не повреждены ли почки. Без лечения это может привести к почечной недостаточности.
Q:
Как обнаружить инфекцию почек на ранних стадиях, чтобы избежать осложнений?
A:
Инфекция почек обычно начинается с боли при мочеиспускании, неприятного запаха мочи и частых позывов к мочеиспусканию.Позже, по мере поражения почек, вы можете заметить боль в боку, жар, тошноту и рвоту.
Лучше всего обратиться к врачу, когда вы начнете замечать изменения в своей моче, например запах или кровь, поскольку лечение до того, как состояние ухудшится, может помочь предотвратить долгосрочные повреждения.
Daniel Murrell, MD Ответы отражают мнение наших медицинских экспертов. Весь контент носит исключительно информационный характер и не может рассматриваться как медицинский совет. .Интерстициальный нефрит: причины, симптомы и диагностика
Что такое интерстициальный нефрит?
Интерстициальный нефрит — это заболевание почек, характеризующееся отеком между канальцами почек.
Основные функции почек — фильтровать кровь и выводить из организма шлаки. Почечные канальцы реабсорбируют воду и важные органические вещества из отфильтрованной крови и выделяют ненужные вещества с мочой для удаления из организма.Набухание этих канальцев может вызвать ряд почечных симптомов от легких до тяжелых.
Интерстициальный нефрит может быть острым (внезапным) или хроническим (длительным).
Наиболее частым симптомом интерстициального нефрита является уменьшение количества мочи. В некоторых случаях диурез может увеличиваться. Иногда симптомы могут отсутствовать.
Другие симптомы интерстициального нефрита включают:
Острый интерстициальный нефрит (ОИН) часто является результатом аллергической реакции.Большинство случаев ОИН возникает из-за плохой реакции на лекарства. Более 100 различных лекарств могут вызвать AIN. Многие из этих лекарств попадают в следующие категории:
- антибиотики
- нестероидные противовоспалительные препараты (НПВП), которые часто используются в качестве болеутоляющих средств
- ингибиторы протонной помпы, которые используются для лечения избытка желудочной кислоты
Аллергические реакции на лекарства более тяжелы у пожилых людей. Кроме того, в этой группе они чаще вызывают необратимое повреждение почек.
Причины неаллергического интерстициального нефрита включают:
Неаллергический интерстициальный нефрит может быть хроническим или острым. Хронические формы могут длиться несколько месяцев и дольше. Обычно они вызваны хроническими заболеваниями.
Пожилые люди являются основной группой риска по ОИН. Это потому, что они часто принимают несколько лекарств. Кроме того, они могут запутаться в приеме препаратов в комбинации.
Другие группы с высоким риском интерстициального нефрита включают тех, кто:
- хронически употребляет безрецептурные обезболивающие
- страдает аутоиммунными заболеваниями
- страдает саркоидозом, воспалительным заболеванием легких
Если ваш врач подозревает, что ваши почки не функционируют должным образом, он составит подробную историю болезни.Они спросят вас об истории болезни вашей семьи. Они также спросят вас:
- какие лекарства вы принимаете
- как часто вы их принимаете
- как долго вы их принимаете
Обязательно сообщайте своему врачу обо всех употребляемых наркотиках, включая безрецептурные обезболивающие и пищевые добавки. Эти препараты могут оказывать значительное влияние на почки.
Ваш врач также послушает ваше сердце и легкие. Жидкость в легких — частый признак почечной недостаточности.Его можно обнаружить по изменению звуков дыхания. Высокое кровяное давление также является потенциальным признаком проблем с почками, а также изменения веса.
Следующие анализы крови используются для оценки функции почек:
Другие тесты, которые можно использовать для выявления проблем с почками, включают:
Если ваш врач подозревает, что ваши проблемы с почками вызваны побочным эффектом или взаимодействием лекарств, вы можете попросить прекратить прием подозреваемого препарата. Во многих случаях эта мера быстро вернет функцию почек в норму.
Лечение интерстициального нефрита зависит от причины.
Когда ОИН вызван лекарственной аллергией, единственным необходимым лечением может быть отмена препарата. В других случаях AIN можно лечить противовоспалительными препаратами. Быстрое лечение часто приводит к полному выздоровлению.
Иногда интерстициальный нефрит вызывает необратимое повреждение почек до того, как вам может быть поставлен диагноз. Это повреждение также требует лечения. Удаление соли из рациона может улучшить удержание воды и высокое кровяное давление.Следование диете с низким содержанием белка также может помочь улучшить функцию почек.
В тяжелом случае может потребоваться диализ для поддержки функции почек. Людям, страдающим почечной недостаточностью, может потребоваться пересадка.
Перспективы интерстициального нефрита зависят от того, какой у вас тип и было ли вызвано какое-либо повреждение почек.
В большинстве случаев вы полностью выздоравливаете, если лечить аллергическую реакцию или основное заболевание и не вызывать необратимого повреждения почек.
.Острый нефрит: типы, причины и симптомы
Почки — это фильтры вашего тела. Эти два органа в форме бобов представляют собой сложную систему удаления отходов. По данным Национального института диабета, болезней пищеварительной системы и почек (NIDDK), они перерабатывают от 120 до 150 литров крови в день и удаляют до 2 литров отходов и лишней воды.
Острый нефрит возникает, когда ваши почки внезапно воспаляются. У острого нефрита есть несколько причин, и в конечном итоге он может привести к почечной недостаточности, если его не лечить.Это состояние раньше было известно как болезнь Брайта.
Существует несколько типов острого нефрита:
Интерстициальный нефрит
При интерстициальном нефрите воспаляются пространства между канальцами почек. Это воспаление вызывает опухание почек.
Пиелонефрит
Пиелонефрит — это воспаление почек, обычно вызванное бактериальной инфекцией. В большинстве случаев инфекция начинается в мочевом пузыре, а затем мигрирует по мочеточникам в почки.Мочеточники — это две трубки, по которым моча транспортируется из каждой почки в мочевой пузырь.
Гломерулонефрит
Этот тип острого нефрита вызывает воспаление клубочков. В каждой почке миллионы капилляров. Клубочки — это крошечные скопления капилляров, которые транспортируют кровь и действуют как фильтрующие элементы. Поврежденные и воспаленные клубочки могут не фильтровать кровь должным образом. Узнайте больше о гломерулонефрите.
У каждого типа острого нефрита свои причины.
Интерстициальный нефрит
Этот тип часто является результатом аллергической реакции на лекарство или антибиотик. Аллергическая реакция — это немедленная реакция организма на инородное вещество. Ваш врач мог прописать вам лекарство, чтобы помочь вам, но организм считает его вредным веществом. Это заставляет тело атаковать само, что приводит к воспалению.
Низкий уровень калия в крови — еще одна причина интерстициального нефрита. Калий помогает регулировать многие функции организма, включая сердцебиение и обмен веществ.
Прием лекарств в течение длительного времени может повредить ткани почек и привести к интерстициальному нефриту.
Пиелонефрит
Большинство случаев пиелонефрита вызвано бактериальными инфекциями E.coli . Этот тип бактерий в основном встречается в толстом кишечнике и выделяется с калом. Бактерии могут перемещаться из уретры в мочевой пузырь и почки, что приводит к пиелонефриту.
Хотя бактериальная инфекция является основной причиной пиелонефрита, другие возможные причины включают:
- Исследования мочи с использованием цистоскопа, инструмента, который заглядывает внутрь мочевого пузыря
- Хирургия мочевого пузыря, почек или мочеточников
- образование камни в почках, скальные образования, состоящие из минералов и других отходов
Гломерулонефрит
Основная причина этого типа почечной инфекции неизвестна.Тем не менее, некоторые состояния могут способствовать развитию инфекции, в том числе:
- проблемы в иммунной системе
- рак в анамнезе
- абсцесс, который разрывается и попадает в почки через кровь
У некоторых людей риск острого заболевания выше. Нефрит . Факторы риска острого нефрита включают:
Ваши симптомы будут зависеть от типа острого нефрита. Наиболее частыми симптомами всех трех типов острого нефрита являются:
Врач проведет медицинский осмотр и изучит историю болезни, чтобы определить, есть ли у вас повышенный риск острого нефрита.
Лабораторные тесты также могут подтвердить или исключить наличие инфекции. Эти тесты включают анализ мочи, который проверяет наличие крови, бактерий и лейкоцитов (лейкоцитов). Их значительное присутствие может указывать на инфекцию.
Врач также может назначить анализ крови. Двумя важными показателями являются азот мочевины крови (АМК) и креатинин. Это отходы, которые циркулируют в крови, а почки отвечают за их фильтрацию. Если эти цифры увеличиваются, это может указывать на то, что почки тоже не работают.
Визуализирующее сканирование, такое как компьютерная томография или ультразвуковое исследование почек, может показать закупорку или воспаление почек или мочевыводящих путей.
Биопсия почек — один из лучших способов диагностики острого нефрита. Поскольку это включает в себя тестирование реального образца ткани почек, этот тест проводится не всем. Этот тест проводится, если человек плохо реагирует на лечение или если врач должен поставить точный диагноз.
Лечение гломерулонефрита и интерстициального нефрита может потребовать лечения основных состояний, вызывающих проблемы.Например, если лекарство, которое вы принимаете, вызывает проблемы с почками, ваш врач может назначить альтернативное лекарство.
Лекарства
Врач обычно назначает антибиотики для лечения почечной инфекции. Если ваша инфекция очень серьезна, вам могут потребоваться внутривенные (IV) антибиотики в условиях стационара. Внутривенные антибиотики обычно действуют быстрее, чем антибиотики в форме таблеток. Такие инфекции, как пиелонефрит, могут вызывать сильную боль. Ваш врач может назначить лекарство для облегчения боли по мере выздоровления.
Если у вас сильно воспалены почки, врач может назначить кортикостероиды.
Добавки
Когда ваши почки не работают, это может повлиять на баланс электролитов в вашем организме. Электролиты, такие как калий, натрий и магний, отвечают за химические реакции в организме. Если у вас слишком высокий уровень электролитов, ваш врач может назначить внутривенное введение жидкости, чтобы стимулировать почки выделять дополнительные электролиты. Если у вас низкий уровень электролитов, вам могут потребоваться добавки.Это могут быть таблетки калия или фосфора. Однако вам не следует принимать какие-либо добавки без одобрения и рекомендации врача.
Диализ
Если ваша функция почек значительно нарушена из-за инфекции, вам может потребоваться диализ. Это процесс, при котором специальный аппарат действует как искусственная почка. Диализ может быть временной необходимостью. Однако, если ваши почки сильно повреждены, вам может потребоваться диализ навсегда.
Уход на дому
При остром нефрите вашему организму нужно время и энергия для выздоровления.Ваш врач, вероятно, порекомендует постельный режим во время вашего выздоровления. Ваш врач может также посоветовать вам увеличить потребление жидкости. Это помогает предотвратить обезвоживание и удерживает фильтрацию почек для выделения продуктов жизнедеятельности.
Если ваше состояние влияет на функцию почек, ваш врач может порекомендовать специальную диету с низким содержанием определенных электролитов, таких как калий. Многие фрукты и овощи содержат много калия. Ваш врач может проинструктировать вас, какие продукты содержат мало калия.
Вы также можете замочить некоторые овощи в воде и слить воду перед их приготовлением.Этот процесс, известный как выщелачивание, может удалить лишний калий.
Ваш врач может также порекомендовать сократить потребление продуктов с высоким содержанием натрия. Когда в крови слишком много натрия, почки задерживают воду. Это может повысить кровяное давление.
Есть шаги, которые вы можете предпринять, чтобы уменьшить содержание натрия в своем рационе.
Ешьте меньше натрия
- Используйте свежее мясо и овощи вместо расфасованных. Расфасованные продукты, как правило, содержат много натрия.
- По возможности выбирайте продукты с пометкой «с низким содержанием натрия» или «без натрия».
- Когда обедаете вне дома, попросите официанта попросить повара ограничить добавление соли в ваши блюда.
- Приправляйте пищу специями и травами вместо приправ на основе натрия или соли.
Все три типа острого нефрита улучшатся после немедленного лечения. Однако, если ваше состояние не будет лечиться, у вас может развиться почечная недостаточность. Почечная недостаточность возникает, когда одна или обе почки перестают работать на короткое время или навсегда. В этом случае вам может потребоваться диализ навсегда.По этой причине крайне важно немедленно обратиться за лечением при подозрении на проблемы с почками.
.