Грипп
Сезонный грипп — это острая респираторная инфекция, вызываемая вирусами гриппа, которые циркулируют во всем мире.
Патоген
Существует 4 типа вирусов сезонного гриппа – типы A, B, C и D. Вирусы гриппа A и B циркулируют и вызывают сезонные эпидемии болезни.
Вирусы гриппа А подразделяются на подтипы в соответствии с комбинациями гемагглютинина (HA) и нейраминидазы (NA), белков на поверхности вируса. В настоящее время среди людей циркулируют вирусы гриппа подтипов A(h2N1) и A(h4N2). A(h2N1) также обозначается как A(h2N1)pdm09, поскольку он вызвал пандемию 2009 г. и впоследствии сменил вирус сезонного гриппа A(h2N1), циркулировавший до 2009 года. Известно, что пандемии вызывали только вирусы гриппа типа А.
Вирусы гриппа В не подразделяются на подтипы, но могут подразделяться на линии. В настоящее время циркулирующие вирусы гриппа типа В принадлежат к линиям В/Ямагата и В/Виктория.
Вирус гриппа С
 Поэтому он не представляет проблемы для общественного
здравоохранения.
Поэтому он не представляет проблемы для общественного
здравоохранения. Вирусы группы D, в основном, инфицируют крупный рогатый скот. По имеющимся данным, они не инфицируют людей и не вызывают у них заболеваний.
Признаки и симптомы
Для сезонного гриппа характерно внезапное появление высокой температуры, кашель (обычно сухой), головная боль, мышечные боли и боли в суставах, тяжелое недомогание, боль в горле и насморк. Кашель может быть тяжелым и длиться 2 недели и более. У большинства людей температура нормализуется и симптомы проходят в течение недели без какой-либо медицинской помощи. Но грипп может приводить к развитию тяжелой болезни и к смерти, особенно у людей из групп высокого риска (см. ниже).
Болезнь может протекать как в легкой, так и в тяжелой форме и даже заканчиваться смертельным исходом. Случаи госпитализации и смерти происходят, в основном, в группах высокого риска. По оценкам, ежегодные эпидемии гриппа приводят к 3-5 миллионам случаев тяжелой болезни и к 290 000 – 650 000 случаев смерти от респираторных заболеваний.
В промышленно развитых странах большинство случаев смерти, связанных с гриппом, происходят среди людей в возрасте 65 лет и старше (1). Эпидемии могут приводить к высоким уровням отсутствия на работе/в школе и к потерям производительности. Во время пиковых периодов заболеваемости клиники и больницы могут быть переполнены.
Последствия эпидемий сезонного гриппа в развивающихся странах недостаточно известны, но по результатам научных исследований 99% случаев смерти детей в возрасте до 5 лет с инфекциями нижних дыхательных путей, связанных с гриппом, происходят в развивающихся странах (2).
Эпидемиология
Люди болеют гриппом в любом возрасте, но есть группы населения, подверженные повышенному риску.
- Повышенному риску развития тяжелой болезни или осложнений в результате инфицирования подвергаются беременные женщины, дети в возрасте до 59 месяцев, пожилые люди, люди с хроническими нарушениями здоровья (такими как хронические болезни сердца, легких и почек, нарушения метаболизма, нарушения неврологического развития, болезни печени и крови) и люди с ослабленным иммунитетом (в результате ВИЧ/СПИДа, химиотерапии или лечения стероидами, а также в связи со злокачественными новообразованиями).

- Работники здравоохранения подвергаются высокому риску инфицирования вирусом гриппа во время контактов с пациентами и могут способствовать дальнейшей передаче инфекции, особенно людям из групп риска.
В районах с умеренным климатом сезонные эпидемии происходят, в основном, в зимнее время года, тогда как в тропических районах вирусы гриппа циркулируют круглый год, приводя к менее регулярным эпидемиям.
Период времени с момента инфицирования до развития болезни, известный как инкубационный период, длится около 2 дней, но может варьироваться от 1 до 4 дней.
Диагностика
В большинстве случаев грипп человека клинически диагностируется. Однако в периоды низкой активности вирусов гриппа и при отсутствии эпидемий инфекция, вызванная другими респираторными вирусами, такими как риновирус, респираторный синцитиальный вирус, вирус парагриппа и аденовирус, может также протекать как гриппоподобное заболевание, что затрудняет клинически дифференцировать грипп от других патогенов.
Для постановки окончательного диагноза необходимо собрать надлежащие респираторные образцы и выполнить лабораторный диагностический тест. Первым важнейшим шагом для лабораторного выявления вирусных инфекций гриппа является надлежащий сбор, хранение и транспортировка респираторных образцов. Обычно лабораторное подтверждение вирусов гриппа в выделениях из горла, носа и носоглотки или в аспиратах или смывах из трахеи осуществляется путем прямого выявления антигенов, изоляции вирусов или выявления специфичной для гриппа РНК методом полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР).
В клиниках для выявления гриппа применяются диагностические экспресс-тесты, но по сравнению с методами ОТ-ПЦР они имеют низкую чувствительность, и надежность их результатов в значительной мере зависит от условий, в которых они используются.
Лечение
Пациенты, не входящие в группы повышенного риска, должны получать симптоматическое лечение. При наличии симптомов им рекомендуется оставаться дома с тем, чтобы минимизировать риск инфицирования других людей в сообществе. Лечение направлено на смягчение симптомов гриппа, таких как высокая температура. Пациенты должны следить за своим состоянием и в случае его ухудшения обращаться за медицинской помощью. Если известно, что пациентам угрожает высокий риск развития тяжелой болезни или осложнений (см. выше), они, помимо симптоматического лечения, должны как можно скорее получать противовирусные препараты.
Пациенты с тяжелым или прогрессирующим клиническим заболеванием, связанным с предполагаемой или подтвержденной вирусной инфекцией гриппа (например, с клиническими синдромами пневмонии, сепсиса или обострения сопутствующих хронических заболеваний), должны как можно скорее получать противовирусные препараты.
- Для получения максимального терапевтического эффекта следует как можно скорее (в идеале, в течение 48 часов после появления симптомов) назначать ингибиторы нейраминидазы (например, озельтамивир). Для пациентов на более поздней стадии болезни следует также предусматривать прием лекарственных препаратов.
- Лечение рекомендуется проводить не менее 5 дней, но можно продлевать до получения удовлетворительных клинических результатов.
- Использование кортикостероидов следует предусматривать только при наличии других показаний (таких как астма и другие конкретные нарушения здоровья), поскольку оно связано с более длительным выведением вирусов из организма и ослаблением иммунитета, что приводит к бактериальной или грибковой суперинфекции.
- Все циркулирующие в настоящее время вирусы гриппа устойчивы к противовирусным препаратам класса адамантанов (таким как амантадин и римантадин), поэтому эти препараты не рекомендуется применять в качестве монотерапии.

Профилактика
Среди здоровых взрослых людей противогриппозная вакцина обеспечивает защиту даже в том случае, если циркулирующие вирусы не соответствуют в точности вакцинным вирусам. Однако для пожилых людей вакцинация против гриппа может быть менее эффективной с точки зрения предотвращения болезни, но ослабляет ее тяжесть и уменьшает вероятность развития осложнений и смертельного исхода.
ВОЗ рекомендует ежегодную вакцинацию для следующих групп населения:
- беременные женщины на любом сроке беременности
- дети в возрасте от 6 месяцев до 5 лет
- пожилые люди (старше 65 лет)
- люди с хроническими нарушениями здоровья
- работники здравоохранения.
Эффективность противогриппозной вакцины зависит от того, насколько циркулирующие вирусы совпадают с вирусами, содержащимися в вакцине. Из-за постоянно изменяющейся природы вирусов гриппа Глобальная система эпиднадзора за гриппом и ответных мер ВОЗ (ГСЭГО) – система национальных центров по гриппу и сотрудничающих центров ВОЗ во всем мире – осуществляет непрерывный мониторинг за вирусами гриппа, циркулирующими среди людей, и дважды в год обновляет состав противогриппозных вакцин.
На протяжении многих лет ВОЗ обновляет свои рекомендации в отношении состава вакцины (трехвалентной), нацеленной на 3 наиболее представленных циркулирующих типа вируса (два подтипа вируса гриппа А и один подтип вируса гриппа В). Начиная с сезона гриппа 2013-2014 г. в северном полушарии для содействия разработке четырехвалентной вакцины рекомендуется вводить четвертый компонент. Четырехвалентные вакцины в дополнение к вирусам, входящим в состав трехвалентной вакцины, включают второй вирус гриппа типа В, и ожидается, что они обеспечат более широкую защиту против инфекций, вызванных вирусом гриппа типа В. Многие инактивированные и рекомбинантные противогриппозные вакцины доступны в инъекционной форме. Живая аттенуированная противогриппозная вакцина доступна в форме назального спрея.
Предэкспозиционная и постэкспозиционная профилактика с помощью противовирусных препаратов возможна, но ее эффективность зависит от ряда факторов, таких как индивидуальные особенности, тип воздействия и риск, связанный с воздействием.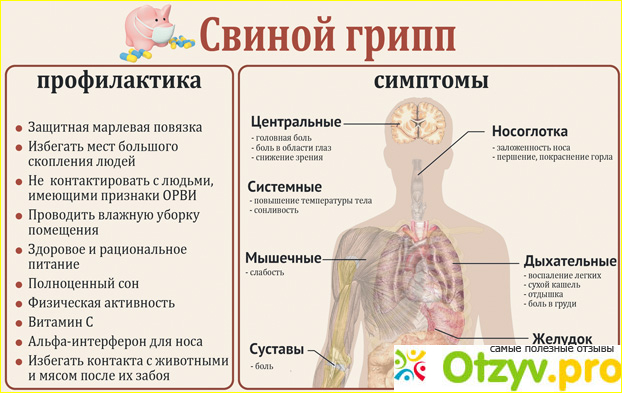
Помимо вакцинации и противовирусного лечения мероприятия общественного здравоохранения включают меры индивидуальной защиты, такие как:
- регулярное мытье и надлежащее высушивание рук;
- надлежащая респираторная гигиена – прикрытие рта и носа при кашле и чихании салфетками с их последующим надлежащим удалением;
- своевременная самоизоляция людей, почувствовавших себя нездоровыми, с высокой температурой и другими симптомами гриппа;
- предотвращение тесных контактов с больными людьми;
- предотвращение прикасаний к глазам, носу и рту.
Деятельность ВОЗ
ВОЗ через систему ГСЭГО ВОЗ и в сотрудничестве с другими партнерами проводит мониторинг за активностью гриппа в глобальных масштабах, дает рекомендации по составам вакцины против сезонного гриппа дважды в год для северного и южного полушарий, помогает странам с тропическим и субтропическим климатом в выборе вакцинных препаратов (для северного и южного полушарий) и принятии решений в отношении времени проведения кампаний вакцинации и оказывает поддержку государствам-членам в разработке стратегий профилактики и контроля.
ВОЗ работает в целях усиления национального, регионального и глобального потенциала для принятия мер в связи с гриппом (включая диагностику, мониторинг чувствительности к противовирусным препаратам, эпиднадзор за болезнью и реагирование на вспышки болезни), расширения охвата вакцинацией в группах населения высокого риска и обеспечения готовности к следующей пандемии гриппа.
(1) Estimates of US influenza-associated deaths made using four different methods.
Thompson WW, Weintraub E, Dhankhar P, Cheng OY, Brammer L, Meltzer MI, et al. Influenza Other Respi Viruses. 2009;3:37-49
(2) Global burden of respiratory infections due to seasonal influenza in young children: a systematic review and meta-analysis.
Nair H, Abdullah Brooks W, Katz M et al. Lancet 2011; 378: 1917–3
(3) WHO recommended surveillance standards, Second edition.
Высокопатогенный грипп птиц Текст научной статьи по специальности «Ветеринарные науки»
ПТИЦА
УДК 619:616. 921.5
921.5
Материалы по гриппу птиц предоставлены РОАО «Росагробиопром»
Высокопатогенный грипп птиц
Б.П. Экви, Российский ветеринарный журнал Н.И. Рогожина, Торговый Дом «Биопром»
Ключевые слова: грипп, птицы
Сокращения: ВГП — вирус гриппа птиц; КЭ — куриные эмбрионы; РГА — реакция гемагглютинации; РДП — реакция диффузионной преципитации; ПЦР — полимеразная цепная реакция
Введение
Грипп птиц впервые описал Перрончито в 1878 г. Первоначально его путали с болезнью Ньюкасла, но после установления этиологии последнюю стали называть азиатской, а грипп — европейской (классической) чумой птиц. Вспышки европейской чумы птиц регулярно происходили в начале минувшего века в странах Европы, Африки и Азии. В Северную Америку болезнь попала только в 1925 г.
В Северную Америку болезнь попала только в 1925 г.
За последние 50 лег минувшего столетия за рубежом зарегистрировали 18 наиболее крупных эпизоотий этого заболевания: 5 в Великобритании, 5 в Австралии, 3 в других странах Европы, и по одной в Пакистане, Гонконге, Канаде, США и Мексике [2]. Не обошло оно стороной и нашу страну — особенно большой ущерб инфекция она нанесла птицеводству центральных районов России в 60…70-х годах минувшего столетия.
В новом миллениуме болезнь стала одной из основных причин беспокойства ветеринарных и медицинских специалистов всего мира. В 2002 г. ее впервые зарегистрировали в Южной Америке. Эпизоотия, начавшаяся на следующий год в Юго-Восточной Азии, отличается от предыдущих участившимися случаями заболевания и смерти людей, продолжительностью и масштабами, грозящими ее переходом в пандемию.
В данной публикации обсудим лишь некоторые особенности биологии ВГП, которые могут объяснить причины происходящего, а также остановимся на аспектах практического плана, важных для правильной диагностики и предотвращения широкого распространения заболевания.
Возбудитель
Вирусы гриппа — агенты с одноцепочечной РНК, входящие в сем. ОлЬотухоутс1ае. Их делят на 3 рода: А, В и С. У птиц в полевых условиях инфекцию вызывает ВГП, входящий в состав рода А. Генетический анализ показал, что ВГП был прародителем исчезнувшего 15 лет тому назад и современного вирусов гриппа лошадей, вируса гриппа свиней и вируса гриппа человека [4].
О степени родства штаммов ВГП судят по поверхностным гликопротеинам — гемагглютинину (Н) и нейраминида-зс (К). Выделенные за обозримый период времени от домашних и диких пернатых штаммы ВГП относились к подтипам, обладающим комбинацией 15 вариантов Н (Н1…Н15) и 9 вариантов N (Ш…Ы9). При одновременной инфекции несколькими подтипами ВГП между их нуклеиновыми кислотами происходит обмен сегментами (в нуклеиновой кислоте вируса их 8). Поэтому гипотетически (с учетом числа вариантов НиИ) возможно 256 модификаций возбудителя.
Многие подтипы ВГП (их называют слабопатогенными) широко распространены, но их инфекция протекает бессимптомно или в легкой форме. Встреча восприимчивой птицы с высокопатогенными подтипами ВГП (в настоящее время их известно 2 — Н5 и Н7) значительно опаснее — инфекция может принять генерализованную форму и завершиться леталь-
ным исходом. Но далеко не все штаммы ВГП, имеющие антигены Н5 или Н7, высокопатогенны для домашней птицы.
Грань между слабопатогенными и высокопатогенными штаммами ВГП крайне тонка. Прекрасной иллюстрацией этому служит вспышка гриппа птиц в Чили (2002 г.), вызванная высоковирулентным штаммом подтипа Н7Ш. Он эволюционировал из слабопатогенных штаммов ВГП того же подтипа, широко распространенных в Южной Америке, но ранее никогда не вызывавших у птицы симптомов гриппа |9).
В последние годы вспышки высокопатогенного гриппа птиц на Американском континенте (США, 2004 г. ), в Пакистане (2004 г) и Нидерландах (2004 г.) вызвал подтип Н7, а в Юго-восточной Азии и других странах Европы — подтип Н5. Подтип Н5Ы1, получивший в настоящее время наиболее широкое распространение, появился, по всей видимости, в Гонконге в 1997 г. В последующем он проник в Южную Корею, Китай, Вьетнам, Японию, Таиланд, Камбоджу, Лаос, Индонезию, Малайзию и Филиппины, а затем перелетные птицы занесли его в Монголию, Казахстан, Россию, Турцию, Грецию, Хорватию и Кувейт.
), в Пакистане (2004 г) и Нидерландах (2004 г.) вызвал подтип Н7, а в Юго-восточной Азии и других странах Европы — подтип Н5. Подтип Н5Ы1, получивший в настоящее время наиболее широкое распространение, появился, по всей видимости, в Гонконге в 1997 г. В последующем он проник в Южную Корею, Китай, Вьетнам, Японию, Таиланд, Камбоджу, Лаос, Индонезию, Малайзию и Филиппины, а затем перелетные птицы занесли его в Монголию, Казахстан, Россию, Турцию, Грецию, Хорватию и Кувейт.
Специфические природно-климатические и социально-экономические условия Юго-восточной Азии сделали этот регион «генетическим котлом», в котором периодически возникают опасные варианты ВГП. Например, в Таиланде в последние годы от заболевшей птицы изолировали не только подтип Н5Ш, но и Н5Ы2.
Устойчивость
ВГП способен длительно сохраняться в фекалиях и тушках птицы, особенно при низкой температуре: при 4 °С несколько недель, а при -60 °С в течение нескольких лет. В зависимости от субстрата, в котором находится вирус, он инак-тивируется при температуре 56 °С за 1…3 ч., при 60 °С за 10…30 мин, при 70 °С за 2…5 мин. На ВГП губительно действуют кислая рН, формалин, додецилсульфат натрия, растворители жиров, (3-пропиолактон, препараты йода, широко применяемые средства дезинфекции (хлорная известь, креолин, карболовая кислота и др.).
В зависимости от субстрата, в котором находится вирус, он инак-тивируется при температуре 56 °С за 1…3 ч., при 60 °С за 10…30 мин, при 70 °С за 2…5 мин. На ВГП губительно действуют кислая рН, формалин, додецилсульфат натрия, растворители жиров, (3-пропиолактон, препараты йода, широко применяемые средства дезинфекции (хлорная известь, креолин, карболовая кислота и др.).
Резервуар инфекции
Важнейшую часть природного резервуара ВГП составляют дикие водоплавающие птицы. Их сезонные миграции и относительно высокая устойчивость к возбудителю создают условия для широкого распространения инфекции. Филогенетический анализ изолятов ВГП, выделенных от диких птиц в разных уголках планеты, выявил удивительный факт: возбудитель в этом резервуаре на протяжении длительного периода времени не претерпевает существенных генетических изменений. С одной стороны это радует, поскольку было бы значительно хуже, если бы в стадах диких птиц регулярно появлялись новые высокопатогенные варианты возбудителя. Но в такой экологии инфекции кроется опасная ловушка — дикие птицы могут сохранять многие опасные штаммы ВГП в состоянии генетического стаза на протяжении неопределенно длительного времени. Эти «мины замедленного типа» могут «взорваться» в любой момент.
Но в такой экологии инфекции кроется опасная ловушка — дикие птицы могут сохранять многие опасные штаммы ВГП в состоянии генетического стаза на протяжении неопределенно длительного времени. Эти «мины замедленного типа» могут «взорваться» в любой момент.
Из домашней птицы к ВГП наиболее восприимчивы курица и индейка, в меньшей степени фазан, перепелка, утка, гусь, цесарка, павлин и страус.
ВГП способен преодолевать межвидовые барьеры. От свиней выделяли его подтипы НШ1, Н1Ы7, НЗЫ2, Н5Ш, от
I
лошадей h4N8, от норок h20N4, от тигра, леопарда и домашней кошки H5N1, от тюленей H7N7, h5N5, h5N6 и h4N3, от китов h23N2, h23N9 и от людей h2N1, h3N2, h4N2, h4N8, H5N1, H7N3, H7N7. Роль большинства перечисленных видов млекопитающих в эпизоотологии гриппа птиц не изучена.
Говоря о зооантропонозном потенциале ВГП, следует в первую очередь вспомнить испанку, вызванную подтипом h2N1: в 1919 г. она унесла жизнь у 40…50 млн. людей. Жертвы распространяющегося в настоящее время подтипа пока не столь велики — в Юго-восточной Азии и Турции он вызвал заболевание нескольких сотен человек, из которых умерло около 80. Очевидно, циркулирующие штаммы H5N1 пока не приспособились к распространению от человека к человеку. Если это произойдет, то велика вероятность возникновения пандемии, последствия которой трудно предсказать.
она унесла жизнь у 40…50 млн. людей. Жертвы распространяющегося в настоящее время подтипа пока не столь велики — в Юго-восточной Азии и Турции он вызвал заболевание нескольких сотен человек, из которых умерло около 80. Очевидно, циркулирующие штаммы H5N1 пока не приспособились к распространению от человека к человеку. Если это произойдет, то велика вероятность возникновения пандемии, последствия которой трудно предсказать.
Пути заражения
Птицы заражаются ВГП при непосредственном контакте с источником инфекции, а также через контаминированные слюной, назальным секретом и фекалиями последнего объекты внешней среды (чаще всего воду). Как показывает опыт стран Азии, к контаминации возбудителем водоемов ведет не только пребывание на них инфицированных птиц, но также кормление выращиваемой рыбы птичьим пометом.
ВГП может механически распространяться, длительно сохраняясь на одежде персонала, оборудовании, в транспортных средствах и т. д. Попав на благополучную птицеферму, инфекция начинает быстро распространяться.
д. Попав на благополучную птицеферму, инфекция начинает быстро распространяться.
У людей случаев передачи подтипа H5N1, как это имело место с подтипом h2N1, не зарегистрировано. Однако у кошек H5N1 может передаваться горизонтальным путем |7|.
Сезонность
Поскольку основным резервуаром ВГП служат перелетные птицы, то вспышки гриппа в птицеводческих хозяйствах обычно происходят во время сезонных миграций пернатых — весной и осенью.
Симптоматика
Инкубационный период составляет 1…4 дня. Высокопатогенные штаммы ВГП, в отличие от слабопатогенных, инфекция которых обычно протекает бессимптомно или в легкой клинической форме, вызывают у восприимчивой птицы острую форму болезни. Наблюдают также молниеносное течении инфекции, когда птица погибает без предшествующего переболевания.
Острая форма гриппа сопровождается разнообразными клиническими проявлениями системной инфекции с преимущественным поражением органов пищеварения, дыхания, репродукции, а также нервной системы. У больной птицы проявляются вариабельные сочетания следующих симптомов: угнетения, сонливости, снижения аппетита, кашля, хрипов, чихания, обильного слезотечения, диареи, тремора, нарушен™ координации движений, цианоза непокрытых перьями участков кожи (особенно гребешка и сережек), отека головы, взъерошенности перьевого покрова, диареи, снижения яйценоскости и качества скорлупы яиц. Летальный исход наступает в течение 1…2 сут после появления первых симптомов. Падеж птицы может достигать 90…100%.
Патоморфология
Патоморфологическая картина при гриппе птицы также вариабельна, как и симптоматика, которой она во многом соответствует. При вскрытии павшей птицы отмечают отек мышц и подкожных тканей (особенно в области головы и шеи), скопление слизистых выделений в просвете трахеи, носовой и ротовой полостях, конъюнктивит, синусит, аэросак-кулит, ларинготрахеит, интерстициальную пневмонию, энтерит, нефрит, кровоизлияния (в нутряном жире, яичниках, лимфоидных тканях, тканях грудины, серозных покровах.
слизистой оболочке преджелудков и кишечника), скопление кровянистой жидкости в брюшной полости.
При гистологическом исследовании чаще всего выявляют некротические изменения печени, селезенки, головного мозга, поджелудочной железы, лимфоидных тканей кишечника, бронхит, дегенерацию мышечного слоя клоаки, катаральное поражение пищеварительного тракта.
Иммуногистохимическими методами обнаруживают антиген ВГП в печени, селезенке, сердце, кишечнике, преджелудках, яйцепроводах, головном мозге, почках, поджелудочной железе, легких и трахее. Вирусный антиген локализуется преимущественно в эндотелии капилляров и паренхиматозных клетках [6].
Диагностика
Неспецифичность и вариабельность симптоматики и па-томорфологических изменений у птицы при гриппе выдвигают на первый план при постановке диагноза вирусологическое исследование (это совсем не означает, что следует пренебрегать результатами клинического и патоморфологического исследований, а также данными эпизоотологического анализа).
При жизни от птицы для вирусологического исследования берут пробы фекалий, смывы со слизистых оболочек (клоаки, конъюнктивы, носа), выделения из глаз и носа, а от трупов — пораженные органы (трахею, легкие, кишечник, селезенку, почки, печень, головной мозг и сердце). Патологическим материалом заражают 8… 11-дневных КЭ. Для ускорения экспертизы уже через сутки после инокуляции патологического материала можно собирать пробы аллантоисной жидкости для тестирования в реакции гемагглютинации. Однако более надежные результаты получают при исследовании погибших КЭ (различные штаммы ВГП вызывают такой эффект в течение 1…7 дней). В конце этого срока аллантоисную жидкость повторно исследуют в РГА, а суспензию хорионаллантоисных оболочек в РДП. Эти реакции, проводимые с референтными антисыворотками к разным подтипам ВГП, служат надежными средствами идентификации возбудителя. В последние годы с той же целью стали применять иммуноферментный анализ.
ВОЗ рекомендует применять для экспресс-диагностики гриппа птиц перевиваемые линии клеток НеР-2, К!) и МОСК [ 1]. С помощью иммуноферментного анализа и реакции иммунофлюоресценции, а также ПЦР удается диагностировать инфекцию ВГП в течение 1..2 суток после внесения патологического материала в культуру клеток. В более поздние сроки для этого пользуются РГА.
Иммуноферментный анализ и ПЦР все шире применяют для тестирования патологического материала, взятого от птицы, подозреваемой в заражении ВГП.
После изоляции и идентификации ВГП биопробой на 4…8-недельных цыплятах определяют вирулентность штамма.
Определение аминокислотного состава кливедж-сайта гемагглютинина открывает еще большие возможности для оценки патогенности изолятов ВГП. Однако 2 подтипа ВПГ (1 [ 10X4 и 1110X5), которые не вызывают заболевания или гибели птицы после интраназатьного заражения и не имеют характерной для высокопатогеннных подтипов ВГП аминокислотной последовательности гемагглютинина, после внутривенного введения убивают практически всех цыплят. Причины данного феномена пока не известны.
Причины данного феномена пока не известны.
При клиническом обследовании заболевшей птицы, вскрытии трупов, взятии патологического материала и проведении лабораторных исследований следует придерживаться мер безопасности, чтобы не заразиться ВГП.
Серологическая диагностика
У инфицированной ВГП птицы развивается гуморальный иммунитет. Для обнаружения в ее сыворотке крови специфических антител пользуются РДП, РГА, реакцией инги-биции гемагглютинации и иммуноферментным анализом.
ПТИЦА
В РДП выявляют матричный и нуклеокапсидный антигены ВГП — они сходны у всех подтипов вируса. Эти антигены образуют с антисыворотками наиболее четкие линии преципитации при содержании в агаровом геле 8% натрия хлорида. Результаты РДП учитывают 2 раза: через 24 и 48 ч. после внесения реагентов в лунки.
после внесения реагентов в лунки.
Для постановки РГА и реакции ингибицйи гемагглюти-нации пользуются эритроцитами свободных от патогенных возбудителей цыплят. Эти тесты проводят в пластиковых планшетах при комнатной температуре или 4 «С. При исследовании сыворотки крови кур очень редко отмечают неспецифическую ингибицию агглютинации эритроцитов цыплят. Поэтому сыворотку крови кур тестируют без предварительной обработки. Из-за более высокой частоты неспецифических реакций сыворотку крови других видов птицы заранее обрабатывают эритроцитами цыплят. С этой целью смесь тестируемой сыворотки и эритроцитов после перемешивания выдерживают не менее 30 мин при комнатной температуре и центрифугируют 2.„5 мин при 800 g. Верхний слой сыворотки собирают для исследования.
РГА, реакцию ингибиции гемаплютпнации и иммунофер-ментный анализ применяют для исключения инфекции в стадах привитых птиц. Иммуноферментный анализ позволяет решить ту же задачу по обнаружению антител к неструктурному протеину NS1 ВГП, титр которых после иммунизации инакт!тированными вакцинами значительно ниже, чем при инфекции.
Профилактика и контроль
Успех борьбы с гриппом птиц во многом зависит от мониторинга эпизоотической ситуации в разных регионах мира, возможности создания на пути миграции перелетных птиц условий, снижающих риск заражения домашней птицы, в т.ч. иммунизации птицы в наиболее опасных районах. Пока нет вакцин, способных предотвратить заражение птицы всеми известными подтипами возбудителя. Однако вакцинация повышает резистентность птицы, снижая тяжесть симптоматики, интенсивность выделения возбудителя во внешнюю среду и уровень смертности.
Применение живых вакцин сопряжено с двумя проблемами — риском создания стационарных очагов инфекции в популяции привитой птицы и усложнением диагностики [5|.
Пнактивированные вакцины против гриппа птиц бывают 2 типов: гомологичные (из того же подтипа ВГП, что и циркулирующие в данном регионе полевые штаммы) и гетероло-гичные (из штамма, сходного с циркулирующими в данном регионе но гемагглютинину, но отличающегося от последних по нейраминидазе).
В настоящее время на Покровском заводе биопрепаратов, входящем в состав РОАО «Росагробиопром», возобновлено промышленное производство инактивированной эмульгированной вакцины, предназначенной для профилактическое! иммунизации против гриппа всех видов домашней птицы. Клинически здоровую птицу прививают сю двукратно: первый раз в возрасте 30…45 сут, второй раз в возрасте 90…120сут, но не позднее 1 мес до начала яйцекладки. Птицы старше 1 года подлежат ревакцинации. Препарат вводят птицам подкожно (в среднюю треть шеи) или внутримышечно (в область груди либо в область копчика) в дозе 0,5 см3. Через 28 сут после иммунизации оценивают напряженность поствакцинального иммунитета привитого стада. С этой целью в РТГА или И ФА исследуют сыворотку крови не менее 25 птиц. Вакцина должна вызывать у i 80% привитых птиц накопление в крови антител к ВГП в титре i 4 Лог2 и выше (в РТГА) или i 2 положительных показателей, как предусмотрено инструкцией по применению тест-системы ИФА, зарегистрированной в РФ. Если результаты проверки свидетельствуют о недостаточно высоком поствакцинальном иммунитете, стадо птиц ревакцинируют. Продолжительность по-
Если результаты проверки свидетельствуют о недостаточно высоком поствакцинальном иммунитете, стадо птиц ревакцинируют. Продолжительность по-
ствакцинального иммунитета составляет не менее 6 мес. Вакцина не вызывает клинически выраженной реакции. В некоторых случаях на месте инъекции возможно образование припухлости, исчезающей через 2…3 нед.
Серологическими методами отличить привитую птицу от цнфицированной можно только после вакцинации гетероло-гичными вакцинами. Это преимущество весьма существенно, тем более, что оба типа пнактивированных вакцин создают приблизительно одинаковый протектпвный иммунитет |8]. Данный принцип заложен в основу ряда разрабатываемых в настоящее время субъединичных и рекомбпнантных вакцин [3].
При проведении вакцинации часть птиц (обычно цыплят моложе 45 дней) не прививают. После проникновения высокопатогенного ВГ11 на ферму они заболевают в первую очередь.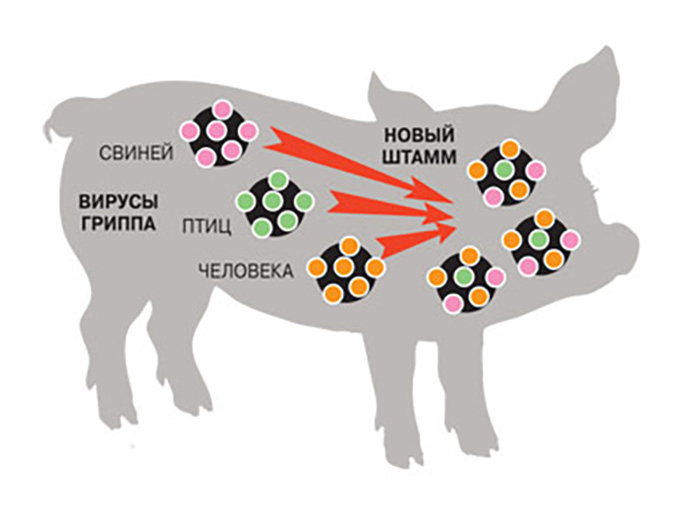
В периоды эпизоотий заболевания следует ограничить поступление в благополучные хозяйства птицы из других источников. При отсутствии такой возможности для восполнения поголовья птицу получают только из тщательно проверенных хозяйств. Необходима дезинфекция всех используемых за пределами птицефермы транспортных средств, а также регулярная обеззараживающая обработка одежды и обуви персонала хозяйства и всех посетителей.
В случае подозрения на проникновение инфекции в птицеводческое хозяйство принимают экстренные меры для проведения диагностических исследований и распространения возбудителя. При подтверждении диагноза на высокопатогенный грипп на неблагополучный пункт накладывают карантин и прибегают к полному уничтожению в нем домашней птицы. Трупы птицы целесообразно сжигать. Такой подход оправдан невозможностью надежной ликвидации инфекции ВГП одними только санитарно-карантинными мерами. После уничтожения пораженного стада птицы проводят дезинфекцию помещений птицефермы, всего находящегося в них оборудования, транспортных средств и прилегающей территории.
После уничтожения пораженного стада птицы проводят дезинфекцию помещений птицефермы, всего находящегося в них оборудования, транспортных средств и прилегающей территории.
БИБЛИОГРАФИЯ
1. Anon. Recommended laboratory tests to identity influenza A/H5 virus in specimens from patients with an influenza like illness, http://www.int/en.
2. Alexander D.J. Ecology of avian influenza in domestic birds. Proc Intern Symp Emergence & Control of Zoonotic Ortho- and Paramyxovirus Diseases, Merieux Foundation Veyrier-du-lac France 13-15 Dec 2000. In: Dodet В., Vicari M. (Eds.). John Libbey Eurotext, Montrouge, France, 2001, p. 25-34
3. Arriola J.M., Farr W., Uribe G., Zurita J. Experiencias de campo en el uso de vacunos contra influenza aviar. In: Proc. Curso de Enfermed Respir de las Aves, Asoc Nacion de Espec en Cienvias Avicelase, 1999, 3-13.
4. Gorman O.T., Bean W.J., KawaokaY., Webster R.G. Evolution of the nucleoprotein gene of influenza A virus. J Virol, 1990, 64, 1487-1497.
5. Lee C.W, Senne D.A., Suarez D.L.. Effect of vaccine use in the evolution of Mexican lineage H5N2 avian influenza virus. J Virol, 2004, 78, 15, 8372-8381.
6. Nakatani H; NakamuraK., YamamotoY. et al. Epidemiology, pathology, and immunohistochemistry of layer hens naturally affected with H5N1 highly pathogenic avian influenza in Japan. Avian Dis, 2005, 49, 3 , 436-441.
7. Rimmelzwaan G.F., van Riel D., Baars M. et al. Influenza A Virus (H5N1) Infection in Cats Causes Systemic Disease with Potential Novel Routes of Virus Spread within and between Hosts. Am J Pathol, 2006, 168, 1, 176-183.
8. Swaine D.E., Suarez D.L. Highly pathogenic avian influenza. Rev Sci Tech OIE., 2000, 20, 463-482.
Swaine D.E., Suarez D.L. Highly pathogenic avian influenza. Rev Sci Tech OIE., 2000, 20, 463-482.
9. Suarez D.L, Senne D.A., Banks J. et al. Recombination resulting in virulence shift in avian influenza outbreak, Chile. Emerg Inf Dis, 2004, 10, 4.
SUMMARY
B.P. Equi, N.I. Rogoghina. Highly pathogenic avian influenza.
Avian Influenza is a highly contagious viral infection which can affect all species of birds and can manifest itself in different ways depending mainly on the pathogenicity of the virus involved and on the species affected. In this article author describes the distinctive features of the higly pathogenic avian influenza, its epizootology, symptomatic, pathomorphology, methods of diagnostic & prophylactic. Proper vaccination can increase the resistance of birds to infection, reduce or prevent clinical signs & virus shedding. The control program against avian influenza must include immunization of all poultry from the age of 45 days.
The control program against avian influenza must include immunization of all poultry from the age of 45 days.
Высокопатогенный грипп птиц.
Грипп птиц – это остропротекающая особо опасная болезнь домашних, синантропных (голуби, вороны, галки, воробьи) и диких (утки, гуси, чайки) птиц. Наиболее восприимчива к заболеванию домашняя птица – куры, гуси, утки, индейки (особенно цыплята, гусята, утята, индюшата). Болезнь поражает органы дыхания, пищеварения, нервную систему и может вызывать гибель до 100% заболевшей птицы. Заболевание может протекать молниеносно, с массовой гибелью всей птицы в течение суток без клинических признаков или в острой форме с характерными для гриппа птиц признаками и гибелью больной птицы в течение 3-7 суток (особенно молодняка кур и уток).
Основные признаки болезни у больной домашней птицы: общее угнетение (слабость, сонливость), взъерошенность оперения, диарея, истечения из носовых отверстий и ротовой полости, хрипы, помутнение роговицы и слепота, отек головы, синюшность гребня, сережек и голени, нарушение координации движения, запрокидывание головы, искривление шеи, судороги, парезы и параличи конечностей. Тяжелее переболевают куры-несушки, яйценоскость их резко снижается. Как правило, чаще заболевает домашняя птица при свободном выгуле и содержании её в открытых условиях, чем содержащаяся в неволе.
Тяжелее переболевают куры-несушки, яйценоскость их резко снижается. Как правило, чаще заболевает домашняя птица при свободном выгуле и содержании её в открытых условиях, чем содержащаяся в неволе.
Источником вируса гриппа птиц служит зараженная, больная и переболевшая птица, которая выделяет вирус с пометом и слюной. Дикие перелетные птицы являются основным источником и переносчиком вируса гриппа птиц.
Заражение птицы происходит при приёме кормов и воды, заражённых помётом, содержащим вирус, при контакте домашней птицы на водоемах, реках, прудах с больной дикой водоплавающей птицей во время свободного выгула, с дикой перелётной и синантропной птицей на открытой местности (на выгулах, в личных подворьях) и заражённой домашней птицей со здоровой. Рекомендуется содержание домашней птицы в закрытых помещениях во избежание контакта с дикой птицей.
Имели место случаи заражения домашней птицы птичьим гриппом при отлове и заносе больных диких гусят, утят в личные подворья граждан и выращивании их совместно с домашней птицей, при скармливании водных растений и прибрежной травы, собранных на водоемах и вблизи них.
Нужно знать, что некоторые типы вируса гриппа птиц заражают людей и вызывают у них болезнь различной степени тяжести со смертельным исходом.
Лечение больной птицы не разработано, поэтому главным способом профилактики является вакцинация домашней птицы.
В настоящее время используется специально разработанная инактивированная вакцина против гриппа птиц, которая безопасна и не вызывает клинически выраженной реакции. Лишь в некоторых случаях на месте инъекции возможно образование припухлости, исчезающей через 2 недели. Яйцо, полученное от вакцинированных птиц, можно использовать без ограничений. Прививка при необходимости проводиться двукратно. Только такая вакцинация создает надежный иммунитет против заболевания и может его предотвратить в случае контакта с больной, инфицированной птицей или кормом.
Основные меры защиты личных подворий граждан от высокопатогенного гриппа птиц:
безвыгульное содержание сельскохозяйственной птицы в целях недопущения контактов с дикой перелетной и синантропной птицей;
-профилактическая вакцинация домашней птицы в угрожаемой зоне – населенных пунктах, расположенных вблизи рек, прудов, болот и других водоемов, а также расположенных на маршрутах миграции диких перелетных птиц;
-регулярная вакцинация и ревакцинация выращенного молодняка, а также приобретенного (закупленного) молодняка птиц;
-не рекомендуется совместное содержание птицы на подворьях с другими видами животных;
-при подозрении на заболевание птицы и в случае её гибели (падежа) немедленно сообщать в ГБУ ВО «Кольчугинская райСББЖ»;
-посещение помещений для содержания птицы посторонними лицами не рекомендуется;
-запрещается отлов молодняка дикой водоплавающей птицы для содержания и выращивания в личных подворьях граждан.
Владельцы птицы должны знать, что в соответствии с Законом Российской Федерации «О ветеринарии» они обязаны предоставлять ветеринарным специалистам по их требованию птицу для осмотра и проведения профилактических прививок.
Государственное Бюджетное Учреждение Владимирской области «Кольчугинская районная станция по борьбе с болезнями животных». Контактные телефоны: (8-49-245) 2-29-50; 49-368.
Администрация муниципального образования Киришский муниципальный район Ленинградской области
3 июня 2021
С начала 2021 года на территории пяти субъектов Российской Федерации были зарегистрированы очаги высокопатогенного гриппа птиц. Необходимо отметить, что на территории Ростовской области, Ставропольского и Краснодарского краев высокопатогенный грипп птиц регистрировался на крупных птицеводческих предприятиях. Одной из существенных причин его распространения является циркуляция возбудителя в популяциях диких и синантропных птиц. Так, в текущем году выявлены случаи гриппа птиц в дикой фауне в Астраханской области, Республике Дагестан, Краснодарском крае.
В связи с напряженной обстановкой по высокопатогенному гриппу птиц на территории Российской Федерации, необходимо знать основную информацию по данному заболеванию.
Острая контагиозная вирусная инфекция домашних и диких птиц, характеризующаяся общим угнетением, отеками, множественными кровоизлияниями и поражениями внутренних органов, мозга и кожи. Птицы задыхаются, гребешок и бородка синеют, яйценоскость падает до 100%.
К высокопатогенному гриппу восприимчивы все виды птиц, в том числе куры, индейки, утки, перепела, аисты, чайки и практически все виды синантропных птиц (голуби, воробьи, вороны, чайки, и пр.), и человек.
Наиболее чувствительны к вирусу цыплята и индейки. У кур часто протекает молниеносно, бессимптомно и приводит к 100%-ному летальному исходу.
Источники вирусов гриппа птиц в природе
Основным источником вируса в природе являются дикие птицы, в основном водоплавающие, которые переносят вирус в кишечнике и выделяют его в окружающую среду со слюной и пометом и от которых могут заразиться домашние птицы, прежде всего, домашние водоплавающие птицы — утки и гуси. С помощью перелетных птиц эта болезнь распространяется на большие расстояния.
С помощью перелетных птиц эта болезнь распространяется на большие расстояния.
Основные пути передачи возбудителя болезни — через корм или воду, а также — при прямом контакте восприимчивого поголовья с инфицированной птицей.
Опасен ли грипп птиц для человека?
Заражение человека происходит при тесном контакте с инфицированной дикой или домашней птицей. В ряде случаев возможно заражение человека при употреблении в пищу мяса и яиц больных птиц без достаточной термической обработки.
Профилактика гриппа птиц
В целях предупреждения возникновения и распространения гриппа птиц владельцы, осуществляющие уход, содержание, разведение и реализацию птицы обязаны:
- Предоставлять специалистам в области ветеринарии по их требованию птиц для осмотра;
- Извещать специалистов в области ветеринарии о всех случаях внезапного падежа или одновременного массового заболевания птиц, а также об их необычном поведении;
- До прибытия специалистов принять меры по изоляции птиц, подозреваемых в заболевании;
- Не допускать выгула домашней птицы за пределы дворовой территории, исключить контакт домашней птицы с дикими птицами, особенно водоплавающими.

- Осуществлять куплю-продажу только вакцинированной против гриппа птицы при наличии ветеринарных сопроводительных документов, характеризующих территориальное и видовое происхождение птицы, эпизоотическое состояние места ее выхода и позволяющих идентифицировать птицу.
- Содержать территории и строения для содержания животных и птицы в чистоте, проводить механическую очистку и дезинфекцию всех помещений и территории. После дезинфекции птичника насест и гнезда необходимо побелить дважды (с часовым интервалом) свежегашеной известью.
- Обеспечить защиту птичника и помещений для хранения кормов от проникновения дикой и синантропной птицы (засечивание окон и дверей).
Профилактика гриппа птиц у людей
- Соблюдать правила личной гигиены.
- Избегать контакта с подозрительной в заболевании или павшей птицей.
- Осуществлять уход за птицей, уборку помещений и территории в спецодежде
- Приобретать для питания мясо птицы, яйцо и другую птицеводческую продукцию в местах санкционированной торговли, требовать у продавца сопроводительные документы, подтверждающие качество и безопасность продукции (ветеринарное свидетельство, сертификат соответствия, удостоверение о качестве).

- Употреблять в пищу мясо птицы и яйцо после термической обработки: яйцо варить не менее 10 минут, мясо – не менее 30 минут при температуре 100°С.
- Исключить контакт с водоплавающими и синантропными птицами.
По всем возникающим вопросам обращаться в Государственную ветеринарную службу Киришского района по телефону горячей линии: +79313696376
Дата создания: 04-06-2021
Минсельхоз утвердил новые ветправила по высокопатогенному гриппу птиц
С 1 сентября этого года для птицеводческих хозяйств и птицефабрик начнут действовать новые ветеринарные правила по борьбе с высокопатогенным гриппом птиц (ВГП), они утверждены приказом Минсельхоза № 158.
Текст: Юлия МакееваДокумент будет действовать до 1 сентября 2027 года. Этим же приказом будут признаны утратившими силу прежние правила по борьбе с гриппом птиц от 2006 года.
Новые ветправила содержат требования к профилактике ВГП, мероприятиям при подозрении на эту болезнь, ее диагностике и введению карантина.
Так, сотрудники госветслужб должны тестировать на грипп птиц не только сельхозпоголовье, но и диких пернатых. В благополучном по ВГП регионе отбирать пробы у диких птиц по новым ветправилам следует три раза в год: «с марта по май, после вылупления птенцов, с августа по ноябрь». А в неблагополучном регионе такие исследования надо будет проводить один раз в квартал «с интервалом не менее 60 календарных дней и не более 90 календарных дней».
Такой контроль дикой фауны необходим, поскольку основные переносчики этой болезни – дикие перелетные птицы. «Даже одного грамма птичьего помета от зараженной особи достаточно, чтобы инфицировать целое стадо», – ранее сообщал «Ветеринарии и жизни» Михаил Волков, заведующий лабораторией эпизоотологии и мониторинга подведомственного Россельхознадзору Федерального центра охраны здоровья животных (ФГБУ «ВНИИЗЖ»). Помет зараженной птицы может попасть в воду, корм, на подстилку сельхозпоголовья.
Вакцинацию против высокопатогенного гриппа птиц новые правила предписывают проводить только в хозяйствах. На птицефабриках такая вакцинация не проводится.
На птицефабриках такая вакцинация не проводится.
Фото: Александр Плонский / «ВиЖ»
КАРАНТИН ПО ВГП
Карантин по высокопатогенному гриппу птиц, как и по действующим ветправилам, вводится минимум на 21 день.
При введении карантина должны быть определены эпизоотический очаг, угрожаемая зона (от 5 до 10 км от границ очага) и зона наблюдения (от 10 до 100 км от угрожаемой зоны). В эпизоотическом очаге запрещается лечение больных птиц, выгульное содержание, вывоз и перегруппировка поголовья. Также из очага нельзя вывозить инкубационное яйцо, продукцию птицеводства и любые корма, с которыми имели контакт больные особи.
В очаге заболевания происходит изъятие и уничтожение всех птиц. Причем на изъятие птиц новые правила отводят 7 дней. За этот же срок должна быть изъята полученная от них продукция.
Корма подлежат сжиганию, если с ними контактировали больные животные. Также должна быть сожжена и подстилка, на которой содержались птицы.
Также должна быть сожжена и подстилка, на которой содержались птицы.
После отмены карантина из эпизоотического очага и угрожаемой зоны еще 90 дней нельзя вывозить птиц и инкубационное яйцо. Исключение только для птицефабрик, расположенных в угрожаемой зоне.
Высокопатогенный грипп птиц – одна из самых опасных болезней для птицеводства, показатель смертности от этого вируса приближается к 100%. Если в хозяйстве, например, содержится 50 тысяч голов, все они будут уничтожены вирусом всего за семь дней, привел пример Михаил Волков.
По данным ВНИИЗЖ, с 1 января по 21 апреля 2021 года в России зарегистрировано шесть вспышек высокопатогенного гриппа птиц: четыре в дикой фауне, две – среди домашнего поголовья.
Справка «ВиЖ»
Высокопатогенный грипп птиц – высококонтагиозная вирусная болезнь птиц, характеризующаяся поражением кровеносной и центральной нервной систем, органов дыхания, пищеварения, выделения и яйцеобразования.
Клинические признаки ВГП: снижение продуктивности, угнетенное состояние, отказ от корма и воды, взъерошенность оперения, цианоз кожных покровов, отек межчелюстного пространства, подкожные кровоизлияния на конечностях, нарушение координации движений, синусит, ринит, конъюнктивит, диарея.
Подпишитесь на нас в ЯНДЕКС.НОВОСТИ и в Telegram , чтобы читать новости сразу, как только они появляются на сайте.
ОСТОРОЖНО! Высокопатогенный грипп А птиц.,
В настоящее время грипп птиц в форме классической чумы, вызванной подтипами вируса с низкой вирулентностью, встречается редко, в виде периодических эпизоотических вспышек. Вспышки высокопатогенного гриппа птиц с начала 21века начали регистрироваться во многих странах мира в результате распространения гриппа перелетными птицами из стран Юго-Восточной Азии. В Россию высокопатогенный штамм вируса H5N1 был занесен дикой перелетной и водоплавающей птицей в 2005 году, когда вспышки «птичьего» гриппа в среде домашних и диких животных наблюдались в Новосибирской, Омской, Тюменской, Курганской, Челябинской областях и Алтайском крае. Затем «птичий» грипп добрался до Калмыкии, Тульской области, Турции и Румынии.
В Россию высокопатогенный штамм вируса H5N1 был занесен дикой перелетной и водоплавающей птицей в 2005 году, когда вспышки «птичьего» гриппа в среде домашних и диких животных наблюдались в Новосибирской, Омской, Тюменской, Курганской, Челябинской областях и Алтайском крае. Затем «птичий» грипп добрался до Калмыкии, Тульской области, Турции и Румынии.
Экономический ущерб от гриппа птиц чрезвычайно велик и связан с массовой гибелью заболевшей птицы, затратами при проведение жестких карантинных и ветеринарно-санитарных мероприятий, включая уничтожение больной птицы. К примеру панзоотия птичьего гриппа в мире в 2005году нанесла материальный ущерб, который оценивается в 4млр. евро.
Заболеваемость птицы в хозяйствах варьируется от 80% до 100%, смертность — от 90% в зависимости от вирулентности вируса и условий содержания птиц. Болезнь, вызванная высокопатогенными вирусами гриппа, приводит, как правило, к гибели 100% птицы.
Наибольшее значение при профилактике высокопатогенного гриппа птиц получили инактивированные вакцины как самые эпизоотологически безопасные. Такие вакцины разработаны и применяются в России. Вакцинированная птица приобретает напряженный иммунитет. Лечение больной птицы не разработано и нецелесообразно ввиду опасности разноса вируса.
Такие вакцины разработаны и применяются в России. Вакцинированная птица приобретает напряженный иммунитет. Лечение больной птицы не разработано и нецелесообразно ввиду опасности разноса вируса.
Гражданам не приобретает живую птицу, племенное (товарное) яйцо, продукты убоя и переработки птицы в неустановленных местах и без ветеринарных сопроводительных документов. При соблюдении мероприятий по предупреждению заноса возбудителя инфекции обращают внимание на благополучие по гриппу хозяйства, из которых завозят инкубационные яйца проводят дезинфекцию транспорта, оборотной тары, выполняют все мероприятия, предусмотренные Ветеринарно-санитарными правилами для птицеводческих хозяйств.
С 1 сентября 2021 г. вводятся в действие актуализированные ветеринарные правила, направленные на предотвращение распространения и ликвидацию очагов высокопатогенного гриппа птиц
- Главная
- Правовые ресурсы
- «Горячие» документы
- Приказ Минсельхоза России от 24.
 03.2021 N 158 «Об утверждении Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов высокопатогенного гриппа птиц» (Зарегистрировано в Минюсте России 29.04.2021 N 63309)
03.2021 N 158 «Об утверждении Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов высокопатогенного гриппа птиц» (Зарегистрировано в Минюсте России 29.04.2021 N 63309)
Приказ Минсельхоза России от 24.03.2021 N 158 «Об утверждении Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов высокопатогенного гриппа птиц» (Зарегистрировано в Минюсте России 29.04.2021 N 63309)
Высокопатогенный грипп птиц (далее — ВГП) представляет собой высококонтагиозную вирусную болезнь птиц, характеризующуюся поражением кровеносной и центральной нервной систем, органов дыхания, пищеварения, выделения и яйцеобразования.
Правилами устанавливаются обязательные требования к организации и проведению мероприятий по ликвидации ВГП, предотвращению его возникновения и распространения на территории РФ, определению границ территории, на которую должен распространяться режим ограничительных мероприятий и (или) карантина, в том числе в части определения очага болезни животных, осуществления эпизоотического зонирования, включая определение видов зон в целях дифференциации ограничений производства, перемещения, хранения и реализации товаров, подлежащих ветеринарному контролю (надзору), и требования к особенностям применения таких ограничений, в том числе проведению мероприятий в отношении производственных объектов, находящихся в карантинной зоне.
Признается утратившим силу Приказ Минсельхоза России от 27 марта 2006 г. N 90 «Об утверждении Правил по борьбе с гриппом птиц» с внесенными в него изменениями.
Настоящий приказ вступает в силу с 1 сентября 2021 г. и действует до 1 сентября 2027 г.
Перейти в текст документа »
Больше документов и разъяснений по коронавирусу и антикризисным мерам — в системе КонсультантПлюс.
Зарегистрируйся и получи пробный доступ
Дата публикации на сайте: 04.05.2021
Поделиться ссылкой:
Высокопатогенный вирус азиатского птичьего гриппа A (H5N1)
Вирус азиатского высокопатогенного птичьего гриппа (HPAI) A (H5N1) встречается в основном у птиц и очень заразен среди них. HPAI Asian H5N1 особенно опасен для домашней птицы. Впервые вирус был обнаружен в 1996 году у гусей в Китае. Азиатский H5N1 был впервые обнаружен у людей в 1997 году во время вспышки болезни среди домашних птиц в Гонконге и с тех пор обнаружен у домашних и диких птиц более чем в 50 странах Африки, Азии, Европы и Ближнего Востока.Шесть стран считаются эндемичными по азиатскому вирусу HPAI H5N1 у домашней птицы (Бангладеш, Китай, Египет, Индия, Индонезия и Вьетнам).
С момента его повсеместного повторного появления в 2003 г. редкие, спорадические случаи заражения людей этим вирусом были зарегистрированы в Азии, а затем в Африке, Европе и на Ближнем Востоке. Инфицирование людей азиатскими вирусами H5N1 связано с тяжелыми заболеваниями и смертью. Большинство случаев инфицирования людей вирусами птичьего гриппа, в том числе азиатскими вирусами H5N1 HPAI, происходит после длительного и тесного контакта с инфицированными птицами.Произошло редкое распространение этого вируса от человека к человеку, но оно не было устойчивым, и распространение этого вируса среди населения не было обнаружено.
Инфицирование людей азиатскими вирусами H5N1 связано с тяжелыми заболеваниями и смертью. Большинство случаев инфицирования людей вирусами птичьего гриппа, в том числе азиатскими вирусами H5N1 HPAI, происходит после длительного и тесного контакта с инфицированными птицами.Произошло редкое распространение этого вируса от человека к человеку, но оно не было устойчивым, и распространение этого вируса среди населения не было обнаружено.
В январе 2014 года Канада сообщила о первом заражении человека азиатским вирусом HPAI H5N1 в Северной и Южной Америке. Это был «завозный» случай, произошедший с путешественником, недавно вернувшимся из Китая. На сегодняшний день не было сообщений о заражении азиатским вирусом HPAI H5N1 у людей в Соединенных Штатах, а азиатский H5N1 никогда не был обнаружен в США.С. птицы или домашняя птица. (Вирус H5N1, недавно обнаруженный у диких птиц США, представляет собой новый смешанный вирус (реассортант), который генетически отличается от вирусов H5N1 азиатских птиц).
Вирусы гриппа постоянно меняются, и вирусы гриппа животных могут изменяться таким образом, что они могут легко заражать людей и распространяться среди людей, вызывая пандемию. Инфицирование людей новым вирусом птичьего гриппа, таким как азиатский H5N1, вызывает озабоченность из-за этого пандемического потенциала. CDC принимает стандартные меры по обеспечению готовности общественного здравоохранения всякий раз, когда выявляется вирус с пандемическим потенциалом.Поскольку азиатский H5N1 продолжает циркулировать и является причиной ряда инфекций среди людей, азиатские усилия по обеспечению готовности к H5 были обширными. Правительство Соединенных Штатов создает запасы азиатской вакцины против H5N1 для обеспечения готовности к пандемии. Его можно использовать, если вирус HPAI H5N1 начнет легко и эффективно передаваться от человека к человеку.
Высокопатогенный птичий грипп A (H5N1) у птиц и других животных
Птицы и домашняя птица
Высокопатогенный * вирус птичьего гриппа (HPAI) A (H5N1) встречается в основном у птиц, очень заразен среди птиц и может быть смертельным, особенно для домашней птицы.
С декабря 2003 г. азиатский вирус HPAI H5N1 привел к высокой смертности домашних и диких птиц в Азии, на Ближнем Востоке, в Европе и Африке.
Азиатские инфекции, вызванные вирусом HPAI H5N1, среди домашних птиц стали обычным явлением (эндемическим заболеванием) в некоторых странах мира. По состоянию на 2011 год Продовольственная и сельскохозяйственная организация Объединенных Наций считала шесть стран эндемичными по азиатскому вирусу HPAI H5N1 у домашней птицы (Бангладеш, Китай, Египет, Индия, Индонезия и Вьетнам).
В январе 2015 года вирус HPAI H5N1 был обнаружен у дикой утки в США.Этот вирус представляет собой «реассортантный» вирус с генами азиатских вирусов HPAI H5 и низкопатогенных североамериканских вирусов. («Повторная сортировка» происходит, когда гены двух разных вирусов смешиваются, чтобы создать новый вирус.) Вирус HPAI H5N1, обнаруженный в США, представляет собой новую комбинацию генов птичьего гриппа, ранее не встречавшуюся. Хотя случаев заболевания людей, связанных с этим реассортантным вирусом, не зарегистрировано, вполне возможно, что этот вирус может заразить людей и вызвать серьезное заболевание. CDC разработал временное руководство по тестированию и профилактике.
CDC разработал временное руководство по тестированию и профилактике.
См. Птичий грипп у птиц для получения дополнительной информации.
Другие животные
вирусов HPAI H5N1 были обнаружены и у других животных (см. Список ниже). Заражение этими вирусами других животных, кроме птиц, может вызвать заболевание, в том числе тяжелое заболевание и смерть некоторых инфицированных животных.
Примеры включают следующее:
- Азиатская инфекция, вызванная вирусом HPAI H5N1, среди свиней в Китае, Индонезии и Вьетнаме
- Азиатская инфекция кошек вирусом HPAI H5N1 (экспериментальная инфекция домашних кошек в Нидерландах; выделение вируса HPAI H5N1 от домашних кошек в Германии и Таиланде; и обнаружение вирусной РНК HPAI H5N1 у домашних кошек в Ираке и Австрии)
- Инфекция собак азиатским вирусом HPAI H5N1 (выделение вируса HPAI H5N1 от домашней собаки в Таиланде)
- Азиатский вирус HPAI H5N1, инфицированный дикой каменной куницей (млекопитающее, похожее на ласку), был зарегистрирован в Германии и у дикой циветты во Вьетнаме.

- Изоляция азиатских вирусов H5N1 от тигров и леопардов в зоопарках Таиланда
Поскольку вирусы HPAI H5N1 продолжают развиваться, другие млекопитающие могут инфицироваться.Для получения дополнительной информации см. Последнюю информацию о птичьем гриппе у животных на Внешнем веб-сайте Всемирной организации здравоохранения животных (МЭБ).
Сноски
* Вирусы птичьего гриппа A классифицируются как высокопатогенный птичий грипп (HPAI) или птичий грипп с низкой патогенностью (LPAI) на основании молекулярных характеристик вируса и способности вируса вызывать заболевание и смертность цыплят в лабораторных условиях.
Начало страницы
Глобальное распространение высокопатогенного вируса птичьего гриппа H5N8 представляет серьезную проблему для общественного здравоохранения
Американской ассоциацией развития науки 20 мая 2021 г.
Возникновение и глобальное распространение высокопатогенного вируса птичьего гриппа H5N8 (AIV), патогена, который вызывал непрерывные и продолжающиеся вспышки с массовой гибелью как диких, так и сельскохозяйственных птиц в Евразии и Африке в течение 2020 года, представляет собой серьезную проблему для общественного здравоохранения — особенно учитывая, что первые случаи заражения людей H5N8 были впервые зарегистрированы в декабре прошлого года.
В перспективе, Вэйфэн Ши и Джордж Гао обсуждают возникновение и зоонозный потенциал линий H5 AIV. Ши и Гао утверждают, что бдительный надзор и строгие меры инфекционного контроля в отношении этих появляющихся вирусов имеют решающее значение для предотвращения дальнейшего распространения инфекции на человека, которое может привести к новым разрушительным пандемиям.
Возможно, в тени продолжающейся глобальной пандемии COVID-19 за последний год инфекции H5N8 среди диких и домашних птиц были выявлены как минимум в 46 странах Европы, Азии и Африки.Хотя эти вспышки привели к гибели или убою многих миллионов птиц во всем мире, они также, в частности, привели как минимум к одному вторичному событию в России, где у семи рабочих птицефабрики был обнаружен вирус H5N8.
По мнению авторов, быстрое глобальное распространение этого AIV и его продемонстрированная способность преодолевать видовой барьер, передаваясь людям, делает его серьезной проблемой не только для сельского хозяйства и безопасности дикой природы, но и для глобального общественного здравоохранения. Ши и Гао предполагают, что надзор за высокопатогенными AIV на птицеводческих фермах, на рынках живых животных и за дикими птицами должен стать глобальным приоритетом.
Ссылка: «Новые вирусы птичьего гриппа H5N8» 20 мая 2021 г., Science .
DOI: 10.1126 / science.abg6302
W. Shi в Шаньдунском Первом медицинском университете и Шаньдунской академии медицинских наук в Цзинань, Китай; Г.Ф. Гао из Китайского центра по контролю и профилактике заболеваний в Пекине, Китай; Г.Ф. Гао в Китайской академии наук (CAS) в Пекине, Китай.
Высокопатогенный вирус птичьего гриппа — обзор
Клинические признаки и эпидемиология
Заболевание, вызываемое вирусами HPAI у кур и индеек, исторически называлось «птичьей чумой».Сегодня этого термина следует избегать, за исключением случаев, когда он является частью названия хорошо охарактеризованных штаммов [например, вирус чумы птиц / Росток / 1934 (H7N1)]. Вирусы HPAI вызывают внезапную смерть без продромальных симптомов. Если птица выживает более 48 часов (что более вероятно у птиц старшего возраста), происходит прекращение яйцекладки, респираторная недостаточность, слезотечение, синусит, диарея, отек головы, лица и шеи, а также цианоз непернистой кожи. особенно гребешок и сережки. Птицы могут проявлять нервные признаки, такие как тремор головы и шеи, неспособность стоять, кривошея и другие необычные позы, если выживают более 3–5 дней после заражения.
Вирусы LPAI могут также вызывать значительные потери, особенно у индеек, из-за анорексии, летаргии, снижения яйценоскости, респираторных заболеваний и синусита. Клинические признаки у кур и индеек могут заметно усугубляться сопутствующими инфекциями (например, различными вирусными, бактериальными и микоплазменными инфекциями), применением живых ослабленных вирусных вакцин или стрессом окружающей среды (например, плохой вентиляцией и перенаселенностью). Вирусы H9N2 с низкой патогенностью (LPAI) повсеместно распространены среди наземных домашних птиц по всей Азии, а также в некоторых частях Северной Африки и Ближнего Востока.H9N2 был идентифицирован как источник адаптированных к птице генов для реассортации с новыми подтипами гемагглютинина водных птиц, например h20Nx и H7N9, что делает возможным циркуляцию новых вирусов в стадах домашних птиц.
Вирус птичьего гриппа выделяется в высоких концентрациях с фекалиями диких птиц и может длительное время сохраняться в холодной воде. Вирус часто попадает в восприимчивые стада периодически путем межвидовой передачи, то есть от диких водных птиц, особенно диких уток, в помещения, где содержатся смешанные виды домашних птиц; таким образом, помещения, к которым имеют доступ дикие птицы, способствуют передаче этого типа.Неясно, сколько подтипов вирусов птичьего гриппа А сохраняется у диких птиц из года в год; предполагается, что вирусы поддерживаются циркуляцией на низких уровнях в больших популяциях диких птиц, даже во время миграции и перезимовки. Исследования диких уток в Канаде показали, что до 60% молодых птиц уже незаметно инфицированы, поскольку собираются вместе до миграции на юг. Вирусы птичьего гриппа также часто выделяются во многих странах от импортированных птиц, содержащихся в клетках, хотя такие воробьиные и пситтацины не являются естественными резервуарами вирусов LPAI и, вероятно, заражаются только после контакта с зараженной деревенской птицей, особенно с домашними и содержащимися в неволе утками.
Живые рынки также могут иметь решающее значение для эпидемиологии вирусных инфекций гриппа. Эпизоотия H5N1 в Евразии четко подтверждает риск, связанный с постоянным притоком восприимчивых животных и смешением нескольких видов птиц (включая наземных и водных птиц), что приводит к амплификации, перегруппировке и быстрой эволюции вируса через серийную передачу от птиц на этих рынках. Первым признаком потенциально новой эпизоотии вируса птичьего гриппа было выделение вируса HPAI от гуся в Гуандуне, Китай, в 1996 году с последующим распространением и вспышками среди домашних птиц в Гонконге в 1997, 2001 и 2002 годах.Кроме того, этот уникальный вирус вызвал 18 случаев инфицирования людей и 6 смертельных исходов; первый документ о смертельных случаях инфицирования людей вирусом HPAI. Усилия по борьбе со вспышкой путем депопуляции и некоторой вакцинации вакциной H5N2 устранили болезнь и инфекцию в Гонконге, но к 2003 году этот вирус H5N1 HPAI распространился на Корею, Японию, Индонезию, Таиланд и Вьетнам. У диких водоплавающих птиц, экспериментально инфицированных вирусами HPAI, выделенными до 1997 г., клинических признаков не обнаружено. Однако в 2002 году у водоплавающих птиц в двух парках Гонконга развилось неврологическое заболевание после заражения этим вирусом H5N1 линии гусей / Гуандун (Gs / GD).Кроме того, тигры и львы в неволе в Таиланде умирали после кормления зараженной домашней птицей, что подтвердило его необычные свойства. Вирус H5N1 HPAI, циркулировавший в 2002 году, показал множественные перегруппировки генов и мутации по сравнению с вирусом 1997 года. В начале 2005 года вирус H5N1 HPAI был изолирован от мертвых диких птиц в озере Цинхай в центральном Китае, а позднее в том же году вирус был обнаружен в Монголии, Сибири, Казахстане и Восточной Европе. Этот евразийский вирус H5N1 HPAI был обнаружен в большинстве стран Азии, Европы и некоторых частей Африки в 2006 году, хотя «вирус» претерпел множество изменений с момента получения первоначального изолята от гуся в 1996 году (рис.21.7). Вирус H5N1 евразийской линии стал энзоотическим в популяциях домашней птицы из Китая, Вьетнама, Камбоджи, Бангладеш, Индии, Индонезии, Египта и других стран этих регионов. Кроме того, спорадические вспышки были обнаружены на Корейском полуострове, в Японии, Лаосе и Непале. Вирусы H5N8 евразийского происхождения также были обнаружены у домашней птицы в Германии, Нидерландах, Италии и Великобритании. Первая вспышка заболевания была обнаружена 5 ноября 2014 года на индюшатине в Мекленбург-Передняя Померания, Германия.
Рисунок 21.7. Глобальное обнаружение высокопатогенных вирусов птичьего гриппа H5N1 линии A / goose / Guangdong / 1/1996 у животных и людей, включая реассортанты с подтипами гена нейраминидазы N2, N3, N5 и N8, с января 2003 г. по январь 2015 г.
Предоставлено Дж. Белотом, Продовольственная и сельскохозяйственная организация Объединенных Наций. Воспроизведено с разрешения http://empres-i.fao.org/eipws3g/.Межконтинентальные миграции диких птиц занесли родственный вирус H5N8 из Азии в Северную Америку в конце 2014 года.В начале декабря 2014 года в рамках программы наблюдения за дикими птицами был обнаружен полностью евразийский вирус H5N8 2.3.4.4, обнаруженный у кречета ( Falco rusticolus ) в штате Вашингтон. Перегруппировка низкопатогенных вирусов H5N8 Евразии и Северной Америки привела к появлению новых подтипов; например, H5N1 и H5N2 и новые генотипы с тремя-четырьмя дополнительными генами североамериканского происхождения; PB1 , PA , NA и NS (H5N1) и PB1, NP, NA (H5N2).Эти вирусы обозначены как евразийско-американские (EA – AM) H5Nx. В марте 2015 года высокопатогенный вирус H5N2 (HPAI) был обнаружен на коммерческих птицеводческих предприятиях в Миннесоте, Миссури, Арканзасе и Канзасе. Схема вспышки способствовала проникновению вируса на Средний Запад путем миграции водоплавающих птиц по пролетному пути Миссисипи. К концу вспышки более 200 коммерческих объектов в 16 штатах были обезлюдены, что привело к потере более 48 миллионов индеек и кур с прямым убытком в 1,6 миллиарда долларов, что, несомненно, является самой дорогой «иностранной» вспышкой болезней животных в истории США.HPAI H5N2, по-видимому, в настоящее время является эндемичным для водоплавающих птиц, использующих пролетные пути Северной Америки. Хотя быстрое сокращение населения зараженных помещений по-прежнему считается предпочтительной стратегией борьбы, ограниченное использование вакцин может использоваться как временная мера для сдерживания вспышки.
Роль диких птиц в передаче евразийского вируса H5Nx тесно связана с его дифференциальной патогенностью по крайней мере для некоторых видов диких водных птиц. Необходимо также тщательно контролировать законную и незаконную торговлю домашней птицей и дикими птицами, поскольку инфекция H5Nx была обнаружена у импортируемых птиц на международных границах.Интенсивный эпиднадзор за евразийскими вирусами H5Nx ( x = 1, 2, 3, 6 или 8) был возобновлен в Европе, Северной Америке и других странах с конца 2014 года. В Северной Америке первоначальные усилия были нацелены на Аляску, западную Канаду и на западном побережье Соединенных Штатов из-за пересечения миграционных маршрутов азиатских и североамериканских диких птиц, но теперь программа расширилась на пролетные пути через Миссисипи и Атлантику.
Высокопатогенный птичий грипп — обзор
5 Продолжение выявления HPAIV H5N1 у диких птиц, 2006–11 гг.
В то время как HPAIV H5N1 линии Qinghai распространился из Азии в Европу, Ближний Восток и Африку в 2005–2006 годах, HPAIV H5N1 клады 2.3.4 продолжала расширяться в Китае и в других частях Азии, включая Южную Корею, Монголию и Японию (Smith et al., 2006; Sonnberg et al., 2013). Эти данные подчеркивают сложность распространения HPAIV H5N1 с возможной, но не четко определенной ролью диких птиц в нескольких случаях.
В Китае с апреля 2004 г. по август 2007 г. было собрано более 14 000 проб у 56 различных видов диких птиц в 14 провинциях для мониторинга распространенности HPAIV H5N1 (Kou et al., 2009). В общей сложности 149 образцов дали положительный результат, и анализ последовательности полученных изолятов показал, что эти штаммы можно разделить на пять разных клад, что подчеркивает генетическое разнообразие HPAIV H5N1 среди диких птиц в Китае в эти годы. Наибольшая распространенность была обнаружена у крякв и чаще всего в провинции Цинхай, где все изоляты вируса принадлежали к кладе 2.2. В другом исследовании, проведенном в тот же период, были взяты образцы птиц из преимущественно лесных участков южной части Китая, которые были проверены на наличие HPAIV H5N1 (Peterson et al., 2008). В этом исследовании было собрано 939 образцов у 153 видов, из которых 24 образца дали положительный результат, причем относительно высокая доля была получена от перелетных птиц. Новый реассортант HPAIV H5N1 был обнаружен у древесных воробьев ( Passer montanus ) в 2004 году в Китае (Kou et al., 2005), что указывает на незначительную роль наземных птиц в эпидемиологии HPAIV H5N1 из-за вторичного распространения вируса от домашней птицы или диких водоплавающих птиц. Смит и его коллеги собирали пробы диких птиц в Гонконге с 2004 по 2008 год на грипп (Smith et al., 2009). В то время как HPAIV H5N1 не был обнаружен на фермах и рынках Гонконга в течение этого периода, HPAIV H5N1 из клад 2.3.2 и 2.3.4 был обнаружен у различных видов диких птиц. Эти результаты показали, что вирусы из этих клад также широко циркулировали среди диких птиц (Smith et al., 2009).
Зимой 2006–07 гг. В Южной Корее произошло несколько вспышек HPAIV H5N1 среди домашних птиц с вирусами линии Qinghai, тесно связанными с вирусами, обнаруженными в России и Монголии (Lee et al., 2008). Близкородственный HPAIV H5N1 был также обнаружен у перелетных птиц во время этих вспышек (Lee et al., 2008). Впоследствии, в апреле 2008 г., HPAIV H5N1 снова вспыхнул в Южной Корее, когда в 7 различных провинциях было затронуто 19 птицеферм и уток. Примечательно, что эта вспышка произошла в апреле – мае, тогда как предыдущие вспышки имели место в зимний период. В то время как торговля неотапливаемыми продуктами из птицы не происходила между Южной Кореей и Китаем или между Южной Кореей и Вьетнамом с 2003 года (Kim et al., 2010), было показано, что несколько видов диких уток мигрировали из Юго-Восточной Азии и Китая в Южную Корею в апреле и мае 2008 г. (Геологическая служба США (USGS), 2009). Кроме того, вирусы, выделенные в результате этой вспышки, были тесно связаны с вирусами, выделенными от мертвых и умирающих лебедей-кликунов в Японии в апреле – мае 2008 г., и вирусами, выделенными от кур в России в апреле 2008 г. (Uchida et al., 2008; Usui et al., 2009). ). Поэтому было высказано предположение, что дикие птицы могли занести вирус HPAIV H5N1 в Южную Корею.Два года спустя, в ноябре и декабре 2010 г., HPAIV H5N1 (клада 2.3.2.1) снова был обнаружен у обеих диких птиц (кряквы; байкальский чирок, Anas formosa ; мандаринка, Aix galericulata ; лебедь-кликун; и евразийский орел. -owl, Bubo bubo) и домашней птицы в Южной Корее (Kim et al., 2012; Kwon et al., 2011).
В Монголии вирусы HPAIV H5N1 были изолированы в нескольких местах и в нескольких временных точках от трупов различных видов водоплавающих птиц. В 2005 и 2006 гг. Изоляты (гусь с головой; лебедь-кликун, обыкновенный голден; Bucephala clangula ) относились к кладе 2.2, в то время как изоляты из 2009 и 2010 гг. (Лебедь-кликун, полосатый гусь, румяный утенок, обыкновенный голден) относились к кладе 2.3.2.1 (Kang et al., 2011; Sakoda et al., 2010). В июне 2009 г. вспышка HPAIV H5N1 произошла среди диких птиц (большая хохлатая поганка, Podiceps cristatus ; маленькая поганка, Tachybaptus ruficollis ; черноголовая чайка, Chroicocephalus ridibundus ; и колпица обыкновенная, Platalea leucorodia). Озеро Увс-Нуур, Россия. Филогенетический анализ вирусов, выделенных от черноголовой чайки и большой гребенчатой поганки, показал, что эти вирусы также принадлежали к кладе 2.3.2.1 (Шаршов и др., 2010). Поскольку сообщений о вспышках HPAIV в России с 2008 г. не поступало, а домашние птицы в озере Увс-Нур отсутствуют, было высказано предположение, что вирус был занесен перелетными птицами из Юго-Восточной Азии (Шаршов и др., 2010).
После обнаружения HPAIV H5N1 на озере Увс-Нур, Россия, HPAIV H5N1 клады 2.3.2.1 был обнаружен как дальше на запад, так и на восток. В октябре 2009 г. вирус клады 2.3.2.1 был выделен от одичавшего голубя ( Columbia livia ), а в феврале 2010 г. — от домашней птицы во время вспышек в Непале.Вирусы из этой клады впоследствии были обнаружены еще дальше на запад в марте 2010 года: у домашней птицы в Румынии и у мертвого канюка ( Buteo buteo ) с черноморского побережья Болгарии. Последнее место является узким местом миграции птиц, имеющим глобальное значение (Маринова-Петкова и др., 2012; Рейд и др., 2011), что позволяет предположить, что перелетные птицы сыграли роль в распространении этого вируса. Вирусы клады 2.3.2.1 также были обнаружены дальше на восток: осенью 2010 года фекалии, собранные у очевидно здоровых мигрирующих на юг уток на Хоккайдо, Япония (Kajihara et al., 2011) дали положительный результат и, по всей видимости, послужили началом вспышки среди диких и домашних птиц, продолжавшейся до марта 2011 г. (Sakoda et al., 2012).
Происхождение высокопатогенного и потенциально пандемического вируса гриппа H5N1 в Восточной Азии
Всемирная организация здравоохранения, птичий грипп A (H5N1). Weekly Epidemiol. Ред. 79 , 65–70 (2004)
Google Scholar
Сюй, Х., Subbarao, K., Cox, NJ & Guo, Y. Генетическая характеристика вируса патогенного гриппа A / Goose / Guangdong / 1/96 (H5N1): сходство его гена гемагглютинина с генами вирусов H5N1 из вспышек 1997 г. в Гонконге. Конг. Вирусология 261 , 15–19 (1999)
CAS Статья Google Scholar
Claas, E.C.J. et al. Человеческий грипп Вирус H5N1, относящийся к высокопатогенному вирусу птичьего гриппа. Ланцет 351 , 472–477 (1998)
CAS Статья Google Scholar
Гуан Ю., Шортридж К. Ф., Краусс С. и Вебстер Р. Г. Молекулярная характеристика вирусов гриппа H9N2: были ли они донорами «внутренних» генов вирусов H5N1 в Гонконге? Proc. Natl Acad. Sci. США 96 , 9363–9367 (1999)
ADS CAS Статья Google Scholar
Гуань, Ю.и другие. Появление множественных генотипов вирусов птичьего гриппа H5N1 в САР Гонконг. Proc. Natl Acad. Sci. США 99 , 8950–8955 (2002)
ADS CAS Статья Google Scholar
Guan, Y. et al. Грипп H5N1: угроза пандемии различных видов. Proc. Natl Acad. Sci. США 101 , 8156–8161 (2004)
ADS CAS Статья Google Scholar
Шортридж, К.F. et al. Характеристика вирусов птичьего гриппа H5N1 домашней птицы в Гонконге. Вирусология 252 , 331–342 (1998)
CAS Статья Google Scholar
Матросович М., Чжоу Н. Н., Каваока Ю. и Вебстер Р. Г. Поверхностные гликопротеины вирусов гриппа H5, выделенные от людей, кур и диких водных птиц, обладают различными свойствами. J. Virol. 73 , 1146–1155 (1999)
CAS PubMed PubMed Central Google Scholar
Хиен, Т.T. et al. Птичий грипп A (H5N1) у 10 пациентов во Вьетнаме. N. Engl. J. Med. 350 , 1179–1188 (2004)
CAS Статья Google Scholar
Li, K. S. et al. Характеристика вирусов гриппа подтипа H9 уток из южного Китая: кандидат на следующую пандемию гриппа среди людей? J. Virol. 77 , 6988–6994 (2003)
CAS Статья Google Scholar
Прегрейвс, Д.К., Балагопалан, Л., Абмайр, С. М. и Орр, Х. А. Адаптивная эволюция приводит к дивергенции гибридного гена неуязвимости между двумя видами Drosophila . Nature 423 , 715–719 (2003)
ADS CAS Статья Google Scholar
Вебстер Р. Г., Бин В. Дж., Горман О. Т., Чемберс Т. М. и Каваока Ю. Эволюция и экология вирусов гриппа А. Microbiol. Ред. 56 , 152–179 (1992)
CAS PubMed PubMed Central Google Scholar
Scholtissek, C., Квак, Г., Кленк, Х. Д. и Вебстер, Р. Г. Как преодолеть устойчивость вирусов гриппа A к производным адамантана. Antiviral Res. 37 , 83–95 (1998)
CAS Статья Google Scholar
Холсингер, Л. Дж., Шонесси, М. А., Мико, А., Пинто, Л. Х. и Лэмб, Р. А. Анализ посттрансляционных модификаций белка М2 вируса гриппа. J. Virol. 69 , 1219–1225 (1995)
CAS PubMed PubMed Central Google Scholar
Томас, Дж.М., Стивенс, М. П., Перси, Н. и Барклай, В. С. Фосфорилирование белка М2 вируса гриппа А не является существенным для жизнеспособности вируса. Вирусология 252 , 54–64 (1998)
CAS Статья Google Scholar
Ha, Y., Stevens, D. J., Skehel, J. J. & Wiley, D. C. Рентгеновские структуры гемагглютининов вируса птичьего гриппа H5 и вируса свиного гриппа H9, связанных с аналогами рецепторов птиц и человека. Proc.Natl Acad. Sci. США 98 , 11181–11186 (2001)
ADS CAS Статья Google Scholar
Каверин Н.В. и др. Структура антигенных сайтов на молекуле гемагглютинина вируса птичьего гриппа H5 и фенотипические вариации ускользающих мутантов. J. Gen. Virol. 83 , 2497–2505 (2002)
CAS Статья Google Scholar
Ивацуки-Хоримото, К., Kanazawa, R., Sugii, S., Kawaoka, Y. & Horimoto, T. Индекс вируса гриппа A подтипа H5N1, выделенный от человека в 1997 году, отличается по своим рецептор-связывающим свойствам от вирулентного вируса птичьего гриппа. J. Gen. Virol. 85 , 1001–1005 (2004)
CAS Статья Google Scholar
Hatta, M., Gao, P., Halfmann, P. & Kawaoka, Y. Молекулярная основа высокой вирулентности вирусов гонконгского гриппа A H5N1. Наука 293 , 1773–1775 (2001)
Статья Google Scholar
Фушье, Р. А. М. и др. Вирус птичьего гриппа A (H7N7), связанный с конъюнктивитом, и смертельный случай острого респираторного дистресс-синдрома. Proc. Natl Acad. Sci. США 101 , 1356–1361 (2004)
ADS CAS Статья Google Scholar
Seo, S.Х., Хоффманн, Э. и Вебстер, Р. Г. Летальные вирусы гриппа H5N1 ускользают от противовирусных цитокиновых ответов хозяина. Nature Med. 8 , 950–954 (2002)
CAS Статья Google Scholar
Пейрис, Дж. С. М. и др. Совместная циркуляция птичьего вируса H9N2 и современного «человеческого» вируса гриппа h4N2 у свиней в юго-восточном Китае: потенциал для генетической реассортации? J. Virol. 75 , 9679–9686 (2001)
CAS Статья Google Scholar
Симс, Л.D. et al. Птичий грипп в Гонконге 1977–2002 гг. Avian Dis. 47 , 832–838 (2003)
CAS Статья Google Scholar
Guan, Y. et al. Вирусы гриппа H9N2, обладающие внутренними геномами, подобными H5N1, продолжают циркулировать среди домашних птиц на юго-востоке Китая. J. Virol. 74 , 9372–9380 (2000)
CAS Статья Google Scholar
Своффорд, Д.L. PAUP *: Филогенетический анализ с использованием экономичности (и других методов) 4.0 Beta (Sinauer Associates, Сандерленд, США, 2001)
Google Scholar
Кумар, С., Тамура, К., Якобсен, И. Б. и Ней, М. MEGA2: программное обеспечение для анализа молекулярной эволюционной генетики. Биоинформатика 17 , 1244–1245 (2001)
CAS Статья Google Scholar
Что такое высокопатогенный птичий грипп?
Что такое высокопатогенный птичий грипп?
Птичий грипп относится к группе вирусов, которые передаются между птицами.
В декабре 2014 года в Северной Америке появилось несколько штаммов вируса птичьего гриппа, которые вызвали тяжелые заболевания домашних птиц.
Давайте посмотрим, что сделало нынешнюю вспышку такой серьезной и как вы можете помочь предотвратить ее распространение.
Различают две основные формы птичьего гриппа.
Низкопатогенный птичий грипп и высокопатогенный птичий грипп, или сокращенно HPAI.
В большинстве вспышек птичьего гриппа с низкой патогенностью заболевание домашней птицы протекает довольно легко.
Однако вирусы, классифицируемые как высокопатогенный птичий грипп, могут убивать большое количество домашней птицы.
Ученые считают, что эти высокопатогенные штаммы птичьего гриппа возникли в Азии и попали в Северную Америку через мигрирующих уток, смешавшихся в их северных нерестилищах.
Хотя утки и являются переносчиками вируса, они не болеют.
Таким образом, хотя они и не выглядят больными, они все же могут распространять вирус среди вашего стада.
Текущая вспышка не вызвала заболеваний у людей.
Это штамм, отличный от вирусов, вызвавших инфицирование человека в Азии.
На людей не влияет мясо или яйца птиц, у которых позже был диагностирован птичий грипп.
Однако, если у птицы диагностирована болезнь, ее продукты не продаются.
Высокопатогенный птичий грипп вызвал высокую смертность домашних индеек, кур, цесарок и горных диких птиц.
Также очень быстро распространяется.
Один грамм птичьего помета, размером с десять центов, может содержать достаточно вируса, чтобы заразить миллион птиц.
В идеальных условиях, прохладной и влажной, вирус может выжить в навозе до двух недель.
В прохладной воде может выжить до нескольких месяцев.
HPAI может передаваться от птицы к птице при прямом или косвенном контакте с пометом инфицированных птиц.
Вирус может оставаться жизнеспособным при умеренных температурах, поэтому он также может распространяться через воду, ящики для яиц, ящики, оборудование, транспортные средства и людей, чья одежда или обувь контактировали с вирусом.
Более 48 миллионов птиц умерли или были усыплены во время текущей вспышки с марта по июнь 2015 года.
Как видите, Средний Запад несет самые высокие потери.
На сегодняшний день в Пенсильвании не зарегистрировано ни одного случая заболевания.
Однако, из-за миграционных путей диких птиц, возможно, что вирус проникнет на восток во время осенней миграции 2015 года.
Эффект миграции, ответственный за вспышку болезни на Среднем Западе.
На этом изображении показаны четыре основных маршрута, по которым дикие птицы мигрируют по Северной Америке.
Большинство вспышек птичьего гриппа произошло на пролетном пути Миссисипи.
Пенсильвания является частью Атлантического пролетного пути, где до настоящего времени не было вспышек.
Однако из-за этого перехода владельцы домашней птицы на Атлантическом пролетном пути должны знать о симптомах HPAI и принимать меры предосторожности, чтобы не допустить распространения этой болезни на свои стада.
Основными признаками HPAI являются внезапное увеличение смертности птиц, и стадо становится очень тихим.
Птицы часто проявляют недостаток энергии или аппетита.
Могут быть замечены неврологические признаки, такие как нарушение координации, искривленная или наклонная шея.
Видны яйца с мягкой скорлупой.
Также обратите внимание на опухоль или пурпурное изменение цвета головы, расчески, подделок или ног.
От заражения до смерти болезнь может длиться менее одной недели.
Обратите внимание, что респираторные симптомы не типичны для данного вируса.
Коммерческое птицеводство подвергается наибольшему финансовому риску.
Например, только в Миннесоте потери птицеводства летом 2015 года оцениваются в 113 миллионов долларов.
С общим экономическим эффектом около 310 миллионов долларов.
Пенсильвания занимает четвертое место в стране по производству яиц.
Если этой осенью в Пенсильвании появится высокопатогенный птичий грипп, по оценкам Министерства сельского хозяйства Пенсильвании, могут быть потеряны 54 000 рабочих мест и 3,2 миллиарда долларов заработной платы.
С общим экономическим эффектом в 13 миллиардов долларов.
Десять процентов яйцекладушек страны были потеряны в результате вспышки.
Это привело к резкому росту цен на яйца, что сказалось на предприятиях пищевой промышленности и потребительских покупках.
Хотя Министерство сельского хозяйства США изучает несколько вакцин для использования в США, вакцинация будет одобрена только в том случае, если HPAI невозможно контролировать другими способами.
Поэтому особенно важно принимать профилактические меры, чтобы болезнь не попала в ваше стадо.
В качестве меры предосторожности Министерство сельского хозяйства Пенсильвании ввело запрет на продажу живых птиц и птицеводческих продуктов на утвержденных штатом окружных ярмарках и других мероприятиях, таких как выставка «Пенсильвания-ферма 2016».
Поскольку дикие утки считаются основными переносчиками вируса, тем, кто разводит домашнюю птицу на приусадебном участке, в свободном выгуле или на пастбище, рекомендуется изолировать своих птиц, чтобы они не смешались с дикими утками или не вступили в контакт с утками. навоз или зараженные поверхностные воды.


 03.2021 N 158 «Об утверждении Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов высокопатогенного гриппа птиц» (Зарегистрировано в Минюсте России 29.04.2021 N 63309)
03.2021 N 158 «Об утверждении Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов высокопатогенного гриппа птиц» (Зарегистрировано в Минюсте России 29.04.2021 N 63309)