КОГНИТИВНЫЕ РАССТРОЙСТВА – ГАУЗ СО «Полевская центральная городская больница»
Когнитивные расстройства личности – это специфические нарушения, происходящие в познавательной сфере индивида и включающие следующие симптомы: снижение памяти, интеллектуальной работоспособности и снижение других когнитивных процессов мозга в сравнении с персональной нормой (исходным уровнем) каждого индивида. Познавательными или когнитивными функциями называют наиболее сложные процессы, проистекающие в головном мозге. При помощи этих процессов осуществляется рациональное постижение окружающего мира, взаимосвязь и взаимодействие с ним, характеризующееся целенаправленностью.
К познавательным функциям следует отнести: восприятие (прием) информации, обработку и анализ данных, их запоминание и последующее хранение, обмен данными, выработка и реализация плана действий. Причинами когнитивных расстройств может быть множество недугов, отличающихся по механизмам и условиям возникновения, течения болезни.
ПРИЧИНЫ КОГНИТИВНЫХ РАССТРОЙСТВ
Когнитивные нарушения по своей природе бывают функциональными и органическими. Функциональные нарушения в познавательной сфере формируются в отсутствии прямого поражения головного мозга. Переутомление, стрессы и постоянное перенапряжение, отрицательные эмоции – все это может являться причиной функциональных познавательных расстройств. Функциональные нарушения познавательной сферы могут развиться в любом возрасте. Такие расстройства не считаются опасными и всегда исчезают или существенно уменьшаются их проявления после ликвидации причины нарушений. Однако в отдельных случаях может потребоваться применение медикаментозной терапии.
Органические состояния в когнитивной сфере возникают вследствие повреждения головного мозга в результате заболеваний. Они чаще наблюдаются у людей старшего возраста и носят обычно более устойчивые черты. Однако правильная терапия даже в этих случаях помогает добиться улучшения в состоянии и препятствует нарастанию нарушений в дальнейшем.
Наиболее частыми причинами органических патологий в когнитивной сфере считаются: недостаточность кровоснабжения мозга и возрастное понижение массы мозга или атрофия.
Недостаточность кровоснабжения мозга может наступать вследствие гипертонической болезни, сердечнососудистой патологии и инсультов. Поэтому очень важным является своевременное диагностирование перечисленных заболеваний и правильное их лечение. В противном случае могут возникнуть серьезные осложнения. Артериальному давлению, поддержанию уровня сахара в норме и холестерина в крови следует уделять особое внимание. Выделяют также сосудистые когнитивные расстройства, которые развиваются вследствие хронической ишемии головного мозга, повторных инсультов или их сочетания. Такие патологии делятся на два варианта: расстройства, возникающие как результат патологии мелких сосудов, и нарушения вследствие патологии крупных сосудов. Нейропсихологические особенности обнаруженных состояний, отражающие их взаимосвязь с нарушением в работе лобных долей мозга, будут свидетельствовать о сосудистой этиологии когнитивных расстройств.
Сосудистые когнитивные расстройства личности сегодня довольно распространены в практике неврологических патологий.
При атрофии головного мозга, вследствие возрастных изменений, формируются более выраженные патологии когнитивных функций. Такое патологическое состояние именуется болезнью Альцгеймера и считается прогрессирующим заболеванием. Однако темпы нарастания патологий в когнитивной сфере могут значительно варьироваться. Преимущественно, симптомы характеризуются медленным нарастанием, вследствие чего больные могут на протяжении многих лет сохранять независимость и самостоятельность. Огромным значением для таких больных обладает адекватная терапия. Современные методы терапии помогают добиться улучшения в состоянии больного и длительной стабилизации проявлений.
Также причинами патологий в когнитивной сфере могут быть другие заболевания головного мозга, сердечно-сосудистая недостаточность, заболевания внутренних органов, нарушение в обмене веществ, злоупотребление алкогольными напитками или другие отравления.
СИМПТОМЫ КОГНИТИВНЫХ РАССТРОЙСТВ
Расстройство когнитивных функций характеризуется специфической симптоматикой, которая зависит от того, в какой степени выраженности находится патологический процесс, и какие отделы мозга он затрагивает. Поражение отдельных участков обуславливает нарушения отдельных когнитивных функций, однако все же чаще встречается расстройство нескольких сразу или всех функций.
Расстройство когнитивных функций вызывает снижение умственной работоспособности, ухудшение памяти, трудности с выражением собственных мыслей или осмыслением чужой речи, ухудшение концентрации внимания. При тяжелых нарушениях пациенты могут ни на что не жаловаться вследствие потери критичности к собственному состоянию.
Среди патологий познавательной сферы самым частым симптомом считается ухудшение памяти. Вначале возникают прогрессирующие нарушения в запоминании недавних событий, а постепенно и отдаленных событий. Наряду с этим может снижаться умственная активность, нарушаться мышление, вследствие чего человек не может правильно оценить информацию, ухудшается способность обобщать данные, делать выводы. Еще одним не менее распространенным проявлением познавательных нарушений является ухудшение концентрации внимания. Индивидам с такими проявлениями сложно поддерживать энергичную умственную деятельность, концентрироваться на конкретных задачах.
Еще одним не менее распространенным проявлением познавательных нарушений является ухудшение концентрации внимания. Индивидам с такими проявлениями сложно поддерживать энергичную умственную деятельность, концентрироваться на конкретных задачах.
Под понятием умеренные когнитивные расстройства личности обычно подразумевают нарушение работы одного либо нескольких когнитивных процессов, выходящих за границы возрастной нормы, но при этом не доходящих до выраженности деменции. Умеренные когнитивные нарушения, главным образом, считаются патологическим состоянием, результатом которого трансформации на данной стадии не исчерпываются только лишь возрастными инволютивными процессами.
В соответствии с данными ряда исследований, синдром умеренных познавательных расстройств наблюдается у 20% индивидов старше 65 лет. Также исследования свидетельствуют о том, что деменция развивается у 60% индивидов с данной патологией в течение пяти лет.
Умеренные когнитивные расстройства в 20-30% случаев носят устойчивый или вяло прогрессирующий характер, другими словами не преобразуются в деменцию. Такие расстройства способны в течение довольно длительного времени оставаться незамеченными индивидами. Однако если обнаружено наличие нескольких симптомов за короткий срок, то стоит обратиться к специалистам за консультацией.
Такие расстройства способны в течение довольно длительного времени оставаться незамеченными индивидами. Однако если обнаружено наличие нескольких симптомов за короткий срок, то стоит обратиться к специалистам за консультацией.
О наличии расстройства когнитивной сферы свидетельствуют следующие симптомы: сложности в выполнении обычных счетных операций, трудности с повторением только что полученных сведений, нарушение ориентации в малознакомой местности, трудности в запоминании имен людей, новых в окружении, очевидные сложности в подборе слов при обычном разговоре.
Умеренные когнитивные расстройства, выявленные на ранних фазах своего развития, довольно успешно поддаются коррекции при помощи лекарственных препаратов и различных психологических методик.
С целью оценки выраженности нарушений когнитивной сферы применяются специальное нейропсихологическое тестирование, которое заключается в ответе на ряд вопросов и выполнении некоторых заданий пациентом. В соответствии с результатами тестирования становится возможным определить наличие отклонений определенных когнитивных функций, а также их выраженность.
ДЕМЕНЦИЯ (СЛАБОУМИЕ)
Деменцией называется состояние головного мозга, которое приводит к постепенному снижению мыслительной способности; иными словами острота мышления неуклонно «притупляется». Деменция чаще всего поражает именно пожилых людей — развивается старческая деменция (старческое слабоумие). Чем старше мы становимся, тем выше риск развития деменции. У людей в возрасте 65 лет деменция встречается в 5% случаев, а после 80 лет — уже у каждого пятого. Тем не менее очень важно понимать, что деменция вовсе не является нормальной частью процесса старения, это состояние нельзя путать с распространенной «старческой забывчивостью». Помните, что диагноз «деменция» устанавливает только врач и он же определяет причину её возникновения.
КАК ПРОЯВЛЯЕТСЯ ДЕМЕНЦИЯ?
Человек, у которого развивается деменция, постепенно теряет способность к ясному мышлению.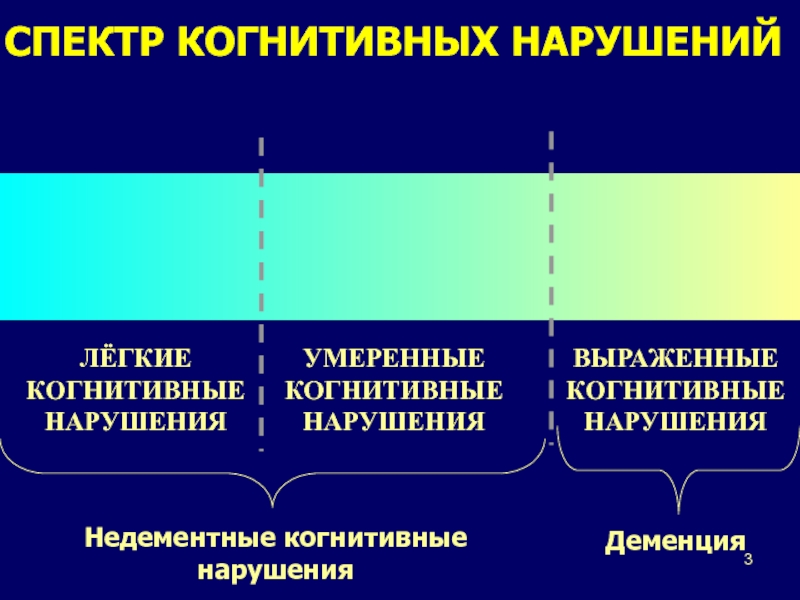 У него «путается» память — на начальных стадиях он не может вспомнить события, которые происходили недавно, но зато очень ярко помнит события своей молодости и детства. Также очень характерны снижение интеллекта и плохая концентрация внимания, которая выражается в невозможности на чём-либо сосредоточиться и выполнить запланированное дело до конца. Постепенно человек утрачивает ориентацию в окружающем (перестаёт понимать, где он находится, не узнаёт родных и близких) и теряет способность к самообслуживанию. При этом состояние организма и всех его систем зачастую остаётся удовлетворительным, что приводит к необходимости длительного (иногда продолжающегося годами) ухода за таким больным.
У него «путается» память — на начальных стадиях он не может вспомнить события, которые происходили недавно, но зато очень ярко помнит события своей молодости и детства. Также очень характерны снижение интеллекта и плохая концентрация внимания, которая выражается в невозможности на чём-либо сосредоточиться и выполнить запланированное дело до конца. Постепенно человек утрачивает ориентацию в окружающем (перестаёт понимать, где он находится, не узнаёт родных и близких) и теряет способность к самообслуживанию. При этом состояние организма и всех его систем зачастую остаётся удовлетворительным, что приводит к необходимости длительного (иногда продолжающегося годами) ухода за таким больным.
Особые беспокойства для ухаживающих причиняют изменения его характера. Поначалу это обычно проявляется в виде угрюмости и раздражительности, однако позднее человек может стать агрессивным и пытаться причинить вред себе и окружающим. При тяжелых формах деменции возможно серьёзное нарушение психики.
КАКОВЫ ПРИЧИНЫ ДЕМЕНЦИИ?
Деменция обычно связана со множеством различных причин. Наиболее часто она развивается из-за болезни Альцгеймера или по причине атеросклероза сосудов, снабжающих кровью головной мозг.
Наиболее часто она развивается из-за болезни Альцгеймера или по причине атеросклероза сосудов, снабжающих кровью головной мозг.
- Болезнь Альцгеймера чаще всего становится причиной деменции (более чем в 60% случаев). При болезни Альцгеймера головной мозг по непонятной причине повреждается и в нём уменьшается количество нервной ткани, благодаря которой осуществляется мышление.
- Сосудистая деменция — вторая по частоте после болезни Альцгеймера причина деменции (около 20% случаев). В этой ситуации деменция развивается в результате закупорки множества мелких сосудов, питающих наш головной мозг, и как следствие, возникает повреждение нервной ткани.
- Существуют и другие, более редкие причины деменции, например алкогольная деменция или деменция после перенесённых тяжёлых инфекционных заболеваний, поражающих головной мозг (например, сифилиса).
КАК БЫСТРО РАЗВИВАЕТСЯ ДЕМЕНЦИЯ?
Как правило, деменция прогрессирует медленно, на протяжении нескольких лет, скорость её развития зависит от причины заболевания и индивидуальных особенностей человека. У пациентов, страдающих болезнью Альцгеймера, время от лёгких нарушений памяти до полной неспособности к самообслуживанию обычно занимает около 8-10 лет, однако, подчеркнём ещё раз, скорость развития болезни может быть неодинаковой у разных людей.
У пациентов, страдающих болезнью Альцгеймера, время от лёгких нарушений памяти до полной неспособности к самообслуживанию обычно занимает около 8-10 лет, однако, подчеркнём ещё раз, скорость развития болезни может быть неодинаковой у разных людей.
ЧТО ВАЖНО ЗНАТЬ О ЛЕЧЕНИИ ДЕМЕНЦИИ?
— Существуют лекарственные средства, замедляющие развитие заболевания. Помните, что выбор лекарства и его доза зависят от многих факторов и должны подбираться индивидуально. Деменцию нужно начинать лечить как можно раньше!
Поддержка и уход за человеком, страдающим деменцией, — важнейшая часть лечения, которая ложится на родных и близких больного.
Когнитивные нарушения в неврологической практике :: ТРУДНЫЙ ПАЦИЕНТ
В.В. Захаров
Кафедра нервных болезней ММА им. И.М. Сеченова, Москва
Одним из наиболее частых неврологических симптомов является нарушение когнитивных функций. Поскольку когнитивные функции связаны с интегрированной деятельностью головного мозга в целом, когнитивная недостаточность закономерно развивается при самых разнообразных очаговых и диффузных поражениях головного мозга. Особенно часто когнитивные расстройства возникают в пожилом возрасте. По статистике от 3 до 20 % лиц старше 65 лет имеют тяжелые когнитивные нарушения в виде деменции [2]. Встречаемость более лёгких когнитивных расстройств у пожилых ещё более велика и достигает, по некоторым данным, от 40 до 80 % в зависимости от возраста [25]. Современная тенденция к увеличению продолжительности жизни и соответственно к увеличению числа пожилых лиц в популяции делает проблему когнитивных нарушений крайне актуальной для неврологов и врачей других специальностей.
Особенно часто когнитивные расстройства возникают в пожилом возрасте. По статистике от 3 до 20 % лиц старше 65 лет имеют тяжелые когнитивные нарушения в виде деменции [2]. Встречаемость более лёгких когнитивных расстройств у пожилых ещё более велика и достигает, по некоторым данным, от 40 до 80 % в зависимости от возраста [25]. Современная тенденция к увеличению продолжительности жизни и соответственно к увеличению числа пожилых лиц в популяции делает проблему когнитивных нарушений крайне актуальной для неврологов и врачей других специальностей.
Определение когнитивных функций
Под когнитивными функциями принято понимать наиболее сложные функции головного мозга, с помощью которых осуществляется процесс рационального познания мира [27]. К когнитивным функциям относится память, гнозис, речь, праксис и интеллект.
Память – это способность головного мозга усваивать, сохранять и воспроизводить необходимую для текущей деятельности информацию. Функция памяти связана с деятельностью всего головного мозга в целом, но особенное значение для процесса запоминания текущих событий имеют структуры гиппокампового круга. Выраженные нарушения памяти на события жизни принято обозначать термином «амнезия» [5, 6, 27].
Выраженные нарушения памяти на события жизни принято обозначать термином «амнезия» [5, 6, 27].
Гнозисом называется функция восприятия информации, её обработки и синтеза элементарных сенсорных ощущений в целостные образы. Первичные нарушения гнозиса (агнозии) развиваются при патологии задних отделов коры головного мозга, а именно височной, теменной и затылочных долей [5, 6, 27].
Речь – это способность обмениваться информацией с помощью высказываний. Нарушения речи (афазии) чаще всего развиваются при патологии лобных или височно-теменных отделов головного мозга. При этом поражение височно-теменных отделов приводит к разного рода расстройствам понимания речи, а при патологии лобных долей первично нарушается способность выражать свои мысли с помощью речевых высказываний [5, 6, 27].
Праксис – это способность приобретать, сохранять и использовать разнообразные двигательные навыки. Нарушения праксиса (апраксии) чаще всего развиваются при патологии лобных или теменных долей головного мозга. При этом патология лобных долей приводит к нарушению способности построения двигательной программы, а патология теменных долей – к неправильному использованию своего тела в процессе двигательного акта при сохранной программе движений [5, 6, 27].
При этом патология лобных долей приводит к нарушению способности построения двигательной программы, а патология теменных долей – к неправильному использованию своего тела в процессе двигательного акта при сохранной программе движений [5, 6, 27].
Под интеллектом понимают способность сопоставлять информацию, находить общее и различия, выносить суждения и умозаключения. Интеллектуальные способности обеспечиваются интегрированной деятельностью головного мозга в целом [5, 6, 27].
Для оценки когнитивных функций используются нейропсихологические методы исследования. Они представляют собой различные тесты и пробы на запоминание и воспроизведение слов и рисунков, узнавание образов, решение интеллектуальных задач, исследование движений и т. д. [5, 27]. Полное нейропсихологическое исследование позволяет выявить клинические особенности когнитивных нарушений и поставить топический диагноз. Однако в повседневной клинической практике провести полное нейропсихологическое исследование не всегда возможно. Поэтому в амбулаторной практике во всём мире широко используются так называемые скрининговые нейропсихологические шкалы, которые позволяют подтвердить наличие когнитивных расстройств в целом и оценить их количественно. Примером такой скрининговой шкалы является краткая шкала оценки психического статуса, которая приведена в таблице [17].
Поэтому в амбулаторной практике во всём мире широко используются так называемые скрининговые нейропсихологические шкалы, которые позволяют подтвердить наличие когнитивных расстройств в целом и оценить их количественно. Примером такой скрининговой шкалы является краткая шкала оценки психического статуса, которая приведена в таблице [17].
Синдромы когнитивных нарушений
Очаговое поражение головного мозга приводит к нарушению одной или нескольких когнитивных функций, в основе которых лежит единый патогенетический механизм. Такого рода когнитивные нарушения характерны для последствий инсульта, ушиба мозга или развиваются при опухоли мозга. Однако при наиболее распространённых неврологических заболеваниях поражение головного мозга не ограничивается одним очагом, но носит многоочаговый или диффузный характер. В таких случаях развивается нарушение нескольких или всех когнитивных функций, и можно проследить несколько патогенетических механизмов формирования нарушений.
Когнитивные нарушения при многоочаговом или диффузном поражении головного мозга принято классифицировать по тяжести нарушений. Наиболее тяжелым видом расстройств подобного рода является деменция. Диагноз деменции правомерен при наличии нарушений памяти и других когнитивных расстройств (по крайней мере, одного из следующих: нарушения праксиса, гнозиса, речи или интеллекта), которые выражены настолько, что непосредственно влияют на повседневную жизнь. Условиями диагностики деменции является также ясное сознание пациента и наличие установленного органического заболевания головного мозга, которое является причиной когнитивных нарушений [7, 13].
Наиболее тяжелым видом расстройств подобного рода является деменция. Диагноз деменции правомерен при наличии нарушений памяти и других когнитивных расстройств (по крайней мере, одного из следующих: нарушения праксиса, гнозиса, речи или интеллекта), которые выражены настолько, что непосредственно влияют на повседневную жизнь. Условиями диагностики деменции является также ясное сознание пациента и наличие установленного органического заболевания головного мозга, которое является причиной когнитивных нарушений [7, 13].
Деменция наиболее часто отмечается в пожилом возрасте, при этом самой распространённой причиной деменции является болезнь Альцгеймера (БА). БА представляет собой дегенеративное заболевание головного мозга, связанное с прогрессирующей гибелью ацетилхолинергических нейронов. Обычно это заболевание начинается после 65 лет. Первым и основным симптомом БА является прогрессирующая забывчивость на события жизни. В дальнейшем к мнестическим расстройствам присоединяются нарушения пространственной ориентировки и речи. На развёрнутых стадиях БА утрачивается самостоятельность пациентов, возникает необходимость в посторонней помощи [2, 23, 28].
На развёрнутых стадиях БА утрачивается самостоятельность пациентов, возникает необходимость в посторонней помощи [2, 23, 28].
При БА избирательно страдают те отделы головного мозга, которые находятся в непосредственной связи с когнитивными процессами. Напротив, первичные моторные и сенсорные корковые поля остаются относительно интактными, по крайней мере, на стадиях лёгкой и умеренной деменции, поэтому БА характеризуется избирательным страданием когнитивных функций. Очаговая неврологическая симптоматика, такая как парезы и параличи, расстройства чувствительности, нарушения координации движений, почти всегда отсутствует. Наличие очаговых неврологических симптомов в сочетании с лёгкой или умеренной деменцией свидетельствует против диагноза БА или говорит о сочетании этого заболевания с другой патологией головного мозга, чаще всего сосудистой [2, 23, 28].
Сосудистая мозговая недостаточность является второй после БА причиной деменции в пожилом возрасте. При этом непосредственной причиной поражения головного мозга являются повторные инсульты, хроническая ишемия мозга или, чаще всего, сочетание повторных острых нарушений и хронической недостаточности мозгового кровообращения. Клиническая картина сосудистой деменции значительно отличается от БА, при этом нарушения памяти на события жизни относительно не выражены, а на первый план клинической картины выходят интеллектуальные расстройства. Пациенты испытывают трудности при обобщениях, выявлении сходств и различий между понятиями, развивается значительная замедленность мышления и снижение концентрации внимания [2, 22].
Клиническая картина сосудистой деменции значительно отличается от БА, при этом нарушения памяти на события жизни относительно не выражены, а на первый план клинической картины выходят интеллектуальные расстройства. Пациенты испытывают трудности при обобщениях, выявлении сходств и различий между понятиями, развивается значительная замедленность мышления и снижение концентрации внимания [2, 22].
В отличие от БА, сосудистая деменция практически всегда характеризуется сочетанием когнитивных нарушений и очаговых неврологических симптомов, при этом формируется синдром дисциркуляторной энцефалопатии (ДЭ). Наиболее типичными проявлениями ДЭ являются псевдобульбарный синдром, гипокинезия, повышение мышечного тонуса по пластическому типу, асимметричное повышение сухожильных рефлексов, нарушение походки, тазовые расстройства [1]. Отсутствие указанных очаговых неврологических нарушений делает диагноз сосудистой деменции весьма сомнительным.
Важное значение в дифференциальной диагностике БА и сосудистой деменции имеет нейровизуализация – компьютерная или магнитно-резонансная томография головного мозга. При БА патологические изменения при нейровизуализации могут отсутствовать или представляют собой церебральную атрофию, наиболее выраженную в области гиппокампа. Напротив, сосудистая деменция характеризуется значительными изменениями при нейровизуализации в виде инфарктов мозга и диффузного разрежения плотности белого вещества (так называемый лейкоареоз).
При БА патологические изменения при нейровизуализации могут отсутствовать или представляют собой церебральную атрофию, наиболее выраженную в области гиппокампа. Напротив, сосудистая деменция характеризуется значительными изменениями при нейровизуализации в виде инфарктов мозга и диффузного разрежения плотности белого вещества (так называемый лейкоареоз).
БА и сосудистая деменция имеют общие факторы риска, такие как пожилой возраст, артериальная гипертензия и атеросклероз церебральных сосудов, носительство гена АПОЕ4 и некоторые другие, поэтому очень часто БА и сосудистая мозговая недостаточность сосуществуют. Клинико-морфологические сопоставления свидетельствуют, что почти в половине случаев БА имеются инфаркты мозга и лейкоареоз. С другой стороны, у 77 % пожилых пациентов с прижизненным диагнозом БА выявляются морфологические признаки сопутствующего нейродегенеративного процесса. В таких случаях принято говорить о смешанной (сосудисто-дегенеративной) этиологии деменции. Многие авторы предполагают, что распространённость смешанной деменции превосходит распространённость «чистой» БА или «чистой» сосудистой деменции [14, 18, 21].
Помимо БА, сосудистой и смешанной деменции, причинами тяжёлых когнитивных нарушений могут быть другие дегенеративные заболевания головного мозга, черепно-мозговая травма, опухоли мозга, нарушения всасывания спинномозговой жидкости из желудочков (так называемая арезорбтивная гидроцефалия), нейроинфекция, дисметаболические нарушения и т. д. В литературе упоминается несколько десятков нозологических форм, которые могут приводить к деменции [2]. Однако распространённость данных заболеваний несопоставима с распространённостью БА, сосудистой и смешанной деменции. Три последние указанные нозологические формы отвечают, по данным статистики, за 70-80 % деменций в пожилом возрасте [2, 28].
Деменция представляет собой наиболее тяжёлые когнитивные нарушения. В подавляющем большинстве случаев деменция развивается постепенно, при этом тяжёлым когнитивным нарушениям препятствуют менее выраженные расстройства. В 1997 г. американский невролог R. Petersen предложил использовать термин «умеренные когнитивные нарушения» (англ. mild cognitive impairment, MCI) для обозначения когнитивных нарушений на преддементных стадиях органического поражения головного мозга [31]. Умеренные когнитивные нарушения (УКН) представляют собой недостаточность одной или нескольких когнитивных функций, выходящих за пределы возрастной нормы, но не ограничивающих повседневную активность, т. е. не вызывающих деменции. УКН является клинически очерченным синдромом. При нём когнитивные расстройства вызывают беспокойства самого пациента и обращают на себя внимание окружающих. Диагноз УКН подтверждается данными нейропсихологических методов исследования, которые выявляют более выраженное снижение когнитивных функций, чем допустимое по возрасту. Согласно эпидемиологическим данным, синдром УКН отмечается у 10-15 % пожилых лиц. Риск развития деменции в данной категории пожилого населения значительно превосходит среднестатистический риск (10-15 % в год по сравнению с 1-2 %). Долговременные наблюдения свидетельствуют, что в течение пяти лет у 55-70 % пациентов с УКН развивается деменция.
mild cognitive impairment, MCI) для обозначения когнитивных нарушений на преддементных стадиях органического поражения головного мозга [31]. Умеренные когнитивные нарушения (УКН) представляют собой недостаточность одной или нескольких когнитивных функций, выходящих за пределы возрастной нормы, но не ограничивающих повседневную активность, т. е. не вызывающих деменции. УКН является клинически очерченным синдромом. При нём когнитивные расстройства вызывают беспокойства самого пациента и обращают на себя внимание окружающих. Диагноз УКН подтверждается данными нейропсихологических методов исследования, которые выявляют более выраженное снижение когнитивных функций, чем допустимое по возрасту. Согласно эпидемиологическим данным, синдром УКН отмечается у 10-15 % пожилых лиц. Риск развития деменции в данной категории пожилого населения значительно превосходит среднестатистический риск (10-15 % в год по сравнению с 1-2 %). Долговременные наблюдения свидетельствуют, что в течение пяти лет у 55-70 % пациентов с УКН развивается деменция. Причины синдрома УКН повторяют причины деменции в пожилом возрасте. Чаще всего причиной УКН является нейродегенеративный процесс, сосудистая мозговая недостаточность или их сочетание [19].
Причины синдрома УКН повторяют причины деменции в пожилом возрасте. Чаще всего причиной УКН является нейродегенеративный процесс, сосудистая мозговая недостаточность или их сочетание [19].
По нашему опыту, наряду с деменцией и синдромом УКН целесообразно выделять также лёгкие когнитивные нарушения (ЛКН), при этом когнитивные расстройства выражены минимально и их объективизация требует применения весьма чувствительных нейропсихологических методик. Чаще всего ЛКН проявляется снижением концентрации внимания и нарушениями кратковременной памяти. Несмотря на незначительную выраженность, данные когнитивные нарушения могут вызывать обеспокоенность пациента и снижение качества жизни. В патогенезе ЛКН у пожилых лиц немаловажную роль играют собственно возрастные изменения. Известно, что, в среднем по статистике, когнитивные способности человека постепенно снижаются начиная с 20-30-летнего возраста [12]. В 1994 г. всемирная психогериатрическая лига предложила использовать специальную диагностическую позицию – связанное со старением когнитивное снижение (англ. aging associated cognitive decline, AACD) – для обозначения лёгких, по преимуществу возрастных нарушений когнитивных функций у пожилых лиц [26]. Однако на практике разграничить естественное возрастное когнитивное снижение и когнитивные расстройства, связанные с самыми ранними проявлениями сосудистых и дегенеративных заболеваний головного мозга, весьма затруднительно. Поэтому, с нашей точки зрения, термин «лёгкие когнитивные нарушения» является более корректным.
aging associated cognitive decline, AACD) – для обозначения лёгких, по преимуществу возрастных нарушений когнитивных функций у пожилых лиц [26]. Однако на практике разграничить естественное возрастное когнитивное снижение и когнитивные расстройства, связанные с самыми ранними проявлениями сосудистых и дегенеративных заболеваний головного мозга, весьма затруднительно. Поэтому, с нашей точки зрения, термин «лёгкие когнитивные нарушения» является более корректным.
Обследование пациентов с когнитивными
нарушениями
Жалобы на снижение памяти или уменьшение умственной работоспособности являются основанием для проведения нейропсихологического обследования. При этом такие жалобы могут исходить как от самого пациента, так и от его родственников или ближайшего окружения. Последнее является более надёжным диагностическим признаком, так как самооценка пациентом состояния своих когнитивных функций не всегда объективна [4, 11].
В рутинной клинической практике нейропсихологическое исследование может быть ограничено простыми скрининговыми шкалами, такими как краткая шкала оценки психического статуса. Усложнение протокола нейропсихологического исследования не всегда целесообразно. Применение сложных тестов, увеличивая чувствительность метода, приводит к уменьшению специфичности полученных результатов, так как их выполнение в большой степени зависит от возраста и уровня образования больного.
Усложнение протокола нейропсихологического исследования не всегда целесообразно. Применение сложных тестов, увеличивая чувствительность метода, приводит к уменьшению специфичности полученных результатов, так как их выполнение в большой степени зависит от возраста и уровня образования больного.
Однако примерно у половины пациентов с активными жалобами на снижение памяти применение простых скрининговых шкал не подтверждает наличия когнитивных нарушений. Самой частой причиной субъективных жалоб на снижение памяти при отсутствии объективного подтверждения являются эмоциональные расстройства в виде повышенной тревожности или снижения фона настроения. Поэтому всем пациентам с жалобами на снижение памяти следует тщательно оценивать эмоциональную сферу. Особенно велика вероятность депрессии при жалобах на снижение памяти у лиц молодого или среднего возраста. Другой причиной отсутствия объективного подтверждения когнитивных нарушений при активных жалобах на память является недостаточная чувствительность скрининговых нейропсихологических шкал. Поэтому, помимо оценки и медикаментозной коррекции эмоционального состояния, в таких случаях целесообразно динамическое наблюдение за пациентом и повторные клинико-психологические исследования с интервалом в три-шесть месяцев [4, 11].
Поэтому, помимо оценки и медикаментозной коррекции эмоционального состояния, в таких случаях целесообразно динамическое наблюдение за пациентом и повторные клинико-психологические исследования с интервалом в три-шесть месяцев [4, 11].
При наличии объективного подтверждения когнитивных нарушений следует постараться установить их причину, т. е. нозологический диагноз. При этом нужно иметь в виду, что когнитивные расстройства не всегда являются проявлением первичного заболевания головного мозга. Не так редко деменция или менее тяжёлые нарушения возникают в результате системных дисметаболических расстройств, которые, в свою очередь, являются осложнением различных эндокринных или соматических заболеваний. Чаще всего когнитивные расстройства дисметаболической природы связаны с гипотиреозом, заболеваниями печени или почек, дефицитом витамина В12 или фолиевой кислоты. Поэтому выявление деменции или менее тяжёлых когнитивных нарушений требует всесторонней оценки состояния здоровья пациента и лечения сопутствующих соматических и эндокринных заболеваний [4, 11, 15].
Важное значение имеет также оптимизация проводимой медикаментозной терапии. Следует помнить, что многие лекарственные средства, особенно психотропного действия, оказывают отрицательное влияние на память и другие когнитивные способности. Наиболее неблагоприятное действие на когнитивные функции оказывают холинолитики, трициклические антидепрессанты, нейролептики и бензодиазепины. От этих препаратов следует, по возможности, воздерживаться, особенно лицам пожилого возраста. Недопустимо также злоупотребление алкоголем [4, 11].
Важно исследовать не только соматический статус пациента, но и его эмоциональное состояние. Выше уже говорилось, что эмоциональные расстройства тревожно-депрессивного ряда могут обусловливать субъективные когнитивные расстройства. Однако тяжёлая депрессия может вызывать также и объективные нарушения когнитивных функций и даже имитировать деменцию (так называемая псевдодеменция). При подозрении на наличие депрессии у пожилого человека допустимо назначение антидепрессантов ex juvantibus, при этом следует использовать антидепрессанты с минимальным холинолитическим эффектом, например селективные ингибиторы обратного захвата серотонина [11, 28].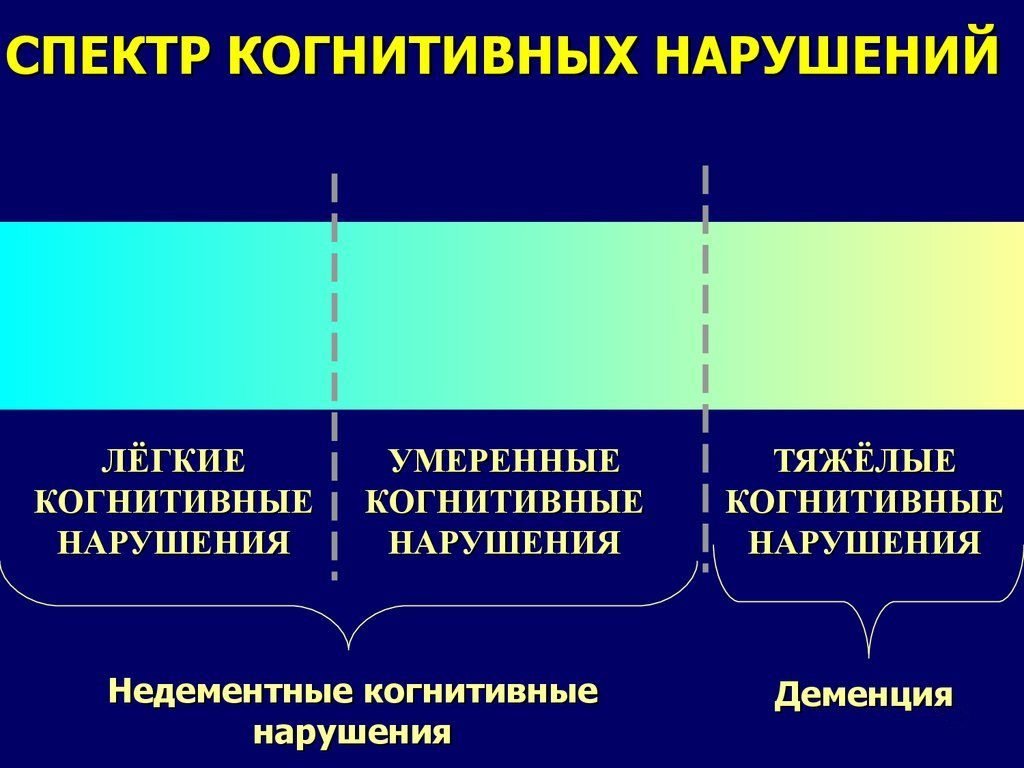
Наличие когнитивных нарушений, безусловно, требует исследования неврологического статуса и проведение компьютерной рентгеновской или магнитно-резонансной томографии (МРТ) головного мозга. В целом, нозологический диагноз базируется на особенностях когнитивных расстройств, характере сопутствующей очаговой неврологической симптоматики и данных нейровизуализации. Так, преобладание в клинической картине нарушений памяти, отсутствие очаговой неврологической симптоматики и атрофия гиппокампа на МРТ характерны для БА. Относительная сохранность памяти на события жизни, выраженная неврологическая симптоматика и инфаркты мозга на МРТ свидетельствуют о сосудистой этиологии когнитивных нарушений. Сочетание указанных выше клинических признаков может указывать на смешанные (сосудисто-дегенеративные) когнитивные расстройства. Более редкие причины когнитивных расстройств имеют специфические нейропсихологические и неврологические особенности, которые в большинстве случаев позволяют правильно поставить диагноз.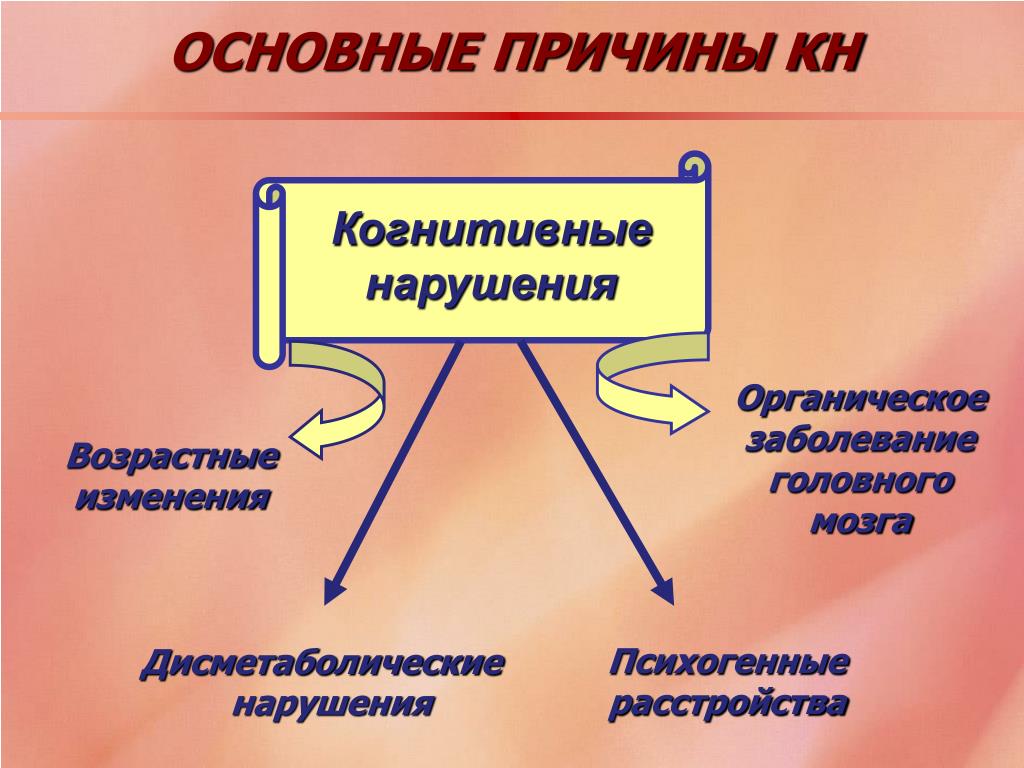
Лечение когнитивных нарушений
Выбор терапевтической тактики определяется тяжестью когнитивных нарушений и их этиологией. При деменции лёгкой и умеренной выраженности, связанной с БА, сосудистой мозговой недостаточностью, или при смешанной, сосудисто-дегенеративной этиологии деменции препаратами первого выбора являются ингибиторы ацетилхолинэстеразы (галантамин, ривастигмин, донепилзин) и/или мемантин. Применение данных препаратов оказывает несомненное положительное влияние на память и другие когнитивные функции, способствует нормализации поведения, повышает адаптацию к повседневной жизни и в целом повышает качество жизни пациентов и их родственников. По некоторым данным, применение данных препаратов способствует также снижению темпа прогрессирования когнитивных нарушений; впрочем, этот вопрос требует дальнейшего изучения [28].
На стадии умеренных и лёгких когнитивных нарушений эффективность ингибиторов ацетилхолинэстеразы и мемантина на сегодняшний день не доказана. Поскольку при УКН и ЛКН когнитивные нарушения не оказывают значительного влияния на повседневную жизнь, главной целью терапии нетяжёлых когнитивных расстройств является не столько улучшение памяти, сколько предотвращение прогрессирования когнитивных расстройств, т. е. профилактика деменции. Поэтому препаратами первого выбора являются лекарственные средства с нейропротективным эффектом. Такой эффект предполагается у так называемых сосудистых и метаболических препаратов [3, 11].
е. профилактика деменции. Поэтому препаратами первого выбора являются лекарственные средства с нейропротективным эффектом. Такой эффект предполагается у так называемых сосудистых и метаболических препаратов [3, 11].
Сосудистые препараты можно разделить на три основные фармакологические группы:
• ингибиторы фосфодиэстеразы: эуфиллин, пентоксифиллин, винпоцетин, препараты гинкго билобы и др. Сосудорасширяющий эффект данных препаратов связан с увеличением в гладкомышечных клетках сосудистой стенки содержания цАМФ, что приводит к их расслаблению и увеличению просвета сосудов. При этом данные препараты оказывают воздействие в основном на сосуды микроциркуляторного русла и не вызывают эффекта обкрадывания [3, 11];
• блокаторы кальциевых каналов: циннаризин, флюнаризин, нимодипин, оказывающие вазодилатирующий эффект благодаря уменьшению внутриклеточного содержания кальция в гладкомышечных клетках сосудистой стенки. По некоторым данным, блокаторы кальциевых каналов оказывают наиболее выраженный эффект на сосуды вертебрально-базилярного бассейна [3, 11];
• блокаторы a2-адренорецепторов: ницерголин. Данный препарат устраняет сосудосуживающее действие медиаторов симпатической нервной системы: адреналина и норадреналина [3, 11].
Данный препарат устраняет сосудосуживающее действие медиаторов симпатической нервной системы: адреналина и норадреналина [3, 11].
Важно отметить, что ишемия и гипоксия имеют патогенетическое значение не только при сосудистой мозговой недостаточности, но и при нейродегенеративном процессе. Поэтому применение сосудистых препаратов оправданно не только при хронической ишемии мозга, но и на начальных стадиях БА. Многие сосудистые препараты обладают также дополнительными метаболическими и антиоксидантными свойствами (например, стандартизованный экстракт гинкго билобы) [3, 11].
Благоприятное влияние на нейрометаболические процессы оказывают ГАМК-ергические препараты (пирацетам и его производные), пептидергические препараты и аминокислоты (церебролизин, Актовегин, глицин, семакс) и некоторые метаболиты (энцефабол). Нейрометаболические препараты оказывают ноотропный эффект, оптимизируя метаболические процессы и увеличивая пластичность нейронов головного мозга. В экспериментальных условиях неоднократно было показано, что нейрометаболические препараты способствуют увеличению выживаемости нейронов в условиях гипоксии или при моделировании нейродегенеративного процесса [3, 11]. Поэтому применение данных препаратов на стадии ЛКН и УКН является абсолютно оправданным.
Поэтому применение данных препаратов на стадии ЛКН и УКН является абсолютно оправданным.
Весьма перспективным препаратом нейрометаболического действия является Актовегин, представляющий собой высокоочищенный депротеинизированный гемодиализат, который получают методом ультрафильтрации из крови телят. Препарат содержит низкомолекулярные соединения массой до 5000 Дальтон, такие как биологически активные аминокислоты, пептиды, нуклеозиды и олигосахариды, а также ряд ценных микроэлементов, при этом биохимический состав Актовегина является строго стандартизованным [9].
На экспериментальных моделях было показано, что биологически активные компоненты Актовегина оказывают положительное влияние на внутриклеточный метаболизм. Под воздействием Актовегина увеличивается трансмембранный транспорт глюкозы и кислорода, что приводит к увеличению выживаемости клеточных культур при различных неблагоприятных воздействиях [16, 20]. Кроме того, очень важным качеством Актовегина является его способность активизировать антиоксидантные ферменты, в первую очередь супероксиддисмутазу и, таким образом, защищать клетки от повреждения активными формами кислорода, образующимися в условиях гипоксии.
Положительный ноотропный эффект препарата был продемонстрирован в серии клинических исследований с применением двойного слепого метода. Так, по данным B. Saletu и соавт., терапия Актовегином способствует статистически и клинически значимому уменьшению выраженности мнестических и интеллектуальных расстройств при лёгких когнитивных нарушениях возрастного характера [32]. Ноотропный эффект Актовегина был подтверждён также электрофизиологическими методами исследования: на фоне терапии данным препаратом была зафиксирована оптимизация когнитивного вызванного потенциала Р300 [33]. О положительном эффекте Актовегина при лёгких и умеренных когнитивных нарушениях сосудистой и дегенеративной природы свидетельствуют также другие исследователи [10, 24, 29, 30].
По данным рандомизированных исследований, Актовегин благоприятно влияет на когнитивные функции не только у больных с легкими и умеренными нарушениями, но и при деменции. Так, в серии работ было показано, что на фоне терапии Актовегином отмечается положительная динамика мнестических и других когнитивных функций у пациентов как при БА, так и при сосудистой деменции [8, 9].
В повседневной клинической практике Актовегин успешно применяется на протяжении 35 лет. Препарат безопасен в применении и обладает хорошей переносимостью. Побочные эффекты возникают редко и не представляют угрозы для жизни и здоровья. Это могут быть чувство жара, головокружение, головная боль, желудочно-кишечные расстройства.
Таким образом, нарушение когнитивных функций является одним из наиболее частых неврологических симптомов, в особенности у пациентов пожилого возраста. Для выявления когнитивных расстройств необходимо применение нейропсихологических методов исследования. В повседневной клинической практике это могут быть простые скрининговые шкалы, применение и интерпретация которых не требует специального психологического образования или опыта. Терапия когнитивных нарушений зависит от их тяжести и этиологии. Наиболее распространёнными причинами когнитивных расстройств в пожилом возрасте являются сосудистая мозговая недостаточность и нейродегенеративный процесс, при этом на стадии деменции наибольший эффект оказывают игибиторы ацетилхолинэстеразы и мемантин. В то же время на стадии легких и умеренных когнитивных нарушений более целесообразны сосудистые и метаболические препараты с нейропротективным эффектом.
В то же время на стадии легких и умеренных когнитивных нарушений более целесообразны сосудистые и метаболические препараты с нейропротективным эффектом.
Литература:
1. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте // Автореф. дисс… докт. мед. наук. М., 1997.
32 с.
2. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция / под ред. Н.Н. Яхно. М., 2002. 85 с.
3. Захаров В.В., Дамулин И.В., Яхно Н.Н. Медикаментозная терапия деменций // Клиническая фармакология и терапия. 1994. Т. 3. № 4. С. 69-75.
4. Захаров В.В., Яхно Н.Н. Нарушения памяти. М.: ГеотарМед. 2003. С. 150.
5. Лурия А.Р. Высшие корковые функции человека. М.: изд-во МГУ. 1969.
6. Лурия А.Р. Основы нейропсихологии. М.: изд-во МГУ. 1973.
7. Международная статистическая классификация болезней и проблем, связанных со здоровьем. Десятый пересмотр (МКБ-10). Женева, ВОЗ. 1995.
8. Херман В.М., Бон-Щлчевский В.Дж., Кунту Г. Инфузионная терапия актовегином у пациентов с первичной дегенеративной деменцией типа Альцгеймера и мульти-инфарктной деменцией (результаты проспективного плацебо-контролируемого двойного слепого исследования у пациентов, находящихся в условиях стационара) // РМЖ. 2002. Т. 10. № 15. С. 658-663.
2002. Т. 10. № 15. С. 658-663.
9. Шмырёв В.И., Остроумова О.Д., Боброва Т.А. Возможности препарата актовегин в профилактике и лечении деменции // РМЖ. 2003. Т. 11. № 4. C. 216-220.
10. Янсен В., Брукнер Г.В. Лечение хронической цереброваскулярной недостаточности с использованием драже актовегин-форте (двойное слепое плацебо-контролируемое исследование) // РМЖ. 2002. Т. 10. № 12-13. С. 543-546.
11. Яхно Н.Н., В.В.Захаров. Нарушение памяти в неврологической практике // Неврологический журнал. 1997. Т. 4. С. 4-9.
12. Яхно Н. Н., Лавров А. Ю. Изменения центральной нервной системы при старении // Нейродегенеративные болезни и старение (руководство для врачей) / под ред. И.А. Завалишина, Н.Н. Яхно, С.И. Гавриловой. М., 2001. С. 242-261.
13. American Psychiatry Association. Diagnostic and Statistical Manual of Mental Disorders. 4th Ed. // Washington: American Psychiatry Association. 1994.
14. Barker W.W., Luis C.A., Kashuba A. et al. Relative frequencies of Alzheimer disease, Lewy body, vascular and frontotemporal dementia, and hippocampal sclerosis in the State of Florida Brain Bank //Alzheimer Dis Assoc Disord. 2002. V.16. P. 203-212.
2002. V.16. P. 203-212.
15. Blass J.B. Metabolic dementias // Aging of the brain and dementia. Aging. V.13. Ed. By L.Amaducci et al. N.Y.: Raven Press. 1980.
P. 261-170.
16. DeGroot M., Brecht M., Machicao F. Evidence for a factor protective against hypoxic parenchymal cell injury in a protein free blood extract // Res commun Cherm Pathol Pharmacol. 1990. V.68. P. 125-128.
17. Folstein M.F., S.E.Folstein, P.R.McHugh. Mini-Mental State: a practical guidefor grading the mental state of patients for the clinician //
J Psych Res. 1975. V. 12. P. 189-198.
18. Fu C., Chute D.J., Farag E.S., Garakian J. et al. Comorbidity in dementia: an autopsy study // Arch Pathol Lab Med. 2004. Vol. 128.
№ 1. P. 32-38.
19. Golomb J., Kluger A., P.Garrard, Ferris S. Clinician’s manual on mild cognitive impairment // London: Science Press Ltd. 2001. P. 56.
20. Herrsshaft H., Kunze U., Glein F. Die Wirkung von Actovegin anf die Gehinstaffwech sel des menschen // Med Welt. 1977. Bd. 28. S.339-345.
Bd. 28. S.339-345.
21. Hulette C.M. Brain banking in the United States // J Neuropathol Exp Neurol. 2003. Vol. 62. N. 7. P. 715-722.
22. Hershey L.A., Olszewski W.A. Ischemic vascular dementia // In: Handbook of Demented Illnesses. Ed. by J.C.Morris. New York etc.: Marcel Dekker, Inc. 1994. P. 335-351.
23. Iqbal K., Winblad B., Nishimura T., Takeda M., Wisniewski(eds) H.M. Alzheimer’s Disease: Biology, Diagnosis and Therapeutics John Willey and Sons Ltd. 1997. 830 p.
24. Kanowsky S., Kinzler E., Lehman E. et al. Confirmed clinical efficacy of actovegin in elderly patients with organic brain syndrome // Pharmacopsychiat. 1995. V. 28. P. 125-133.
25. Larrabee G.J., Crook T. M. Estimated prevalence of age associated memory impairment derived from standardized tests of memory function // Int Psychogeriatr. 1994. V. 6. N.1. P. 95-104.
26. Levy R. Aging-associated cognitive decline // Int Psychogeriatr. 1994. V. 6. P. 63-68.
27. Lezak M.D. Neuropsychology assessment // N. Y. University Press. 1983. P. 768.
Y. University Press. 1983. P. 768.
28. Lovenstone S., Gauthier S. Management of dementia // London: Martin Dunitz. 2001.
29. Oswald W.D., Steyer W., Oswald B., Kuntz G. Die verbesserung fluider kognitiver leistungen als imdikator fur die klinishe wirksamkeit einer nootropen substanz. Eine placebokontrollierte doppelblind studie mit Actovegin // Z. Gerontopsychol Psychiatric. 1991. Bd4. S. 209-220.
30. Oswald W.D., Steyer W., Oswald B., Kuntz G. Die verbesserung fluider kognitiver leistungen mit Actovegin-infusionen bei alterspatienten mit leichem bis millel schweren organisdom psychosyndrom // Z. Geronto-psychiatrie. 1992. Bd5. S. 251-266.
31. Petersen R.S., Smith G.E., Waring S.C. et al. Aging, memory and mild cognitive impairment // Int. Psychogeriatr. 1997. Vol. 9. P. 37-43.
32. Saletu B., Grunberger J., Linzmayer L. et al. EEG brain mapping and psychometry in age-associated memory impairment after acute and 2 weeks infusions with the hemoderivative Actovegin: double blind placebo controlled trials // Neuropsychobiol. 1990-91. V.24. P. 135-145.
1990-91. V.24. P. 135-145.
33. Semlitsch H.V., Anderer P., Saletu B., Hochmayer I. Topographic mapping of cognitive event-related potentials in double blind placebo controlled study with the hemoderivative Actovegin in age-associated memory impairment // Neuropsychobiol. 1990/91. Vol. 24. P. 49-56.
34. VanCrevel. Clinical approach to dementia // In: Aging of the brain and Alzheimer’s disease. Ed. By D.F.Swab et al. Progress in brain research. Vol. 70. Amsterdam etc: Elsevier. 1986. P. 3-13.
Фармакотерапия когнитивных нарушений различного генеза: современное состояние и перспективные направления | Ушкалова Е.А., Ушкалова А.В.
Когнитивные расстройства являются самыми распространенными неврологическими симптомами, т. к. практически любое заболевание с вовлечением ЦНС сопровождается их развитием [1].
Причины когнитивных расстройств
Причинами когнитивных расстройств могут быть нейродегенеративные и сосудистые заболевания головного мозга, токсические и дисметаболические энцефалопатии, нейроинфекции и другие патологии (табл.
 1). Во многих случаях в основе деменции лежат два и более состояния, наиболее часто – сочетание болезни Альцгеймера (БА) с другой патологией головного мозга [2].
1). Во многих случаях в основе деменции лежат два и более состояния, наиболее часто – сочетание болезни Альцгеймера (БА) с другой патологией головного мозга [2].Наблюдающийся в последние десятилетия рост распространенности когнитивных расстройств обусловлен в первую очередь постарением населения [1, 4]. Наиболее распространенным типом деменции у пожилых людей является БА, далее следует деменция с тельцами Леви [5, 6]. «Чистая» сосудистая деменция встречается редко, однако сосудистые заболевания головного мозга, включая субклинические поражения, «немой» инфаркт мозга и клинически явный инсульт, являются важными независимыми факторами, вносящими существенный вклад в ухудшение когнитивной функции у пациентов с другими заболеваниями [2].
Риск развития когнитивных расстройств повышается при ряде соматических патологий, в т. ч. сердечно-сосудистых, сахарном диабете и метаболическом синдроме, дисфункциях щитовидной железы, выраженном поражении функции печени и почек, гиперхолестеринемии и гипергомоцистеинемии, дефиците витаминов группы В, синдроме обструктивного апноэ сна, хроническом обструктивном заболевании легких, анемии и ряде других [5].

Лечение когнитивных расстройств
Лечение когнитивных расстройств, в тех случаях, когда это возможно, в первую очередь должно быть направлено на устранение основной причины. Например, при нейроинфекциях главная роль принадлежит этиотропной терапии, направленной на эрадикацию возбудителя, при артериальной гипертензии – антигипертензивным препаратам, при хронической сосудистой мозговой недостаточности – препаратам, улучшающим микроциркуляцию, при болезни Паркинсона – низким (до 500 мг) дозам леводопы и т. д. [2, 3]. При наличии нескольких патологий лечение должно быть прежде всего направлено на устранение факторов, вносящих наибольший вклад в развитие деменции [2]. Болезнь-модифицирующих препаратов при нейродегенеративных заболеваниях в настоящее время не существует, поэтому в этих случаях проводится симптоматическое и поддерживающее лечение. Среди препаратов для симптоматической терапии наиболее хорошо изучены ингибиторы холинэстеразы (иХЭ) (антихолинэстеразные средства) и мемантин.
Ингибиторы холинэстеразы
Основанием для применения иХЭ послужила «холинергическая гипотеза», согласно которой важным фактором, способствующим снижению когнитивных функций в пожилом возрасте и при БА, является дефицит ацетилхолина в ЦНС, а восстановление его запасов приводит к улучшению когнитивных функций [7]. Эта гипотеза получила подтверждение в экспериментальных и клинических исследованиях.
иХЭ рекомендуют преимущественно пациентам с БА легкой/умеренной степени тяжести. Однако при легких когнитивных расстройствах применение иХЭ, по данным метаанализа, ассоциируется с минимальной пользой, которую следует сопоставлять с риском развития побочных эффектов, особенно желудочно-кишечных [8]. В некоторых странах их применение также одобрено при тяжелой деменции, однако эффективность иХЭ у этих больных подвергается сомнению [5].
Препараты данной группы также улучшают когнитивные функции у пациентов с болезнью Паркинсона и деменцией с тельцами Леви, что подтверждается результатами недавно опубликованного метаанализа 10 РКИ [9]. При деменции с тельцами Леви они также способствуют улучшению поведенческих симптомов [10].
При деменции с тельцами Леви они также способствуют улучшению поведенческих симптомов [10].
Доказательные данные об эффективности иХЭ при сосудистой деменции ограниченны и противоречивы [11, 12]. В последних канадских рекомендациях, опубликованных в 2014 г., препараты этой группы рекомендованы для лечения деменции с сосудистым компонентом (наиболее распространенным типом деменции смешанного патогенеза), но не «чистой» сосудистой деменции [2]. Убедительных доказательств эффективности иХЭ при ЛВД не получено, более того, есть данные, что они могут ухудшать у этих пациентов поведенческие симптомы [13]. Также нет доказательств эффективности иХЭ при других нейрокогнитивных расстройствах.
Данные о влиянии иХЭ на отдаленные исходы, такие как замедление нарушений повседневного функционирования и удлинение срока до помещения в специализированные учреждения по уходу, противоречивы [14].
иХЭ достаточно часто вызывают побочные эффекты, в частности нежелательные симптомы со стороны ЖКТ (тошнота, рвота, диарея, потеря аппетита, снижение веса) наблюдаются примерно у 10–15% пациентов [3]. Серьезные нежелательные реакции, наиболее часто со стороны ЦНС и ЖКТ, а также сердечные аритмии преимущественно развиваются у больных старческого возраста, а также получающих сопутствующую терапию антипсихотиками первого и второго поколения, антигипертензивными лекарственными средствами и препаратами, влияющими на ЖКТ и обмен веществ [15]. Применение иХЭ ограничивает ряд абсолютных и относительных противопоказаний, в их числе язвенная болезнь желудка и двенадцатиперстной кишки, почечная и печеночная недостаточность, синдром слабости синусового узла, брадикардия, бронхиальная астма и эпилепсия [3].
Серьезные нежелательные реакции, наиболее часто со стороны ЦНС и ЖКТ, а также сердечные аритмии преимущественно развиваются у больных старческого возраста, а также получающих сопутствующую терапию антипсихотиками первого и второго поколения, антигипертензивными лекарственными средствами и препаратами, влияющими на ЖКТ и обмен веществ [15]. Применение иХЭ ограничивает ряд абсолютных и относительных противопоказаний, в их числе язвенная болезнь желудка и двенадцатиперстной кишки, почечная и печеночная недостаточность, синдром слабости синусового узла, брадикардия, бронхиальная астма и эпилепсия [3].
Мемантин
Мемантин является неконкурентным антагонистом глутаматных NMDA(N-метил-D-аспартат)-рецепторов. Предполагают, что он оказывает нейропротективное действие в отношении эксайтотоксичности в коре больших полушарий и гиппокампе, обусловленной избыточным выбросом глутамата в синаптическую щель [16].
Эффективность мемантина показана у пациентов со среднетяжелой и тяжелой БА, но не при других формах деменции [17]. Помимо влияния на когнитивные функции мемантин вызывает небольшое снижение ажитации у больных с деменцией [18].
Помимо влияния на когнитивные функции мемантин вызывает небольшое снижение ажитации у больных с деменцией [18].
У пациентов с деменцией с тельцами Леви и когнитивными нарушениями, ассоциированными с болезнью Паркинсона, мемантин вызывал небольшое улучшение общего состояния (по шкале CGI), но не влиял на когнитивные функции [9]. Есть сообщения об ухудшении симптомов бреда и галлюцинаций при применении мемантина у пациентов с деменцией с тельцами Леви [5].
При легкой и умеренной сосудистой деменции он оказывал небольшой и клинически не значимый эффект [18]. Данные исследований мемантина при ЛВД противоречивы [19].
Достоинством мемантина является его хорошая переносимость [5].
Другие препараты
В систематических обзорах и метаанализах не удалось получить доказательств эффективности при каких-либо деменциях пирацетама [20], мелатонина [21] и витаминов [22–24]. Также не доказана способность статинов, заместительной гормональной терапии и нестероидных противовоспалительных препаратов (НПВП) предотвращать ухудшение когнитивных функций [25]. Более того, в 2012 г. на основании спонтанных сообщений о побочных реакциях FDA (США) внесло в инструкции по применению статинов предостережение о возможном нарушении когнитивных функций при их использовании [26]. В целенаправленном систематическом обзоре не удалось ни подтвердить, ни опровергнуть это предостережение, особенно в отношении высоких доз препаратов [27]. Аналогичные данные имеются для НПВП (рофекоксиба, целекоксиба и напроксена) и эквин-эстрогена [25].
Более того, в 2012 г. на основании спонтанных сообщений о побочных реакциях FDA (США) внесло в инструкции по применению статинов предостережение о возможном нарушении когнитивных функций при их использовании [26]. В целенаправленном систематическом обзоре не удалось ни подтвердить, ни опровергнуть это предостережение, особенно в отношении высоких доз препаратов [27]. Аналогичные данные имеются для НПВП (рофекоксиба, целекоксиба и напроксена) и эквин-эстрогена [25].
Таким образом, выбор препаратов, улучшающих когнитивные функции, остается крайне ограниченным. Кроме того, эффективность иХЭ и мемантина умеренная, и они позволяют задерживать прогрессирование когнитивных нарушений в среднем лишь на несколько месяцев. При неэффективности монотерапии часто рекомендуют комбинировать иХЭ и мемантин. Эта комбинация представляется безопасной и рациональной, поскольку ее ингредиенты имеют разные механизмы действия, однако доказательных данных для того, чтобы поддержать или отвергнуть ее применение, на сегодняшний день недостаточно [2].
Поиск эффективных препаратов для лечения когнитивных расстройств продолжается, в настоящее время клинические исследования проходят 70 новых препаратов, предназначенных для лечения БА [28]. Внимание исследователей привлекают и «старые» средства, оказывающие благоприятное влияние на когнитивные функции. К их числу относится холина альфосцерат (ХАФ) [29, 30].
Холина альфосцерат и его комбинации с другими препаратами
ХАФ является предшественником ацетилхолина. Он легко проходит через гематоэнцефалический барьер и в головном мозге расщепляется на холин и глицерофосфат [30]. Холин является субстратом для синтеза нейромедиатора ацетилхолина, некоторых сигнальных молекул и липидов, включая необходимые компоненты клеточных мембран (фосфатидилхолин, лизофосфатидилхолин, сфингомиелин), а также донатором метильных групп, необходимых для процессов метилирования ДНК и ресинтеза метионина [31]. Глицерофосфат – предшественник фосфатидилхолина – одного из главных фосфолипидов клеточных мембран, при повреждении которых в результате ишемических процессов в головном мозге образуются высокотоксичные свободные радикалы. Фосфатидилхолин восстанавливает фосфолипидный состав мембран нейронов и улучшает их пластичность.
Фосфатидилхолин восстанавливает фосфолипидный состав мембран нейронов и улучшает их пластичность.
В экспериментах на животных показано, что ХАФ усиливает выделение ацетилхолина в гиппокампе, улучшает память и обучение, оказывает протективный эффект в отношении микроанатомии головного мозга при экспериментальной модели сосудистой деменции, снижает структурные изменения в головном мозге, обусловленные старением, в т. ч. отвечающие за память и обучение [30–32].
ХАФ изучался в 14 клинических исследованиях с участием 4054 пациентов при деменции нейродегенеративного и сосудистого генеза (табл. 2) и продемонстрировал благоприятное влияние на ориентацию, внимание, память, речь и настроение [32]. В трех из них (n=2484) показана способность ХАФ улучшать функциональное восстановление у пациентов, перенесших инсульт или транзиторную ишемическую атаку (ТИА)[32].
Аналогичные результаты получены в многоцентровом открытом исследовании в Италии, в котором 2044 пациента, недавно перенесших инсульт или ТИА, получали в течение первого месяца инъекции ХАФ, а далее в течение 5 мес. – препарат внутрь [33]. К концу исследования в соответствии с оценкой по шкале Global Deterioration Scale (Шкала общего ухудшения состояния) 71% пациентов соответствовали критериям «отсутствия когнитивного ухудшения». Статистически значимое улучшение было получено и при оценке по всем другим тестам. В исследовании также была продемонстрирована прекрасная переносимость препарата.
– препарат внутрь [33]. К концу исследования в соответствии с оценкой по шкале Global Deterioration Scale (Шкала общего ухудшения состояния) 71% пациентов соответствовали критериям «отсутствия когнитивного ухудшения». Статистически значимое улучшение было получено и при оценке по всем другим тестам. В исследовании также была продемонстрирована прекрасная переносимость препарата.
Сходные данные были получены и в исследованиях отечественных ученых с применением препарата Церетон (ХАФ) [34–37]. В одном из них с участием 95 пациентов с ишемическим каротидным инсультом показана не только клиническая, но и затратная эффективность Церетона по сравнению со стандартной терапией [37].
При когнитивных расстройствах, ассоциированных с болезнью Паркинсона, Церетон достоверно превосходил по эффективности пирацетам [38]. Кроме того, в отличие от пирацетама, применение которого ассоциировалось с тенденцией к увеличению выраженности психотических нарушений, введение ХАФ сопровождалось уменьшением некоторых поведенческих симптомов, прежде всего апатии, а также с достоверным улучшением качества жизни больных. Улучшение настроения пациентов и устранение эмоциональной лабильности, наряду с улучшением соматического состояния, под влиянием ХАФ у пациентов с когнитивными нарушениями различного генеза также отмечено и в других исследованиях [29, 30].
Улучшение настроения пациентов и устранение эмоциональной лабильности, наряду с улучшением соматического состояния, под влиянием ХАФ у пациентов с когнитивными нарушениями различного генеза также отмечено и в других исследованиях [29, 30].
Включение ХАФ на ранних этапах в состав комплексной терапии приводило к улучшению исходов у пациентов (n=23) с черепно-мозговой травмой [39].
Преимуществом ХАФ перед иХЭ является его безопасность и хорошая переносимость, в т. ч. больными с брадикардией, бронхиальной астмой и другими сопутствующими соматическими заболеваниями, являющимися противопоказанием к применению иХЭ [30, 40]. Хорошая переносимость и благоприятное влияние на соматические симптомы позволили экспертам рассматривать ХАФ в качестве препарата выбора у больных с деменцией различного генеза и степени тяжести старше 85 лет. Препарат показывает коррекцию легких и умеренных когнитивных расстройств, в т. ч. при наличии сосудистой коморбидности и других сопутствующих заболеваниях [30, 32].
Для повышения эффективности терапии когнитивных нарушений ХАФ можно комбинировать с препаратами других групп. В многоцентровом двойном слепом плацебо-контролируемом РКИ ASCOMALVA (Effect of association between a cholinesterase inhibitor and GPC on cognitive deficitsin Alzheimer’s disease associated with cerebrovascular injury), участниками которого были пациенты с БА и сопутствующим ишемическим поражением церебральных сосудов, показано, что комбинация ХАФ с иХЭ донепезилом превосходит монотерапию донепезилом по большинству тестов и хорошо переносится больными [41]. В нескольких российских исследованиях были получены хорошие результаты при применении комбинации ХАФ с этилметилгидроксипиридина сукцинатом (ЭМГПС) у больных с нарушениями мозгового кровообращения [42–47].
ЭМГПС – отечественный препарат из группы производных 3-оксипиридинов, обладающий комплексным механизмом действия, позволяющим ему реализовывать свои эффекты на трех уровнях – нейрональном, сосудистом и метаболическом, и оказывать благоприятное влияние не только на ЦНС, но и на периферические органы и ткани [45]. Препарат способен ингибировать процессы свободно-радикального окисления и подавлять окислительный стресс, который рассматривается в качестве одного из наиболее значимых факторов патогенеза нейродегенеративных заболеваний, в т. ч. БА и других видов деменции, болезни Паркинсона, эпилепсии, рассеянного склероза, бокового амиотрофического склероза. ЭМГПС корригирует нарушенные при старении процессы обучения и памяти, способствует улучшению процессов сохранения и воспроизведения информации, снижает уровни маркеров старения (липофусцина, малонового альдегида, холестерина) в головном мозге и крови, уменьшает проявления неврологического дефицита и восстанавливает эмоциональный и вегетативный статус пациентов пожилого возраста [46].
Препарат способен ингибировать процессы свободно-радикального окисления и подавлять окислительный стресс, который рассматривается в качестве одного из наиболее значимых факторов патогенеза нейродегенеративных заболеваний, в т. ч. БА и других видов деменции, болезни Паркинсона, эпилепсии, рассеянного склероза, бокового амиотрофического склероза. ЭМГПС корригирует нарушенные при старении процессы обучения и памяти, способствует улучшению процессов сохранения и воспроизведения информации, снижает уровни маркеров старения (липофусцина, малонового альдегида, холестерина) в головном мозге и крови, уменьшает проявления неврологического дефицита и восстанавливает эмоциональный и вегетативный статус пациентов пожилого возраста [46].
Кроме того, он оказывает благоприятные эффекты на сердечно-сосудистую и свертывающую систему крови: препятствует активации перекисного окисления липидов, снижает гиперлипидемию и содержание атерогенных липопротеидов и триглицеридов, повышает уровень липопротеидов высокой плотности в сыворотке крови, тормозит локальные сосудистые механизмы атерогенеза и уменьшает риск развития патологических изменений в сосудистой стенке. Одновременно ЭМГПС улучшает микроциркуляцию и реологические свойства крови путем угнетения образования тромбоксана А и усиления продукции простациклина [46].
Одновременно ЭМГПС улучшает микроциркуляцию и реологические свойства крови путем угнетения образования тромбоксана А и усиления продукции простациклина [46].
Вышеперечисленные свойства позволяют рассматривать ЭМГПС в качестве препарата для базовой терапии цереброваскулярных заболеваний. Его эффективность продемонстрирована при применении в качестве терапевтического и профилактического средства при острых нарушениях мозгового кровообращения, дисциркуляторной энцефалопатии, вегетососудистой дистонии, атеросклеротических нарушениях функций мозга и при других состояниях, сопровождающихся гипоксией тканей [47].
Механизмы действия и фармакологические свойства ХАФ и ЭМГПС дополняют друг друга с точки зрения влияния как на когнитивные функции, так и на соматические симптомы. Комплексное применение ХАФ и ЭМГПС позволяет обеспечить процессы нейропротекции и нейропластичности клеток мозга необходимой энергией, а синергизм между компонентами комбинации, обусловленный их действием на разные этапы патогенеза, способствует усилению терапевтического эффекта и сокращению длительности лечения, что подтверждается результатами клинических исследований данной комбинации.
Так, синергидный эффект между компонентами комбинации был продемонстрирован при применении Церетона (ХАФ) и Нейрокса (ЭМГПС) в исследовании с участием 49 пациентов в возрасте от 60 до 85 лет с впервые диагностированным ишемическим инсультом и повторным нарушением мозгового кровообращения, большинство из которых страдали артериальной гипертензией, сердечными аритмиями и нарушениями обмена глюкозы [42]. Церетон вводили внутривенно в суточной дозе 1000 мг; Нейрокс – внутривенно капельно (250 мг/5,0 мл в 250 мл физраствора). Длительность лечения составила 14 дней, период наблюдения – 30 дней. Применение комбинации ассоциировалось с положительной динамикой в восстановлении сознания и регрессе очаговых неврологических симптомов. Наряду с высокой эффективностью отмечена ее хорошая переносимость больными пожилого и старческого возраста. Аналогичные данные были получены при применении комбинации ХАФ и ЭМГПС в другом исследовании у пациентов с тяжелым ишемическим инсультом [43]. Применение этой комбинации рекомендуют и в комплексной терапии других цереброваскулярных заболеваний [44–47].
Таким образом, ХАФ представляется эффективным и безопасным препаратом при когнитивных расстройствах различного генеза, а его комбинация с ЭМГПС способствует усилению терапевтического эффекта и сокращению длительности лечения у больных с цереброваскулярными заболеваниями.
Литература
1. Захаров В.В. Диагностика и лечение умеренных когнитивных нарушений // Неврология, нейропсихиатрия, психосоматика. 2009. Вып. № 2. С. 14–19.
2. Moore A., Patterson C., Lee L. et al. Fourth Canadian Consensus Conference on the Diagnosis and Treatment of Dementia: recommendations for family physicians // Can. Fam. Physician. 2014. Vol. 60. № 5. P. 433–438.
3. Деменции: руководство для врачей / Н.Н. Яхно и др. МЕДпресс-информ, 2010. 264 с.
4. Lobo A., Launer L.J., Fratiglioni L., et al. Prevalence of dementia and major subtypes in Europe: A collaborative study of population-based cohorts. Neurologic Diseases in the Elderly Research Group // Neurol. 2000. Vol. 54. № 11 (Suppl. 5). S4–9.
2000. Vol. 54. № 11 (Suppl. 5). S4–9.
5. Hugo J., Ganguli M. Dementia and Cognitive Impairment: Epidemiology, Diagnosis, and Treatment // Clin. Geriatr. Med. 2014.Vol. 30. № 3. P. 421–442.
6. Mayo M.C., Bordelon Y. Dementia with lewy bodies // Semin. Neurol. 2014. Vol. 34. № 2. P. 182–188.
7. Ramanan V.K., Saykin A.J. Pathways to neurodegeneration: mechanistic insights from GWAS in Alzheimer’s disease, Parkinson’s disease, and related disorders // Am. J. Neurodegener. Dis. 2013. Vol. 2. № 3. P. 145–175.
8. Russ T.C., Morling J.R. Cholinesterase inhibitors for mild cognitive impairment // Cochrane Database Syst. Rev. 2012. Vol. 9. CD009132.
9. Wang H.F., Yu J.T., Tang S.W. et al. Efficacy and safety of cholinesterase inhibitors and memantine in cognitive impairment in Parkinson’s disease, Parkinson’s disease dementia, and dementia with Lewy bodies: systematic review with meta-analysis and trial sequential analysis // J. Neurol. Neurosurg. Psychiatry. 2014. May 14.
Psychiatry. 2014. May 14.
10. McKeith I., Mintzer J., Aarsland D. et al. Dementia with Lewy bodies // Lancet Neurol. 2004. Vol. 3. № 1. P. 19–28.
11. Craig D., Birks J. Galantamine for vascular cognitive impairment // Cochrane Database Syst. Rev. 2006. CD004746.
12. Craig D., Birks J. Rivastigmine for vascular cognitive impairment // Cochrane Database Syst. Rev. 2005. CD004744.
13. Hugo, Mendez M.F., Shapira J.S., McMurtray A. et al. Preliminary findings: behavioral worsening on donepezil in patients with frontotemporal dementia // Am. J. Geriatr. Psychiatry. 2007. Vol. 15. № 1. P. 84–87.
14. Press D., Alexander M. Cholinesterase inhibitors in the treatment of dementia. In: Basow DS, editor. UpToDate. Waltham (MA): UpToDate. Available at: http://www. uptodate.com/contents/cholinesterase-inhibitors-in-the-treatment-of-dementi.2013
15. Pariente A., Sanctussy D.J., Miremont-Salame G. et al. //Factors associated with serious adverse reactions to cholinesterase inhibitors: a study of spontaneous reporting // CNS Drugs. 2010. Vol. 24. № 1. P. 55–63.
2010. Vol. 24. № 1. P. 55–63.
16. Robinson D., Keating G. Memantine: a review of its use in Alzheimer’s disease // Drugs. 2006. Vol. 66. № 11. P. 1515–1534.
17. McKeage K. Memantine: a review of its use in moderate to severe Alzheimer’s disease // CNS Drugs. 2009. Vol. 23. P. 881–897.
18. McShane R., Areosa S.A., Minakaran N. Memantine for dementia // Cochrane Database Syst. Rev. 2006. CD003154.
19. Huey E.D., Putnam K.T., Grafman J. A systematic review of neurotransmitter deficits and treatments in frontotemporal dementia // Neurol. 2006. Vol. 66. № 1. P. 17–22.
20. Flicker L., Grimley E.J. Piracetam for dementia or cognitive impairment // Cochrane Database Syst. Rev. 2004. CD001011.
21. Jansen S.L., Forbes D., Duncan V. et al. Melatonin for the treatment of dementia // Cochrane Database Syst. Rev. 2006.CD003802.
22. Malouf R., Grimley E.J. Vitamin B6 for cognition // Cochrane Database Syst. Rev. 2003. CD004393.
23. Malouf R., Areosa S.A. Vitamin B12 for cognition // Cochrane Database Syst. Rev. 2003. CD004394.
Malouf R., Areosa S.A. Vitamin B12 for cognition // Cochrane Database Syst. Rev. 2003. CD004394.
24. Malouf R., Grimley E.J. Folic acid with or without vitamin B12 for the prevention and treatment of healthy elderly and demented people // Cochrane Database Syst. Rev. 2008. CD004514.
25. Preventing Alzheimer’s Disease and Cognitive Decline. NIH State-of-the-Science Conference April 26–28, 2010. Bethesda, Maryland Final Panel Statement.
26. FDA Drug Safety Communication: Important safety label changes to cholesterol-lowering statin drugs http://www.fda.gov/Drugs/DrugSafety/ucm293101.htm
27. Richardson K., Schoen M., French B. et al. Statins and cognitive function: a systematic review //Ann. Intern. Med. 2013. Vol. 159. № 10. P. 688–697.
28. Alzheimer?s Association. Alzheimer’s Association Trial Match . http://www.alz.org/research/clinical_trials/find_clinical_trials_trialmatch.asp.
29. Traini E., Bramanti V., Amenta F. Choline alphoscerate (alpha-glyceryl-phosphoryl-choline) an old choline-containing phospholipid with a still interesting profile as cognition enhancing agent // Curr. Alzheimer Res. 2013.Vol. 10. № 10. P.1070–1079.
Alzheimer Res. 2013.Vol. 10. № 10. P.1070–1079.
30. Scapicchio P.L. Revisiting choline alphoscerate profile: a new, perspective, role in dementia? // Int. J. Neurosci. 2013. Vol.123. № 7. P. 444–449.
31. Tayebati S.K., Amenta F. Choline-containing phospholipids: relevance to brain functional pathways // Clin. Chem. Lab. Med. 2013. Vol. 51. № 3. P. 513–521.
32. Parnetti L., Mignini F., Tomassoni D. et al. Cholinergic precursors in the treatment of cognitive impairment of vascular origin: ineffective approaches or need for re-evaluation? // J. Neurol. Sci. 2007. Vol. 257. P. 264–269.
33. Barbagallo Sangiorgi G., Barbagallo M., Giordano M. et al. Alpha-glycerophosphocholine in the mental recovery of cerebral ischemic attacks. An Italian multicenter clinical trial // Ann. NY Acad Sci. 1994. Vol. 717. P. 253–269.
34. Стулин И.Д., Мусин Р.С., Солонский Д.С. Эффективность холина альфосцерата (церетон) у больных с хронической ишемией мозга // Журн. неврол и психиатр. им. С.С. Корсакова. 2009. № 7. С. 87–89.
неврол и психиатр. им. С.С. Корсакова. 2009. № 7. С. 87–89.
35. Исмагилов М.Ф., Василевская О.В., Гайфутдинов Р.Т. и др. Оценка эффективности церетона в остром периоде ишемического инсульта // Журн. неврол. и психиатр. им. С.С. Корсакова. 2009. № 3. С. 35–36.
36. Буйлова Т.В., Глотова М.Е., Халак М.Е., Вашкевич В.В. Опыт применения Церетона в процессе реабилитации больных с геморрагическим инсультом // Журн. неврол. и психиатр. им. С.С. Корсакова. 2009. № 5. Вып. 2. С. 58–62.
37. Камчатнов П.Р., Абусуева Б.А., Евзельман М.А.и др. Эффективность церетона при остром ишемическом инсульте (результаты исследования СОЛНЦЕ) // Журн. неврол. и психиатр. им. С.С. Корсакова. 2012. № 3. Вып. 2. С. 10–14.
38. Левин О.С., Батукаева Л.А., Аникина М.А., Юнищенко Н.А. Эффективность и безопасность холина альфосцерата (церетона) у пациентов с болезнью Паркинсона с когнитивными нарушениями // Журн. неврол. и психиатр. им. С. С. Корсакова. 2009. Т. 109. № 11. С. 42–46.
39. Mandat T., Wilk A., Manowiec R. et al. Preliminary evaluation of risk and effectiveness of early choline alphoscerate treatment in craniocerebral injury // Neurol. Neurochir. Pol. 2003. Vol. 37. № 6. P. 1231–1238.
40. Parnetti L., Abate G., Bartorelli L. et al. Multicentre study of l-alpha-glyceryl-phosphorylcholine vs. ST200 among patients with probable senile dementia of Alzheimer’s type // Drugs Aging. 1993. Vol. 3. Р.159–164.
41. Amenta F., Carotenuto A., Fasanaro A.M. et al. The ASCOMALVA trial: association between the cholinesterase inhibitor donepezil and the cholinergic precursor choline alphoscerate in Alzheimer’s disease with cerebrovascular injury: interim results // J. Neurol. Sci. 2012. Vol. 322. P. 96–101.
42. Шмырев В.И., Крыжановский С.М. Комбинированная терапия ишемического инсульта холина альфосцератом и этилметилгидроксипиридина сукцинатом // Фарматека. 2013. № 9. С. 79–83.
43. Серегин В.И. Применение глиатилина и мексидола в интенсивной терапии тяжелого острого ишемического инсульта // Фарматека.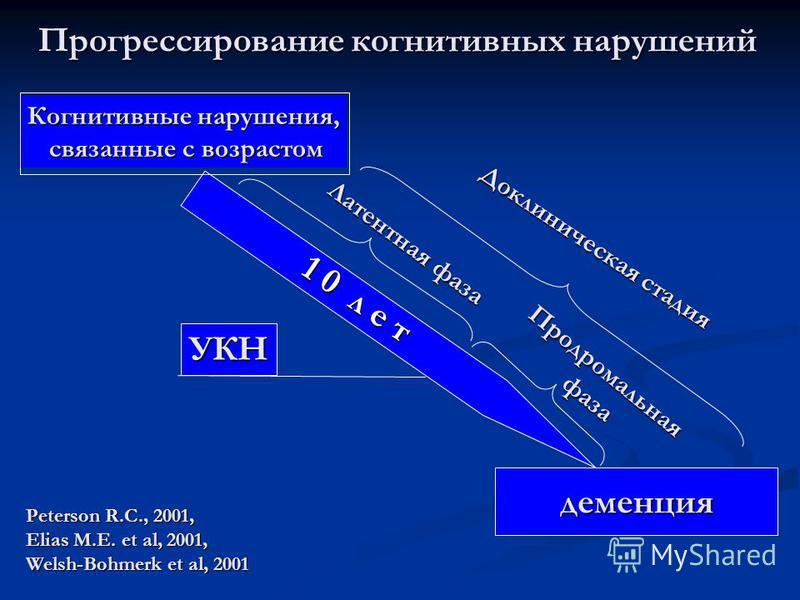 2006. № 5.
2006. № 5.
44. Меньщикова Е.Б. и др. Окислительный стресс: патологические состояния и заболевания. Новосибирск: Изд-во АРТА, 2008.
45. Бадалян О.Л., Савенков А.А., Таншева К.Х., Тертышник О.Ю. Возможности применения нейрокса в комплексном лечении хронической ишемии мозга // РМЖ. 2010. Т. 18. № 8. С. 455–459.
46. Бадалян О.Л., Погосян А.С., Савенков А.А. и др. Применение препаратов Нейрокс и Церетон в комплексном лечении цереброваскулярных заболеваний // РМЖ. 2011. № 12. С. 764–767.
47. Никифоров А.С. и др. Клиническая неврология. М.: Медицина, 2002. 704 с.
.
Когнитивная дисфункция
Высшие мозговые или иначе когнитивные функции являются наиболее сложными функциями головного мозга, с помощью которых осуществляется процесс рационального познания мира и обеспечивается целенаправленное взаимодействие с ним.
К таким функциям относятся:
- память,
- праксис
- гнозис- способности программировать и осуществлять сложные действия,
- речь
- исполнительные функции.

Можно рассмотреть, как мы применяем их в повседневной жизни на простом примере. Стоит взять в зону восприятия любой предмет как тут же наш мозг включает весь спектр своих возможностей для его анализа и составления необходимой программы действий.
Так, например, мы видим объект яйцо — мы обращаем внимание на его характеристики, в частности,на то, что объект круглый, твердый, белый, мы воспринимаем и идентифицируем его как яйцо. Память подсказывает, что оно съедобно, мышление подсказывает, что яйцо можно разбить. Мы можем благодаря праксисуприготовить его, а с помощью речи сообщить об этом окружающим.
Видите, сколько различных функций наш мозг применил для выполнения такой простой, казалось бы, задачи. Одним словом, даже самые элементарные на первый взгляд моменты нашей жизни требуют высшей мозговой активности. Потеря даже одной из когнитивных функций грозит значительным снижением качества жизни и возможности самообслуживания, не говоря об утрате каких-то более сложных навыков, таких как, например, профессиональные.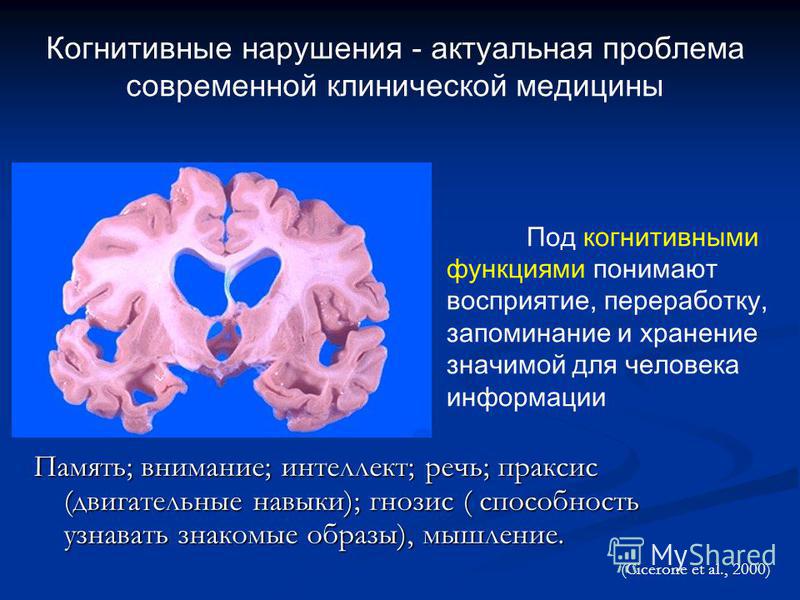
Полная или частичная утрата когнитивных функций называется когнитивный дефицитом, степень его может варьироваться от легких малозаметных нарушений до глубокого слабоумия с полным распадом личности.
В спектре когнитивных нарушений самым легким вариантом является легкий когнитивный дефицит, его выделяет в отдельную категорию научная школа Академика Яхно. Эти расстройства носят преимущественно нейродинамический характер. Страдают такие характеристики как:
- скорость обработки информации,
- способность быстро переключаться с одного вида деятельности на другой̆,
- оперативная память,
- концентрация внимания.
Данный вид нарушений является наиболее доброкачественным, может встречаться в виде легко снижения когниции у пожилых в рамках естественного процесса старения. У молодых людей эти нарушения так же могут встречаться по ряду причин, однако легкий когнитивный дефицит интересует нас в меньшей степени, так как он не представляет серьезной угрозы и часто может уходить самостоятельно.
Надо отметить, что данный вид нарушений выделяется преимущественно в российской научной школе, в западной литературе ему уделяется меньше внимания. Наибольший интерес представляет умеренный когнитивный дефицит признаваемый как серьезная проблема и западными и российскими неврологами.
Синдром умеренных когнитивных нарушений или mildcognitiveimpairment — когнитивные нарушения, отчетливо выходящие за рамки возрастной нормы, но не достигающие масштаба деменции. Значимый интерес для докторов он представляет как самостоятельное состояние, довольно ощутимо влияющее на качество жизни и как неблагоприятный прогностический фактор — до 80% пациентов у которых выявляется УКР в течение 5 лет имеетсязначительное прогрессирование состояние до деменции. Иными словами у большинства пациентов УКР не стоит на месте и переходит в деменцию. Поэтому важно выявить это состояние и начать его своевременное лечение, чтобы затормозить этот процесс.
Что такое деменция?
Деменция — это наиболее тяжёлые когнитивные расстройства, которые приводят к дезадаптации пациента в профессиональной̆ и социально-бытовой̆ сфере.
Иными словами, при деменции теряется способность нормально взаимодействовать с окружающим нас миром, будь то бытовые простые задачи или сложные профессиональные навыки.
Деменции бывают разных видов и происхождений:
- Деменция Альцгеймеровского типа,
- Сосудистая деменция,
- Деменция с тельцами Леви,
- лобно-височная деменция
- и так далее.
Всех их объединяет общий признак — драматическое снижение когнитивных функций,а различаются по особенностям нарушений, возрасту начала заболевания и скорости прогрессирования.
Так Болезнь Альцгеймера может быть сенильного типа (старческого) и пресенильного, т.е. с ранним началом. Однако после клинического дебюта заболевания скорость распада когнитивных функций может быть достаточно велика.Именно поэтому очень важно выявить расстройства на том этапе, когда они не достигли стадии деменции и их лавинообразный ход можно задержать.
Нужно отметить, что причины когнитивных расстройств в молодом возрасте отличаются от таковых в пожилом.
У молодых причинами зачастую могут быть патология перинатального периода или периода рождения. У пожилых причиной снижения может являться легкое снижение памяти и прочих функций в рамках нормального хода старения, однако степень этих изменений в таком случае очень незначительна.
Помимо упомянутых причин, снижение когнитивных функций может наблюдаться в результате:
- Черепно-мозговых травм,
- Сосудистых заболеваний,
- Демиелинизирующих заболеваний,
- Инфекционных заболеваний,
- Нарушений метаболизма и работы гормональной системы,
- Опухолей,
- Нейродегенеративных заболеваний ЦНС.
Нужно помнить, что применение различных психоактивных средств может влиять на когнитивные функции. У пожилых обязательно нужно учитывать применение лекарственных средств, причем не только неврологического профиля, так для довольно большого числа препаратов описан эффект негативного влияния на концентрацию внимания, память и прочие Высшие психические функции. Наконец, важным фактором, способным нарушать память и внимание, является эмоциональный фон и уровень тревожности, который корректно можно оценить лишь со стороны при помощи клинического интервьюирования и применения специальных шкал.
Для определения наличия когнитивных расстройств основными методиками является клиническое интервьюирование и применение тестов. Вспомогательными методиками являются электрофизиологический методы, такие как «вызванные когнитивные потенциалы».
Способы выявления причины имеющихся расстройств крайне разнообразны, к ним относятся:
- методы лабораторной диагностики, определяющие отклонения в крови и прочих биологически материалах.
- методы лучевой диагностики и МРТ, выявляющие структурные изменения в строении органов,
- методы функциональной диагностики, позволяющие оценить функцию того или иного отдела нашего организма.
Однако, при таком разнообразии инструментов, осью, вокруг которой собираются жалобы, объективные данные, результаты обследований — является контакт врача и пациента, потому именно доктор должен определить показания к нужным видам обследования, поставить диагноз а затем назначить лечение.
Легкое когнитивное расстройство (ЛКР)
Марк Спенсер, 72 года, Детройт, начинает забывать важные вещи. Его угнетает необходимость принимать решения и ему трудно планировать повседневные домашние дела. Иногда он теряется в хорошо знакомых местах. Зачастую ему тяжело поддерживать разговор, а также спокойно и обоснованно размышлять о каких-либо проблемах. Его лучший друг Джим и его жена Мира заметили все эти изменения. Марку с каждым разом всё хуже и хуже, но он пока ещё может вести нормальную и независимую жизнь. Однако его всё больше тревожит его психическое здоровье и, в конце концов, он впал в депрессию.
Марк может испытывать симптомы лёгкого когнитивного расстройства (ЛКР). Лёгкое когнитивное расстройство — это когнитивное нарушение, которое, несмотря на то, что не влияет на способность вести самостоятельный образ жизни, является более серьёзным заболеванием, чем связанное с естественным старением снижение когнитивных функций. Симптоматика ЛКР может стабилизироваться и в течение длительного времени оставаться неизменной. Тем не менее высока вероятность того, что вследствие лёгкого когнитивного расстройства может развиться болезнь Альцгеймера. В ряде случаев наблюдается улучшение состояния больных ЛКР. Причины этого расстройства изучены недостаточно хорошо, однако анализ результатов аутопсии показал, что биологические изменения мозга страдающих ЛКР людей схожи с теми, что наблюдаются при болезни Альцгеймера. В частности, речь идёт об образовании бляшек и нейрофибриллярных клубков, телец Леви и уменьшении объема гиппокампа. Исследования выявили связь между лёгким когнитивным расстройством и лёгкой апоплексией мозга, снижением кровотока и утилизации глюкозы. Такие проблемы, как высокий уровень холестерина, диабет, высокое кровяное давление, курение, недостаток физической активности и отсутствие социального взаимодействия также были связаны с ЛКР. Основным фактором риска развития лёгкого когнитивного расстройства является преклонный возраст. Другим фактором риска является наличие гена под названием АпоЕ-е4. Не существует никакого официально одобренного лекарства для лечения ЛКР. Тем не менее в ряде случаев врачи и специалисты могут назначать препараты, используемые для лечения болезни Альцгеймера.
К счастью, исследования в области профилактики и стабилизации ЛКР дали важные результаты. В CogniFit («КогниФит») была разработана специальная программа тренировок для лиц старше 55 лет. Это программа является вспомогательным средством для предупреждения раннего ухудшения. Благодаря многочисленным исследованиям мы подтвердили эффективность данного тренинга для наших пользователей. Кроме того, одна влиятельная статья, опубликованная недавно в журнале Nature, описывает опыты, свидетельствующие о том, что физические упражнения, тренировка мозга, социальные отношения и здоровая диета способствуют снижению риска развития лёгкого когнитивного расстройства или деменции. В частности, автор анализирует результаты научных исследований в области тренировки мозга.
«Тренировка мозга: канадские исследователи использовали функциональную магнитно-резонансную томографию для анализа активности мозга 15 людей с лёгким когнитивным расстройством. После однонедельной программы, разработанной для обучения участников новым стратегиям при работе с памятью, на тестовых сессиях у участников активировались несколько дополнительных областей мозга. Таким образом, удалось выяснить, что неповреждённые участки мозга могут взять на себя функции поражённых областей. Участники также показали более высокие результаты тестов. Многие исследования в области когнитивной стимуляции и деменции используют компьютерные игры, специально разработанные для улучшения умственных способностей. Коррекция с помощью тренировки мозга демонстрирует положительные результаты у людей с болезнью Альцгеймера и связанных с ней заболеваний».
Очень важно поддерживать мозг в здоровом состоянии, чтобы как можно дольше задерживать ухудшение его функций. Поскольку люди, страдающие лёгким когнитивным расстройством, больше предрасположены к развитию деменции или болезни Альцгеймера, необходимо принимать меры для сохранения здоровья мозга.
Когнитивные нарушения при старении: пути решения проблемы
|
О наличии когнитивных расстройств говорят при нарушении наиболее сложных познавательных функций головного мозга, которые отвечают за процесс познания мира и взаимодействия с ним. Актуальность темы неврологического форума обусловлена значительной распространенностью этой патологии в современном мире. Анализ демографических тенденций свидетельствует, что возрастная структура населения развитых стран в последнее время изменилась в сторону увеличения количества лиц пожилого и старческого возраста.
Глобальное постарение населения непосредственно сопряжено с проблемой качества жизни у лиц старшего возраста. Именно в пожилом возрасте наиболее часто диагностируют сосудистые и первично-дегенеративные заболевания головного мозга, приводящие к когнитивным расстройствам различной степени тяжести: от умеренных до выраженных. Различные аспекты этой проблемы вызывают огромный интерес исследователей в развитых странах мира. Приоритетными являются направления ранней диагностики заболевания, поиска эффективных путей лечения, а также решения социальных и психологических проблем, связанных с этим недугом. Для Украины эти направления имеют большое значение в связи с прогнозируемым постарением населения.
В рамках научного форума освещались вопросы, касающиеся когнитивных расстройств при паркинсонизме, эпилепсии, дисциркуляторной энцефалопатии, клинических особенностей деменции с тельцами Леви, смешанной и сосудистой деменции. Часть докладов была посвящена умеренным когнитивным нарушениям (УКН).
В первый день конференции доклад «Когнитивные нарушения при неврологических заболеваниях» руководителя клиники неврологии Московской медицинской академии, академика Российской академии медицинских наук, профессора Николая Яхно предварил выступления его коллег, посвященные более узким аспектам проблемы. В докладе были перечислены основные неврологические заболевания, сопровождающиеся когнитивными расстройствами (КР), дана классификация когнитивных нарушений, определены основные методы обследования больных.
|
Докладчик уделил внимание факторам, влияющим на развитие заболевания КР. В вопросе ведения больных с КР был сделан акцент на раннем выявлении симптомов заболевания (первый врач, который должен ставить вопрос о наличии КР у пациента — участковый терапевт). Российский гость особенно подчеркнул медико-социальную значимость когнитивных расстройств, поскольку при этой патологии снижается работоспособность, уменьшается продолжительность жизни, качественно и количественно ограничиваются трудовые ресурсы общества, увеличиваются затраты государства на исследовательские работы и помощь тяжелобольным.
Интересный и содержательный доклад «Сосудистая деменция» представила главный невролог МОЗ Украины, руководитель отделения сосудистой патологии головного мозга Института неврологии, психиатрии и наркологии АМН Украины, профессор Тамара Мищенко. Сосудистая деменция (СД) или слабоумие — одно из заболеваний, в которое трансформируются когнитивные расстройства. Практикующих врачей настораживает, что за последнее время деменция помолодела.
Однако данные анализа заболеваемости за последние 5 лет свидетельствуют, что количество случаев деменции не увеличилось на фоне роста сосудистых заболеваний. Причинами таких не отображающих реальную ситуацию статистических результатов могут быть: невыявление СД как заболевания, постановка другого диагноза даже при выявлении симптомов, проблемы шифровки при статистике. Правомерно говорить о необходимости проведения эпидемиологических исследований у нас в стране с целью установления истинной картины заболеваемости.
Отвечая на вопросы корреспондента «Еженедельника АПТЕКА», профессор Мищенко обратила особое внимание на то, что сосудистая деменция — это социальная проблема. У нас в стране нет специальных учреждений для этой категории пациентов. Вся тяжесть ухода за таким больным ложится, как правило, на его близких, что нередко ведет к ухудшению материально-финансового положения семьи. Тамара Сергеевна отметила, что один из факторов роста заболеваемости деменцией — слабая информированность населения о превентивных мерах в отношении этого заболевания.
По мнению главного невролога МОЗ Украины стоит начать с наглядной агитации в поликлинических отделениях. Например, одним из факторов, способствующих возникновению когнитивных нарушений, является нелеченая артериальная гипертензия. Даже с помощью мер, не требующих значительных финансовых затрат, можно донести до пациентов мысль о важности своевременной гипотензивной терапии.
«Необходимо, чтобы люди задумывались о профилактике тяжелой патологии заранее, — отметила профессор. — Кроме того, остро стоит вопрос о своевременном выявлении симптомов заболевания. Как правило, диагноз ставится на этапе крайне тяжелых нарушений, когда возможность помочь больному невелика. Начинать борьбу с болезнью нужно значительно раньше, то есть диагностировать и лечить менее выраженные расстройства. При таком условии можно существенно повлиять на ход процесса».
«Синдром умеренных когнитивных нарушений» — с таким докладом выступила заведующая кафедрой нервных болезней и нейрохирургии факультета последипломного образования Днепропетровской государственной медицинской академии МОЗ Украины, профессор Людмила Дзяк. Синдрому УКН, который рассматривается как промежуточное состояние между возрастными изменениями центральной нервной системы и клинически выраженной деменцией, в последние годы уделяется большое внимание. Ранняя диагностика характера и степени нарушения высших психических функций позволяет своевременно использовать адекватные профилактические мероприятия и современные методы лечения.
Профессор обратила внимание на опасность УКН в плане частого прогрессирования этого состояния. Однако первые симптомы (ухудшение памяти, головная боль и др.) порой не вызывают настороженности ни у врача, ни у пациента. Происходит это в связи с устоявшимся мнением, что указанные изменения — норма для пожилых людей. Цель диагностики и лечения УКН в пожилом возрасте — снижение риска и скорости развития деменции, предоставление возможности пожилым пациентам вести привычный активный образ жизни.
В докладе были озвучены данные исследований, проведенных в Днепропетровске. В частности, приводились результаты изучения изменений концентрации белковых фракций в сыворотке крови больных на самых ранних стадиях заболевания.
Обозначая дополнительные маркеры диагностики УКН (нейроморфологические изменения), Л. Дзяк также подчеркнула, что диагностировать необходимо на более ранних стадиях, до появления таких изменений.
Говоря о методах лечения когнитивных расстройств, докладчики обращали внимание на то, что сегодня существуют препараты, своевременное и грамотное применение которых дает длительный положительный эффект. Благодаря их действию замедляется прогрессирование заболевания и улучшаются важные когнитивные функции.
Достойное место среди таких лекарственных средств занимает ТАНАКАН — эффективный церебропротектор, представляющий собой стандартизованный экстракт из натурального сырья (Egb 761). 13 лет назад компания «Ипсен» представила этот препарат на украинском фармацевтическом рынке и с тех пор его успешно применяют отечественные неврологи в лечении цереброваскулярных, микроциркуляторных и нейросенсорных нарушений. В отношении ТАНАКАНА накоплен большой клинический опыт, подтверждающий его эффективность. О хороших результатах лечения препаратом докладывали на конференции не только отечественные, но и российские ученые.
Профессора Людмила Дзяк и Тамара Мищенко особенно подчеркивали еще одно качество ТАНАКАНА — хорошую переносимость. Нежелательные явления при его применении составляют менее 1%. Минимум побочных эффектов — крайне важное свойство, учитывая возраст пациентов. Ведь кроме когнитивных нарушений у них, как правило, выявляют ряд других заболеваний. И, помогая, нужно стараться не навредить. Таким образом, ТАНАКАН — перспективный препарат с большой доказательной базой и широкими возможностями клинического применения.
Следует отметить информативность докладов всех участников конференции. Сообщения ученых были восприняты присутствующими с большим интересом, так как содержали сведения, необходимые для повседневной практической деятельности.
О значении подобных научных форумов нашему корреспонденту рассказала член оргкомитета конференции, руководитель отделения возрастной физиологии и патологии нервной системы Института геронтологии АМН Украины, доктор медицинских наук Наталья Бачинская:
— Даже сам факт озвучивания проблемы на таком высоком профессиональном уровне и привлечение к ней внимания — значительный шаг в борьбе с распространением когнитивных нарушений среди лиц пожилого и старческого возраста, конечной целью которой является улучшение качества жизни этой категории населения и снижение затрат на лечение таких больных.
Специалисты, побывавшие на форуме, получили ценную информацию, что называется, из первых уст. Конференции и семинары, посвященные когнитивным нарушениям, необходимо проводить каждый год. Это прекрасная возможность для неврологов всех уровней узнать о результатах исследований различных научных центров, о новых препаратах и поделиться с коллегами собственным опытом.
Высокий уровень конференции, который отмечали ее участники, удалось обеспечить благодаря поддержке многочисленных спонсоров. Ключевая помощь в привлечении международного участия оказана генеральным спонсором форума — компанией «Ипсен». Благодаря сотрудничеству компании с оргкомитетом на конференцию пригласили известных отечественных и российских ученых в области неврологии.
|
Фармацевтическая компания «Ипсен» успешно работает на украинском рынке 15 лет. В 2005 г. компания уже выступала в качестве официального спонсора научного семинара в Украине по проблеме когнитивных расстройств. Естественно, столь пристальное внимание к подобным форумам — повод задать несколько вопросов главе представительства компании в Украине Виктору Шафранскому.
— Виктор Викторович, чем можно объяснить интерес «Ипсен» к научным форумам, посвященным медицинским проблемам?
— С 2004 г. представительство компании уделяет значительное внимание этичному продвижению своих продуктов. Немаловажную роль в этом играет участие в серьезных профильных научных мероприятиях. Наш интерес всегда связан не только с их темой, но и с направленностью, с концепцией прежде всего.
В последние 2–3 года в деятельности представительства компании отмечается усиление социальной активности. Мы стремимся строить партнерские отношения с различными организациями в сфере здравоохранения Украины. Подтверждение тому — наше постоянное участие в различных образовательных, благотворительных и социально ориентированных проектах.
Вопросы, рассматриваемые на таких мероприятиях, затрагивают интересы самых незащищенных групп населения. Например, эта конференция была посвящена проблемам людей пожилого и старческого возраста. Еще одна группа, нуждающаяся в повышенной заботе и внимании — это дети. А дети-инвалиды еще чаще ждут помощи и участия. В качестве оказания благотворительной помощи мы передавали для лечения детей с ДЦП многообещающий, эффективный препарат — ДИСПОРТ.
Компания продолжает работать в этом направлении, организуя научные семинары по проблеме лечения ДЦП в нашей стране.
— Наши читатели уже знают, что продукты, внедряемые «Ипсен», — инновационные препараты мирового класса.
— Да, это так. Наша компания разрабатывает и производит лекарственные средства, применяемые в трех областях медицины: онкология, эндокринология и неврология. Многие препараты впервые появились на украинском рынке благодаря деятельности компании. Мы с полной уверенностью можем говорить, что лекарственные средства, разработанные и внедряемые «Ипсен», нужны людям. Они эффективны, безопасны, удобны в применении. Наше стремление довести информацию о них до врачей и пациентов продиктовано не только и не столько условиями бизнес-проектов. Есть желание помочь больным, дать им возможность вернуться к полноценной жизни.
Подводя итоги научной конференции, следует отметить, что во время ее проведения был обозначен ряд важных задач, стоящих сегодня перед украинской медицинской общественностью. Среди них — повышение информированности врачей и общества в целом по проблеме когнитивных нарушений при старении, необходимость систематического обучения специалистов методам ранней диагностики цереброваскулярной недостаточности, своевременное применение новых эффективных лекарственных средств на начальных стадиях заболевания и пр.
Будем надеяться, пути решения столь актуальных проблем найдут применение в практической деятельности врачей, помогая им улучшать здоровье и качество жизни пациентов. o
Наталья Очеретяная,
фото Игоря Кривинского
и предоставленное представительством компании «Ипсен» в Украине
Когнитивные нарушения — обзор
Когнитивные функции как предиктор реакции на фармакологическое и психотерапевтическое лечение
Когнитивные нарушения были связаны не только с обострением психических симптомов, но и с ухудшением реакции на фармакологическое лечение при психических расстройствах позднего возраста (Mohlman & Горман, 2005; Снид и др., 2007; Снид и др., 2010). Например, исполнительная дисфункция была связана с более слабым фармакологическим ответом на лечение у лиц с расстройствами позднего возраста, хотя отчасти это может быть связано с более низким соблюдением режима лечения (Cristancho et al., 2018; Manning et al., 2015). Однако люди с более слабой управляющей функцией могут также получить больше пользы, чем люди с более высокой управляющей функцией, от когнитивных вмешательств, таких как когнитивно-поведенческая терапия.
Учитывая потенциальную двунаправленную связь между когнитивной дисфункцией и психиатрическими симптомами, считается, что лечение одного влияет на другое. Есть некоторые свидетельства того, что фармакологические методы лечения, направленные на когнитивные функции, снижают психические расстройства и, наоборот, у лиц с расстройствами позднего возраста.Повышение дофаминергической активности при биполярном расстройстве в позднем возрасте привело к умеренным улучшениям когнитивных функций, особенно в скорости обработки данных и рабочей памяти (Aprahamian et al., 2013). Кроме того, арипипразол, назначаемый при устойчивой к лечению депрессии в позднем возрасте, был связан с улучшенной способностью менять установки, а также с более высокими показателями ремиссии по сравнению с плацебо (Kaneriya et al., 2016; Lenze et al., 2015). Было обнаружено, что селективные ингибиторы обратного захвата серотонина (СИОЗС) в сочетании с когнитивно-поведенческой терапией снижают пиковые уровни кортизола у пациентов с ГТР в позднем возрасте (Rosnick et al., 2016). В свете описанной выше гипотезы кумулятивного стресса эти результаты могут иметь значение для снижения стресса и улучшения когнитивных функций у этих людей.
Однако другие фармакологические методы лечения расстройств позднего возраста в целом показали либо умеренные, либо незначительные эффекты в улучшении или замедлении ухудшения когнитивной функции. Трициклические антидепрессанты не были связаны с когнитивными улучшениями у пациентов с депрессией в позднем возрасте (Alexopoulos, Katz, Reynolds, Carpenter, & Docherty, 2001; Nebes et al., 2003). Результаты были неоднозначными относительно эффективности СИОЗС в улучшении когнитивной функции при депрессии позднего возраста. Было обнаружено, что пароксетин не улучшает когнитивную дисфункцию у пожилых людей с депрессией (Nebes et al., 2003), в то время как сертралин умеренно улучшает один показатель внимания и исполнительную функцию, но только у лиц, отвечающих на лечение (Devanand et al., 2003). Антидепрессанты донепезил и сертралин оказались неэффективными для предотвращения когнитивных нарушений у здоровых пожилых людей (Munro et al., 2012) и в улучшении когнитивных функций у пациентов с депрессией и БА (Reynolds et al., 2011). У пожилых людей с БА и депрессией сертралин не улучшал психиатрические симптомы (Rosenberg et al., 2010). Точно так же некоторые исследования показали, что когнитивная реабилитационная терапия дала ограниченные улучшения для пожилых пациентов с шизофренией (Golas et al., 2015; Kontis, Huddy, Reeder, Landau, & Wykes, 2013). Однако в других исследованиях были обнаружены положительные эффекты когнитивной реабилитационной терапии у пожилых людей с психическими расстройствами; например, одно исследование показало уменьшение положительных симптомов и менее резкое снижение повседневной активности у пациентов с гериатрической шизофренией, получавших когнитивную реабилитационную терапию (Thomas, Puig, & Twamley, 2017).
Поскольку фармакологические методы лечения менее эффективны у пациентов с более высоким уровнем когнитивной дисфункции, подход к лечению, направленный на улучшение когнитивных нарушений, может оказаться полезным для уменьшения симптомов психических расстройств в пожилом возрасте. Плохой когнитивный контроль приводит к снижению исполнительной функции и регуляции эмоций, а также к обострению психиатрических симптомов (Spinhoven et al., 2017). Распространенной причиной отсутствия ответа на антидепрессанты при расстройствах позднего возраста являются более серьезные когнитивные нарушения.Было обнаружено, что у пожилых людей, которые не реагируют на фармакологическое лечение, нарушены исполнительные функции планирования и организации (Pimontel et al., 2015). Таким образом, усиление лечения с акцентом на эти области может быть более эффективным подходом к лечению у людей с депрессией в позднем возрасте.
(PDF) Травма головного мозга у очень недоношенных детей, нейросенсорные и когнитивные нарушения в детстве: Когортное исследование EPIPAGE
на протяжении всей жизни зависит от социальной среды и социально-экономического статуса [12,27].
Это исследование также подтверждает, что тяжелые (расстройства аутистического спектра)
и умеренные психические расстройства (дефицит внимания / гиперактивность
и поведенческие расстройства), а также эпилепсия встречаются чаще
, чем в общей популяции, и обратно коррелируют с
.гестационный возраст при рождении [28,29]. Поздно мигрирующие ГАМКергические нейроны
представляют собой временную популяцию нейронов в подкорковом белом веществе
недоношенных детей, а уменьшение
ГАМКергических нейронов (которые опосредуют ингибирование потенциала действия
у взрослых), зарегистрированное в центральном белом веществе. из
недоношенныхдетей с ПВЛ предполагает тормозной дефицит в младенчестве [9].
Тем не менее, отсутствие очевидной связи между психиатрическими
расстройствами и неонатальными повреждениями головного мозга еще раз указывает на нарушение
развития мозга и связи в популяции недоношенных. При аутизме
, трактография с диффузионно-тензорной визуализацией показала различия в анатомии лобных путей белого вещества при
аутизме, а фкМРТ [30,31] показала недостаточную связанность.
В заключение мы показали, что у младенцев, рожденных VPT,
высокий риск развития когнитивных и моторных нарушений, риск
обратно коррелирован с гестационным возрастом.Сильная связь
между двигательными нарушениями и более поздней когнитивной дисфункцией
подтверждает гипотезы об общем происхождении этих трудностей
и / или влиянии моторного развития на последующие
когнитивные навыки. Срочно необходимо улучшить нашу способность защищать развивающийся мозг
, поскольку у нас нет окончательной стратегии
для предотвращения долгосрочных неврологических последствий
, которые могут возникнуть у этих младенцев.Только одно соединение,
сульфата магния в низкой дозе, вводимое женщинам с риском преждевременных родов, продемонстрировало некоторые положительные эффекты в профилактике церебрального паралича
у недоношенных людей [32]. Неонатальный уход за развитием и
вмешательств после выписки у детей с VPT должны быть оценены
в долгосрочной перспективе, чтобы определить те из них, которые наиболее эффективны для улучшения
когнитивного и моторного развития.
Благодарности
Мы благодарим всех родителей и детей, которые участвовали в этом исследовании
на протяжении многих лет.Мы благодарим Джо Энн Кан за помощь в редактировании рукописи
и всех членов группы EPIPAGE. INSERM U149: B
Larroque (национальный координатор), PY Ancel, B Blondel, G Bre´art, M Dehan,
M Garel, M Kaminski, F Maillard, C du Mazaubrun, P Missy, F Sehili, K
Супернант, Л. Маршан. Эльзас: М. Дюран, Дж. Матис, Дж. Мессер, А. Трейссер
(Госпиталь де Отепьер, Страсбург). Franche-Comte´: A Burguet, L
Abraham-Lerat, A Menget, P Roth, JP Schaal, G Thiriez (CHU St
Jacques, Besanc¸on), Верхняя Нормандия: C Le´veˆque, S Marret, L Marpeau
(Госпиталь Шарля Николя, Руан).Лангедок-Руссильон: P Boulot, G
Cambonie J-C Picaud (Госпиталь Арно де Вильнев, Монпелье), A-M
Donadio, B Lede´sert (ORS Montpellier). Лотарингия: М. Андре, Дж. Фрессон,
Дж. М. Хаскоет (Maternite´Re´gionale, Нэнси). Юг-Пиренеи: C Arnaud, H
Grandjean (INSERM U558, Toulouse), M Rolland (Hoˆpital des Enfants,
Toulouse). Нор-Па-де-Кале: A Fily, A Ego, ML Outtier, V Pierrat, D
Subtil, P Truffert (Госпиталь Жанны де Фландр, Лилль).Pays-de-Loire: G Boog,
V Rouger-Bureau, J-C Roze´ (Hoˆpital Me` re-Enfant, Нант). Paris-Petite —
Couronne: PY Ancel, G Bre´art, M Kaminski, C du Mazaubrun (INSERM
U149, Париж), M Dehan, V Zupan-Simunek (Hoˆpital Antoine Be´cle`re,
Clamart ), М. Водовар, М. Войер (Институт сельского хозяйства, Париж).
Вклад авторов
Критический пересмотр рукописи для важного интеллектуального содержания: SM
LM JCP JMH CA JCR PT BL MK PYA.Статистический анализ: LM.
Проведены эксперименты: SM LM JCP JMH CA PT JCR BL MK PYA.
Проанализированы данные: SM LM JCP JMH CA PT JCR BL MK PYA. Написал
в статье: СМ ЛМ МК ПЯ.
Ссылки
1. SCPE (2000) Эпиднадзор за церебральным параличом в Европе: сотрудничество
обследований и регистров церебрального паралича. Дев Мед Чайлд Нейрол 42: 816–824.
Доступно: http://onlinelibrary.wiley.com/doi/10.1111/j.1469-8749.2000.
tb00695.х / pdf. По состоянию на 10 апреля 2013 г.
2. Saigal S, Doyle LW (2008) Обзор смертности и последствий недоношенных
родов от младенчества до взрослого возраста. Ланцет 371: 261–269.
3. Химмельманн К., Хагберг Г., Увебрант П. (2010) Меняющаяся панорама церебрального паралича
в Швеции. X. Распространенность и происхождение в период года рождения
1999–2002 гг. Acta Paediat 99: 1337–1343.
4. van Haastert IC, Groenendaal FG, Uiterwaal CSPM, Termote JUM, van der
Heide-Jalving M, et al.(2011) Снижение заболеваемости и тяжести церебрального паралича
у недоношенных детей. J Pediatr 159: 86–91.
5. Bhutta AT, Cleves MA, Casey PH, Cradock MM, Anand KJ (2002) Когнитивные
и поведенческие результаты недоношенных детей школьного возраста: метаанализ
. JAMA 288: 728–737.
6. Ларрок Б., Ансель П.Й., Маррет С., Маршан Л., Андре М. и др. (2008)
Нарушения развития нервной системы и особый уход за 5-летними детьми, рожденными
до 33 недель беременности (исследование EPIPAGE): продольное когортное исследование.
Ланцет 371: 813–820.
7. de Vries LS, van Haastert IL, Rademaker KJ, Koopman C, Groenendaal F
(2004) Ультразвуковые аномалии, предшествующие церебральному параличу, у недоношенных детей высокого риска
младенцев. J Pediatr 144: 815–820.
8. Кубань К.С., Оллред Э.Н., О’Ши ТМ, Панет Н., Пагано М. и др. (2009) Ультразвуковые поражения черепа
в отделении интенсивной терапии позволяют прогнозировать церебральный паралич в возрасте 2 лет у детей
, рожденных на чрезвычайно низком гестационном сроке. J Child Neurol 24: 63–72.
9. Volpe JJ (2009) Травма головного мозга у недоношенных детей: сложная смесь
деструктивных нарушений и нарушений развития. Ланцет Neurol 8: 110–124.
10. Ансель П.Й., Ливинек Ф., Ларрок Б., Маррет С., Арно С. и др. (2006) Церебральный паралич
у очень недоношенных детей в зависимости от гестационного возраста и неонатальные
ультразвуковые аномалии: когортное исследование EPIPAGE. Педиатрия 117: 828–835.
11. Арно С., Добисс-Марлиак Л., Уайт-Конинг М., Пьерра В., Ларрок Б. и др.
(2007) Распространенность и сопутствующие факторы незначительных нейромоторных дисфункций в возрасте
в возрасте 5 лет у недоношенных детей: исследование EPIPAGE. Arch Pediatr
Adolesc Med 161: 1053–1061.
12. Ларрок Б., Ансель П.Й., Маршан-Мартин Л., Камбони Г., Фрессон Дж. И др.
(2011) Особый уход и трудности в школе у 8-летних очень недоношенных детей:
когортное исследование Epipage. PLoS One 6: e21361.
13. Ларрок Б., Маррет С., Ансель П.Й., Арно С., Марпо Л. и др.(2003) White
Повреждение веществаи внутрижелудочковое кровоизлияние у очень недоношенных детей: исследование
EPIPAGE. J Pediatr 143: 477–483.
14. Кауфманн А., Кауфманн Н. (1983) Батарея оценок Кауфманна для детей.
Круговые сосны, Миннесота: Американская служба гидов.
15. Вольке Д., Мейер Р. (1999) Когнитивный статус, владение языком и предварительное чтение
навыков 6-летних очень недоношенных детей и их сверстников: баварское лонгитюдное исследование
.Дев Мед Чайлд Нейрол 41: 94–109.
16. Weisglas-Kuperus N, Hille ET, Duivenvoorden HJ, Finken MJ, Wit JM, et al.
(2009) Интеллект очень недоношенных детей или детей с очень низкой массой тела при рождении в молодом возрасте
. Arch Dis Child Fetal Neonatal Ed 94: F196–200.
17. Марлоу Н., Вулк Д., Брейсуэлл М.А., Самара М. (2005) Неврологические и
нарушения развития в возрасте шести лет после чрезвычайно преждевременных родов.
N Engl J Med 352: 9–19.
18.Джонсон С., Хеннесси Э., Смит Р., Трикич Р., Вольке Д. и др. (2009) Академический
достижения и особые образовательные потребности у крайне недоношенных детей в возрасте 11
лет: исследование EPICure. Arch Dis Child Fetal Neonatal Ed 94: F283–
289.
19. Moore T, Hennessy EM, Myles J, Johnson SJ, Draper ES, et al. (2012)
Неврологические исходы и исходы развития у крайне недоношенных детей, родившихся в
Англии в 1995 и 2006 годах: исследования EPICure.Br Med J 345: e7961.
20. Бейано Дж., Хошнуд Б., Камински М., Пьерра В., Маррет С. и др. (2010)
Церебральные поражения и другие прогностические факторы церебрального паралича у очень
недоношенных детей. Проспективное когортное исследование EPIPAGE. Dev Med Child
Neurol 52: e119–25.
21. Бейано Г., Хошнуд Б., Камински М., Маррет С., Пьерра В. и др. (2011)
Предикторы риска когнитивной недостаточности у очень недоношенных детей: проспективная когорта
EPIPAGE.Acta Paediatr 100: 370–378.
22. Smyser CD, Inder TE, Shimony JS, Hill JE, Degnan AJ, et al. (2010)
Продольный анализ развития нейронной сети у недоношенных детей. Cereb
Cortex 20: 2852–2862.
23. Болл Г., Бордман Дж. П., Рюкерт Д., Альджабар П., Аричи Т. и др. (2012) Влияние преждевременных родов
на таламическое и корковое развитие. Cereb Cortex 22: 1016–
1024.
24. Петерсон Б.С., Вор Б., Кейн М.Дж., Уэлен Д.Х., Шнайдер К.С. и др.(2002) Исследование обработки речи с помощью функциональной магнитно-резонансной томографии
и его когнитивных коррелятов
у недоношенных детей. Педиатрия 110: 1153–1162.
25. Gozzo Y, Vohr B., Lacadie C, Hampson M, Katz KH, et al. (2009) Изменения в нейронных связях
у недоношенных детей школьного возраста. Нейроизображение 48: 458–463.
26. Foix-l’He´lias L, Marret S, Ancel PY, Marchand L, Arnaud C, et al. (2008)
Влияние использования антенатальных кортикостероидов на смертность, церебральные поражения и
пятилетние исходы нервного развития у очень недоношенных детей: когортное исследование EPIPAGE
.Br J Obstet Gynaecol 115: 275–282.
Преждевременные роды, травма головного мозга, нервное развитие
PLOS ONE | www.plosone.org 8 мая 2013 г. | Том 8 | Выпуск 5 | e62683
pone.0062683 1..9
% PDF-1.4
%
1 0 obj
>
эндобдж
6 0 obj /Заголовок
/Предмет
/ Автор
/Режиссер
/ CreationDate (D: 20210523225124-00’00 ‘)
/ ModDate (D: 201304136 + 08’00 ‘)
>>
эндобдж
2 0 obj
>
эндобдж
3 0 obj
>
эндобдж
4 0 obj
>
эндобдж
5 0 obj
>
поток
Блокировать сосудистые истоки когнитивного спада
Блокировать сосудистые истоки когнитивного упадка
Февраль 2015
Майкл Дауни
По мере старения населения все больший процент людей сталкивается с перспективой когнитивного спада и слабоумия.1,2
Трудно обратить вспять развитие болезней, вызывающих истощение мозга, поэтому профилактика становится логичным выбором.
Мало кто понимает, что существует тесная связь между факторами риска сердечно-сосудистых заболеваний и неврологическим спадом.3,4
Винпоцетин, производное растения барвинок, использовался в Японии, Венгрии, Германии, Польше и России в качестве лекарственного средства. лечение цереброваскулярных заболеваний с конца 1970-х годов.5
В этой статье вы узнаете о захватывающих исследованиях, демонстрирующих, что винпоцетин улучшает церебральный кровоток, подавляет атеросклероз и увеличивает потребление кислорода и глюкозы мозгом.
Через эти пути винпоцетин помогает защитить от множества возрастных нейрональных нарушений, включая снижение памяти / когнитивных функций, повреждение инсульта, сосудистую деменцию и болезнь Альцгеймера.
Связь между сердцем и мозгом
В конце 1970-х нескольким исследователям стало известно о важной связи между сердечно-сосудистыми заболеваниями и началом когнитивного ухудшения, которое часто переходило в сосудистую деменцию.6
Многие многие игнорировали эту связь между сердцем и мозгом. годы.Ученые в конечном итоге начали исследовать эту интригующую область, в которой когнитивные нарушения могут быть вызваны сердечно-сосудистыми проблемами.6
К началу 1990-х годов исследователи обнаружили связь между сердечными заболеваниями и начальными стадиями болезни Альцгеймера.6 С тех пор продолжались исследования этой связи. эпидемией болезни Альцгеймера — затронувшей более 5 миллионов американцев, число которых, по прогнозам, увеличится до 16 миллионов к 2050 году.7
Многие крупные исследования, в том числе исследования Фрамингема, Кунгсхольмена и Гонолулу-Азия, серьезно указывают на гипертензию (высокое кровяное давление). ) у пожилых людей как причина нарушения познавательной способности.Также было хорошо установлено, что гипертония у пожилых людей является фактором риска развития болезни Альцгеймера.6
Неясно, как именно гипертония может привести к болезни Альцгеймера. Однако есть подозрение, что пульсирующие изменения давления в микрососудистой сети головного мозга, вызванные гипертонией, могут повреждать эндотелиальные клетки головного мозга, контролирующие церебральный кровоток.6
Эти сосудистые изменения могут вызывать хроническую гипоперфузию (снижение кровотока) в головном мозге, что приводит к образование высыпаний белого вещества.Эти поражения обнаруживаются при сканировании с помощью магнитно-резонансной томографии головного мозга (МРТ) пациентов с болезнью Альцгеймера и считаются хорошим маркером этого смертельного заболевания.6
Гипоперфузия головного мозга может быть результатом жесткости сосудов, вторичной по отношению к атеросклерозу, повышенного сосудистого сопротивления и нарушения гемодинамики (кровообращения). ) схемы потока. Последующее снижение кровотока в головном мозге в значительной степени связано с постепенным снижением когнитивных функций, наблюдаемым среди все большего числа стареющих людей.6
Общий церебральный кровоток у пациентов с болезнью Альцгеймера на 20% ниже, чем у пациентов без деменции.7 И исследования показали, что постоянный низкий приток крови к мозгу часто является маркером того, разовьется ли у кого-то болезнь Альцгеймера. Гипоперфузия головного мозга
Каскад нейрональных повреждений, вызванный гипоперфузией, может проявляться как потеря памяти, 8,9 депрессия, 10-13 когнитивная дисфункция, 14-16 и, в конечном итоге, более высокий риск инсульта, 17,18 сосудистой деменции 8, 19,20 и болезнь Альцгеймера.21-23
Почему сосудистые факторы риска оказывают такое сильное влияние на здоровье мозга? Ученые полагают, что, возможно, этот путь усиливает снижение церебрального кровотока, которое уже присутствует в результате нормального старения.6 Различные факторы риска болезни Альцгеймера — старение, бывшая травма головы и генотип ApoE4 (вариант гена с более высокой степенью риска). Риск болезни Альцгеймера) — все они потенциально могут снизить приток крови к мозгу6.
Ученые описали процесс, при котором хронический низкий приток крови к мозгу приводит к разрушению даже самых устойчивых нейронов.Велика вероятность того, что этот низкий кровоток в конечном итоге проявится как болезнь Альцгеймера.6
Срочная потребность в безопасном способе блокирования этого деструктивного процесса подчеркивается тревожным фактом: сочетание гипертонии и гипоперфузии связано с меньшим объемом мозга24. делает накопление доказательств способности винпоцетина ингибировать этот процесс еще более важным.
Что вам нужно знать
Блокирование повреждений мозга
Растущее число людей сталкивается с ухудшением когнитивных функций и деменцией.
Ученые показали, что факторы риска сердечно-сосудистых заболеваний и снижение когнитивных функций тесно связаны.
Обширные исследования показывают, что винпоцетин, используемый в Европе в качестве цереброваскулярного препарата, подавляет атеросклероз, улучшает церебральный кровоток и увеличивает использование мозгом глюкозы и кислорода.
Эти действия позволяют винпоцетину подавлять ряд возрастных нейрональных нарушений, включая снижение памяти и когнитивных функций, повреждение инсульта, сосудистую деменцию и болезнь Альцгеймера.
Преодоление упадка мозга
После повреждения сосудистой сети головного мозга уменьшение размеров мозга невозможно обратить вспять, просто снизив высокое кровяное давление. Объем мозга может продолжать сокращаться, несмотря на успешный контроль артериального давления.25 После деформации и дисфункции церебральные артерии у некоторых людей могут нуждаться в повышенном артериальном давлении, чтобы «втиснуть» кровь в мозг и избежать гипоперфузии. Этот процесс сдавливания вызывает дальнейшее повреждение кровеносных сосудов и увеличивает риск инсульта.26
Таким образом, хотя гипертония является важной причиной повреждения артерий и гипоперфузии, стареющим людям приходится делать больше, чем просто понижать кровяное давление, чтобы обратить вспять гипоперфузию и замедлить снижение активности мозга.
К счастью, эксперименты на грызунах показывают, что, хотя изначально гипоперфузия часто снижает функцию памяти, вызывая состояние пониженного метаболизма, пораженные нейроны головного мозга остаются структурно нетронутыми. Когда церебральная перфузия восстанавливается через пять недель, метаболически нарушенные нейроны могут вернуться в нормальное состояние.Это открытие показывает, что гипоперфузия может ухудшить память, не убивая нейроны. Что еще более важно, это предполагает, что гипоперфузированные клетки мозга могут быть спасены даже после периода снижения мозгового кровотока.6
Это предположение о том, что гипоперфузированные нейроны все еще могут быть спасены, было подтверждено клиническими исследованиями человеческого мозга.6
Накапливающиеся доказательства теперь показывает, что винпоцетин, производное винкамина из растения барвинок, 5 предоставляет новую возможность для предотвращения воздействия факторов риска сосудов на мозг.Таким образом, винпоцетин может предотвратить или обратить вспять ухудшение состояния мозга, которое часто предшествует сосудистой деменции и болезни Альцгеймера.
Винпоцетин способствует здоровью сосудов головного мозга
Исследования показывают, что винпоцетин оказывает антиатерогенное действие на кровеносные сосуды и усиливает кровоток в головном мозге. 27 Эти защитные эффекты для мозга являются результатом множества механизмов, вызванных винпоцетином.
Винпоцетин непосредственно расслабляет гладкие мышцы сосудов, что делает его чрезвычайно мощным сосудорасширяющим средством.28 Он, по-видимому, действует путем ингибирования фермента фосфодиэстеразы 1 (ФДЭ1), что приводит к расслаблению стенок церебральных кровеносных сосудов.29 В результате данные свидетельствуют об усилении церебрального кровотока у пациентов с цереброваскулярными нарушениями28.
Винпоцетин снижает вязкость крови. кровь и плазма. Он также снижает агрегацию тромбоцитов и эритроцитов, повышает гибкость мембран эритроцитов и проявляет клинически подтвержденную противоишемическую активность.28
Биологические механизмы винпоцетина включают ингибирование гипоксического повреждения ткани мозга, удаление гидроксильных радикалов, противосудорожную активность и др. модуляция нескольких систем химических передатчиков и ингибирование обратного захвата аденозина (считается основным эндогенным противосудорожным средством и церебральным защитным средством).28
Селективное усиление церебрального кровотока винпоцетином считается учеными потенциально более безопасным, чем многие фармакологические вазодилататоры. 28
Исследования также показывают, что винпоцетин усиливает церебральный метаболизм28. Это достигается за счет увеличения поглощения кислорода мозгом30 и глюкозы из крови31-34 и за счет увеличения выработки нейронами АТФ (аденозинтрифосфата), молекулы, которая хранит и транспортирует химическую энергию внутри клеток для метаболизма.35
Еще одним полезным свойством этого экстракта является его способность хелатировать металлы.Винпоцетин успешно обращает вспять опухолевый кальциноз (опухолевидные отложения кальция) у гемодиализных пациентов с почечной недостаточностью.28
Ученые продемонстрировали, что винпоцетин эффективно увеличивает микроциркуляцию в сетчатке, а также улучшает кровообращение во внутреннем ухе, что предполагает возможность лечения тиннитуса. .28
Сильная противовоспалительная активность винпоцетина делает его потенциальным средством лечения ряда воспалительных заболеваний, таких как атеросклероз, хроническая обструктивная болезнь легких (ХОБЛ), артрит и средний отит.36
Защита от неврологического упадка
Многие поддерживающие мозг эффекты винпоцетина были продемонстрированы в научных исследованиях, чтобы предложить потенциал новой защиты от широкого спектра неврологических заболеваний, обычно связанных со старением мозга.
Память
Поддержка винпоцетином в головном мозге усиления кровообращения и метаболизма может объяснить его способность, подтвержденную исследованиями на животных, уменьшать потерю нейронов в результате снижения кровотока.Основываясь на этих результатах, ученые провели три контролируемых клинических исследования пожилых людей с проблемами памяти, связанными с плохим мозговым кровообращением или заболеванием, связанным с деменцией. Эти испытания на людях показали, что винпоцетин дает значительно больше улучшений, чем плацебо, в комплексных когнитивных тестах, отражающих память, внимание и концентрацию.37
Когнитивные нарушения
Еще в 1987 году исследователи показали, что винпоцетин может вызывать значительное улучшение у пожилых пациентов с хроническая церебральная дисфункция.В двойном слепом клиническом исследовании исследователи давали 42 пациентам 10 мг винпоцетина ежедневно в течение одного месяца, затем 5 мг в течение еще двух месяцев, в то время как контрольные пациенты получали плацебо. Пациенты, получавшие добавку, получили более высокие баллы по всем шкалам эффективности, которые включали измерения когнитивных функций и общего психического статуса.38
Затем, в 1991 году, 203 пациента с деменцией легкой и средней степени тяжести приняли участие в гораздо более крупном контролируемом рандомизированном исследовании, в котором они принимали участие. 30 или 60 мг винпоцетина или плацебо в течение 16 недель.Наблюдалось значительное улучшение показателей группы, получавшей добавку, по шкалам когнитивных способностей и снижение тяжести заболевания. Опять же, винпоцетин хорошо переносился.39
Более позднее обзорное исследование показало, что винпоцетин усиливал вазодилатацию (или расслабление) кровеносных сосудов и улучшал когнитивную дисфункцию, связанную с сосудистыми заболеваниями, в результате снижения кровотока.28
В другом обзоре нескольких контролируемых исследований пожилых людей. У взрослых с нарушением памяти, связанным с плохим кровообращением или слабоумием, авторы исследования обнаружили убедительные доказательства того, что винпоцетин значительно улучшал показатели внимания, концентрации и памяти, чем плацебо.37
В одном исследовании изучали кровоток у пациентов с ишемическим инсультом и легкими когнитивными нарушениями. Исследователи обнаружили, что винпоцетин улучшил цереброваскулярный резерв крови у этих пациентов и положительно повлиял на их когнитивный статус и общее состояние. Эти результаты побудили авторов исследования рекомендовать винпоцетин для лечения пациентов с легкими когнитивными нарушениями.40
На основании обзора клинических исследований европейские ученые написали, что винпоцетин «улучшает кровоток и метаболизм в пораженных участках мозга» и что «Появляется все больше доказательств того, что винпоцетин улучшает качество жизни пациентов с хроническими цереброваскулярными заболеваниями.41
Болезнь Альцгеймера
Каждые 68 секунд у американца развивается болезнь Альцгеймера. К 2050 году эта частота будет увеличиваться до 33 секунд42.
Ученые лечили крыс химическим стрептозоцином, чтобы создать модель исследования, которая имитирует некоторые когнитивные проблемы, подобные болезни Альцгеймера, включая нарушение памяти и обучаемости. Затем, обработав крыс винпоцетином в течение 21 дня, исследовательская группа смогла восстановить работоспособность грызунов в водном лабиринте и в тесте пассивного избегания.Винпоцетин, по-видимому, помогает защитить от повреждения нейронов.43
В более позднем отчете ученые пришли к выводу, что способность винпоцетина повышать пластичность нейронов и оказывать сильное противовоспалительное действие может иметь положительные эффекты против болезней Альцгеймера и Паркинсона, состояний, при которых наблюдается плохая пластичность нейронов и воспаление. присутствует.44
Инсульт
Винпоцетин может помочь предотвратить ишемический инсульт, а также защитить от некоторых повреждений, связанных с инсультом.
В 2003 году болгарский исследователь обобщил данные о том, что винпоцетин может защищать ткань мозга от последствий бессимптомного цереброваскулярного заболевания, скрытого повреждения кровеносных сосудов, которое предшествует инсульту.В их важной статье упоминается способность добавки вмешиваться на различных этапах каскада событий, приводящих к инсульту, включая ее способность подавлять чрезмерную стимуляцию нервных клеток, ингибировать окисление и предотвращать высвобождение свободных радикалов. Эти ученые показали, что винпоцетин быстро проходит через гематоэнцефалический барьер и выборочно накапливается в частях мозга, наиболее тесно связанных с когнитивной функцией.
Наконец, ссылаясь на известные положительные эффекты винпоцетина на церебральный кровоток, в документе делается вывод, что «винпоцетин также может стать новым терапевтическим подходом к профилактической нейропротекции у пациентов с высоким риском ишемического инсульта.33
Это исследование показало, что винпоцетин способен ингибировать высвобождение глутамата и подавлять повреждающие свободные радикалы в головном мозге.33
Было показано, что винпоцетин ингибирует атеросклероз, накопление отложений на внутренней стенке артерии, которое является основной причиной Инсульт. В исследовании на мышах исследователи обнаружили, что винпоцетин оказывает антиатерогенное действие, подавляя окислительный стресс, воспалительную реакцию и адгезию белых кровяных телец, известных как моноциты.27 В другом исследовании на мышах и культивируемых макрофагах45 изучалось влияние винпоцетина на окисленные лектины. Рецептор ЛПНП 1 (LOX-1), рецепторный белок, играющий роль в патогенезе атеросклероза.46 Исследователи обнаружили новую роль винпоцетина в блокировании патогенеза атеросклероза, по крайней мере, частично за счет подавления передачи сигналов LOX-1.45 «Учитывая превосходный профиль безопасности винпоцетина, это исследование предполагает, что винпоцетин может быть терапевтическим кандидатом для лечения атеросклероза, 45 сказал автор исследования.
Хотя профилактика инсульта является идеальным вариантом, винпоцетин также может ограничить неврологические повреждения после инсульта. Клиническое исследование 2005 года, проведенное в Венгрии, подтвердило влияние винпоцетина на пациентов с множественными инсультами.Пациенты прошли ультразвуковое сканирование кровеносных сосудов головного мозга для изучения кровотока, а затем им назначили винпоцетин или добавку плацебо.
Через три месяца они выполнили серию когнитивных тестов. Кровоток мозга у пациентов, принимающих винпоцетин, улучшился по сравнению с получателями плацебо. По когнитивным тестам у пациентов, получавших плацебо, значительно ухудшилось состояние, в то время как у получателей добавок не было никаких изменений через три месяца. Это исследование продемонстрировало нейрозащитный эффект винпоцетина у пациентов, перенесших инсульт.47
Основываясь на этой защите после инсульта, в 2012 году российские ученые провели многоцентровую клинико-эпидемиологическую программу по изучению воздействия на пациентов с ишемическим инсультом инфузии винпоцетина в острой стадии инсульта, а затем давали винпоцетин в таблетках в течение более длительного периода. Обе группы — дополненная и контрольная — получали стандартную терапию инсульта. По всем измеренным показателям эффективности группа с добавками показала более значительные улучшения.В исследовании сделан вывод о том, что эти двухэтапные вмешательства с использованием инфузии с последующим приемом таблеток «улучшают восстановление неврологических функций» у пациентов с ишемическим инсультом.48
Болезнь Паркинсона
Был проведен эксперимент для оценки нейропротекторного действия винпоцетина у животных. модель болезни Паркинсона. Ротенон, инсектицид, использовался для индукции паркинсонизма у популяции крыс, а в некоторые были добавлены различные дозы винпоцетина. Все крысы, получавшие ротенон, демонстрировали брадикинезию (замедление движений), двигательные нарушения, истощение дофамина в полосатом теле (подкорковую часть переднего мозга) и повышенный уровень малонового диальдегида в полосатом теле (MDA), маркера окислительного стресса.В отличие от контрольной группы, группа, принимавшая винпоцетин, показала значительное изменение локомоторного дефицита, повышение уровня дофамина в полосатом теле и снижение уровня MDA в полосатом теле. Автор исследования пришел к выводу, что винпоцетин может рассматриваться как возможный кандидат для лечения болезни Паркинсона.49
Повреждение мозга
Исследователи тестировали винпоцетин на новорожденных младенцах, которые получили повреждение головного мозга из-за травмы во время родов. Добавка заметно уменьшила или искоренила судороги у новорожденных и снизила аномально высокое давление в их мозгу.Это исследование свидетельствует о широкой неврологической защите винпоцетина.50
Тиннитус и слух
Исследователи протестировали винпоцетин при лечении акустической травмы, связанной с последующей потерей слуха и шумом в ушах. Среди тех, кто начал прием винпоцетина в течение одной недели после инцидента, у 50% наблюдалось полное исчезновение шума в ушах. Добавление винпоцетина в любое время после травмы привело к значительному снижению тяжести шума в ушах у 66% людей и улучшению слуха у 79% людей.51
Согласно исследованию 2003 года, предварительное лечение винпоцетином предотвращало потерю слуха, связанную с аминогликозидными антибиотиками (такими как гентамицин), у 118 пациентов, получающих лечение от туберкулеза. внутреннее ухо, влияющее на слух и равновесие) и при лечении вторичных нарушений зрения по отношению к атеросклерозу.53,54
Безопасность
Испытания на людях и исследования на грызунах показали, что винпоцетин безопасен, эффективен и хорошо переносится.34,38,55 Однако, поскольку винпоцетин снижает агрегацию тромбоцитов, его следует использовать с осторожностью у пациентов, принимающих разжижающие кровь препараты.28
Резюме
Все большее число людей сталкивается с когнитивным снижением и деменцией. В настоящее время фактические данные прочно связывают факторы риска сердечно-сосудистых заболеваний и снижение когнитивных функций. Обширные исследования показывают, что винпоцетин, используемый в Европе с 1970-х годов в качестве лекарственного средства для цереброваскулярного лечения, подавляет атеросклероз, улучшает церебральный кровоток и увеличивает потребление кислорода и глюкозы мозгом.Посредством этих путей винпоцетин подавляет множественные возрастные нейрональные нарушения, начиная от ухудшения памяти и когнитивных функций и заканчивая повреждением инсульта, сосудистой деменцией и болезнью Альцгеймера.
Если у вас есть какие-либо вопросы по научному содержанию этой статьи, позвоните консультанту по здоровью Life Extension® по телефону 1-866-864-3027.
Ссылки
Доступно по адресу: http://www.alz.co.uk/research/statistics. По состоянию на 11 ноября 2014 г.
Corrada MM, Brookmeyer R, Paganini-Hill A, Berlau D, Kawas CH.Заболеваемость деменцией у самых пожилых людей продолжает расти с возрастом: исследование 90+. Энн Нейрол. 2010 Янв; 67 (1): 114-21.
Heckman GA, Patterson CJ, Demers C, St Onge J, Turpie ID, McKelvie RS. Сердечная недостаточность и когнитивные нарушения: проблемы и возможности. Clin Interv Aging. 2007; 2 (2): 209-18.
Феррейра Л.К., Тамаширо-Дуран Дж. Х., Скварзони П. и др. Связь между риском сердечно-сосудистых заболеваний, болезнью Альцгеймера и легкими когнитивными нарушениями: подтверждение недавних исследований функциональной нейровизуализации.Rev Bras Psiquiatr. 2014 г. 10 июня.
Доступно по адресу: http://ntp.niehs.nih.gov/ntp/htdocs/chem_background/exsumpdf/vinpocetine091613_508.pdf. По состоянию на 29 ноября 2014 г.
De la Torre JC. Факторы риска сердечно-сосудистых заболеваний способствуют гипоперфузии головного мозга, ведущей к снижению когнитивных функций и деменции. Cardiovasc Psychiatry Neurol. 2012; 2012: 367516.
Роэр А.Е., Деббинс Дж. П., Малек-Ахмади М. и др. Церебральный кровоток при болезни Альцгеймера. Vasc Health Risk Manag. 2012; 8: 599-611.
Zhao Y, Gu JH, Dai CL, et al.Хроническая гипоперфузия головного мозга вызывает снижение O-GlcNAcylation, гиперфосфорилирование тау-белка и поведенческие нарушения у мышей. Front Aging Neurosci. 2014 10 февраля; 6:10.
Birdsill AC, Carlsson CM, Willette AA, et al. Низкий мозговой кровоток связан со снижением функции памяти при метаболическом синдроме. Ожирение (Серебряная весна). 2013 июл; 21 (7): 1313-20.
Alosco ML, Spitznagel MB, Cohen R и др. Снижение церебральной перфузии предсказывает более выраженные депрессивные симптомы и когнитивную дисфункцию при последующем наблюдении в течение 1 года у пациентов с сердечной недостаточностью.Int J Geriatr Psychiatry. 2014 Апрель; 29 (4): 428-36.
Bonne O, Krausz Y, Gorfine M и др. Гипоперфузия головного мозга у пациентов с лекарственной устойчивостью и депрессией, оцененная с помощью Tc99m HMPAO SPECT. J влияет на Disord. 1996 16 декабря; 41 (3): 163-71.
Грассо М.Г., Пантано П., Риччи М. и др. Гипоперфузия мезиальной височной коры связана с депрессией при подкорковом инсульте. Инсульт. 1994 Май; 25 (5): 980-5.
Онода К., Курода Ю., Ямамото Ю. и др. Постинсультная апатия и гипоперфузия в базальных ганглиях: исследование SPECT.Cerebrovasc Dis. 2011 31 (1): 6-11.
Farkas E, de Wilde MC, Kiliaan AJ, Luiten PG. Хронические нейропатологические изменения, связанные с гипоперфузией головного мозга, и нарушение когнитивного статуса: окно лечения. Наркотики сегодня (Barc). 2002 Май; 38 (5): 365-76.
Vicente E, Degerone D, Bohn L, et al. Астроглиальные и когнитивные эффекты хронической гипоперфузии головного мозга у крыс. Brain Res. 2009 28 января; 1251: 204-12.
Беннет С.А., Теннисвуд М., Чен Дж. Х. и др. Хроническая гипоперфузия головного мозга вызывает апоптоз нейронов и нарушение поведения.Нейроотчет. 1998, 5 января; 9 (1): 161-6.
Hillis AE, Wityk RJ, Barker PB, et al. Подкорковая афазия и запущенность при остром инсульте: роль корковой гипоперфузии. Мозг. 2002 Май; 125 (Pt 5): 1094-104.
Pullicino PM, McClure LA, Wadley VG, et al. Артериальное давление и инсульт при сердечной недостаточности в исследовании «Причины географических и расовых различий в инсульте» (REGARDS). Инсульт. 2009 декабрь; 40 (12): 3706-10.
Román GC. Гипоперфузия головного мозга: критический фактор сосудистой деменции. Neurol Res.2004 июл; 26 (5): 454-8.
Schuff N, Matsumoto S, Kmiecik J, et al. Церебральный кровоток при ишемической сосудистой деменции и болезни Альцгеймера, измеренный с помощью магнитно-резонансной томографии с меткой спина артерии. Демент Альцгеймера. 2009 ноябрь; 5 (6): 454-62.
De la Torre JC. Критический порог гипоперфузии головного мозга вызывает болезнь Альцгеймера? Acta Neuropathol. 1999 Июль; 98 (1): 1-8.
Ким Х.А., Миллер А.А., Драммонд Г.Р. и др. Сосудистые когнитивные нарушения и болезнь Альцгеймера: роль церебральной гипоперфузии и окислительного стресса.Naunyn Schmiedebergs Arch Pharmacol. 2012 Октябрь; 385 (10): 953-9.
Нисимура Т., Хашикава К., Фукуяма Х. и др. Снижение мозгового кровотока и прогноз болезни Альцгеймера: многоцентровое исследование HMPAO-SPECT. Ann Nucl Med. 2007 Январь; 21 (1): 15-23.
Alosco ML, Brickman AM, Spitznagel MB, et al. Независимые и интерактивные эффекты артериального давления и сердечной функции на объем мозга и гиперинтенсивность белого вещества при сердечной недостаточности. J Am Soc Hypertens. 2013 сентябрь-октябрь; 7 (5): 336-43.
Дженнингс Дж. Р., Мендельсон Д. Н., Малдун М. Ф. и др.Региональное серое вещество сокращается у гипертоников, несмотря на успешное снижение артериального давления. J Hum Hypertens. 2012 Май; 26 (5): 295-305.
Iadecola C, Дэвиссон Р.Л. Гипертония и цереброваскулярная дисфункция. Cell Metab. 2008 июн; 7 (6): 476-84.
Чжуан Дж., Пэн В., Ли Х и др. Тормозящие эффекты винпоцетина на прогрессирование атеросклероза опосредуются Akt / NF-κB-зависимыми механизмами у мышей apoE — / -. PLoS One. 2013 декабря 9; 8 (12): e82509.
Kidd PM. Обзор питательных веществ и растений в комплексном управлении когнитивной дисфункцией.Альтернативная медицина, июнь 1999; 4 (3): 144-61.
Ван К., Вэнь Л., Пэн В. и др. Винпоцетин ослабляет неоинтимальную гиперплазию в сонных артериях диабетических крыс после баллонного повреждения. PLoS One. 2014 12 мая; 9 (5): e96894.
Bönöczk P, Panczel G, Nagy Z. Винпоцетин увеличивает церебральный кровоток и оксигенацию у пациентов с инсультом: ближняя инфракрасная спектроскопия и транскраниальное допплеровское исследование. Eur J Ultrasound. 2002 июн; 15 (1-2): 85-91.
Szakáll S, Boros I, Balkay L, et al. Церебральные эффекты однократного внутривенного введения винпоцетина у пациентов с хроническим инсультом: исследование ПЭТ.J Neuroimaging. 1998 Октябрь; 8 (4): 197-204.
Vámosi B, Molnár L, Demeter J, Túry F. Сравнительное исследование действия этилаповинкамината и ксантинола никотината при цереброваскулярных заболеваниях. Немедленное воздействие препарата на концентрацию углеводных метаболитов и электролитов в крови и спинномозговой жидкости. Arzneimittelforschung. 1976; 26 (10a): 1980-4.
Хаджиев Д. Бессимптомные ишемические нарушения мозгового кровообращения и нейропротекция винпоцетином. Ideggyogy Sz. 2003 20 мая; 56 (5-6): 166-72.
Vas A, Gulyas B, Szabo Z, et al.Клинические и доклинические исследования нейропротекторного препарата винпоцетин с использованием позитронно-эмиссионной томографии, ближней инфракрасной спектроскопии и транскраниального допплера: резюме доказательств. J Neurol Sci. 2002 15 ноября; 203-204: 259-62.
Jeon KI, Xu X, Aizawa T, et al. Винпоцетин подавляет NF-kB-зависимое воспаление посредством IKK-зависимого, но независимого от PDE механизма. Proc Natl Acad Sci USA. 2010 25 мая; 107 (21): 9795-800.
Доступно по адресу: http://www.urmc.rochester.edu/news/story/index.cfm? id = 2836. По состоянию на 11 ноября 2014 г.
McDaniel MA, Maier SF, Einstein GO. «Специфические для мозга» питательные вещества: лекарство от памяти? Питание. 2003 ноя; 19 (11-12): 957-75.
Балестрери Р., Фонтана Л., Астенго Ф. Двойная слепая плацебо-контролируемая оценка безопасности и эффективности винпоцетина при лечении пациентов с хронической сосудистой сенильной церебральной дисфункцией. J Am Geriatr Soc. 1987 Май; 35 (5): 425-30.
Hindmarch I, Fuchs HH, Erzigkeit H. Эффективность и переносимость винпоцетина у амбулаторных пациентов, страдающих от легких до умеренных органических психосиндромов.Int Clin Psychopharmacol. 1991; 6 (1): 31-43.
Валикович А. Исследование влияния винпоцетина на мозговой кровоток и когнитивные функции. Ideggyogy Sz. 30 июля 2007 г .; 60 (7-8): 301-10.
Bagoly E, Feher G, Szapary L. Роль винпоцетина в лечении цереброваскулярных заболеваний, основанная на исследованиях на людях. Орв Хетиль. 22 июля 2007 г .; 148 (29): 1353-8.
Alzheimer’s Association. Факты и цифры о болезни Альцгеймера, 2012 г. Демент Альцгеймера. 2012; 8 (2): 131-68.
Deshmukh R, Sharma V, Mehan S, Sharma N, Bedi KL.Винпоцетин — ингибитор ФДЭ1 — снижает уровень интрацеребровентрикулярного стрептозотоцина, вызванного когнитивной дисфункцией и окислительным стрессом. Eur J Pharmacol. 2009 12 октября; 620 (1-3): 49-56.
Medina AE. Терапевтическое применение ингибиторов фосфодиэстеразы I типа при неврологических состояниях. Front Neurosci. 2011 18 февраля; 5:21.
Cai Y, Li JD, Yan C. Винпоцетин ослабляет накопление липидов и образование атеросклероза. Biochem Biophys Res Commun. 2013 10 мая; 434 (3): 439-43.
Mehta JL, Chen J, Hermonat PL, Romeo F, Novelli G.Лектин-подобный окисленный рецептор-1 липопротеинов низкой плотности (LOX-1): важнейший игрок в развитии атеросклероза и связанных с ним заболеваний. Cardiovasc Res. 2006; 69: 36-45.
Кемени В., Мольнар С., Андрейкович М., Макай А., Чиба Л. Острые и хронические эффекты винпоцетина на церебральную гемодинамику и нейропсихологические показатели у пациентов с множественным инфарктом. J Clin Pharmacol. 2005 сентябрь; 45 (9): 1048-54.
Табеева Г.Р., Азимова Ю.Е. Мультимодальная стратегия нейропротекции при инсульте: результаты российской многоцентровой клинико-эпидемиологической программы СОКОЛ.Ж. Неврол Психиатр Им С. С. Корсакова. 2012; 112 (12, п. 2): 20-30.
Zaitone SA, Abo-Elmatty DM, Elshazly SM. Пирацетам и винпоцетин улучшают индуцированный ротеноном паркинсонизм у крыс. Индийский J Pharmacol. 2012 ноябрь-декабрь; 44 (6): 774-9.
Дутов А.А., Гальтваница Г.А., Волкова В.А. и др. Кавинтон в профилактике судорожного синдрома у детей после родовой травмы. Ж. Невропатол Психиатр м С.С. Орсакова. 1991; 91 (8): 21-2.
Konopka W, Zalweski P, Olszewski J, et al. Лечение акустической травмы.Отоларингол Pol. 1997; 51: 281С-4С.
Малявина Ю.С., Овчинников И.В., Фасенко В.П. и др. Кавинтон профилактика нейросенсорной гипоакузии у больных различными формами туберкулеза. Вестн Оториноларингол. 2003; (3): 35-40.
Рибари О., Зелен Б., Коллар Б. Этилаповинкаминат в лечении нейросенсорной недостаточности слуха. Arzneimittelforschung 1976; 26: 1977-80.
Кахан А., Олах М. Использование этилаповинкамината в офтальмологической терапии. Arzneimittelforschung 1976; 26: 1969-1972.
Фейгин В.Л., Доронин Б.М., Попова Т.Ф., Грибачева Е.В., Червов Д.В.Лечение винпоцетином при остром ишемическом инсульте: пилотное слепое рандомизированное клиническое исследование. Eur J Neurol. 2001 Янв; 8 (1): 81-5.
Проблемы со здоровьем
Психогенное или нейрогенное происхождение аграмматизма и синдрома иностранного акцента у пациента с биполярным расстройством: описание случая | Annals of General Psychiatry
Pick A: Uber anerungen des sprach-characters als begleiterscheinung aphasischer strorungen. Zeitschrift fuer de gesamte Neurun Psychologie. 1919, 54: 230-241.
Артикул Google Scholar
Эдвардс Р.Дж., Патель Н.К., Попл И.К.: Иностранный акцент после травмы головного мозга: синдром или эпифеномен ?. Eur Neurol. 2005, 53 (2): 87-91. 10.1159 / 000085503.
Артикул PubMed Google Scholar
Munson PD, Heilman B: Синдром иностранного акцента: анатомические, патофизиологические и психосоциальные аспекты. S D J Med. 2005, 58 (5): 187-189.
PubMed Google Scholar
Мариен П., Верховен Дж., Энгельборгс С., Рукер С., Пикут Б.А., Де Дейн П.П.: Роль мозжечка в планировании двигательной речи: данные о синдроме иностранного акцента. Clin Neurol Neurosurg. 2005, 105 (5): 518-522.
Google Scholar
Фридрикссон Дж., Риаллс Дж., Рорден С., Морган П.С., Джордж М.С., Бейлис Г.С.: Повреждение мозга и корковая компенсация при синдроме иностранного акцента.Нейроказ. 2005, 11 (5): 319-324. 10.1080 / 135547
006302.Артикул PubMed Google Scholar
Ван Борсель Дж., Янссенс Л., Сантенс П. Синдром иностранного акцента: органическое заболевание ?. J Commun Disord. 2005, 38 (6): 421-429. 10.1016 / j.jcomdis.2005.03.004.
Артикул PubMed Google Scholar
Райаллс Дж., Уайтсайд Дж .: Нетипичный случай синдрома иностранного акцента.Clin лингвист Phon. 2006, 20 (2–3): 157–162.
Артикул PubMed Google Scholar
Карбари Т.Дж., Паттерсон Дж. П., Снайдер П.Дж.: Синдром иностранного акцента после катастрофической второй травмы: корреляты МРТ, анализ лингвистических и голосовых паттернов. Brain Cogn. 2000, 43 (1-3): 78-85.
CAS PubMed Google Scholar
Ривз Р.Р., Нортон Дж. У.: Синдром, похожий на иностранный акцент, во время обострений психоза.Нейропсихиатрия Neuropsychol Behav Neurol. 2001, 14 (2): 135-138.
CAS PubMed Google Scholar
Коэльо К., Робб М.: Акустический анализ синдрома иностранного акцента: исследование трех пояснительных моделей. Журнал медицинской патологии речи и языка. 2001, 9: 227-242.
Google Scholar
Верховен Дж., Мариен П., Энгельборгс С., Д’Хэнен Х., Де Дейн П.: акцент иностранной речи в случае конверсионного расстройства.Behav Neurol. 2005, 16 (4): 225-232.
Артикул PubMed Google Scholar
Дикерсон Ф., Бороноу Дж. Дж., Столлингс С., Оригони А.Э., Коул С.К., Йолкен Р.Х .: Когнитивное функционирование при шизофрении и биполярном расстройстве: сравнение результатов на повторяющейся батарее для оценки нейропсихологического статуса. Psychiatry Res. 2004, 129 (1): 45-53. 10.1016 / j.psychres.2004.07.002.
Артикул PubMed Google Scholar
Smith A: Тест модальностей цифр символа. 1991, Лос-Анджелес: Western Psychological Services
Google Scholar
Риддок М.Дж., Хамфрис Г.В.: Бирмингемская батарея распознавания объектов. 1993, Хоув: Лоуренс Эрлбаум Ассошиэйтс
Google Scholar
Joanette Y, Ska B, Belleville S, Lecours AR, Peretz I., Poissant A: Нейропсихологическая оценка dans la démence de type Alzheimer: бескомпромиссно оптимально.L’année gérontologique. 1995, 3: 69-83.
Google Scholar
Barbeau E, Tramoni E, Joubert S, Mancini J, Ceccaldi M, Poncet M: Evaluation de la mémoire de reconnaissance visuelle: normalization d’une nouvelle épreuve en choix forcé (DMS48) et utilité en нейропсихология. L’évaluation des Trouble de la mémoire. Под редакцией: Ван дер Линден М. 2004, Марсель: Солаль, 85-101.
Google Scholar
Уоррингтон EK: Тест памяти Камдена. 1996, Хоув: Psychology Press
Google Scholar
Милнер Б. Межполушарные различия и психологические процессы. Британский медицинский бюллетень. 1971, 27: 273-7.
Google Scholar
Браун Дж .: Некоторые проверки теории распада непосредственной памяти. Q J Exp Psycho1. 1958, 10: 12-21.
Артикул Google Scholar
Golden JC: Тест цвета и слова Stroop. 1978, Чикаго: Stoelting Co
Google Scholar
Рейтан Р., Вольфсон Д.: Набор нейропсихологических тестов Холстеда-Рейтана: теория и клиническая интерпретация. 1993, Tucson: Neuropsychology Press
Google Scholar
Delis DC, Kaplan E, Kramer JH: Система исполнительных функций Delis-Kaplan. 2001, Лондон: Психологическая корпорация
Google Scholar
Ховард Д., Паттерсон К.: Тест пирамид и пальм: тест на семантический доступ из слов и изображений. 1992, Бери-Сент-Эдмундс: испытательная компания Thames Valley
Google Scholar
De Renzi E, Faglioni P: Нормативные данные и возможности проверки сокращенной версии Token Test. Cortex. 1978, 14: 41-49.
CAS Статья PubMed Google Scholar
Deloche G, Hannequin D: Test de dénomination orale d’images-DO 80. 1997, Paris: Éditions du Centre de Psychologie Appliquée
Google Scholar
Strakowski SM, Delbello MP, Adler CM: Функциональная нейроанатомия биполярного расстройства: обзор результатов нейровизуализации. Мол Психиатрия. 2005, 10 (1): 105-116. 10.1038 / sj.mp.4001585.
CAS Статья PubMed Google Scholar
Lochhead RA, Parsey RV, Oquendo MA, Mann JJ: Региональные различия в объеме серого вещества мозга у пациентов с биполярным расстройством, оцененные с помощью оптимизированной морфометрии на основе вокселей. Биол Психиатрия. 2004, 55 (12): 1154-1162. 10.1016 / j.biopsych.2004.02.026.
Артикул PubMed Google Scholar
Gyulai L, Alavi A, Broich K, Reilley J, Ball WB, Whybrow PC: Однофотонная компьютерная эмиссионная томография иофетамина I-123 при быстро меняющемся биполярном расстройстве: клиническое исследование.Биол Психиатрия. 1997, 41 (2): 152-161. 10.1016 / S0006-3223 (96) 00002-9.
CAS Статья PubMed Google Scholar
Дронкерс Н.Ф .: Новая область мозга для координации речевой артикуляции. Природа. 1996, 384 (6605): 159-161. 10.1038 / 384159a0.
CAS Статья PubMed Google Scholar
Бланк С.К., Скотт С.К., Мерфи К., Уорбертон Э., Уайз Р.Дж.: Производство речи: Вернике, Брока и другие.Мозг. 2002, 25 (Pt 8): 11829-1838.
Google Scholar
Mohr JP, Pessin MS, Finkelstein S, Funkenstein HH, Duncan GW, Davis KR: Афазия Брока: патологическая и клиническая. Неврология. 1978, 28 (4): 311-324.
CAS Статья PubMed Google Scholar
Фассбендер К., Мерфи К., Фокс Дж. Дж., Уайли Г. Р., Джавитт Д. К., Робертсон И. Х., Гараван Х: топография исполнительных функций и их взаимодействия, выявленные с помощью функциональной магнитно-резонансной томографии.Brain Res Cogn Brain Res. 2004, 20 (2): 132-143. 10.1016 / j.cogbrainres.2004.02.007.
CAS Статья PubMed Google Scholar
Коллетт Ф., Хогге М., Салмон Э., Ван дер Линден М.: Исследование нервных субстратов исполнительного функционирования с помощью функциональной нейровизуализации. Неврология. 2006, 139 (1): 209-221. 10.1016 / j.neuroscience.2005.05.035.
CAS Статья PubMed Google Scholar
Тейлор С.Ф., Корнблюм С., Лаубер Е.Дж., Миношима С., Коппе Р.А.: Изоляция обработки специфических помех в задаче Струпа: исследования активации ПЭТ. Нейроизображение. 1997, 6 (2): 81-92. 10.1006 / nimg.1997.0285.
CAS Статья PubMed Google Scholar
Дав А., Поллманн С., Шуберт Т., Виггинс С.Дж., фон Крамон Д.Ю.: Активация префронтальной коры при переключении задач: исследование фМРТ, связанное с событием. Brain Res Cogn Brain Res.2000, 9 (1): 103-109. 10.1016 / S0926-6410 (99) 00029-4.
CAS Статья PubMed Google Scholar
Menon V, Adleman NE, White CD, Glover GH, Reiss AL: активация мозга, связанная с ошибкой, во время задачи ингибирования реакции Go / NoGo. Hum Brain Mapp. 2001, 12 (3): 131-143. 10.1002 / 1097-0193 (200103) 12: 3 <131 :: AID-HBM1010> 3.0.CO; 2-C.
CAS Статья PubMed Google Scholar
Peinemann A, Schuller S, Pohl C, Jahn T, Weindl A, Kassubek J: Исполнительная дисфункция на ранних стадиях болезни Хантингтона связана с атрофией полосатого тела и островка: нейропсихологическое и морфометрическое исследование на основе вокселей. J Neurol Sci. 2005, 239 (1): 11-19. 10.1016 / j.jns.2005.07.007.
Артикул PubMed Google Scholar
Schmitz N, Rubia K, Daly E, Smith A, Williams S, Murphy DG: Нейронные корреляты исполнительной функции при расстройствах аутистического спектра.Биол Психиатрия. 2006, 59 (1): 7-16. 10.1016 / j.biopsych.2005.06.007.
Артикул PubMed Google Scholar
Daban C, Amado I, Bourdel MC, Loo H, Olie JP, Poirier MF, Krebs MO: Когнитивные дисфункции у принимающих и не принимающих лекарства пациентов с недавно начавшейся шизофренией. J Psychiatr Res. 2005, 39 (4): 391-398. 10.1016 / j.jpsychires.2004.09.001.
Артикул PubMed Google Scholar
Целевая группа Американской психиатрической ассоциации по DSM-IV: Руководство по диагностике и статистике психических расстройств: DSM-IV-TR. 2000, Вашингтон: Американская психиатрическая ассоциация
Google Scholar
Нири Д., Сноуден Дж. С., Густафсон Л., Пассант У, Стусс Д., Блэк С., Фридман М., Кертес А., Роберт П. Х., Альберт М., Бун К., Миллер Б. Л., Каммингс Дж., Бенсон Д. Ф.: лобно-височная доля дегенерация: консенсус по клиническим диагностическим критериям.Неврология. 1998, 51: 1546-1554.
CAS Статья PubMed Google Scholar
Гроссман М., Эш С: Первичная прогрессивная афазия: обзор. Нейроказ. 2004, 10 (1): 3-18. 10.1080 / 135547
960440.
Артикул PubMed Google Scholar
Lempert T, Dieterich M, Huppert D, Brandt T: Психогенные расстройства в неврологии: частота и клинический спектр.Acta Neurol Scand. 1990, 82 (5): 335-340.
CAS Статья PubMed Google Scholar
Андраде К., Сингх Н.М., Бхакта С.Г .: Одновременные истинные припадки и псевдоприпадки. J Clin Psychiatry. 2006, 67 (4): 673-
Статья PubMed Google Scholar
Vuilleumier P: Истерическое преобразование и функция мозга. Prog Brain Res. 2005, 150: 309-329.
Артикул PubMed Google Scholar
Блэк Д. Н., Серитан А. Л., Табер К. Х., Херли Р. А.: Преобразовательная истерия: уроки функциональной визуализации. J Neuropsychiatry Clin Neurosci. 2004, 16 (3): 245-251.
Артикул PubMed Google Scholar
Ницерголин — Приложения I-IV-en
% PDF-1.5 % 1 0 obj > / Метаданные 2 0 R / Страницы 3 0 R / StructTreeRoot 5 0 R / Тип / Каталог >> эндобдж 2 0 obj > поток 2013-11-25T16: 38: 18Z2013-11-25T16: 38: 18Z2013-11-25T16: 38: 18ZAcrobat PDFMaker 11 для Wordapplication / pdf
Жевание поддерживает когнитивную функцию, зависящую от гиппокампа
Int J Med Sci 2015; 12 (6): 502-509.DOI: 10.7150 / ijms.11911
Обзор
Хуаюе Чен 1 , Мицуо Иинума 2 , Минору Онозука 3 , Кин-Я Кубо 4
1. Кафедра анатомии, Высшая школа медицины Университета Гифу, Гифу, 501-1194, Гифу, Япония,
2. Кафедра детской стоматологии, Отделение строения, функции и развития полости рта, Университет Асахи, Школа стоматологии, Мидзухо, 501- 0296, Гифу, Япония,
3. Кафедра дзюдо-терапии и медицинских наук, факультет медицинских наук, Ниппонский университет спортивных наук, Йокогама 227-0033, Канагава, Япония
4.Высшая школа медицинских исследований при Университете Сейджо, Токай, 476-8588, Айти, Япония,
Чен Х., Иинума М., Онозука М., Кубо К.Ю. Жевание поддерживает когнитивные функции, зависящие от гиппокампа. Int J Med Sci 2015; 12 (6): 502-509. DOI: 10.7150 / ijms.11911. Доступна с https://www.medsci.org/v12p0502.htm
Жевание (жевание) важно не только для приема пищи, но также для сохранения и укрепления общего состояния здоровья. Недавние исследования показали, что жевание помогает поддерживать когнитивные функции в гиппокампе, области центральной нервной системы, жизненно важной для пространственной памяти и обучения.Цель этой статьи — рассмотреть недавний прогресс в связи между жеванием и когнитивной функцией, зависимой от гиппокампа. Жевательные органы и гиппокамп соединены множеством нервных цепей. Исследования как на животных, так и на людях показали, что на когнитивные функции влияет жевание. Нарушение жевательной функции связано с морфологическими нарушениями гиппокампа и гиппокампозависимым дефицитом пространственной памяти, особенно у пожилых людей. Жевание — это эффективное средство для поддержания когнитивных функций, зависящих от гиппокампа, которые ухудшаются с возрастом.Следовательно, жевание может представлять собой полезный подход к сохранению и развитию когнитивной функции, зависящей от гиппокампа, у пожилых людей. Мы также обсудили несколько возможных механизмов, участвующих во взаимодействии между жеванием и нейрогенезом гиппокампа, и будущие направления этого уникального увлекательного исследования.
Ключевые слова : познание, гиппокамп, жевание
В связи с быстрым увеличением численности пожилого населения деменция становится все более важной проблемой здравоохранения и социально-экономической проблемы [1].Когнитивный дефицит связан со старением, а также с нейробиологическими, психологическими и социальными факторами [2, 3]. В последнее время внимание было сосредоточено на состояниях полости рта, особенно на жевании, а также на количестве зубов в контексте когнитивных нарушений. Исследования как на животных, так и на людях показали возможную причинную связь между жеванием и когнитивной функцией [4-6]. Многие пожилые люди имеют проблемы с жеванием из-за потери зубов, что ставит под угрозу общее состояние здоровья. Пожилым людям становится трудно есть некоторые продукты, особенно при потере зубов [7].Утрата жевательной функции также связана с увеличением инвалидности и смертности [8]. Следовательно, умение правильно жевать крайне важно для пожилых людей для поддержания здорового питания и сохранения когнитивных функций. Было продемонстрировано, что жевание имеет большое значение для периферических сенсорных входов в гиппокамп для сохранения и развития когнитивной функции. Системный эффект жевательной дисфункции считается эпидемиологическим фактором риска деменции [9, 10].В настоящее время широко признана важность когнитивной модуляции гиппокампа. Гиппокамп важен для формирования и восстановления эпизодических воспоминаний у людей [11]. Накапливающиеся данные показывают, что нарушение жевательной функции вызывает морфологические и функциональные изменения гиппокампа [12-20]. Жевание или жевание помогает поддерживать функцию гиппокампа [20–23]. В данной рукописи мы стремимся предоставить всесторонний обзор и критический анализ современного понимания взаимосвязи между жеванием и функциями гиппокампа.
Основными жевательными компонентами являются кости, мышцы, зубы и мягкие ткани. В жевании участвуют кости верхней и нижней челюсти. Жевательные движения выполняются с помощью мышц, связанных с верхней и нижней челюстями. Нижняя и верхняя челюсти являются опорными точками для молочных или молочных зубов у детей и постоянных зубов у взрослых. Мягкие ткани, включая язык, губы и щеки, также важны при манипуляциях с пищей во время пероральной обработки [24]. Жевание — это первая стадия пищеварения, включающая прерывистый ритмический акт, при котором мышцы языка, лица и челюсти действуют согласованно, чтобы поместить пищу между зубами, разрезать ее и подготовить к глотанию.Пережевывание направлено на уменьшение гранулометрического состава пищевого комка и образование связного комка со слюной для облегчения глотания [24]. Зубы обеспечивают уникальное распознавание осязания и специфичность направления для ощущения окклюзии, внутриротового контакта для управления пищевым болюсом, различения текстуры и твердости пищи и контроля мышц челюсти при жевании и глотании [25]. Эти особенности зубов тесно связаны с чувствительностью пародонта, что предполагает интегральную роль комплекса пульпа-дентин-эмаль [26].Эти данные дополнительно определяют важность зубов в сенсомоторном контроле функции челюсти. Нейронная основа чувствительности пульпы способствует изысканному механизму сенсорной дискриминации зубов. Соматосенсорная информация от орофациальных механорецепторов, таких как пародонт, слизистая оболочка, мышечное веретено, терморецептор, а также вкусовые и обонятельные рецепторы, играет решающую роль в генерации и контроле движений челюсти во время жевания [25-27].
Существует несколько методов изучения жевания у животных и людей.В экспериментах на животных для исследования жевательных функций обычно используются удаление моляров [13, 14], окклюзионная дисгармония или состояние приподнятого прикуса [16, 17], мягкое диетическое питание [28, 29] и жевание деревянных палочек [21, 22]. . В исследованиях на людях независимые переменные включают самооценку состояния зубов и трудности жевания [9, 30]. Обследование полости рта — это стандартизированный протокол с учетом количества естественных зубов, прикуса и состояния пародонта.
Серия исследований продемонстрировала вклад различных областей коры головного мозга в жевание [31].Эпидемиологические исследования показали, что потеря остаточных зубов, неадекватные протезы и снижение силы прикуса напрямую связаны с обострением деменции [9, 30]. В исследованиях на животных жевание увеличивает корковый кровоток головного мозга и широко активирует различные области коры соматосенсорной, дополнительной моторной и островковой коры [32]. Уровни кислорода в крови в префронтальной коре и гиппокампе повышаются при жевании, что может иметь важное значение для процессов обучения и памяти [32].Жевательная стимуляция может предотвратить ухудшение сенильной функции мозга и связанные со стрессом расстройства без лекарств. Снижение жевательной функции за счет удаления или уменьшения коренных зубов и связанного с этим длительного кормления с мягкой диетой может подавлять обучение и память [12, 13, 16, 18, 19, 22, 33, 34]. Показано, что обучаемость снижается у взрослых крыс от 2 до 30 месяцев после удаления коренных зубов [13, 28, 29]. Мягкое кормление также подавляет способность к пространственному обучению с 6 до 12 месяцев [28, 29, 35].Пространственное обучение ухудшается после периода отсутствия коренных зубов более 2 месяцев у молодых взрослых животных [33, 34]. Поэтому важно понимать взаимосвязь между жеванием и функцией мозга со старением.
Сенсорная информация из полости рта, включая зубы, передается через сенсорный нерв тройничного нерва к сенсорным ядрам тройничного нерва, мозжечку, подъязычным двигательным ядрам и ретикулярной формации ствола мозга [27, 31, 36, 37]. Ретикулярная формация и восходящая ретикулярная активирующая система необходимы для возбуждения мозга для внимания, восприятия и сознательного обучения.Нейроны сенсорных ядер тройничного нерва достигают вентрально-заднего таламического ядра, ретикулярной формации и гипоталамуса. Сенсорная информация от вентрально-заднего ядра таламуса заканчивается соматосенсорной корой. Нейроны соматосенсорной коры проецируют свои аксоны в область соматосенсорной ассоциации, которая имеет реципрокную проекцию с энторинальной корой. Энторинальная кора головного мозга является основным афферентным источником зубчатой извилины гиппокампа. Следовательно, сенсорная информация от жевательных органов может влиять на гиппокамп через таламус и кору головного мозга.Гипоталамус получает входные данные от ретикулярной формации и проецируется в гиппокамп непосредственно в виде опиоидергических и гистаминергических волокон. Гиппокамп играет жизненно важную роль в контроле высвобождения различных гормонов по оси гипоталамус-гипофиз-надпочечники (HPA). Кортикотропин-рилизинг-гормон (CRH), продуцируемый гипоталамусом, стимулирует секрецию адренокортикотропного гормона (АКТГ) передней долей гипофиза, который стимулирует высвобождение кортикостерона из коры надпочечников [6, 38].Благодаря липофильной природе кортикостерон может быстро проникать в мозг. Гиппокамп показывает самую высокую плотность рецепторов глюкокортикоидов (ГР), что делает его мишенью для действия гормона стресса [39]. Гиппокамп получает проекции норадренергических, серотонинергических и дофаминергических волокон из голубого пятна, ядер шва и вентральной тегментальной области, которые являются частью восходящей ретикулярной активирующей системы. Таким образом, возможно, что жевание может влиять на функцию гиппокампа через ретикулярную формацию.Следовательно, влияние жевания на гиппокамп может быть связано с множественными нервными путями.
Данные нейровизуализационных исследований свидетельствуют о том, что жевательная дисфункция вызывает дефицит пространственной памяти и обучения, связанный со структурной и функциональной реорганизацией гиппокампа. Предыдущие исследования выявили возможную связь между жевательной дисфункцией и зависимым от гиппокампа познанием с использованием моделей на животных, таких как удаление коренных зубов, уменьшение коронки или увеличение прикуса [14-18].Эти животные модели способны жевать, но окклюзионная функция заметно снижается, вызывая дегенеративные изменения механорецепторов пародонта, что свидетельствует о подавлении сенсорной стимуляции периодонтальных связок во время жевания. В этих экспериментах животные без коренного зуба или животные с укусом демонстрировали дефицит пространственной памяти с морфологическими изменениями гиппокампа [17].
1. Патологическая морфология гиппокампа и жевательная дисфункция
Исследования на животных показали, что старые мыши или крысы с нарушениями памяти имеют более высокую активность оси HPA [17-20].Активность оси HPA отрицательно связана как с характеристиками пространственной памяти, так и с нейрогенезом гиппокампа. Снижение жевательной стимуляции уменьшало объем гиппокампа и вызывало дефицит памяти. Плотность пирамидных клеток гиппокампа Cornu Ammonis 1 (CA1) и CA3 у безмолярных мышей или мышей с приподнятым прикусом значительно снизилась [12, 13, 18]. Количество дендритных шипов уменьшилось, а ветвление дендритов уменьшилось в зависимости от возраста [18, 20]. Дендритные шипы в гиппокампе изменяются из-за дисфункции жевательной функции через внутриклеточные механизмы, которые реорганизуют цитоскелет нейронов, вызывая изменения цитоскелета [40, 41].Мыши, получавшие мягкую диету, демонстрировали более низкую плотность синаптофизин-иммунореактивных окончаний и синаптическое образование в гиппокампе [34].
Установлено, что нейрогенез происходит в субгранулярной зоне (SGZ) DG гиппокампа и субвентрикулярной зоне переднего мозга (SVZ) на протяжении всей жизни [42]. Обычно считается, что DG играет ключевую роль в кодировании пространственной и контекстной информации, особенно в разделении образов и обнаружении новизны [43]. Вновь сгенерированные нейроны в SGZ мигрируют во внутренний слой гранулярных клеток, быстро расширяют длинные аксональные выступы вдоль пути мшистых волокон и достигают своего целевого слоя пирамидных нейронных клеток CA3, образуют связи с нейронами CA3, внутригрудными интернейронами и высвобождают глутамат в качестве своего основного нейротрансмиттер, таким образом, приобретает функциональное значение.Обнаружено, что вновь созданные клетки в гиппокампе взрослых мышей проявляют нейрональную морфологию и проявляют свойства пассивных мембран, потенциалы действия и функциональные синаптические входы, аналогичные тем, которые обнаруживаются в зрелых клетках DG. Скорость нейрогенеза регулируется различными физиологическими и патологическими состояниями. Вновь созданные клетки могут выполнять функцию механизмов познания и восстановления мозга. Исследования на животных показали, что длительная жевательная дисфункция подавляет нейрогенез нейронов гранул DG [44].Нейрогенез как в SVZ, так и в DG гиппокампа снижался у мышей, получавших мягкую диету [45]. Состояние отсутствия моляров или прикуса у мышей и крыс значительно снижает пролиферацию клеток в DG гиппокампа в зависимости от возраста [15, 21]. После удаления коренных зубов или увеличения прикуса у старых мышей пролиферация клеток резко снизилась, а затем увеличилась, но не восстановилась до контрольных уровней. Эти данные свидетельствуют о том, что уменьшение жевания нарушает пролиферацию клеток в DG гиппокампа, что приводит к дефициту пространственного обучения и памяти.
2. Молекулярная морфология гиппокампа и жевательная дисфункция
Прототипный немедленный ранний ген c-fos транскрибируется в нейронах в течение нескольких минут после стимуляции различными деполяризующими и нейротрофическими межклеточными сигналами, а быстрая деградация мРНК c-fos гарантирует, что его экспрессия отражает недавние изменения в нейрональной активности [46]. Белок Fos является индикатором нервной пластичности и сильно участвует в формировании памяти. Опыт и пространственное обучение стимулируют экспрессию Fos.Было продемонстрировано, что мыши с нокаутом c-fos обнаруживают дефицит долговременной памяти и синаптической пластичности [47]. Более того, нарушение памяти после ишемии мозга часто связано со снижением экспрессии c-fos [48]. Нарушение жевательной функции вызывало снижение количества Fos-положительных клеток в области CA1. Этот эффект был более выраженным, чем дольше сохранялось безмолярное состояние. Подавление индукции Fos в области CA1, вызванное безмолярным состоянием, было уменьшено за счет восстановления утраченных моляров с помощью искусственных коронок [49].
Холинергическая система базального переднего мозга является одной из ключевых передающих систем для обучения и памяти. Гиппокамп получает множество регулирующих сигналов от холинергической системы базального переднего мозга. Холинергическая система гиппокампа играет решающую роль в пространственном обучении [50]. Лечение донепезилом, мощным и селективным ингибитором ацетилхолинэстеразы, значительно увеличивало выживаемость новорожденных нейронов. Лечение донепезилом может обратить вспять вызванное хроническим стрессом снижение нейрогенеза.Активация холинергической системы способствует выживанию новорожденных нейронов в DG взрослых как в нормальных, так и в стрессовых условиях [51]. Введение нейротоксина 192 IgG-сапонина избирательно разрушало холинергические нейроны базального отдела переднего мозга, нарушало нейрогенез в слоях гранулярных клеток и увеличивало количество апоптотических клеток, особенно в субгранулярной зоне области DG [52]. Прокогнитивные влияния холинергической системы в гиппокампе включают производство новых нейронов, которые вносят вклад в синаптическую пластичность DG и формирование следов памяти.Нацеливание на холинергическую систему ингибиторов холинэстеразы, которое приводит к когнитивным улучшениям у пациентов, страдающих возрастной деменцией, возможно, может оказывать терапевтическое действие за счет стимуляции нейрогенеза в гиппокампе [51, 52]. У мышей без молярного возраста или у мышей с повышенным прикусом высвобождение ацетилхолина в гиппокампе, активность ацетилтрансферазы и холинацетилтрансферазы были значительно снижены [13, 53]. Количество холинацетилтрансфераз-иммунопозитивных нейронов в ядре медиальной перегородки также было снижено.Однако состояние без моляров или прикуса имело небольшой эффект у молодых мышей, что указывает на возрастное снижение холинергической системы гиппокампа. Снижение жевательной активности у мышей может быть связано с развитием возрастных функциональных нарушений холинергической системы гиппокампа.
Недавние исследования показали, что нарушение жевательной функции подавляет связанные с памятью сигнальные пути и гены в нейронах гиппокампа, включая нейротрофический фактор мозга (BDNF) и его рецептор, родственную тропомиозину киназу B (trkB) [54, 55].BDNF — это семейство факторов роста нервов, которые связываются с trkB. В ответ на передачу сигналов BDNF его специфический высокоаффинный рецептор trkB оказывает усиливающее действие на нервную передачу. Как BDNF, так и trkB, как было показано, являются важными модуляторами синаптической пластичности и имеют решающее значение для развития центральной нервной системы [56]. Эксперименты на животных показали, что BDNF необходим для поддержания дендритных шипов в мозге взрослого человека [57]. Передача сигналов BDNF-TrkB может влиять на дендритный шип и плотность синапсов в нейронах гиппокампа [56].Экспрессия trkB-мРНК использовалась в качестве эффективного маркера повышенных уровней синаптической передачи в сигнальных путях, связанных с пространственным обучением. Уровни trkB-мРНК были значительно ниже у крыс после удаления зубов [56, 57]. На пространственную память и количество trkB-мРНК-положительных клеток отрицательно влияли продолжительность потери зубов и количество удаленных зубов. В качестве медиатора зависимого от гиппокампа обучения и памяти связывание BDNF-trkB играет критическую роль в зависимой от активности синаптической пластичности.Нарушение пространственной памяти у крыс могло иметь тесную связь со снижением уровней trkB в проводящих путях, расположенных от области тройничного нерва к гиппокампу.
3. Астроциты гиппокампа и жевательная дисфункция
Астроциты претерпевают изменения, ведущие к гипертрофии и гиперплазии, увеличивая продукцию провоспалительных цитокинов, таких как производный микроглии IL-1β. Гиперсекреция иммуномодулирующих цитокинов и последующие воспалительные реакции в астроцитах и нейронах часто наблюдаются в гиппокампе пожилого возраста, что связано с возрастными когнитивными нарушениями [58].Астроциты играют центральную роль практически во всех формах невропатологии, определяя в значительной степени прогрессирование и исход неврологических заболеваний [59]. Глиальный фибриллярный кислый белок (GFAP) считается универсальным глиальным маркером и обычно считается признаком патологического ответа астроглии, реактивного астроглиоза. GFAP-положительные астроциты различаются в зависимости от области мозга, около 80% клеток находится в гиппокампе [60]. Старение связано с пролиферацией астроцитов и увеличением экспрессии GFAP, что считается признаком реактивной гипертрофии астроглии [61].У мышей или крыс без моляров или укусов наблюдалась гипертрофия астроцитов в CA1, что свидетельствует о воспалении и дегенерации глиальных клеток, что указывает на усиление продукции цитокинов [4, 14]. Количество GFAP-положительных астроцитов увеличивается с возрастом, особенно у мышей без моляров или мышей с приподнятым прикусом. Дефицит жевания не только вызывает дегенерацию нейронов, но и вызывает увеличение числа астроцитов, сопровождающееся морфологическими и физиологическими изменениями гиппокампа.
Сенсорная информация от жевательных органов важна для поддержания обучения, зависящего от гиппокампа.Нарушение жевания у молодых животных может не повлиять на гиппокамп в краткосрочной перспективе, поскольку гиппокамп постоянно получает различные периферические сенсорные сигналы для поддержания своей функции. Однако у старых животных сниженная жевательная активность и дегенеративные периодонтальные механорецепторы не обеспечивают достаточного сенсорного ввода для поддержания функции гиппокампа, что приводит к ухудшению когнитивных функций гиппокампа. У молодых мышей требуется период более двух месяцев для снижения способности к обучению.У пожилых мышей без моляров или выращенных на укусе мышей быстро развивался дефицит обучения [4, 6, 14, 19].
Несколько исследований на людях показали, что жевание эффективно для сохранения функции гиппокампа, которая ухудшается с возрастом [9, 62-66]. Основываясь на данных крупномасштабных опросов, проведенных в нескольких европейских странах, Листл предоставил новые эпидемиологические данные, подтверждающие связь между здоровьем полости рта и когнитивными функциями [67]. Популяционное поперечное исследование показало, что естественные зубы важны для когнитивных процессов в гиппокампе, таких как эпизодическая долговременная память [30].Было показано, что жевание или даже сосание кусочка жевательной резинки без сахара со вкусом мяты связано с немедленным улучшением когнитивных функций, улучшением показателей запоминания слов, индекса чувствительности задачи пространственной рабочей памяти и времени реакции числовой работы. задача памяти у людей. Жевание увеличивает мозговой кровоток и может снизить риск когнитивных нарушений [62–64]. Связь между жевательной способностью и познанием была обнаружена в популяционном исследовании. Было обнаружено, что жители сельской местности в возрасте 70–74 лет без деменции, имеющие плохую жевательную способность, хуже выполняли те же когнитивные тесты [65].В другом исследовании связь между жеванием резинки и когнитивными способностями зависела от индивидуальных различий, таких как чувство жажды и интровертность [66]. Lexomboon и его коллеги провели интересное исследование, касающееся взаимосвязи между жевательной способностью, потерей зубов и когнитивными нарушениями у пожилого населения Швеции в целом [9]. Они обнаружили, что связь между жевательной способностью и когнитивными нарушениями была сильнее, чем между потерей зубов и когнитивными нарушениями, с поправкой на возраст, пол и образование.Они предположили, что жевание само по себе может положительно влиять на церебральный кровоток, снимать стресс и, следовательно, улучшать когнитивные способности. Недавно Brobeil et al. сообщили, что белок 51, взаимодействующий с тирозинфосфатазой (PTPIP51), вероятно, является новым белком, регулирующим формирование памяти, влияя на рост дендритов и аксонов и синаптогенез [68]. Экспрессия PTPIP51 была специфически ограничена мозжечком и гиппокампом [69], предполагая взаимодействие между мозжечком и гиппокампом.Исследование функциональной магнитно-резонансной томографии (фМРТ) показало, что жевание влияет на функции мозжечка [62]. Мозжечок может быть вовлечен в ритмику жевания и моторный контроль, мотивированный проприоцептивными сигналами. Увеличение нервной активности мозжечка во время жевания может улучшить гиппокамп-зависимую память и познавательные способности.
В экспериментах на животных мыши, получавшие мягкую диету, показали низкий нейрогенез, в то время как мыши, получавшие только жесткую диету или жесткую диету после мягкой, показали нормальный или восстановленный нейрогенез [45].Это исследование предполагает, что жесткая диета улучшает нейрогенез. Пережевывание в ограниченных условиях полностью изменило вызванное стрессом подавление пролиферации клеток в DG [6, 21]. Пережевывание пищи в стрессовом состоянии ослабляло влияние стресса на когнитивные функции. Жевание во время стрессового события изменило функцию оси HPA и улучшило способность справляться со стрессом у грызунов [21, 70-73]. Жевание во время сдерживающего стресса значительно подавляло вызванное стрессом усиление экспрессии CRH в паравентрикулярном ядре [74].Количество стресс-супрессированных GR-иммунопозитивных нейронов в области CA1 гиппокампа увеличивалось после жевательной стимуляции [74]. GR играют важную роль в консолидации и извлечении памяти [75]. Нейроэндокринной активации оси HPA противодействует GR-опосредованная отрицательная обратная связь, которая прекращает стрессовую реакцию. Нарушение жевательной функции подавляло реакцию отрицательной обратной связи путем подавления экспрессии белка GR и мРНК [16]. У старых мышей состояние без моляров или прикуса подавляло пролиферацию клеток в DG гиппокампа [15, 21].Предварительная обработка метирапоном, блокатором синтеза кортикостерона, ингибировала повышение уровня кортикостерона в плазме, вызванное состоянием прикуса, а также ослабляла снижение пролиферации клеток [21]. Введение метирапона ослабляло хроническую стресс-индуцированную дегенерацию нейронов в гиппокампе и хронические стресс-индуцированные нарушения пространственного обучения у крыс [76]. Иммобилизационный стресс подавлял пролиферацию клеток в DG-области гиппокампа. Однако жевание в условиях ограничивающего стресса блокировало вызванное стрессом подавление пролиферации клеток в области DG.Функциональные морфологические дефициты, вызванные безмолярным состоянием у старых мышей SAMP8, были результатом повышенного уровня кортикостерона в плазме, и то, что жевание в условиях ограничивающего стресса предотвращало вызванное стрессом подавление нейрогенеза в DG, которое требуется для зависимого от гиппокампа обучения. и память у взрослых. Таким образом, жевание во время стрессового события может ослабить вызванное стрессом нарушение когнитивной функции.
Жевание во время стресса у крыс и мышей ослабляло вызванное стрессом повышение уровня кортикостерона, экспрессию CRH, индукцию белка c-Fos, фосфорилирование внеклеточной сигнальной протеинкиназы 1/2, окислительный стресс и оксид азота в гипоталамусе.Жевание также снижает вызванные стрессом нарушения пластичности гиппокампа, активируя долгосрочную потенциацию (LTP), опосредованную рецептором N-метил-D-аспартата (NMDA), которая отвечает за обучение и память [71]. Стресс вызывает длительную активацию оси HPA, стимулируя кору надпочечников на секрецию кортикостерона. Повышенный уровень кортикостерона вызвал приток Ca 2+ в нейроны через активацию рецепторов кортикостерона, ослабление клеточной возбудимости и ослабление LTP гиппокампа избирательно, что зависит от рецептора NMDA [71, 77].Сниженной стрессом пластичности гиппокампа можно противодействовать, если у крыс есть возможность поведенчески реагировать на стресс, жевая деревянную палочку. Жевание в условиях стресса улучшало вызванное стрессом нарушение гиппокампа за счет восстановления функции NMDAR [71, 77]. Жевание также может вызвать высвобождение гистамина и стимулировать активацию гистаминового рецептора h2 в гиппокампе. Вызванная жеванием активация гистаминергической нервной системы в гиппокампе способствовала повышению уровня внеклеточного гистамина и восстанавливала ослабленную стрессом функцию рецепторов NMDA в гиппокампе.
Жевание может изменить функцию оси HPA, улучшить способность справляться со стрессом и облегчить вызванный хроническим стрессом гиппокамп-зависимый дефицит пространственного обучения. Влияние жевания на функцию гиппокампа может быть связано с несколькими путями, включая различные регуляторные нервные импульсы, гены, связанные с памятью, и сигнальные пути, гормон стресса и его рецепторы. Сообщалось, что жевание резинки улучшило способность вспоминать у пожилых людей, но не показало никаких эффектов у молодых людей [4, 78].По сравнению с молодыми животными жевание более эффективно для пожилых животных, поскольку дает дополнительные сенсорные сигналы для улучшения функции гиппокампа, которая ухудшается с возрастом.
Жевание играет важную роль в сохранении зависимой от гиппокампа когнитивной функции. Дефицит жевания нарушает морфологию гиппокампа через нейронные цепи и ось HPA, что приводит к дефициту пространственной памяти и обучению. Пережевывание во время стрессового события может обратить вспять вызванную стрессом дегенерацию нейронов и подавление пролиферации клеток в гиппокампе и ослабить вызванные стрессом нарушения пластичности гиппокампа за счет различных регуляторных нервных импульсов, связанных с памятью генов и сигнальных путей, гормона стресса и его рецепторов.Следовательно, жевание может быть эффективным подходом к поддержанию пространственного обучения и памяти, связанных с гиппокампом. Жевание может представлять собой полезный подход к сохранению и развитию когнитивной функции, зависящей от гиппокампа, у пожилых людей.
Полное понимание механизмов, опосредующих нейрогенез гиппокампа, вызванного жеванием, осложняется участием множества регуляторных факторов, включая гормон стресса и его рецептор, системы нейротрансмиттеров, связанные с памятью гены и сигнальные пути.На сегодняшний день исследования, как правило, сосредоточены на влиянии жевательной стимуляции на функцию гиппокампа. Существует нехватка информации о том, как множество субстратов, нейромедиаторных систем и генов взаимодействуют друг с другом, чтобы модулировать взаимодействие между жеванием и функцией гиппокампа. В будущих исследованиях следует сосредоточить внимание на перекрестной связи между системами нейротрансмиттеров и рецепторов и принять подход нейронных сетей, чтобы лучше понять функцию гиппокампа.Нет сомнений в том, что многочисленные модели на животных, которые были разработаны, способствовали лучшему пониманию взаимосвязи между жеванием и функциональной морфологией гиппокампа. Возможно, стоит подумать, какие из этих животных моделей наиболее подходят для моделирования на людях. Это сложное рассмотрение, и очень трудно выделить какую-либо одну модель как ту, которая наиболее точно моделирует условия жизни человека, когда само состояние человека еще не полностью изучено.Существует потребность в дальнейших исследованиях, изучающих связь между жеванием и зависимым от гиппокампа познанием на протяжении всей жизни, а также влияние старения на познание на животных моделях и на людях.
Эта работа была поддержана грантом на научные исследования Японского общества содействия науке Х.К. (№ 26462916).
Авторы заявили об отсутствии конкурирующих интересов.
1. Reitz C, Brayne C, Mayeux R. Эпидемиология болезни Альцгеймера . Nat Rev Neurol. 2011; 7 : 137-152
2. Герсторф Д., Герлитц А., Смит Дж. Стабильность половых различий в познании в пожилом возрасте: роль образования и истощения . J Gerontol B Psychol Sci Social Sci. 2006; 61 : 245-249
3. Хабиб Р., Ниберг Л., Нильссон Л.Д. Когнитивные и некогнитивные факторы, способствующие продольной идентификации успешных пожилых людей в исследовании betula . Neuropsychol Dev Cogn B Aging Neuropsychol Cogn. 2007; 14 : 257-273
4. Оно Й., Ямамото Т., Кубо К.Ю., Онозука М. Окклюзия и функция мозга: жевание как профилактика когнитивной дисфункции . J Oral Rehabil. 2010; 37 : 624-640
5. Тейшейра Ф. Б., Фернандес Л. М., Норонья, Пенсильвания. и др. . Жевательная недостаточность как фактор риска когнитивной дисфункции . Int J Med Sci. 2014; 11 : 209-214
6. Кубо К.Ю., Чен Х., Онозука М. Взаимосвязь между жеванием и познанием . В: (ред.) Ван З., Инузука Х. Старение и расстройства, связанные со старением. Риека: InTech. 2013: 115-132
7. Локер Д. Изменения жевательной способности с возрастом: 7-летнее исследование пожилых людей . J Oral Rehabil. 2002; 29 : 1021-1029
8.Симадзаки Ю., Сох И., Сайто Т. и др. . Влияние зубного ряда на физическую инвалидность, умственную отсталость и смертность у пожилых людей в специализированных учреждениях . J Dent Res. 2001; 80 : 340-345
9. Lexomboon D, Трулссон M, Wårdh I, Parker MG. Жевательная способность и потеря зубов: связь с когнитивными нарушениями в исследовании пожилого населения . J Am Geriatr Soc. 2012; 60 : 1951–1956
10.Штейн П.С., Дерозье М, Донеган С.Дж. и др. . Потеря зубов, деменция и невропатология в исследовании Nun . J Am Dent Assoc. 2007; 138 : 1314-1322
11. Хенке К. Модель систем памяти, основанная на режимах обработки, а не на сознании . Nat Rev Neurosci. 2010; 11 : 523-532
12. Onozuka M, Watanabe K, Mirbod SM. и др. . Снижение жевания стимулирует нарушение пространственной памяти и дегенерацию нейронов гиппокампа у старых мышей SAMP8 . Brain Res. 1999; 826 : 148-153
13. Онозука М., Ватанабе К., Нагасаки С. и др. . Нарушение пространственной памяти и изменения астроглиальной реакции после потери коренных зубов у старых мышей SAMP8 . Behav Brain Res. 2000; 108 : 145-155
14. Онозука М., Ватанабе К., Фудзита М., Томида М., Озоно С. Изменения в холинергической системе перегородки гиппокампа после удаления коренных зубов у пожилой мыши SAMP8 . Behav Brain Res. 2002; 133 : 197-204
15. Ватанабе К., Тоносаки К., Кавасе Т. и др. . Доказательства участия дисфункциональных зубов в старческом процессе в гиппокампе мышей SAMP8 . Exp Gerontol. 2001; 36 : 283-295
16. Мори Д., Катаяма Т., Мияке Х, Фудзивара С., Кубо К.Ю. Окклюзионная дисгармония ведет к дефициту обучения, связанному со снижением клеточной пролиферации в зубчатой извилине гиппокампа мышей SAMP8 . Neurosci Lett. 2013; 534 : 228-232
17. Ичихаши Ю., Аракава Ю., Иинума М. и др. . Окклюзионная дисгармония ослабляет отрицательную обратную связь по глюкокортикоидам у старых мышей SAMP8 . Neurosci Lett. 2007; 427 : 71-76
18. Кубо К.Ю., Ямада Ю., Иинума М. и др. . Окклюзионная дисгармония вызывает нарушение пространственной памяти и дегенерацию нейронов гиппокампа через стресс у мышей SAMP8 . Neurosci Lett. 2007; 414 : 188–191
19. Кавахата М., Оно Ю., Оно А. и др. . Утрата коренных зубов в раннем возрасте приводит к латерализации поведения и ухудшению памяти распознавания, зависящей от гиппокампа . BMC Neurosci. 2014; 15 : 4
20. Кубо К.Ю., Иваку Ф., Ватанабе К., Фудзита М., Онозука М. Безмолярные изменения шипов в области гиппокампа мышей SAMP8 . Brain Res. 2005; 1057 : 191-195
21. Кубо К.Ю., Сасагури К., Оно Ю. и др. . Жевание с ограничениями подавляет вызванное стрессом подавление рождения клеток в зубчатой извилине старых мышей SAMP8 . Neurosci Lett. 2009; 466 : 109-113
22. Ониши М., Иинума М., Тамура Ю., Кубо К.Ю. Нарушения обучаемости и подавление пролиферации клеток в зубчатой извилине гиппокампа у потомства ослабляются жеванием матери во время пренатального стресса . Neurosci Lett. 2014; 560 : 77-80
23. Хирано Ю., Обата Т., Такахаши Х. и др. . Влияние жевания на скорость когнитивной обработки данных . Brain Cogn. 2013; 81 : 376-381
24. Трулссон М., ван дер Билт А., Карлссон Г.Е. и др. . От мозга к мосту: жевательная функция и зубные имплантаты . J Oral Rehabil. 2012; 39 : 858-877
25.Клайнберг И.Л., Трулссон М., Мюррей Г.М. Окклюзия на имплантатах — есть ли проблема? . J Oral Rehabil. 2012; 39 : 522-537
26. Фарахани Р.М., Симониан М., Хантер Н. Чертеж наследственного нейросенсорного органа, обнаруженного в глиальной сети пульпы зуба человека . J Comp Neurol. 2011; 519 : 3306-3326
27. Capra NF. Механизмы орального ощущения . Дисфагия. 1995; 10 : 235-247
28. Ямамото Т., Хираяма А. Влияние кормления на мягкой диете на синаптическую плотность в гиппокампе и теменной коре головного мозга мышей с ускоренным старением . Brain Res. 2001; 902 : 255-263
29. Аоки Х, Кимото К., Хори Н., Тойода М. Пролиферация клеток в зубчатой извилине гиппокампа крысы подавляется кормлением мягкой диетой . Геронтология. 2005; 51 : 369-374
30.Ханссон П., Суннегард-Грёнберг К., Бергдал Дж. и др. . Взаимосвязь между естественными зубами и памятью у здорового пожилого населения . Eur J Oral Sci. 2013; 121 : 333-340
31. Такемура М., Сугийо С., Моритани М. и др. . Механизмы контроля орофациальной боли в центральной нервной системе . Arch Histol Cytol. 2006; 69 : 79-100
32. Мияке С, Вада-Такахаши С, Хонда Х. и др. . Стресс и жевание влияют на кровоток и уровень кислорода в мозге крысы . Arch Oral Biol. 2012; 57 : 1491-1497
33. Като Т., Усами Т., Нода Ю. и др. . Влияние потери коренных зубов на пространственную память и высвобождение ацетилхолина из теменной коры у старых крыс . Behav Brain Res. 1997; 83 : 239-342
34. Ямазаки К., Вакабаяси Н., Кобаяши Т., Сузуки Т. Влияние потери зубов на пространственную память и уровни trkB-мРНК у крыс . Гиппокамп. 2008; 18 : 542-547
35. Цуцуи К., Каку М., Мотокава М. и др. . Влияние уменьшения жевательных сенсоров от мягкого кормления на пространственную память / способность к обучению у мышей . Biomed Res. 2007; 28 : 1-7
36. Сессле Б.Дж., Адачи К., Авиви-Арбер Л. и др. . Нейропластичность первичной моторной коры лица, контроль орофациальных движений . Arch Oral Biol. 2007; 52 : 334-337
37. Малик А., Бурштейн Р. Клетки происхождения тригеминогипоталамического тракта крысы . J Comp Neurol. 1998; 400 : 125-144
38. Иинума М., Кондо Х., Курахаши М. и др. . Связь между ранним состоянием беззубости и функциональной морфологией гиппокампа . Анатомия и физиология. 2014; 4 : 3
39. De Kloet ER, Vreugdenhil E, Oitzl MS, Joëls M. Баланс рецепторов кортикостероидов мозга в состоянии здоровья и болезни . Endocr Rev. 1988; 19 : 269-301
40. Кулкарни В.А., Файрестейн БЛ. Дендритное дерево и заболевания головного мозга . Mol Cell Neurosci. 2012; 50 : 10-20
41. Пензес П, Рафалович И. Регуляция актинового цитоскелета в дендритных шипах . Adv Exp Med Biol. 2012; 970 : 81-95
42. Кун Х.Г., Дикинсон-Энсон Х., Гейдж Ф.Х. Нейрогенез в зубчатой извилине взрослой крысы: возрастное снижение пролиферации нейронов-предшественников . J Neurosci. 1996; 16 : 2027-2033
43. Кеснер Р.П. Анализ функции зубчатой извилины . Behav Brain Res. 2013; 254 : 1-7
44. Шенфельд Т.Дж., Гулд Э. Дифференциальные эффекты стресса и глюкокортикоидов на нейрогенез у взрослых . Curr Top Behav Neurosci. 2013; 15 : 139-164
45. Уцуги К., Миязоно С., Осада К. и др. . Жесткое кормление восстанавливает нейрогенез в субвентрикулярной зоне и обонятельные функции мышей, нарушенных мягким кормлением . PLos One. 2014; 9 : e97309
46.Ковач KJ. Измерение немедленной ранней активации генов c-fos и выше . J Neuroendocrinol. 2008; 20 : 665-672
47. Гузовски JF, Setlow B, Wagner EK, McGaugh JL. Экспрессия гена, зависящая от опыта, в гиппокампе крысы после пространственного обучения: сравнение немедленных ранних генов Arc, c-fos и zif268 . J Neurosci. 2001; 21 : 5089-5098
48. Хань Х, Чжао Х, Лу М. и др. . Электроакупунктура улучшает обучение и память за счет активации сигнального пути CREB в гиппокампе для ослабления апоптоза после церебральной гипоперфузии . Evid Based Complement Alternat Med. 2013; 2013 : 156489
49. Ватанабе К., Озоно С., Нишияма К. и др. . Безмолярное состояние у старых мышей SAMP8 ослабляет индукцию Fos в гиппокампе, связанную с работой водного лабиринта . Behav Brain Res. 2002; 128 : 19-25
50. Bartus RT, Dean RL 3rd, Beer B, Lippa AS. Холинергическая гипотеза дисфункции гериатрической памяти . Наука. 1982; 217 : 408-414
51. Канеко Н., Окано Х., Савамото К. Роль холинергической системы в регулировании выживания новорожденных нейронов в зубчатой извилине и обонятельной луковице взрослых мышей . гены клеток. 2006; 11 : 1145-1159
52.Mohapel P, Leanza G, Kokaia M, Lindvall O. Ацетилхолин переднего мозга регулирует нейрогенез и обучение гиппокампа взрослых . Neurobiol Aging. 2005; 26 : 939-946
53. Катаяма Т., Мори Д., Мияке Х. и др. . Влияние состояния прикуса на холинергическую систему гиппокампа у старых мышей SAMP8 . Neurosci Lett. 2012; 520 : 77-81
54. Иида С., Хара Т., Араки Д. и др. . Профиль экспрессии связанных с памятью генов гиппокампа самцов крыс, индуцированный удалением зубов и восстановлением окклюзионной поддержки . Arch Oral Biol. 2014; 59 : 133-141
55. Монси М.С., Бойл Л.М., Чжан М.Л. и др. . Экспрессия генов, связанных с памятью, в боковой миндалине и усиливает консолидацию памяти Павлова о страхе . PLoS One. 2014; 9 : e91530
56.Коэн-Кори С., Кидане А.Х., Ширки Н.Дж., Маршак С. Нейротрофический фактор мозга и развитие структурной нейрональной связи . Dev Neurobiol. 2010; 70 : 271-288
57. Вигерс А.Дж., Амин Д.С., Талли-Фарнхэм Т. и др. . Устойчивая экспрессия мозгового нейротрофического фактора необходима для поддержания дендритных шипов и нормального поведения . Неврология. 2012; 212 : 1-18
58.Родригес Дж. Дж., Йе С. Ю., Терзиева С. Комплексные и региональные изменения астроглиальных маркеров в стареющем мозге . Neurobiol Aging. 2014; 35 : 15-23
59. Парпура В., Хенека М.Т., Монтана В. и др. . Глиальные клетки в (пато) физиологии . J Neurochem. 2012; 121 : 4-27
60. Kimelberg HK. Проблема идентичности астроцитов . Neurochem Int. 2004; 45 : 191-202
61. Котрина М.Л., Недергаард М. Астроциты в стареющем мозге . J Neurosci Res. 2002; 67 : 1-10
62. Онозука М., Фудзита М., Ватанабе К. и др. . Картирование активности областей мозга во время жевания: исследование функциональной магнитно-резонансной томографии . J Dent Res. 2002; 81 : 743-746
63. Хирано Ю., Обата Т., Такахаши Х. и др. . Влияние жевания на скорость когнитивной обработки данных . Brain Cogn. 2013; 81 : 376-381
64. Hasegawa Y, Tachibana Y, Sakagami J. и др. . Модуляция церебрального кровотока с усиленным вкусом во время жевания резинки . PLoS One. 2013; 8 : e66313
65. Мория С., Тей К., Мурата А. и др. . Связь между самооценкой жевательной способности и более высокой функцией мозга у пожилых людей . J Oral Rehabil. 2011; 38 : 746-753
66. Стивенс Р., Эдельстин СМП. Умеряют ли индивидуальные различия когнитивные преимущества жевательной резинки? . Психология. 2011; 2 : 834-840
67. Listl S. Состояние здоровья полости рта и когнитивные функции в среднем и позднем взрослом возрасте . BMC Oral Health. 2014; 14 : 70
68. Бробейл А, Виард М, Петри МК. и др. . Память и PTPIP51 — новый белок в гиппокампе и мозжечке . Mol Cell Neurosci. 2015; 64 : 61-73
69. Кох П., Виард М., Стензингер А. и др. . Профиль экспрессии PTPIP51 в мозге мыши . J Comp Neurol. 2009; 517 : 892-905
70. Оно Й., Катаока Т., Мияке С. и др. . Жевание улучшает вызванное стрессом подавление долгосрочной потенциации гиппокампа . Неврология. 2008; 154 : 1352-1359
71. Оно Й., Катаока Т., Мияке С. и др. . Жевание восстанавливает подавленную стрессом долгосрочную потенциацию гиппокампа посредством активации гистаминового рецептора h2 . Neurosci Res. 2009; 64 : 385-390
72. Мияке С., Йошикава Г., Ямада К. и др. . Жевание улучшает вызванное стрессом подавление пространственной памяти за счет увеличения экспрессии рецепторов глюкокортикоидов в гиппокампе . Brain Res. 2012; 1446 : 34-39
73. Кубо К.Ю., Чен Х. Жевание как способ справиться со стрессом . Biomed Res Int. 2015; 2015 : 876409
74. Хори Н., Юяма Н., Тамура К. Укус подавляет вызванную стрессом экспрессию кортикотропин-рилизинг-фактора (CRF) в гипоталамусе крысы . J Dent Res. 2004; 83 : 124-128
75. Oitzl MS, Rechardt HM, Joëls M, de Kloet ER. Точечная мутация глюкокортикоидного рецептора мыши, препятствующая связыванию ДНК, нарушает пространственную память . Proc Natl Acad Sci USA. 2001; 98 : 12790-12795
76. Райт Р.Л., Лайтнер Е.Н., Харман Дж.С., Мейер О.К., Конрад К.Д. Снижение уровня кортикостерона в день оценки памяти предотвращает хронические стресс-индуцированные нарушения пространственной памяти . Eur J Neurosci. 2006; 24 : 595-606
77.Wiegert O, Pu Z, Shor S, Joëls M, Krugers H. Активация глюкокортикоидного рецептора избирательно препятствует зависимой от рецептора N-метил-D-аспартата синаптической пластичности гиппокампа in vitro . Неврология. 2005; 135 : 403-411
78. Онозука М., Хирано Ю., Тачибана А. и др. . Взаимодействие жевания и мозговой деятельности у человека . В: (ред.) Onozuka M, Yen CT.
