Аутоиммунные заболевания — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 мая 2019; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 мая 2019; проверки требуют 5 правок.Аутоимму́нные заболева́ния (от αὐτός [authos] «сам; он самый») — обширный класс разнородных по клиническим проявлениям заболеваний, развивающихся вследствие патологической выработки аутоиммунных антител или размножения аутоагрессивных клонов киллерных клеток против здоровых, нормальных тканей организма, приводящих к повреждению и разрушению нормальных тканей и к развитию аутоиммунного воспаления.
По механизму аутоиммунизации:
- Органоспецифичные аутоиммунные заболевания — развиваются в связи с разрушением гистогематических барьеров органов, обособленных от иммунной системы. В результате иммунная система реагирует на неизмененные антигены этих органов, вырабатывая антитела и сенсибилизированные лимфоциты, в органах развиваются изменения по типу гиперчувствительности замедленного типа: инфильтрация ткани лимфоцитами, гибель паренхимы, в финале развивается склероз. К ним относятся аутоиммунный тиреоидит (болезнь Хасимото), энцефаломиелит, полиневрит, рассеянный склероз, идиопатическая аддиссонова болезнь, асперматогения, симпатическая офтальмия и др.
- Органонеспецифичные аутоиммунные заболевания — ведущими факторами являются нарушения в системе иммунобиологического надзора. Аутоиммунизация развивается по отношению к антигенам многих органов и тканей, в которых возникают изменения, характерные для гиперчувствительности как замедленного, так и немедленного типов. К данной группе относятся системная красная волчанка, ревматоидный артрит, системная склеродермия, дерматомиозит, вторичная тромботическая тромбоцитопеническая пурпура (болезнь Мошковича) и др.
- Аутоиммунные заболевания промежуточного типа — миастения гравис, сахарный диабет I типа, тиреотоксикоз, синдром Шегрена, синдром Гудпасчера и др.[2]
Продукция патологических антител или патологических киллерных клеток может быть связана с инфицированием организма таким инфекционным агентом, антигенные детерминанты (эпитопы) важнейших белков которого напоминают антигенные детерминанты нормальных тканей организма хозяина. Именно по такому механизму развивается аутоиммунный гломерулонефрит после перенесённой стрептококковой инфекции или аутоиммунные реактивные артриты после перенесённой гонореи.
Аутоиммунная реакция может быть также связана с вызванной инфекционным агентом деструкцией или некрозом тканей или изменением их антигенной структуры так, что патологически изменённая ткань становится иммуногенной для организма хозяина. Именно по такому механизму развивается аутоиммунный хронический активный гепатит после перенесённого гепатита B.
Третья возможная причина аутоиммунной реакции — нарушение целостности тканевых (гисто-гематических) барьеров, в норме отделяющих некоторые органы и ткани от крови и, соответственно, от иммунной агрессии лимфоцитов хозяина. При этом, поскольку в норме антигены этих тканей в кровь вообще не попадают, тимус в норме не производит негативной селекции (уничтожения) аутоагрессивных лимфоцитов против этих тканей. Но это не мешает нормальному функционированию органа до тех пор, пока цел тканевой барьер, отделяющий данный орган от крови. Именно по такому механизму развивается хронический аутоиммунный простатит: в норме простата отделена от крови гемато-простатическим барьером, антигены ткани простаты в кровь не попадают, тимус не уничтожает «антипростатические» лимфоциты. Но при воспалении, травме или инфицировании простаты нарушается целостность гемато-простатического барьера и может начаться аутоагрессия против ткани простаты. По похожему механизму развивается аутоиммунный тиреоидит, так как в норме коллоид щитовидной железы в кровь также не попадает (гемато-тиреоидный барьер), в кровь высвобождается лишь тиреоглобулин со связанными с ним T3 и T4. Известны случаи, когда после перенесения травматической ампутации глаза человек достаточно быстро теряет и второй глаз (т.н. симпатическая офтальмия): иммунные клетки воспринимают ткани здорового глаза как антиген, поскольку перед этим они лизировали остатки тканей разрушенного глаза.
Аутоиммунное бесплодие[3][4] вызывается антиспермальными антителами, которые образуются при повреждении гемато-тестикулярного барьера или при анальном сексе
Четвёртая возможная причина аутоиммунной реакции организма — гипериммунное состояние (патологически усиленный иммунитет) или иммунологический дисбаланс с нарушением «селекторной», подавляющей аутоиммунитет, функции тимуса или со снижением активности T-супрессорной субпопуляции клеток и повышением активности киллерных и хелперных субпопуляций.
Аутоиммунные заболевания вызваны нарушением функции иммунной системы в целом или её отдельных компонентов.
В частности, доказано, что в развитии системной красной волчанки, миастении или диффузного токсического зоба, задействованы Т-лимфоциты супрессоры. При этих заболеваниях наблюдается снижение функции этой группы лимфоцитов, которые в норме тормозят развитие иммунного ответа и предотвращают агрессию собственных тканей организма. При склеродермии наблюдается повышение функции Т-лимфоцитов помощников (Т-хелперы), что в свою очередь приводит к развитию избыточного иммунного ответа на собственные антигены организма. Не исключено, что в патогенезе некоторых аутоиммунных заболеваний задействованы оба эти механизма, равно как и другие типы нарушений функции иммунной системы.
Большинство аутоиммунных заболеваний являются хроническими. В их развитии есть периоды: полной ремиссии, обострений и ремиссий. Как правило, хронические аутоиммунные заболевания приводят к серьёзным нарушениям функции внутренних органов и инвалидизации больного. Аутоиммунные реакции, сопровождающие различные заболевания или прием медикаментов, напротив, кратковременны и исчезают вместе с заболеванием, вызывающим их развитие.
Иммуносупрессоры: азатиоприн, преднизолон, тимодепрессин, циклофосфамид, циклоспорин.
Биологически активные агенты (считается наиболее перспективным): блокаторы ФНО-α (инфликсимаб, адалимумаб, этанерцепт), блокаторы CD40-рецепторов: ритуксимаб (мабтера), блокаторы дифференцировки T-лимфоцитов (галофугинон).
Иммуномодуляторы: альфетин, кордицепс.
- ↑ 1 2 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Струков А.И., Серов В.В. Патологическая анатомия: учебник. — 5-е изд. — М.: Литтерра, 2010. — С. 203-205. — 880 с.
- ↑ A. Heidenreich, R. Bonfig, D. M. Wilbert, W. L. Strohmaier, U. H. Engelmann. Risk factors for antisperm antibodies in infertile men // American Journal of Reproductive Immunology (New York, N.Y.: 1989). — March 1994. — Т. 31, вып. 2—3. — С. 69–76. — ISSN 1046-7408.
- ↑ Акушерство и Гинекология » Патогенез снижения фертильности при аутоиммунных реакциях против сперматозоидов (неопр.). www.aig-journal.ru. Дата обращения 23 сентября 2017.
- ↑ H. Wolff, W. B. Schill.
- ↑ B. P. Mulhall, S. Fieldhouse, S. Clark, L. Carter, L. Harrison. Anti-sperm antibodies in homosexual men: prevalence and correlation with sexual behaviour // Genitourinary Medicine. — February 1990. — Т. 66, вып. 1. — С. 5–7. — ISSN 0266-4348.
Иммунные болезни — причины, симптомы, диагностика и лечение
Болезни иммунной системы включают в себя патологические состояния, развивающиеся на фоне изменения эффекторных механизмов иммунитета. Болезни иммунной системы классифицируются с учетом активности иммунных реакций: в случае гиперреакции на внешние аллергены развиваются аллергические болезни, при извращенной реакции на собственные (эндогенные) тканевые антигены – аутоиммунные заболевания. При гипореактивности иммунной системы возникают иммунодефицитные состояния, при которых организм становится уязвимым к различного рода инфекциям. Основными органами иммунной системы являются костный мозг, тимус, селезенка, миндалины, лимфатические узлы, а также лимфоидная ткань слизистых оболочек.
Диагностикой и лечением болезней иммунной системы занимаются врачи различных специальностей: аллергическая патология и иммунная недостаточность находятся в поле зрения аллергологов-иммунологов, аутоиммунные заболевания (в зависимости от ведущего синдрома) – в компетенции специалистов-ревматологов, эндокринологов, неврологов, гастроэнтерологов, кардиологов и др. Вместе с тем, в возникновении аллергической, иммунодефицитной и аутоиммунной патологии прослеживается тесная взаимосвязь. Например, при дефиците секреторного иммуноглобулина A вначале могут развиваться хронические инфекционные поражения кожи, осложняющиеся в дальнейшем аутоиммунными заболеваниями (дерматомиозитом, ревматоидным артритом, СКВ и бронхиальной астмой.
Болезни иммунной системы, при которых развивается состояние иммунодефицита, могут быть первичными – врожденными или наследственными и вторичными – приобретенными. К первой группе относятся агаммаглобулинемия, лимфоцитарная дисгенезия, синдром Луи-Бар, синдром Вискотта–Олдрича и др. Вторичные иммунодефициты могут развиваться на фоне инфекционных, лимфопролиферативных, метаболических заболеваний, интоксикации, облучения, приема лекарственных препаратов (иммунодепрессантов, кортикостероидов). При них может повреждаться клеточное или/и гуморальное звено иммунитета, система фагоцитоза. Самой известной формой вторичного иммунодефицита является СПИД (ВИЧ-инфекция).
Общими проявлениями, сопровождающими различные иммунодефициты, служат рецидивирующие инфекции — пневмонии, инфекции мочевыводящих путей, менингит, генерализованный кандидоз, герпес, фурункулез и др. Иммунодефицитные состоянии часто сочетаются с аллергическими болезнями — экземой, отеком Квинке. На сегодняшний день доказано, что врожденные дефекты или приобретенный дефицит каких-либо иммунных факторов играют ведущую роль в развитии многих онкологических заболеваний. Пациенты с выраженной иммунной недостаточностью часто погибают от оппортунистических инфекций.
Для выявления или подтверждения иммунодефицита необходимо специальное лабораторное исследование иммунного статуса: определение численности и морфологии лимфоцитов, содержания иммуноглобулинов в сыворотке крови, исследование системы комплемента, определение специфических антител и др. Может быть показано проведение биопсии лимфатических узлов, рентгенографии органов грудной клетки, УЗИ тимуса и селезенки. Лечение болезней иммунной системы, протекающих с иммунологической недостаточностью, предусматривает заместительную терапию (введение иммуноглобулинов, сывороток, трансплантацию костного мозга), иммунокоррекцию, иммуномодуляцию.
Особую категорию болезней иммунной системы составляют аутоиммунные нарушения. При данной группе заболеваний клетки иммунной системы проявляют аутоагрессию по отношению к тканям собственного организма. Распространенность аутоиммунных заболеваний чрезвычайно высока – ими страдает около 5-7% населения планеты. Болезни иммунной системы с аутоаллергическим механизмом делятся на органоспецифические – при них аутоантитела направлены против конкретного органа-мишени (аутоиммунный гастрит, аутоиммунный тиреоидит, аутоиммунный гепатит и др.), неорганоспецифические – в этом случае аутоантитела могут атаковать разные органы и ткани (склеродермия, СКВ, ревматоидный артрит и др.) и смешанные.
Триггерами, запускающими каскад иммунопатологических реакций, могут выступать бактериально-вирусные инфекции, радиационное воздействие, лекарственные и токсические вещества, стресс. Ряд аутоиммунных заболеваний обусловлен наследственными факторами. Для многих болезней иммунной системы данной группы характерны боли в суставах и мышцах, кожная сыпь, набор или потеря веса, утомляемость, повышенная кровоточивость или склонность к тромбозам, лихорадка, мышечная слабость. Большинство аутоиммунных заболеваний имеет неуклонно прогрессирующее течение, и без соответствующего лечения они могут привести к тяжелой инвалидизации.
Наиболее ценными методами диагностики болезней аутоиммунного характера являются лабораторные исследования, направленные на выявление в крови аутоантител к различным тканям, циркулирующих иммунных комплексов, острофазовых белков, компонентов системы комплемента, генетических маркеров. Поскольку многие антитела не являются специфичными для той или иной патологии, а обнаруживаются при целом ряде болезней иммунной системы, лабораторная диагностика всегда дополняется инструментальными методами (рентгенографией, УЗИ, эндоскопией, сцинтиграфией, биопсией и др.). В последние годы достигнут заметный прогресс в лечении болезней иммунной системы. Традиционный подход включает проведение иммуносупрессорной терапии, противовоспалительной терапии кортикостероидами, эфферентной терапии (гемодиализ, плазмаферез, гемосорбция). По показаниям выполняется хирургическое лечение (спленэктомия при гемолитической анемии, перикардэктомия при аутоиммунном перикардите, тиреоидэктомия при аутоиммунном тиреоидите и т. д.). Очень обнадеживающие перспективы открывает трансплантация CD34+ аутологичных стволовых гемопоэтических клеток.
В разделе «Иммунные болезни» справочника «Красота и Медицина» собран подробный перечень иммунодефицитных и аутоиммунных патологий. Ознакомившись с ними, читатель получит исчерпывающую информацию о причинах, течении, современных возможностях диагностики и лечения заболеваний.
далее…Что такое аутоиммунные заболевания простыми словами и список болезней
Содержание
- 1 Что это такое и причины развития
- 2 Основные симптомы
- 3 Список болезней
- 4 Какой врач может поставить диагноз
- 5 Основные методы лечения
- 6 Профилактика
Аутоиммунные заболевания — это патологии, которые возникают при сбое в работе защитных сил организма. С подобными болезнями чаще сталкиваются женщины, чем мужчины.
Что это такое и причины развития
Аутоиммунные патологии возникают по причине нарушений в организме, которые может спровоцировать ряд факторов. Чаще всего в основе лежит наследственная предрасположенность. Иммунные клетки, вместо чужеродных агентов, начинают атаковать ткани различных органов. Часто такой патологический процесс происходит в щитовидной железе и суставах.
Необходимые вещества не успевают восполнять полученные потери от разрушающего воздействия собственной иммунной системы. Спровоцировать подобные нарушения в организме могут:
- вредные условия труда;
- вирусные и бактериальные инфекции;
- генетические мутации во время внутриутробного развития.
Основные симптомы
Аутоиммунные процессы в организме проявляются в виде:
- выпадения волос;
- воспалительного процесса в суставах, органах ЖКТ и щитовидной железе;
- тромбозов артерий;
- многочисленных выкидышей;
- болей в суставах;
- слабости;
- кожного зуда;
- увеличения пораженного органа;
- нарушений менструального цикла;
- болей в животе;
- нарушений пищеварения;
- ухудшения общего состояния;
- изменений веса;
- нарушений мочеиспускания;
- трофических язв;
- усиление аппетита;
- изменений настроения;
- психических расстройств;
- судорог и дрожания конечностей.
Аутоиммунные нарушения провоцируют бледность, аллергические реакции на холод, а также сердечно-сосудистые патологии.
Список болезней
Самые часто встречающиеся аутоиммунные болезни, причины возникновения которых схожи:
- Очаговая алопеция — происходит облысение, так как иммунитет атакует волосяные фолликулы.
- Аутоиммунный гепатит — возникает воспаление печени, так как ее клетки попадают под агрессивное воздействие Т-лимфоцитов. Происходит изменение окраски кожи на желтый, причинный орган увеличивается в размере.
- Целиакия — непереносимость глютена. При этом на употребление злаковых организм отвечает бурной реакцией в виде тошноты, рвоты, диареи, метеоризма и болей в желудке.
- Диабет 1 типа — иммунная система поражает клетки, продуцирующие инсулин. При развитии данного заболевания человека постоянно сопровождает жажда, повышенная утомляемость, ухудшение зрения и т. д.
- Болезнь Грейвса — сопровождается повышенной выработкой гормонов щитовидной железой. При этом возникают такие симптомы, как эмоциональная нестабильность, дрожание рук, бессонница, сбои в менструальном цикле. Может происходить повышение температуры тела и снижение массы тела.
- Болезнь Хашимото — развивается в результате снижения выработки гормонов щитовидной железой. При этом человека сопровождает постоянная усталость, запоры, чувствительность к низким температурам и т. д.
- Синдром Джулиана-Барре — проявляется в виде поражения нервного пучка, соединяющего спинной и головной мозг. По мере прогресса заболевания может развиться паралич.
- Гемолитическая анемия — иммунная система разрушает эритроциты, в результате чего ткани страдают от гипоксии.
- Идиопатическая пурпура — происходит разрушение тромбоцитов, в результате чего страдает свертывающая способность крови. Появляется повышенный риск возникновения кровотечений, длительных и обильных менструаций и гематом.
- Воспалительные заболевания кишечника — это болезнь Крона или неспецифический язвенный колит. Иммунные клетки поражают слизистую оболочку, провоцируя возникновение язвы, которая протекает с кровотечениями, болями, потерей веса и др. нарушениями.
- Воспалительная миопатия — происходит поражение мышечной системы. Человек испытывает слабость и чувствует себя неудовлетворительно.
- Рассеянный склероз — собственные клетки иммунитета поражают оболочку нерва. При этом нарушается координация движений, могут возникнуть проблемы с речью.
- Билиарный цирроз — разрушается печень и желчные протоки. Появляется желтый оттенок кожи, зуд, тошнота и др. нарушения пищеварения.
- Миастения — в зону поражения входят нервы и мышцы. Человек постоянно ощущает слабость, любое движение дается с трудом.
- Псориаз — происходит разрушение клеток кожи, в результате слои эпидермиса распределяются неправильно.
- Ревматоидный артрит — системное аутоиммунное заболевание. Защитные силы организма атакуют оболочку суставов. Болезнь сопровождается дискомфортом во время движения, воспалительными процессами.
- Склеродермия — происходит патологическое разрастание соединительной ткани.
- Витилиго — разрушаются клетки, вырабатывающие меланин. При этом кожа окрашивается неравномерно.
- Системная красная волчанка — в зону поражения входят суставы, сердце, легкие, кожа и почки. Заболевание протекает крайне тяжело.
- Синдром Шегрена — иммунной системой поражаются слюнные и слезные железы.
- Антифосфолипидный синдром — повреждается оболочка сосудов, вен и артерий.
Какой врач может поставить диагноз
Иммунолог — врач, который специализируется на лечении подобных патологий. Специалист учитывает анализ крови пациента, который подтверждает или опровергает предполагаемый диагноз. Дополнительно могут потребоваться консультации:
- уролога;
- терапевта;
- ревматолога;
- эндокринолога;
- дерматолога;
- невролога;
- гематолога;
- гастроэнтеролога.
Основные методы лечения
Лечение аутоиммунных патологий направлено на облегчение симптомов заболеваний. Для этого нередко назначают обезболивающие медикаменты, такие как: Ибупрофен, Анальгин, Спазмалгон и др. Важным этапом в лечении является восполнение дефицита необходимых веществ, которые должны вырабатываться в норме. Например, при сахарном диабете назначают инъекции инсулина, а при снижении функции щитовидной железы соответствующие гормоны.
Главным в лечении таких видов заболеваний является подавление активности иммунитета. Это необходимо для того, чтобы защитные клетки полностью не разрушили ткани органа и не спровоцировали опасных для жизни осложнений. В данном случае иммуносупрессоры подавляют выработку антител. Такие препараты назначает только врач, так как при неправильном их приеме можно спровоцировать ряд опасных последствий, в том числе и присоединение инфекции.
Профилактика
Для того чтобы снизить риск возникновения аутоиммунных заболеваний, необходимо вести здоровый образ жизни, отказавшись от вредных привычек. Важно не принимать без назначения врача никакие сильнодействующие медикаменты. Необходимо снизить количество стрессов, чаще отдыхать и бывать на свежем воздухе.
Питание в качестве профилактики играет решающую роль. Рекомендуется употреблять больше свежих фруктов и овощей, круп и кисломолочных продуктов. Необходимо отказаться от канцерогенов, жиров и ГМО.
Большую роль играет своевременная терапия инфекционных и вирусных патологий. Не рекомендуется запускать заболевания и заниматься самолечением. Следует больше двигаться и избегать гиподинамии. Если существует генетическая предрасположенность к аутоиммунным заболеваниям, то важно 1 раз в год бывать на приеме у иммунолога и следить за состоянием организма.
Иммунные заболевания список, способы лечения, механизм защиты
20:05:22 - 11.03.2020

Человек имеет очень сложный и уникальный организм и его строение. Одну из самых главных ролей в организме играет иммунная система. На сегодняшний день заболевания иммунной системы встречаются чаще, нежели другие заболевания в организме. Задача иммунитета в организме заключается в том, чтоб защитить его от микробов и различных вирусов. Вырабатываться она начинает с первых дней жизни человека, а значит, с рождения. Как правило, иммунитет становится слабым в то время, когда в организм попадают различные вирусы и инфекции, или же возникновение каких либо патологий. Ослабевший иммунитет приводит к иммунным заболеваниям. Самочувствие человека напрямую зависит от иммунитета. Если организм здоров и крепок, то он может справиться самостоятельно с вирусными и инфекционными заболеваниями, при этом, иммунная система только укрепляется. Специалисты различают два вида иммунитета, а какие это виды, и как себя обезопасить от инфекций, поговорим чуть ниже
Первый тип иммунитета — неспецифический, как называют «базовый»; это наследственный иммунитет, который выработан с самого зачатия, еще находясь внутри матери, например слизистая оболочка.
Ко второму типу относят — специфический иммунитет; это именно тот иммунитет, который вырабатывается уже в процессе жизни. Когда наш иммунитет встречается с бактериями или вирусами, то бесследно его уничтожает, а информацию передает всем клеткам во все организме человека
Бывают случаи, когда иммунитет не опознаёт вирус, с которым уже сталкивался, это такие вирусы, как, грипп или ОРВИ
Заболевания иммунной системы
Ученые очень долго боролись с различными болезнями, забыв о том, что существует иммунитет, который сам может справиться с данной задачей. Разнообразные антибиотики и препараты конечно же улучшают состояние человека, но это временное состояние, да и очаг заболевания он не уничтожает. Причиной постоянным заболеваниям является иммунные заболевания. Как показывает практика, занимаясь лечением с помощью антибиотиков, не думаем о том, что на другие органы организма они влияют с не очень хорошей стороны, например, сажаются почки, печень и сердце, и это не все перечисленные органы. После того, как человек «вылечился», он начинает страдать еще хуже, чем было до этого… Вопросы об иммунных заболеваниях обсуждаются в первую очередь, так как хорошая и здоровая иммунная система — это залог долгой и здоровой жизни
Инфекционные и иммунные заболевания
Существует два вида заболеваний иммунной системы:
- аутоиммунные — это заболевания, при которых иммунитет разрушает свой организм. В этом случае заболевания очень опасны, так как влияют на весь иммунитет целиком. Говоря на обычном языке, организм убивает сам себя. Ученые до сих пор не выявили причины такого вида заболеваний. В процессе возникают такие болезни, как: аллергия, склероз, волчанка. Если вовремя восстановить иммунную систему организма, то модно избежать разные виды болезней и патологий
- иммунодефицитные — им характерны не эффективная и пассивная работа иммунитета. Причиной, чаще всего, является нарушение координации между клетками, или их отсутствие и вовсе. Данные заболевания имеют много сил, поэтому иммунитет работает плохо и не может с ними справиться. Иммунодефициты различают по двум видам: первичным и вторичным
К первичному виду относятся заболевания иммунной системы, которые несут наследственный характер, а значит передаются по наследству. К вторичному относятся те заболевания, которые развились в результате процесса жизнедеятельности. Такие заболевания могут нести множество осложнений, последствий и патологий. Практика показывает, что к последствиям бактериальным, относят такие заболевания, как холера или лепра, а к вирусным — гепатит, ВИЧ, или кори. Кроме всего этого, патологии могут возникать из-за плохой и токсичной окружающей среды. Токсичные отходы и их воздух влияет на наш организм разрушая защиту иммунитета, и появляются такие заболевания, как: астма, бронхит, гепатит, диабет, СПИД
Симптомы заболевания иммунной системы
Как показывает практика, заболевания иммунной системы на начальных этапах ее развития практически невозможно, даже не все доктора могут определить заболевание на начальной стадии ее развития. Изначальна, иммунные заболевания схожи с обычными вирусными заболеваниями или же с воспалительным процессом, поэтому качество лечения иммунной системы в дальнейшем снижается. Симптомами данного заболевания, это слабость, сонливость и выпадение волос. Спустя некоторое время после лечения, люди только начинают понимать, что проблема их недомогания скрыта намного глубже, а на этот момент, заболевания иммунитета перестают в хроническую. Для того, чтобы не столкнуться с подобными ситуациями, необходимо проходить обследование ежегодно, это спасет от различных негативных для вас процессов в организме
Список иммунных заболеваний
На сегодняшний день, ученые и врачи отдают не мало времени на изучения иммунных заболеваний. Препараты для лечения данного недуга постоянно меняется и пополняется, но все же, все советуют заботиться о здоровье с самого раннего возраста. Важно укреплять иммунитет с самого рождения, в будущем, различные известные заболевания будут обходить стороной, так как иммунная система очень крепка и защищена. Любые открытия приводят к одному итогу: для того, чтобы иммунитет всегда был крепким, необходимо правильное питание, витамины на основе трав, но не антибиотики, а также различные микроэлементы. Доктора знают большое количество препаратов для укрепления иммунной системы, в составе которых нет химических элементов и растворов
Как сделать правильный выбор среди большого разнообразия таблеток?
Главной задачей является помочь организму. Бывают случаи, когда помогая одному, вы наносите вред другому. Наше долголетие зависит лишь от того, как ответственно вы подходите к лечению или поддержанию своего организма, правильно ли вы выбираете то, что необходимо иммунной системе. Не стоит забывать, что лечение различными препаратами может назначить только специалист, но не редко случается, что у людей нет на это времени, и в такие случаи приходит на помощь обычные природные ингридиенты, которые помогают укрепить иммунитет не нанося никакого вреда каки либо другим органам в организме. С давних времен люди пользуются травами, которые приносят лишь пользу как взрослому, так и юному организму. Самыми популярными и распространёнными считаются:
- алоэ, придает организму силу и энергию
- чеснок; хорошее противомикробное воздействие на организм
- кардицепс, гриб, который повышает иммунитет
Как вылечить заболевания иммунитета с помощью Трансфер Фактора
Если вы хотите, чтоб ваш иммунитет сохранялся таким же здоровым, или немного увеличить и придать себе сил, то вопрос о лечении иммунных заболеваний должен у вас стоят в первую очередь. Многие задаются вопросом; как поднять свой иммунитет? Для восстановления или поднятия иммунитета существуют множество витаминов и препаратов, так как иммунология изучает именно такие вопросы
Практически все врачи твердят, что необходимо употреблять натуральные витамины, и вести здоровый образ жизни, это и является залогом хорошего и крепкого иммунитета. В последнее время все чаще начали упоминать препарат Трансфер Фактор. За последнее десятилетие его быстро раскупают, так как с ним, лечение дает отличные положительные результаты. Министерство здравоохранения рекомендовал употребление данного препарата с самого рождения. Наверняка, многие сейчас задают вопрос: что это за препарат и как он работает? Попробуем ответить! Это не препарат который лечит, скорее он просто защищает иммунную систему. Попадая в организм, молекулы определяют заболевания, связанные с иммунитетом, различные вирусы или бактерии. После того, как определены инфекции в организме, он способствует их устранению, при этом просто помогая организму, чтоб он все это сделал самостоятельно. Многие препараты подобные этому, устраняют подобные проблемы вместе с молекулами иммунитета, а Трансфер Фактор лишь укрепляет клетки иммунитета, для того, чтобы он самостоятельно справился с вирусом или инфекцией
На сегодняшний день еще не созданы аналоги этого препарата. Лечение с помощью данного препарата дает желаемые результаты в том, где раньше не удавалось добиться каких либо результатов и вовсе. Препарат имеет несколько воздействий на организм, кроме как укреплять иммунную систему. Он также обладает эффектом омолаживания организма, помогает быть устойчивым к перепадам температуры, а также может выявить сразу же вирус, который только-только попал в организм. Любой медикамент имеет свои показания, и этот не исключение. Список показаний данного препарата очень большой, его рекомендуют принимать как для профилактики, так и при лечении самых страшных и сложных болезней. Чем популярен препарат, так тем, что его можно сочетать с любыми другими, а это значит: при лечении какого либо заболевания вы пьете прописанные доктором лекарства, а вместе с ними употребляете и Трансфер Фактор, то действия препаратов на больной организм в целом станут более мощными, а вскоре приведут к быстрому выздоровлению. Не стоит забывать, что болезни связанные с иммунной системой могут развиваться не только один день, но и год, а для того, чтобы они развивались, необходимо укреплять иммунитет заранее, и чем раньше вы это начнете делать, тем лучше будете себя чувствовать в будущем. Данный препарат специалисты называют препаратом будущего! Многие уже испробовали этот препарат, каких результатов они добились вы можете посмотреть на странице нашего официального сайта
Препарат очень прост в применении, но вопросы связанные с тем, как принимать препарат и каковы его дозировки, вы можете задать их позвонив на номер 8-925-045-0003. Если у вас нет возможности позвонить, то можно оформить заявку для обратной связи. Стоит отметить, что доставить товар можно в любую точку России в самые кратчайшие сроки
Аутоиммунные заболевания и препараты для их лечения
Аутоиммунными называется широкая группа заболеваний, которые объединяет то, что иммунная система организма начинает атаковать его собственные клетки и ткани. Поскольку иммунная система крайне сложна, то и сломаться в ней может любая её часть. Атаке может подвергнуться любая ткань организма, в настоящий момент насчитывается более восьмидесяти аутоиммунных заболеваний, ими страдают 5% населения. Мы поговорим об их классификации, подходах к лечению и перспективах.
Почему возникают аутоиммунные заболевания?
В норме иммунная система должна защищать организм от инфекций и других заболеваний. Для этого ей нужно уметь отличать вредоносные агенты (бактерии, паразиты, раковые клетки, заражённые вирусом клетки и т. п.) от безопасных — здоровых клеток своего организма, пыльцы, пищи, бактерий, которые живут в кишечнике и др. Однако нередки случаи, когда из-за какого-то дефекта иммунная система не может отличить своё от чужого. Точная причина таких сбоев до сих пор неизвестна. Но сейчас учёные уже в общих чертах разобрались, как иммунная система в здоровом организме обучается отличать антигены (молекулы, способные вызвать иммунный ответ) своего организма от чужих и что именно происходит при нарушении этих процессов.
Первые клетки иммунной системы, которые сталкиваются с «аномальными» агентами — это клетки врождённого иммунитета (дендритные и другие), которые постоянно находятся во всех тканях и поглощают любые подозрительные объекты. Затем эти клетки мигрируют в лимфоузлы и представляют фрагменты поглощённых белков на своей поверхности T-лимфоцитам — клеткам адаптивного (или приобретённого) иммунитета.
Врождённая иммунная система не способна к обучению и запоминанию, в отличие от адаптивного иммунитета, способного к обучению и формированию иммунологической памяти. Главные действующие лица адаптивного иммунитета — B- и T-лимфоциты. В здоровом организме существует довольно много таких клеток, они формируются в основном в эмбриональном периоде и способны связываться с широким спектром молекул. До встречи с конкретными возбудителями сила связывания недостаточно высока для возбуждения иммунного ответа, такие лимфоциты называются наивными.
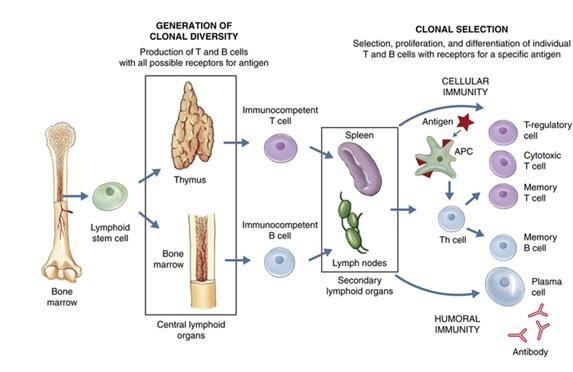 Рис. 1. Схема развития и активации иммунных клеток. Предшественники лимфоцитов мигрируют из костного мозга в тимус, где дают начало T-клеткам, или остаются в костном мозге, давая начало B-клеткам. После встречи с антигеном (красная звёздочка) дендритная клетка (АРС — antigen presenting cell) представляет фрагменты антигена наивной T-клетке (Th cell), которая даёт начало зрелым популяциям T-клеток и стимулирует B-клетки. Из наивных B-клеток получаются плазматические клетки, продуцирующие антитела, и B-клетки памяти.
Рис. 1. Схема развития и активации иммунных клеток. Предшественники лимфоцитов мигрируют из костного мозга в тимус, где дают начало T-клеткам, или остаются в костном мозге, давая начало B-клеткам. После встречи с антигеном (красная звёздочка) дендритная клетка (АРС — antigen presenting cell) представляет фрагменты антигена наивной T-клетке (Th cell), которая даёт начало зрелым популяциям T-клеток и стимулирует B-клетки. Из наивных B-клеток получаются плазматические клетки, продуцирующие антитела, и B-клетки памяти.Когда дендритная клетка встречается в лимфоузле с наивными T-лимфоцитами, те из них, которые проявляют сродство к чужеродному агенту, активируются, в них начинается процесс мутации генов, кодирующих рецептор для узнавания этих чужеродных агентов, и происходит отбор популяций T-лимфоцитов со всё большим сродством к ним (Рис. 1). Далее высокоспецифичные T-лимфоциты размножаются, помогают образованию антител против возбудителя и обе ветви иммунитета — врождённый и приобретённый — эффективно уничтожают возбудитель. Этот процесс занимает несколько дней, именно поэтому, например, грипп проходит не сразу, а только после стадии повышения температуры и воспаления. Воспаление играет важную роль в этом процессе: оно развивается под действием цитокинов (сигнальных белков), выделяемых всеми иммунными клетками, и характеризуется покраснением, болью, отёком воспалённого органа и температурой. «Нормальное» воспаление всегда должно завершаться, поэтому на его поздней стадии иммунные клетки вырабатывают противовоспалительные цитокины. Затем часть лимфоцитов преобразуются в клетки памяти, и таким образом организм приобретает иммунитет к данному возбудителю.
Почему же лимфоциты здорового человека не реагируют на собственные молекулы? Это обеспечивается механизмами центральной и периферической толерантности.
В эмбриональном периоде, когда образуются наивные лимфоциты, их специфичность (то есть то, против каких молекул они направлены) определяется путём случайных мутаций. Те лимфоциты, которые срабатывают против своих молекул, либо уничтожаются, либо становятся регуляторными клетками, призванными оберегать свои ткани от атаки иммунной системы. Это механизм центральной толерантности.
Существует также периферическая толерантность, которая контролирует те аутореактивные (специфичные против «своего») лимфоциты, которым удалось проскочить через сито центральной толерантности. Так, практически во всех органах имеются регуляторные T-клетки.
Толерантность в норме вырабатывается не только по отношению к антигенам собственного организма, но и по отношению к тем внешним агентам, на которые не должна возникать иммунная реакция: микрофлору, пищу, вдыхаемые частицы, плод в утробе матери. Особенно сложная задача у клеток иммунитета возникает в слизистых оболочках, там, где организм контактирует с внешней средой и где необходимо отличать патогенные микроорганизмы от неопасных и полезных симбиотических. В этих местах, особенно в кишечнике, выстроена многослойная система, определяющая, насколько велика опасность, исходящая от чужеродного агента.
Так почему же, несмотря на многочисленные системы защиты собственных белков от иммунной системы, лимфоциты иногда всё же выходят из-под контроля и начинают атаковать своё? Простого ответа на этот вопрос не существует. Аутоиммунные заболевания возникают, как правило, в результате сочетания генетических факторов и воздействия внешней среды. Наиболее понятная, но не единственная причина — инфекции. В некоторых случаях белки патогенов имеют сходство с какими-то белками организма, и когда иммунная система реагирует на инфекционный агент, реакция «перебрасывается» и на свои белки. К тому же, во время инфекций может произойти активация аутореактивных клеток, которые не были уничтожены в ходе развития толерантности, а находились в неактивном состоянии. Травмы, курение, некоторые химические вещества или облучение ультрафиолетом1 также могут спровоцировать аутоиммунное заболевание, так как антигены, которые были раньше недоступны для иммунной системы, вследствие стрессового воздействия могут стать ей доступны. Женщины по не вполне понятным причинам страдают от аутоиммунных заболеваний более чем в два раза чаще мужчин.
Есть гипотеза, связывающая рост числа аутоиммунных заболеваний в XX веке с распространением гигиены и снижением количества паразитов в организме человека (так называемая гигиеническая гипотеза). Иммунная система в первый год жизни испытывает меньше контактов с чужеродными антигенами, что снижает её способность вырабатывать к ним толерантность. Более подробно эта гипотеза освещена в статье по ссылке.
Сейчас также много внимания уделяется роли микробиома в аутоиммунных заболеваниях. Если при таких расстройствах, как воспалительные заболевания кишечника, она очевидна, то механизмы влияния населяющих кишечник бактерий на мозг и другие отдалённые органы пока только начинают изучаться. Во всяком случае, до каких-то практических результатов здесь пока очень далеко.
Генетические факторы возникновения аутоиммунных заболеваний пока изучены недостаточно, можно говорить лишь о некоторых корреляциях. Как правило, аутоиммунные заболевания ассоциированы с мутациями не одного гена, а сразу многих. Чаще всего — это гены главного комплекса гистосовместимости (МНС), которые кодируют белки, отвечающие за взаимодействие антигенов с компонентами иммунной системы.
Таким образом, видно, что баланс между активацией иммунного ответа и толерантностью, — это тонкий динамический процесс, который регулируется множеством механизмов, и неудивительно, что они порой ломаются.
Классификация аутоиммунных заболеваний (АЗ)
Клинические проявления аутоиммунных заболеваний очень разные, и только в прошлом веке учёные и врачи пришли к выводу, что их объединяет что-то общее. С середины XX века, по мере развития инструментальных методов клеточной и молекулярной биологии, за различными проявлениями непохожих друг на друга заболеваний стали проступать общие черты — реакция иммунной системы на свои антигены и следующий за этим хронический воспалительный процесс.
АЗ можно разделить на орган-специфичные, те, которые поражают какой-то один орган или одну систему, и на системные, поражающие организм в целом. В таблице ниже приводятся некоторые аутоиммунные заболевания вместе с предполагаемыми антигенами и клиническими проявлениями.
| Заболевание | Основной орган | Аутоантигены | Клинические проявления |
|---|---|---|---|
| Орган-специфичные аутоиммунные заболевания | |||
| Рассеянный склероз | Центральная нервная система | Основный белок миелина, олигодендроцитарный белок миелина | Потеря зрения, слабость конечностей, нарушения слуха, недержание мочи |
| Болезнь Крона | Кишечник | Микробные антигены | Кровавый понос, брюшная боль |
| Язвенный колит | Толстый кишечник | Микробные антигены | Кровавый понос, брюшная боль |
| Диабет I типа | Поджелудочная железа | Белки островковых клеток, инсулин, декарбоксилаза глутаминовой кислоты | Патологическая жажда, голод, чрезмерное выделение мочи, потеря веса |
| Псориаз | Кожа | Кератин | Покраснение, шелушение кожи, зуд | Системные аутоиммунные заболевания |
| Синдром Шегрена | Слюнные и слёзные железы | Ядерные антигены (SSA, SSB) | Высыхание роговицы, полости рта, поражение лёгких и почек |
| Ревматоидный артрит | Суставы, лёгкие, иногда нервы | Определённые пептиды в суставах | Деформирующий артрит, кожные узелки, иногда — поражение лёгких и нервов |
| Системная красная волчанка | Почки, кожа, суставы, центральная нервная система | ДНК, гистоны, рибонуклеопротеины | Артрит, кожный зуд, почечная недостаточность, поражение нервов |
| Целиакия | Тонкий кишечник | Глютен2 | Диарея, диспепсия, дистрофия |
Нередко бывает, что у человека развивается более одного аутоиммунного заболевания, так, у 33% пациентов с псориазом развивается псориатический артрит.
Ранее считалось, что астма и аллергические заболевания не относятся к аутоиммунным, так как в патогенезе астмы и аллергии главная роль принадлежит тучным клеткам и специальному виду антител — IgE (иммуноглобулин Е). Однако сейчас появилось много данных в пользу того, что аутоиммунные механизмы играют существенную роль в развитии этих болезней, в частности, у многих больных обнаруживают антитела против собственных белков и снижение количества регуляторных T-клеток, характерное для аутоиммунных заболеваний [1].
Тем не менее, далее мы не будем рассматривать астму и аллергии, хотя ряд подходов к лечению аутоиммунных заболеваний применим и к астме.
История подходов к лечению
Несмотря на то, что в основе всех аутоиммунных заболеваний лежат одни и те же процессы нарушения толерантности, человечество пока не научилось лечить все их единообразным способом. Поскольку поражаются разные органы, для каждого заболевания существуют свои подходы, хотя есть и пересечения. В большинстве случаев речь идёт не об излечении от заболевания, а о борьбе с симптомами или, в лучшем случае, замедлении ухудшения. Правда, у многих пациентов наступает стойкая длительная ремиссия, но заранее нельзя предсказать, поможет ли стандартная терапия данному пациенту или состояние будет со временем ухудшаться.
Неясно, почему препараты, которые очень хорошо работают при одних заболеваниях, не помогают при других, хотя, казалось бы, механизм действия должен обеспечивать эффективность. Для доказательства эффективности и безопасности всех новых лекарств требуются тщательно спланированные, длинные исследования на большом количестве пациентов, которые чаще всего заканчиваются неудачей.
Однако некоторые препараты всё же доказали свою эффективность: расскажем подробнее о некоторых из них. Мы не преследуем цель дать полный обзор нынешнего состояния или дать какие-то рекомендации пациентам, а хотим продемонстрировать то, как успехи фундаментальных наук привели к появлению лекарств, помогающих зачастую очень тяжёлым пациентам.
В XX веке, одновременно с изучением причин аутоиммунных болезней, начали применять подходы, основанные на снятии воспаления и иммуносупрессии. Они и сейчас представляют собой первые линии терапии3 таких болезней, как ревматоидный артрит, болезнь Крона, язвенный колит, псориаз и другие.
Как правило, руководства по лечению аутоиммунных заболеваний предписывают начинать лечение с более лёгких препаратов — например, местных в случае псориаза, пероральных нестероидных противовоспалительных в случае других заболеваний. Если болезнь перестаёт прогрессировать или даже отступает, в более сильных средствах нет необходимости, а иногда препараты можно даже отменить. Однако некоторые больные не отвечают на первые линии терапии, и тогда требуются более сильные препараты: теперь это чаще всего инъекционные биопрепараты, которые обычно к тому же дороги. Эти лекарства прицельно воздействуют на отдельные элементы иммунной системы и подавляют именно те клетки, которые принимают активное участие в патогенезе. Конечно, высокая эффективность идёт рука об руку с нежелательными явлениями, поэтому врачи всегда взвешивают соотношение пользы и риска, прежде чем начать лечение такими сильными препаратами.
Особняком стоит лечение диабета I типа — здесь пациентам сразу требуются инъекции инсулина, без которого ткани не способны усваивать глюкозу. Другие терапевтические подходы также специфичны для диабета и направлены на снижение уровня глюкозы, поэтому далее диабет I типа мы не рассматриваем.
Исторически первыми препаратами, которые произвели революцию в лечении ряда аутоиммунных и воспалительных заболеваний, стали кортикостероиды — производные и аналоги стероидных гормонов надпочечников. Это всем известные преднизон, дексаметазон, бетаметазон и многие другие. С 1950-х годов они стали применяться для лечения таких заболеваний, как псориаз, ревматоидный артрит, язвенный колит, рассеянный склероз и др. Однако нежелательные явления при приёме кортикостероидов (а они влияют на множество систем организма, вызывая проблемы с сердцем, костями, метаболизмом и пр.) заставили искать более безопасные средства в случае лёгких форм заболеваний. Тем не менее стероиды применяются и сейчас у тяжёлых больных и в случае непереносимости более лёгких препаратов. Правда, и стероиды, и нестероидные противовоспалительные препараты (такие как аспирин и ибупрофен) не способны остановить прогрессию заболевания, а в основном помогают снять симптомы — воспаление и боль.
При псориазе возможно топическое применение препаратов, то есть в виде мазей, кремов. Поскольку вещества в этом случае практически не проникают в системный кровоток, можно применять сразу довольно сильные препараты: кортикостероиды и антрациклины. Антрациклины — это антибиотики, которые нарушают структуру ДНК и приводят к гибели активно делящихся клеток. Неудивительно, что их используют для лечения онкологических заболеваний. Однако поскольку такие препараты действуют на любые делящиеся клетки, под удар попадают не только клетки опухоли, но и клетки кишечного эпителия (что вызывает, например, диарею), волосяных луковиц (что вызывает облысение) и иммунной системы. Если в случае онкологических заболеваний воздействие на иммунную систему может приводить к тяжёлым побочным эффектам, то при аутоиммунных заболеваниях иммуносупрессия — основной терапевтический механизм антрациклинов и других подобных веществ.
Основой терапии язвенного колита и болезни Крона (которые объединяют под общим названием «Воспалительные заболевания кишечника») стал месалазин (мезаламин, 5-аминосалициловая кислота, 5-ASA) — производное аспирина, также введённое в обращение в 1950-х годах. Это же действующее вещество образуется в организме из сульфасалазина, который применяется для лечения и воспалительных заболеваний кишечника, и ревматоидного артрита.
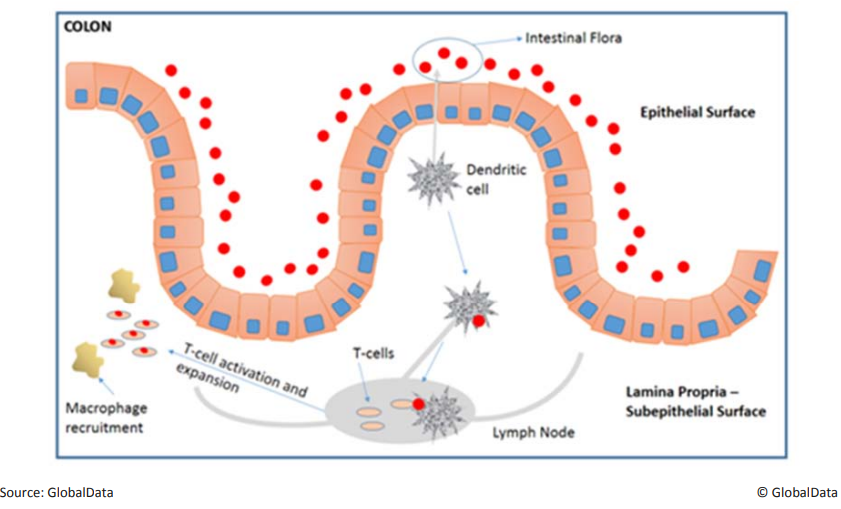 Рис. 2. Механизм развития воспалительных заболеваний кишечника. Кишечная микрофлора (красные кружки) захватывается дендритными клетками, воспринимается как чужеродный объект и в лимфоузле презентируется T-клеткам. T-клетки активируются и делятся, привлекают макрофаги, в кишечнике возникает иммунный ответ.
Рис. 2. Механизм развития воспалительных заболеваний кишечника. Кишечная микрофлора (красные кружки) захватывается дендритными клетками, воспринимается как чужеродный объект и в лимфоузле презентируется T-клеткам. T-клетки активируются и делятся, привлекают макрофаги, в кишечнике возникает иммунный ответ.Ещё один важнейший препарат — метотрексат — был синтезирован в 1947 году, но сначала применялся только как противоопухолевое средство, и только с 1980-х годов начал использоваться при ревматоидном артрите, язвенном колите и псориазе. Как и в случае других лекарств, синтезированных до наступления эпохи таргетных препаратов (конец 1990-х годов), его механизм действия до конца неизвестен, но ясно, что он снижает активность T- и B-лимфоцитов и при этом подходит для длительного применения, так как относительно безопасен.
![Рис. 3. История изучения псориаза и появления лекарств против него [2]](/800/600/https/22century.ru/wp-content/uploads/2019/09/p3.png) Рис. 3. История изучения псориаза и появления лекарств против него [2].
Рис. 3. История изучения псориаза и появления лекарств против него [2].Целый ряд других иммуносупрессивных химиопрепаратов, полученных во второй половине XX века, применяется при том или ином аутоиммунном заболевании: это 6-меркаптопурин, циклоспорин, такролимус, азатиоприн и др. Все они действуют достаточно неизбирательно, останавливая рост и уничтожая не только иммунные клетки, но и прочие делящиеся клетки организма, поэтому вызывают много побочных эффектов. Некоторые пациенты не отвечают на лечение первыми линиями терапии или начинают лечиться уже в довольно тяжёлом состоянии. До конца XX века у них практически не было опций терапии, пока не были разработаны таргетные4, в первую очередь, биологические препараты. Об этих препаратах мы и поговорим в следующем разделе.
Новые препараты
Первым биологическим таргетным препаратом стало моноклональное антитело infliximab (Remicade), зарегистрированное в 1998 году. Оно вводится внутривенно и связывает TNF-alpha — один из основных воспалительных цитокинов. Infliximab удаляет TNF-alpha из кровотока, тем самым снижая воспаление и задерживая развитие болезни.
Вслед за infliximab на рынок вышли действующие похожим образом etanercept (Enbrel) и adalimumab (Humira). Эти три препарата в начале 2000-х годов были зарегистрированы по ряду аутоиммунных заболеваний — псориазу, ревматоидному артриту, воспалительным заболеваниям кишечника (кроме etanercept). Данные препараты в последнее десятилетие возглавили список лидеров по объёму продаж в мире — их суммарный объём продаж превышает 30 млрд долларов (или 3,6% всего мирового рецептурного рынка лекарств в 2018 году).
Конечно, у таких сильных препаратов есть и недостатки. Так как TNF-alpha — один из основных воспалительных цитокинов, он необходим для нормальной борьбы иммунной системы с инфекциями, поэтому его удаление из организма может снизить сопротивляемость организма инфекциям и злокачественным образованиям. Особенно опасны реактивация латентных инфекций, таких как туберкулёз, против которого организм становится практически беззащитен, и редкие случаи развития лимфом.
Вслед за ними стали доказывать свою эффективность и доходить до пациентов и другие таргетные препараты, как низкомолекулярные, так и биологические. Так, в случае ревматоидного артрита у части пациентов anti-TNF-препараты оказываются неэффективными, и тогда им назначают антитела против ещё одного воспалительного цитокина — интерлейкина-6 (IL-6), которые впервые вышли на рынок в 2008 году [3]. С 2012 года на рынке также есть низкомолекулярный пероральный (проще говоря, таблетка) ингибитор белка JAK. Это внутриклеточный фермент, участвующий в воспалительных сигнальных путях в клетках иммунной системы. Его подавление снижает производство воспалительных цитокинов и замедляет развитие заболевания [4].
При псориазе с 2009 года также используются биопрепараты, удаляющие интерлейкины, но другие — IL-17 и IL-23, в связи с тем, что при разных аутоиммунных заболеваниях активация клеток иммунной системы происходит по-разному. А с 2014 года на рынок вышла малая молекула apremilast (Otezla), ингибирующая внутриклеточный фермент фосфодиэстеразу-4, которая снижает выработку иммунными клетками интерлейкинов-17 и -23, TNF-alpha и ещё одного воспалительного цитокина, интерферона-гамма.
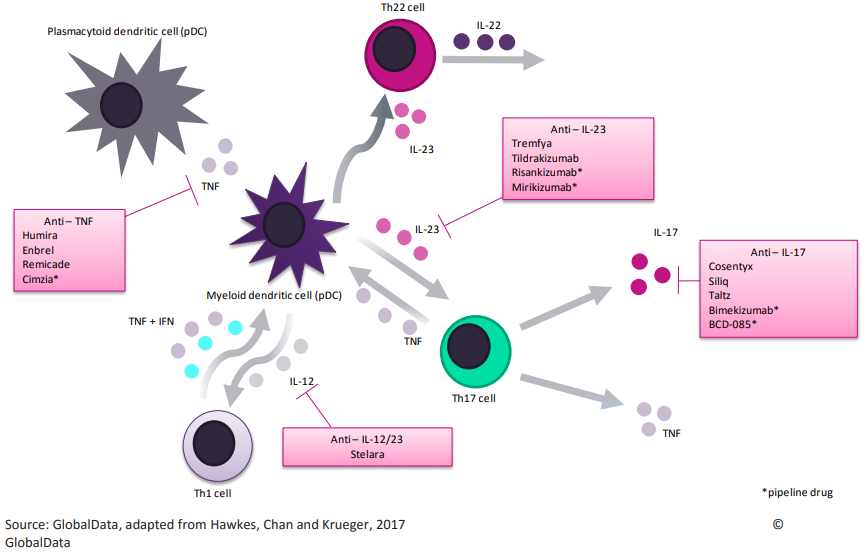 Рис. 4. Взаимное влияние различных клеток иммунной системы и цитокинов при псориазе. В розовых прямоугольниках приведены лекарства, подавляющие отдельные элементы. Звёздочкой отмечены препараты, ещё не вышедшие на рынок.
Рис. 4. Взаимное влияние различных клеток иммунной системы и цитокинов при псориазе. В розовых прямоугольниках приведены лекарства, подавляющие отдельные элементы. Звёздочкой отмечены препараты, ещё не вышедшие на рынок.А вот при воспалительных заболеваниях кишечника, помимо anti-TNF, используется несколько другой подход, не связанный с удалением цитокинов. При этих заболеваниях важную роль в развитии аутоиммунного воспаления играют T-клетки, которые мигрируют из кровеносных сосудов, снабжающих кишечник, в область поражения. Один из рецепторов, который использует для этого T-клетка — α4β7-интегрин, взаимодействующий с рецептором на поверхности эндотелиальной клетки (клетка стенки кровеносного сосуда) и затем проникающий в область контакта между двумя эндотелиальными клетками. Блокирование этого взаимодействия с помощью антитела vedolizumab (Entyvio) снижает количество T-клеток в тканях кишечника, что позволяет задержать прогрессию болезни. По похожему принципу действует антитело natalizumab (Tysabri), однако при воспалительных заболеваниях кишечника оно вызывало слишком много нежелательных явлений, поэтому применяется только при рассеянном склерозе, где профиль безопасности оказался более благоприятным.
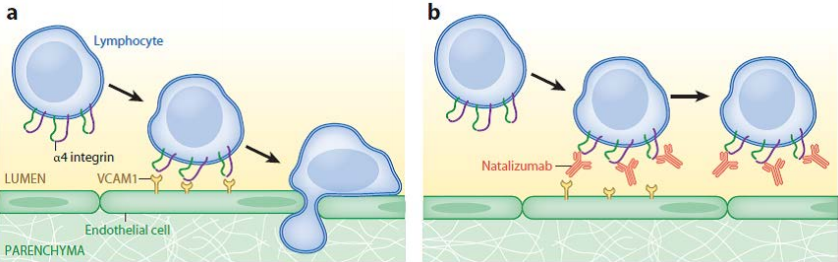 Рис. 5. Механизм действия Tysabri (natalizumab). a. Лимфоцит прикрепляется к стенке кровеносного сосуда благодаря взаимодействию α4-интегрина на поверхности лимфоцита и VCAM1 на поверхности эндотелиальной клетки, проникает через гематоэнцефалический барьер в паренхиму мозга и разрушает миелиновые оболочки нейронов. b. Natalizumab блокирует взаимодействие α4-интегрина и VCAM1, снижая проникновение лимфоцитов в мозг.
Рис. 5. Механизм действия Tysabri (natalizumab). a. Лимфоцит прикрепляется к стенке кровеносного сосуда благодаря взаимодействию α4-интегрина на поверхности лимфоцита и VCAM1 на поверхности эндотелиальной клетки, проникает через гематоэнцефалический барьер в паренхиму мозга и разрушает миелиновые оболочки нейронов. b. Natalizumab блокирует взаимодействие α4-интегрина и VCAM1, снижая проникновение лимфоцитов в мозг.Рассеянный склероз также стоит отдельно от других аутоиммунных заболеваний, так как здесь объектом атаки иммунной системы становится головной мозг — наиболее сложный орган, находящийся к тому же за гематоэнцефалическим барьером. Тем удивительнее, что для рассеянного склероза за последнее десятилетие было зарегистрировано много довольно эффективных препаратов. До 2010-х годов основными препаратами для терапии рассеянного склероза (РС) были бета-интерфероны и Копаксон. Бета-интерфероны применяются с 1993 года и до сих пор на первой линии лечения РС. Это природные цитокины, обладающие противовоспалительными свойствами, однако механизм их действия неясен. Они обладают умеренной эффективностью в плане снижения количества обострений рассеянного склероза, многие пациенты плохо их переносят, потому что они вызывают повышение температуры и другие симптомы, похожие на грипп.
Ещё более загадочный препарат — глатирамера ацетат (Копаксон), зарегистрированный в 1996 году. Это в каком-то смысле уникальное лекарство, потому что представляет собой полимер из четырёх аминокислот, идущих в случайном (!) порядке. Предполагаемый механизм действия таков: четыре аминокислоты — лизин, глутаминовая кислота, аланин и тирозин — наиболее часто встречаются в основном белке миелина (myelin basic protein, MBP), против которого у многих пациентов с РС развивается иммунный ответ. Каким-то образом введение Копаксона индуцирует появление вне ЦНС регуляторных T-клеток, мигрирующих в мозг и снижающих там иммунный ответ на MBP.
С середины двухтысячных годов выходят на рынок моноклональные антитела для лечения рассеянного склероза, построенные на рациональном подходе к модуляции иммунной системы (насколько это возможно при нашем пока ещё слабом понимании её работы).Помимо упомянутого выше Tysabri, это alemtuzumab (Lemtrada), который связывается с белком CD52 на поверхности T- и B-клеток, что приводит к их уничтожению. Затем происходит восстановление популяции лимфоцитов из предшественников, но по неизвестной причине новые лимфоциты оказываются уже не настолько агрессивными против своих белков в мозге, как до уничтожения, поэтому заболевание протекает легче. Примерно по тому же принципу действует антитело daclizumab (Zinbryta), уничтожающее только активированные T-клетки, связываясь с белком CD25 на их поверхности, и антитела против белка CD20, уничтожающие B-клетки.
Параллельно с антителами для лечения РС разрабатывались и малые молекулы с довольно оригинальным механизмом действия. Fingolimod (Gilenya) связывается с рецептором S1P1 на T-лимфоцитах и задерживает их выход из лимфоузлов. Таким образом, в крови становится меньше активных T-лимфоцитов, следовательно, они меньше попадают в ЦНС и их негативное воздействие снижается. Препарат оказался эффективнее интерферонов, однако в клинических исследованиях и после выхода на рынок отмечались случаи внезапной смерти, главным образом, из-за сердечно-сосудистых осложнений. Поэтому на первой линии лечения РС Gilenya, как правило, не применяется.
Самым поразительным примером смены области применения молекулы в фармацевтической индустрии является, наверное, диметилфумарат (Tecfidera). Эта молекула использовалась с 1950-х готов для травли моли в мебели, но потом была запрещена, так как вызывала аллергию. Также её применяли для лечения псориаза, однако широкого распространения она не получила. Обычно фармкомпании скептически относятся к новой разработке уже известных молекул, у которых истёк срок действия патентной защиты на химическую структуру, так как есть опасность, что выведенная на рынок после дорогостоящих исследований молекула будет тут же скопирована и на её основе будут сделаны дженерики5. Однако компания Biogen рискнула, в 2003 году она приобрела права на диметилфумарат и взялась за его дальнейшую разработку против РС, полагаясь на патентную защиту состава таблетки и метода использования. Клинические исследования неожиданно для многих закончились успешно (механизм действия этого препарата ещё менее понятен), и в 2013 году препарат удачно вышел на рынок: за неполный первый год продажи составили 800 млн долл. Во многом это произошло благодаря очень высокой безопасности препарата при схожей эффективности с конкурентами.
Перспективы
Несмотря на ряд препаратов с новыми механизмами действия, появившихся за последнее десятилетие, неудовлетворённая потребность в лечении аутоиммунных заболеваний по-прежнему велика. Излечивающих способов терапии нет, а имеющиеся средства хотя и способны замедлить ухудшение состояния, но помогают далеко не всем или плохо переносятся некоторыми пациентами.
Много надежд возлагалось и возлагается на так называемую передовую терапию: генные и клеточные технологии. Исследования в области различных популяций T-клеток привели к открытию регуляторных T-клеток, которые должны обеспечивать периферическую толерантность и снижать активность аутореактивных T-клеток. Однако ряд провалов в клинических исследованиях по введению таких клеток пациентам с рассеянным склерозом и диабетом I типа привёл к определённому скептицизму в этой области [5]. Тем не менее, разработки продолжаются и, возможно, успехи в умении манипулировать толерогенными клетками приведут к появлению работающих средств передовой терапии [6].
Единственная клеточная терапия, зарегистрированная при аутоиммунном заболевании, — стволовые клетки, полученные из жировой ткани здоровых доноров. Они используются по очень узкому показанию: у определённой подгруппы пациентов с болезнью Крона. Данный продукт, Alofisel (darvadstrocel), вышел на рынок в 2018 году и показал значимое увеличение доли пациентов с ремиссией в группе терапии (49,5%) по сравнению с группой плацебо (34,3%). Довольно высокий процент в плацебо-группе объясняется неравномерным течением заболевания с высокой частотой спонтанных ремиссий. Здесь играет роль множество факторов: например, в исследование пациенты включаются в момент обострения, а потом у многих из них активность болезни снижается. Играет роль также эффект включения в исследования, когда пациент начинает лучше следить за собой и выполнять все указания врачей. Неравномерное и очень гетерогенное течение аутоиммунных заболеваний — одна из проблем разработки лекарств против них: требуются долговременные наблюдения над большими группами пациентов, чтобы доказать, что лекарство действительно работает. Другая важная проблема — отсутствие достаточно качественных доклинических моделей аутоиммунных заболеваний, так как иммунная система человека (как и мозг) уникальна, то есть ни одно исследование на других видах животных не может предсказать всех эффектов у человека.
Потенциально излечивающая терапия, возможно, будет разработана для диабета I типа: уже сейчас в клинических исследованиях изучают трансплантированные бета-клетки островков Лангерганса поджелудочной железы (именно они поражаются при аутоиммунном процессе), защищённые от иммунной системы внешней капсулой [7].
Несмотря на то, что в клинических исследованиях сейчас находятся более 300 продуктов для лечения аутоиммунных заболеваний, по-настоящему новых и революционных на поздних стадиях исследований немного. В основном речь идёт о расширении показаний уже вышедших на рынок агентов (например, применение JAK-ингибиторов в псориазе), разработке более безопасных, удобных и дешёвых аналогов имеющихся препаратов.
Более интересные разработки связаны с воздействием на новые мишени иммунной системы с целью их «переучивания» в регуляторные или на генетическую модификацию T-лимфоцитов, но эти технологии пока находятся в самом начале исследований. Можно быть уверенными, что большинство таких разработок провалится, однако какая-то часть, возможно, доберётся до рынка и принесёт пользу пациентам.
Делается всё больше попыток не просто подавить иммунную систему, но одновременно с этим регенерировать повреждённые ткани. Так, в разработке по рассеянному склерозу находится антитело против LINGO-1 — рецептора на поверхности предшественников олигодендроцитов, клеток, которые вырабатывают миелин. По идее разработчиков, стимуляция этого рецептора позволит подстегнуть производство олигодендроцитов и снова миелинизировать те нервные волокна, которые лишились миелиновой оболочки в результате аутоиммунной атаки.
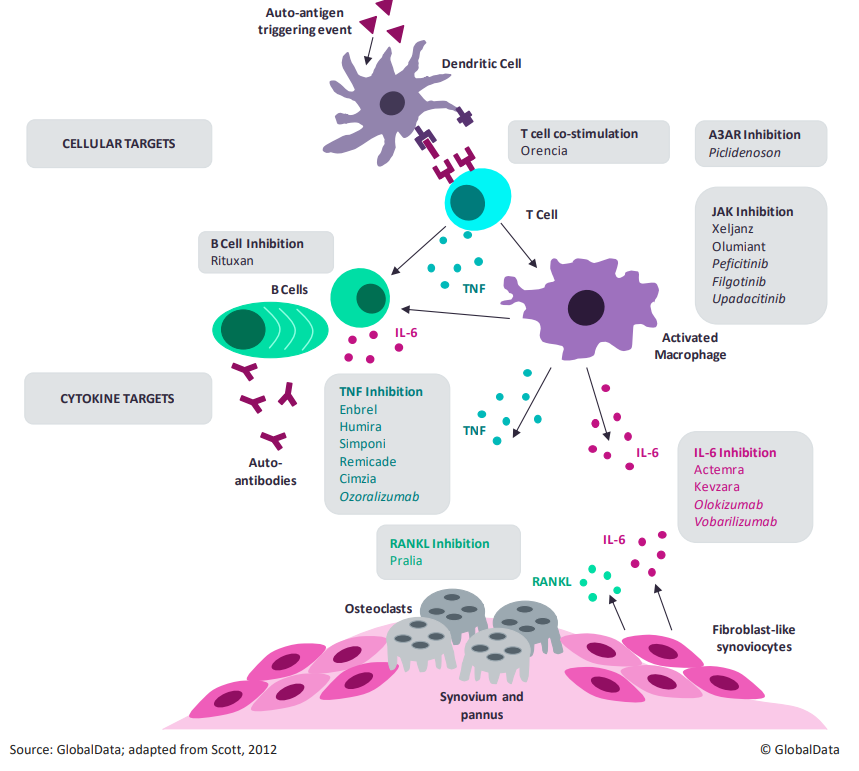 Рис. 6. Сеть взаимодействий между клетками иммунной системы, сустава и цитокинами при ревматоидном артрите. В серых прямоугольниках — лекарства, которые воздействуют на эти элементы. Курсивом выделены те препараты, которые ещё не вышли на рынок. Видно, что новые разработки воздействуют на те же элементы патогенеза, что и имеющиеся лекарства.
Рис. 6. Сеть взаимодействий между клетками иммунной системы, сустава и цитокинами при ревматоидном артрите. В серых прямоугольниках — лекарства, которые воздействуют на эти элементы. Курсивом выделены те препараты, которые ещё не вышли на рынок. Видно, что новые разработки воздействуют на те же элементы патогенеза, что и имеющиеся лекарства.Заключение
Мы выборочно рассмотрели несколько заболеваний и ряд продуктов, чтобы показать, насколько динамично развивается область терапии аутоиммунных заболеваний. Вместе с тем мы находимся только в самом начале понимания того, как работает иммунная система и тем более как её модулировать. Препараты разрабатываются почти вслепую, хотя, конечно, не совсем наугад, как это было до наступления 21 века.
Литература
- Tedeschi A, Asero R. Asthma and autoimmunity: a complex but intriguing relation. Expert Rev Clin Immunol. 2008 Nov;4(6):767—76.
- Gooderham MJ, Papp KA, Lynde CW. Shifting the focus — the primary role of IL-23 in psoriasis and other inflammatory disorders. J Eur Acad Dermatol Venereol JEADV. 2018 Jul;32(7):1111—9.
- Mócsai A, Kovács L, Gergely P. What is the future of targeted therapy in rheumatology: biologics or small molecules? BMC Med. 2014 Mar 13;12(1):43.
- Hodge JA, Kawabata TT, Krishnaswami S, Clark JD, Telliez J-B, Dowty ME, Menon S, Lamba M, Zwillich S. The mechanism of action of tofacitinib — an oral Janus kinase inhibitor for the treatment of rheumatoid arthritis. Clin Exp Rheumatol. 2016 Apr;34(2):318—28.
- Mosanya CH, Isaacs JD. Tolerising cellular therapies: what is their promise for autoimmune disease? Ann Rheum Dis. 2019 Mar 1;78(3):297—310.
- Romano M, Fanelli G, Albany CJ, Giganti G, Lombardi G. Past, Present, and Future of Regulatory T Cell Therapy in Transplantation and Autoimmunity. Front Immunol [Internet]. 2019 [cited 2019 Sep 3];10. Available from: https://www.frontiersin.org/articles/10.3389/fimmu.2019.00043/full
- Hering BJ, Clarke WR, Bridges ND, Eggermann TL, Alejandro R, Bellin MD, Chaloner K, Czarniecki CW, Goldstein JS, Hunsicker LG, Kaufman DB, Korsgren O, Larsen CP, Luo X, Markmann JF, Naji A, Oberholzer J, Posselt AM, Rickels MR, Ricordi C, Robien MA, Senior PA, Shapiro AMJ, Stock PG, Turgeon NA. Phase 3 Trial of Transplantation of Human Islets in Type 1 Diabetes Complicated by Severe Hypoglycemia. Diabetes Care. 2016 Jul 1;39(7):1230—40.
- https://www.fiercepharma.com/pharma/top-10-all-time-biggest-selling-drugs-by-2024
- https://www.immunopaedia.org.za/immunology/advanced/2-central-peripheral-tolerance/
- https://www.webmd.com/a-to-z-guides/autoimmune-diseases
Примечания
1 Имеется в виду прежде всего загар. Однако, хотя ультрафиолет (УФ) и является для некоторых заболеваний фактором риска, в случае других расстройств это скорее положительный фактор. В частности, следует помнить, что УФ стимулирует выработку витамина D, низкий уровень которого коррелирует с повышенным риском рассеянного склероза, системной красной волчанки и диабета I типа.
2 Целиакия стоит особняком, так как глютен — не аутоантиген, а белок, содержащийся в злаках, и поступает он с пищей. Однако иммунная реакция на него типична для аутоиммунных заболеваний. Вместе с тем болезнь проходит, если человек придерживается безглютеновой диеты.
3 Линиями терапии в медицине называются последовательные этапы применения все более «тяжёлых» (то есть более эффективных, но и менее безопасных) препаратов по мере того, как предыдущие этапы перестают работать.
4 Под таргетным понимается препарат, разработанный для воздействия на определённую мишень, известную заранее, и действующий преимущественно на неё.
5 Воспроизведённые препараты, имеющие то же действующее вещество, что и оригинальный препарат.
Виды заболеваний иммунной системы, причины и лечение
 В нашем организме есть уникальная система охраны, защиты и саморегуляции. Мы не можем существовать замкнуто, отгородившись от всего мира, мы вынуждены ежесекундно контактировать с миллионами вирусов и бактерий. Единственная причина, по которой мы остаемся в живых, это наша иммунная система. Это чуткая самообучающаяся система, которая не только защищает нас от атак извне, но и дирижирует работой всех подсистем организма.
В нашем организме есть уникальная система охраны, защиты и саморегуляции. Мы не можем существовать замкнуто, отгородившись от всего мира, мы вынуждены ежесекундно контактировать с миллионами вирусов и бактерий. Единственная причина, по которой мы остаемся в живых, это наша иммунная система. Это чуткая самообучающаяся система, которая не только защищает нас от атак извне, но и дирижирует работой всех подсистем организма.
Но, к сожалению, наша иммунная система также может страдать, заболевания иммунной системы приводят к дисбалансу всего организма. Большинство заболевания прогрессируют именно из-за ослабленного иммунитета. Но самое интересное, что слишком сильный, гипер активный иммунитет, тоже может стать проблемой. Итак, проблемы с иммунитетом делят на две большие группы: иммунодефицитные заболевания – ослабленный иммунитет, и аутоиммунные заболевания – слишком активный иммунитет. Далее мы рассмотрим каждую проблему в отдельности.
Иммунодефицитные заболевания
Как правило, это замедленная реакция иммунитета на возникшую проблему, либо ее полное отсутствие. Происходит это в результате общего ослабления организма. Признаки иммунодефицита просты: любая ранка долго заживает, гноится, вы простываете от любого сквозняка и.т.д. Данные заболевания делят на две подгруппы.
А) Врожденный иммунодефицит. Чаще всего это генетическая предрасположенность, наследственное. В пример можно привести аплазию тимуса, иммунитет не способен к самообучению, синдром Висконта – Олдрича. Как следствие врожденного иммунодефицита, может наблюдаться замедление физического развития.
Б) Приобретенный иммунодефицит. Само название говорит о том что заболевание получило развитие, из-за каких то действий самого человека. Часто это могут быть осложнения после перенесенных тяжелых заболеваний. К ним можно отнести проказу, холеру, гепатит, корь. Также иммунодефицит может развиться после облучения, химиотерапии, лечения антибиотиками, либо гормонами, кортикостероидами.
Аутоиммунные заболевания
 Следующая группа, но не менее опасная. Считается что иммунодефицит можно поправить, но аутоиммунное заболевание это чаще всего приговор на всю жизнь. Причины развития аутоиммунных заболеваний очень многообразны. Это и злоупотребление алкоголем, и антибиотики, окружающая среда, питание, злоупотребление иммуностимуляторами, стрессы, лекарства разного вида и многое другое. Среди аутоиммунных заболеваний можно назвать все виды аллергий, тиреоидит, псориаз, экзема, рассеянный склероз и др.
Следующая группа, но не менее опасная. Считается что иммунодефицит можно поправить, но аутоиммунное заболевание это чаще всего приговор на всю жизнь. Причины развития аутоиммунных заболеваний очень многообразны. Это и злоупотребление алкоголем, и антибиотики, окружающая среда, питание, злоупотребление иммуностимуляторами, стрессы, лекарства разного вида и многое другое. Среди аутоиммунных заболеваний можно назвать все виды аллергий, тиреоидит, псориаз, экзема, рассеянный склероз и др.
Перечислять заболевания, в основании которых лежит расстройство иммунитета можно очень долго, это практически все известные болезни. На самом деле наша иммунная система довольно гибка, ее можно тренировать и обучать. Все мы знаем золотое правило, любую болезнь легче предотвратить, чем лечить. Такие простые действия как зарядка, или утренняя пробежка, многое могут решить. Ведите активный образ жизни, следите за своим питанием, закаляйтесь, наконец. Старайтесь избегать стрессов, насколько это возможно.
К сожалению, для многих, особенно для жителей мегаполисов, этого недостаточно. Мы каждый день подвергаемся стрессам. Нас отравляют угарными газами, атмосфера в городах отравлена всевозможными токсинами. Наш иммунитет, атакуемый со всех сторон, просто не в силах справиться. А что говорить про тех людей, у которых проблемы с иммунитетом преследуют от рождения. Начиная с 20-х годов до 90-х, в нашей стране действовал закон, запрещающий матери передать иммунный опыт своему ребенку. Детей не прикладывали к груди, пока не отойдет молозиво, в котором содержаться молекулы передачи иммунного опыта – трансфер факторы.
К счастью теперь у нас есть возможность тренировать наш иммунитет, обучить его, выровнять чашу весов. С открытием Трансфер Фактора, началась новая эра – эра надежды. Люди научились извлекать эти молекулы, носители иммунной памяти, из молозива коров и куриных желтков. Субстанций самых богатых этими молекулами. Препарат компании 4Life, Трансфер Фактор это не панацея от всех болезней, сам по себе он не лечит ничего. Это препарат обучающий наш иммунитет. Как ему самым лучшим образом решить любую проблему.
весов. С открытием Трансфер Фактора, началась новая эра – эра надежды. Люди научились извлекать эти молекулы, носители иммунной памяти, из молозива коров и куриных желтков. Субстанций самых богатых этими молекулами. Препарат компании 4Life, Трансфер Фактор это не панацея от всех болезней, сам по себе он не лечит ничего. Это препарат обучающий наш иммунитет. Как ему самым лучшим образом решить любую проблему.
Уникальность Трансфер Фактора в том, что он является действительным иммунокорректором, он применим и при иммунодефицитах и при аутоиммунных заболеваниях.
Применение Трансфер Фактора одобрено Министерством Здравоохранения РФ, для монотерапии и комплексного лечения заболеваний иммунной системы.
Трансфер Фактор купить, и получить консультацию, вы можете на нашем сайте, либо связавшись с нашими консультантами по т. +7 (495) 544 80 59

Аутоиммунное заболевание: Как снизить активность болезни
Все аутоиммунные заболевания представляют собой такую активацию иммунитета, которая приводит к сильному росту уровня воспаления в организме. Именно поэтому для людей, страдающих от аутоиммунного расстройства, важным шагом может быть снижение циркуляции провоспалительных Th-17 и преобразование этих клеток в T-рег. Подробнее — читайте далее…
Известно, что иммунные клетки Т-хелперы CD4+ возникают из «наивных» Т-клеток, и в зависимости от локализации антигена, способны трансформироваться в Th-1 и Th-2 типы клеток, а также в тип Th-17. Такие Th-17 представляют собой клетки, поддерживающие и индуцирующие воспаление, а другие клетки под наименованием — Т-рег, так называемые регуляторные, наоборот, снижают воспаление. При этом возможно преобразование Th-17 в T-рег.
Как с помощью клеток Th-17 развивается аутоиммунное заболевание
Все аутоиммунные заболевания представляют собой такую активацию иммунитета, которая приводит к сильному росту уровня воспаления в организме. Именно поэтому для людей, страдающих от аутоиммунного расстройства, важным шагом может быть снижение циркуляции провоспалительных Th-17 и преобразование этих клеток в T-рег.
модель клеточной дифференцировки из наивных cd4 т-клеток
Но для того, чтобы началась трансформация «наивных» Т-клеток в другие типы, требуется воздействие цитокинов. Ученые считают, что такие цитокины, как TGF-b и IL-6 (возможно и цитокины IL-23 и IL-1b) способствуют превращению T-клеток в провоспалительные или противовоспалительные клетки. Интересен момент, что именно цитокин IL-23 способен определить, вызовут ли воспалительные клетки Th-17 аутоиммунное заболевание.
Сами воспалительные клетки Th-17 производят цитокин IL-17, а также Фактор некроза опухоли (ФНО). В свою очередь цитокин IL-17 увеличивает выработку кинуренина, который часто обнаруживается в повышенных уровнях при синдроме раздраженного кишечника, способствует росту окислительного стресса и приводит к депрессии.
Th27 клетки иммунной системы влияют на развитие аутоиммунного заболевания Кинуренин является метаболитом аминокислоты триптофана, используемой в производстве ниацина. L-кинуренин представляет собой основное вещество, вырабатываемое при метаболизме триптофана, и способен превращаться в нейропротективную кинуреновую кислоту или в нейротоксические агенты хинолиновой кислоты.
Изменение баланса содержания этих эндогенных соединений наблюдается при многих заболеваниях. Подобный дисбаланс происходит при нейродегенеративных расстройствах, таких как болезнь Паркинсона, болезнь Хантингтона и болезнь Альцгеймера, инсульт, эпилепсия, рассеянный склероз, боковой амиотрофический склероз, шизофрения и депрессия.
Подписывайтесь на наш аккаунт в INSTAGRAM!
Кинуреновая кислота блокирует NMDA, AMPA, глутамат и никотиновые рецепторы, которые имеют важное значение для обучения и памяти. Именно поэтому повышенная выработка кинуреновой кислоты способна сделать нас глупее, а подавление выработки этой кислоты позволяет улучшить работу мозга и восстановить процесс обучения и запоминания.
Цитокин IL-17 способен усиливать действие фактора некроза опухоли (ФНО) и воспалительного цитокина Il-1. Зачастую повышенная выработка IL-17 связана с развитием аллергических реакций. IL-17 активирует выработку многих воспалительных веществ в организме, например, способствует сужению дыхательных путей у людей с астмой.
Сама выработка воспалительных клеток Th-17 обладает циркадным ритмом. Производство Th-17 усиливается в полночь и снижается во время светового дня.
Подобный ритм легко проследить на примере такого аутоиммунного заболевания, как болезнь Бехтерева, когда в людей с этой болезнью болевые ощущения в суставах увеличиваются именно в ночное время.
Но не стоит считать, что клетки Th-17 и вырабатываемый ими цитокин IL-17 представляют собой только отрицательный фактор. Известно, что Th-17 обладают защитной ролью против грибков и некоторых бактериальных инфекций, что некоторые ученые связывают с триггером активации аутоиммунных заболеваний от воздействия микроорганизмов (инфекций). Более того, увеличение выработки клеток Th-17 обладает неким противоопухолевым свойством, что показывает на некий компромисс между аутоиммунным заболеванием и развитием рака.
Ученые обнаружили, что у людей с пищевой аллергией проявляется нарушение в производстве клеток Th-17, способствуя росту числа этих клеток. Исследования показали, что уровень выработки цитокина IL-17 является достаточно точным биомаркером толерантности к пищевым антигенам. Например, у здоровых людей уровень IL-17A составляет около 0,89 пг/мл, а у людей с апноэ сна этот уровень уже достигает от 1,02 до 1,62 пг/мл.
Риски аутоиммунных заболеваний у мужчин и женщин
Воспалительные процессы протекают с разной интенсивностью у мужчин и женщин
Оказалось, что женщины более восприимчивы к развитию аутоиммунных заболеваний, чем мужчины. К подобным болезням можно отнести: рассеянный склероз (соотношение заболевших женщин к мужчинам 2:1), реаматоидный артрит (2:1), системная красная волчанка (9:1), синдром Шегрена (9:1), тиреодит Хасимото (9:1).
Подобное повышенное развитие аутоиммунных заболеваний у женщин связано, скорее всего, с тем, что организм женщины способен создавать более высокий иммунный ответ, чем это делает организм мужчины. Кроме того, женщины имеют более высокий уровень клеток Th-1, которые считаются воспалительными. Подобное можно наблюдать при реакции женщин на прививки, когда их иммунный ответ более явно выражен, чем у мужчин. Женщины склонны к Th-1 доминированию, а мужчины к доминированию Th-17. Это происходит потому, что мужские андрогены тормозят (снижают) доминирование Th-1 и увеличивают количество Th-17.
Если же провести кастрацию самцов, например мышей, то у таких особей происходит усиление Th-1 иммунного ответа и снижение продукции цитокинов от клеток типа Th-2.
Какие заболевания связаны с повышением количества Th-17 лимфоцитов
Доминирование выработки и циркуляции клеток Th-17 приводит к развитию множества нарушей здоровья, в частности развиваются:
- Тиреодит Хасимото
- Склерозы
- Волчанка
- Уевит
- Диабет 1-го типа
- Системная склеродермия
- Аутоиммунный миокардит
- Витилиго
- Ишемическая болезнь сердца (в некоторых случаях)
- Ревматоидный артрит
- Рассеянный склероз
- Астма
- Воспаления дыхательных путей
- Болезнь Крона
- Язвенный колит
- Апноэ сна
- Акне
- Псориаз
- Экзема
- Лейкоз
- Множественная миелома
- Фибромиалгия (увеличение цитокинов IL-17A)
- Остеопороз
- Депрессия (обнаруживаются высокие титры IL-17 и TGF-b)
- Бесплодие у женщин. Повышенное производство клеток Th-17 способно активировать нападение этих клеток на мужские сперматозоиды, а рост уровня женского гормона эстрадиола, наоборот, тормозит такую реакцию Th-17 лимфоцитов. Такое защитное свойство эстрадиола связано с тем, чтобы защищать сперматозоиды во время овуляции от нападения и уничтожения клетками Th-17. Бесплодие особенно проявляется, если женщина имеет грибковую инфекцию, которая стимулирует выработку Th-17 клеток, призванных эту инфекцию уничтожать.
- Пародонтоз
- Инсульт (повреждение мозга уже после кровотечения)
Почему некоторые люди чувствуют себя хуже, когда едят мясо или пьют чайный гриб?
Некоторые люди, могут ощущать себя хуже, если их диета будет содержать повышенное количества белка, особенно животного происхождения. Подобное происходит потому, что мясные продукты богаты триптофаном и аргинином, которые используются как «хворост для костра», чтобы увеличить выработку Th-17 клеток и усилить общее воспаление в организме. Другие аминокислоты из мясных продуктов способны активировать mTOR, что также способствует росту количества Th-17 лимфоцитов.
Чайный гриб способен уменьшить число Th-17 клеток, но, в тоже время, способствует росту выработки цитокина IL-17, что снова стимулирует выработку Th-17. Вот почему у людей с предрасположенностью к аутоиммунным нарушениям чайный гриб часто вызывает ухудшение самочувствие.
Если вы плохо спите, то ваш организм нарушает свои циркадные ритмы и подобное изменение способствует выработке Th-17. Зачастую, люди с хроническим нарушением сна, показывают повышенный уровень воспаления в организме. А такое воспаление стимулирует развитие большого числа заболеваний от диабета до рака.
Солнечные лучи способны не только обеспечить наш организм полезным витамином D, но и могут сильно тормозить Th-17 ответ. Именно поэтому те люди, кто долго живет в удаленных от экватора районах, обладают повышенным риском развития аутоиммунного заболевания.
Кроме того, диеты, где много цинка, витамина А и витамина D, например в средиземноморской диете, могут помочь уменьшить выработку Th-17 лимфоцитов.
Как вы можете снизить активность Th-17 и IL-17
Как правило, все вещества, способные подавить Th-1 клетки, также угнетают и клетки Th-17, но существуют некоторые исключения. IL-17 является одним из основных цитокинов, который выпускается Th-17 клетками. Это означает, что блокировка этого цитокина способна снижать весь или часть этого урона здоровью, который наносится чрезмерной выработкой воспалительных Th-17. Существуют два белка, которые нужны для выработки цитокина IL-17 – это STAT3 и NF-kB. Это означает, что снижая выработку этих белков, можно снизить уровень выработки цитокина IL-17.
Образ жизни, повышающий активность клеток Th-17
- Хронический стресс (через повышенную выработку гормона стресса – кортизола, что опасно для здоровья)
- Солнечное облучение
- Оксид азота
- Нездоровый циркадный ритм
- Жизнь в холодном климате
Продукты питания и вещества, способствующие подавлению клеток Th-17
- Лектины
- Рыбий жир
- Судьфорафан (наибольшее содержание в ростках брокколи)
- Один прием пищи в сутки
- Кофе
- Чайный гриб (хотя он и увеличивает количество цитокина IL-17A)
- Молочная кислота
- Витамин А (ретинол)
- Цинк
- Витамин D3
- Калий
- Фолат/фолиевая кислота (дефицит приводит к снижению количества клеток T-рег в кишечнике)
- Хром
- Кортизол (хроническое повышение этого гормона опасно для здоровья)
- Эстрадиол/Эстрогены
- Прогестерон
- Мелатонин (вот почему важен правильный здоровый сон)
Добавки, способствующие подавлению выработки Th-17
- Пробиотики: salivarius, L plantarum
- Куркумин
- Берберин
- EGCG (из зеленого чая)
- Урсоловая кислота
- Андрограолид
- Масло черного тмина (осторожно, сильный аллерген)
- Экстракт оливковых листьев
- Fisetin (очень много в клубнике)
- Байкалин (из Китайского шлемника)
- Красный дрожжевой рис
- Босвелия
- R-липоевая кислота
- Апигенин
- Хонокиол
- Аспирин
- Галантамин
- Гиперзин
- Никотин
- Бутират
- Корица
- Артемизинин
- Ресвератрол
- Солодка
- Имбирь
Лекарственные препараты, подавляющие Th-17 клетки
- Метотрексат
- Метформин
Какие факторы и вещества способны увеличить выработку Th-17 клеток и ухудшить течение аутоиммунного заболевания
Образ жизни, увеличивающий Th-17
- Хронический психологический стресс. Длительность такого стресса приводит к развитию сопротивления действия гормона кортизола (вырабатываемого в наибольшем количестве во время стресса). Последствия этого будет ухудшение течения аутоиммунного заболевания в тот момент, когда стресс будет снижен. Это означает, что организму уже потребуется более высокий уровень кортизола для снижения активности иммунной системы.
- Длительные физические нагрузки с очень высоким напряжением (марафонский бег)
- Ожирение
- Нарушение циркадного ритма (плохой сон, позднее засыпание, выработка меньшего количества гормона мелатонина)
- Электро-магнитные волны (мобильный телефон, Wi-Fi роутер)
Подписывайтесь на наш канал VIBER!
Продукты питания и вещества, увеличивающие Th-17
- Глютен (клейковина)
- Холестерин (не обязательно из продуктов питания, но и в организме)
- Йод (чрезмерное количество этого вещества способно активировать Th-1 клетки)
- Триптофан
- Аргинин
- Масла жареных продуктов
- Диета с высоким содержанием соли
- Длинноцепочечные жирные кислоты (говяжий и свиной жир, олеиновая кислота из оливкового масла, пальмитолеиновая кислота)
- Форсколин
- Мочевая кислота
- Бутират
Токсины и инфекции, увеличивающие выработку Th-17 клеток
- Cвободные радикалы
- Грибковые инфекции
- Вирусы (включая вирус гриппа)
- Бактерии (включая полости рта)
- Кандида
- Бактерия пневмонии
- Сальмонелла
- Микобактерия туберкулеза
- Хламидиоз
- Некоторые микробы кишечника
Гормоны, способствующие выработке Th-17 клеток
- Лептин (повышен при ожирении)
- Адипонектин (часто увеличен у худых людей). Зачастую этот гормон способствует лучшей реакции клеток на инсулин и анти-раковым эффектам. Но его повышение может быть индикатором развития сердечно-сосудистых заболеваний, ревматоидного артрита и воспалительных заболеваний кишечника.
- Альдостерон (повышает кровяное давление)
- Инсулин
- Инсулиноподобный фактор роста (IGF-1)
- Подавление выработки белка STAT3 имеет решающее значение для снижения количества и активности Th-17 клеток
- STAT3 — это белок, который связывается с ДНК клеток и повышает экспрессию генов. Белок STAT3 необходим для производства клеток Th-17, поэтому, если уменьшить выработку этого белка, то количество Th-17 клеток неизбежно снизится. Неудивительно, что STAT3 играет важную роль в развитии аутоиммунных и воспалительных заболеваний, и некоторых видов рака.
Естественные вещества, способные снизить количество выработки белка STAT3
- Спермидин
- Специи (черный перец, корица, гвоздика, мелисса, душица, конопля, розмарин, хмель)
- Рыбий жир
- Расторопша
- Черника
- Масло черного тмина
- Оливковое масло (только первого холодного отжима в темных бутылках)
- Цинк
- Литий
- EGCG (из зеленого чая)
- Желчь
- Куркума
- Лютеолин
- Ресвератрол
- Кверцетин
- Апигенин
- Урсоловая кислота
- Сульфорафан
- Босвелия
- Капсаицин
- Эмодин
- Берберин
- Икариин
- Горькая дыня
- Кофейная кислота
- Бетулиновая кислота
- Морин (листья гуавы)
- Диосмин
Подавление активации mTOR – критично важно для снижения количества Th-17
Рост активности mTOR способствует выработки Th-1 и Th-17 лимфоцитов, что приводит к росту различных воспалений в организме, в том числе и воспалительных заболеваний кишечника. mTOR способствует выработке белка под названием гипоксия-индуцированный фактор, который и повышает выработку клеток Th-17. Подавление пути mTOR является важным направлением по снижению активности Th-17 клеток, и тем самым, уменьшения активности аутоиммунного заболевания.опубликовано econet.ru.
Задайте вопрос по теме статьи здесь
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! © econet