Рабдомиосаркома
Рабдомиосаркома (РМС) – наиболее распространённый вид сарком мягких тканей у детей, который развивается из поперечно – полосатой мускулатуры или эмбриональных зачатков мышечной ткани.
Наиболее часто РМС встречается в первой декаде жизни. Пик заболеваемости приходиться на 5-9 лет. Мальчики болеют несколько чаще девочек (1,3:1).
Выделяют три основных морфологических варианта РМС: эмбриональный (включая ботриоидный) -70-75%, альвеолярный-20-25%, плеоморфный -1%.
Самое благоприятное течение характерно для эмбриональных РМС.
РМС может встречаться везде, где есть поперечнополосатая мускулатура. Однако наиболее часто РМС локализуется в области головы и шеи (35% от всех других локализаций).
Выделяют РМС параменингеальной локализации (70%):
- Крылонебная, подвисочная ямка — 50%
- Полость носа, придаточные пазухи носа -25%
- Среднее ухо -20%
- Носоглотка- 5%
- Околоушно-жевательная область
- Мягкие ткани лица
- Мягкие ткани волосистой части головы
- Полость рта
- Ротоглотка
- Гортань
- Гортаноглотка
- Шея
- Орбита
- благоприятную локализацию: орбита, голова и шея (непараменингеальные).
- неблагоприятную локализацию: параменингеальные опухоли.
Как устанавливается стадия? Что такое TNM?
Для определения стадии болезни необходимо тщательное комплексное обследование.- Т – отражает распространённость и размеры первичной опухоли
- Т1 – опухоль ограничена одним органом или тканью из которого она возникла;
- Т1а – опухоль менее 5 см. в наибольшем измерении;
- Т1в — опухоль более 5 см. в наибольшем измерении;
- Т2 – опухоль распространяется на соседние органы и ткани;
- Т2а – опухоль менее 5 см. в наибольшем измерении;
- Т2в — опухоль более 5 см. в наибольшем измерении;
- N –отражает наличие поражения регионарных лимфатических узлов
- N0 – метастазов в л/у нет
- N1 – метастазы в регионарные л/у
- М – отражает наличие отдаленных метастазов
- М0 – метастазов нет
- М1 – имеются отдаленные метастазы
I стадия- небольшая опухоль без метастазов;
II стадия –более крупная опухоль без метастазов;
III стадия – любая опухоль с метастазами в ближайшие лимфатические узлы;
IV стадия – любая опухоль с отдаленными метастазами, вне зависимости от наличия метастазов в ближайших лимфатических узлах.
Какие обследования необходимо выполнить до начала лечения и определения стадии заболевания?
Для оценки местного распространения процесса (категория T, N):- Ультразвуковая томография первичного очага, зон регионарных лимфатических узлов, брюшной полости;
- магнитно-резонансная томография с в\в контрастированием и измерением объема первичной опухоли
- Радиоизотопное сканирование мягких тканей с Ga
- Дополнительные инструментальные методы исследования в зависимости от локализации опухолевого процесса (назофарингоскопия).
- Компьютерная томография легких;
- Радиоизотопное сканирование костной системы с Tx;
- Пункция костного мозга;
- Люмбальная пункция (при распространении опухоли в полость черепа среднее ухо).
Как проявляется рабдомиосаркома при ее локализации в области головы и шеи? Симптомы.
Основная опасность при поражении ЛОР-органов (полость носа, среднее ухо, носоглотка, гайморовы пазухи и т.д.), основания черепа (крыловидная, крылонёбная, подвисочная ямки и т. д) заключается в том, что заболевание длительное время может протекать бессимптомно. Опухоли этой локализации обычно первоначально принимаются за инфекционные или воспалительные заболевания (хронический отит, аденоиды, пансинусит, мастоидит, полипоз и т.д.) и тогда ребенку назначают физиопроцедуры, антибиотики, что обусловливает запоздалую диагностику.Первым признаком при наружной локализации (голова и шея непараменингеальной локализации) является наличие опухоли, быстро увеличивающейся в размерах. В такой ситуации лучше сразу обратиться к онкологу и тогда заболевание можно застать на более ранней стадии, что улучшит результат выживаемости.
При наличии опухоли в полости носа или носоглотке у детей может наблюдаться затруднение носового дыхания, обструкция дыхательных путей, синуситы, носовые кровотечения, иногда нарушение глотания, а при распространении в орбиту – экзофтальм. У детей с распространением опухоли в среднее ухо часто в наружном слуховом проходе определяется полипоидное образование в сочетании с болями и наличием в анамнезе хронического рецидивирующего среднего отита. При вовлечении лицевого нерва могут отмечаться боли, выделения из уха или паралич Белла.
Помимо местной симптоматики при больших размерах опухоли практически у всех детей отмечается так называемый «синдром опухолевой интоксикации» (вялость, снижение аппетита и массы тела, лихорадка).
Рабдомиосаркома головы и шеи часто очень быстро растет, а поэтому при запоздалой диагностике в процесс могут вовлекаться жизненно важные структуры, такие как полость черепа, нижняя челюсть, шейный отдел позвоночника или легкие, что резко затрудняет лечение этих опухолей.
Параменингеальные опухоли склонны распространяться по оболочкам головного мозга, в результате чего присоединяются менингеальные симптомы, неврологическая симптоматика, и тогда вылечить ребенка не представляется возможным.
Лечение и прогноз рабдомиосаркомы у детей
Лечение рабдомиосаркомы располагающейся в области головы и шеи – это задача не одного специалиста.Учитывая, что основной метод лечения — это проведение системной химиотерапии, необходим квалифицированный детский онколог, который смог бы не только ввести химиопрепараты, но обеспечить ребенка адекватным сопроводительным лечением, что в данном случае немало важно. Необходим специалист по лучевой терапии, высококвалифицированный хирург-онколог, анестезиолог, патоморфолог.
Результаты лечения в нашем центре соответствуют мировым стандартам.
При своевременном обращении эта болезнь лечиться!
Наблюдение после лечения
Правильный контроль после завершения программного лечения – залог успеха. Наблюдение за пациентами проводиться в поликлинике НИИ детской онкологии и гематологии НМИЦ онкологии им. Н.Н Блохина по специально разработанным программам. После контрольного обследования пациентов консультирует заведующий отделением опухолей головы и шеи, академик РАН, профессор, д.м.н. Поляков В.Г., ведущие специалисты отделения опухолей головы и шеи, лечащие врачи.симптомы у детей, прогноз, лечение и стадии
Рабдомиосаркома – это узел, который формирует поперечно-полосатый мышечный тип ткани. Болезнь носит злокачественный характер. Часто поражает скелетный тип мышц. Также встречается в области мягких тканей – в зоне забрюшинного пространства, средостения, носоглотки, в участках желчевыводящих и мочевыводящих путей и в других органах.
Опухоль провоцирует деформацию органа, в котором развивается. При увеличении в размерах начинает давить на соседние ткани, вызывая соответствующие признаки. Распространение метастазов провоцирует усиление симптоматики поражённых органов. Для уточнения диагноза требуется пройти расширенное обследование с применением лабораторных и инструментальных методов. На основании полученных результатов принимается решение о терапии. Обычно используется хирургическое иссечение и радиотерапия с химиотерапией. Рабдомиосаркома у детей диагностируется чаще.
Характеристика заболевания
Рабдомиосаркома представляет новообразование, располагающееся в области мягких тканей. Формирует узел поперечнополосатый вид мышцы. Недифференцированная мезенхимальная клетка участвует в образовании злокачественного узла. Заболевание может развиваться в скелетных мышцах, в зоне гладкомышечных тканей органов с клетчаткой. Поражённая мышца со временем деформируется и вызывает соответствующие признаки нарушений в функционировании.
Развитие новообразования на участках лица или шеи вызвано внутриутробным пороком формирования дериватов жаберных дуг. Саркома часто возникает у детей – медицинская статистика фиксирует от 19 до 50% таких случаев. Возраст болезни колеблется от 10 до 20 лет. У мальчиков опухоль диагностируется чаще. Девочки страдают недугом редко. Болезнь считается детской, но есть случаи обнаружения у взрослых. В лечении участвует несколько специалистов – зависит от того, где локализован злокачественный узел.
Код по МКБ-10 у патологии С49 «Злокачественное новообразование других типов соединительной и мягких тканей».

Рабдомиосаркома носоглотки у человека
Причины развития болезни
Причины образования опухоли пока точно не установлены. Исследование новообразования проводится до сегодняшнего дня. Учёные выявили связь между болезнью и наследственной предрасположенностью. Доказано, что в семьях с присутствием у кого-то заболевания повышается риск возникновения у остальных членов семьи. Вызвать формирование узла может врождённый порок в развитии клеток и тканей. У четверти пациентов причиной патологии становятся серьёзные нарушения в функционировании центральной нервной системы, органов половой системы, мочевыводящих путей, в органах пищеварительного тракта и сердечно-сосудистой системы.
Спровоцировать патологию может ряд врождённых хронических заболеваний:
- Хронический диффузный полипоз и врождённая ретинобластома часто вызывают формирование рака.
- Эпидермальный и меланоцитныйневусы.
- Патология клеточного набора, которая вызывает альбинизм или болезнь множественного лентиго провоцируют раковые заболевания.
- Синдром Ли-Фраумени и Реклингхаузена (нейрофиброматоз I типа и нейрофиброматоз с феохромоцитомой) способен вызывать формирование новообразования.
- Рабдомиосаркома развивается на фоне синдрома Рубинштейна-Тейби, характеризующегося развитием признаками, деформирующими тело.
Врачи выделяют ещё ряд причин, которые провоцируют развитие злокачественного новообразования:
- Воздействие радиоактивного излучения на организм ребёнка или женщины во время беременности, которое вызвало мутацию клеток.
- Воздействие токсичных веществ на организм.
- Частые травмы скелетных костей с кожным покровом – заживление открытых ран может происходить с затруднением, плохо поддаётся лечению.
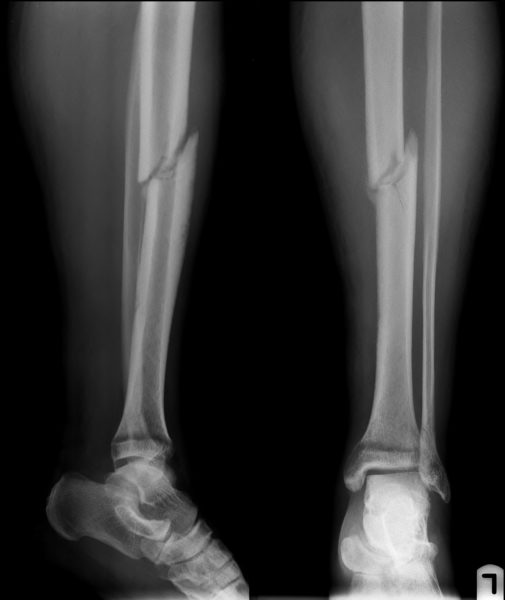

Перелом кости на рентгене
Классификация заболевания
Рабдомиосаркома классифицируется по нескольким параметрам – строению, размерам, развитию и наличию метастазных ростков.
Согласно гистологическому строению выделяют следующие виды:
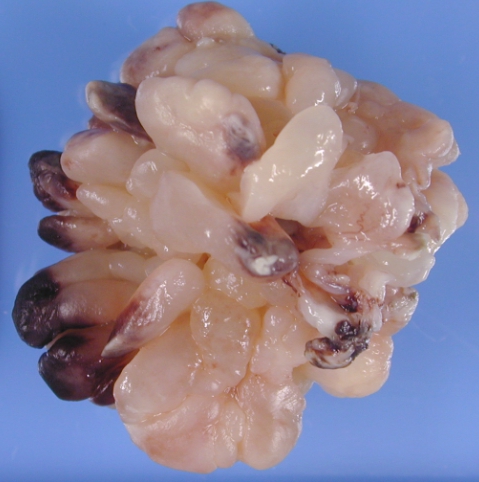
- Альвеолярная форма характеризуется формированием овальных или круглых недифференцированных патогенов, содержащих почковидное или дольчатое ядро. Данные клетки напоминают поперечно-полосатые мышцы плода в первом триместре. Формируются скопления с фиброзными перегородками, внешне напоминают альвеолярную ткань. Локализуется в разных участках туловища или конечностей. Возрастная категория представляет 5-20 лет.
- Эмбриональная форма встречается чаще. Внешне клетки выглядят по-разному – вытянутые, круглые, звёздчатые и т.д. Незрелый тип клеток формируют поперечно-полосатые мышцы десятинедельного плода. Поражают орбиты глаза, мочевого пузыря, шеи и головы. Страдают в основном дети от 3 до 12 лет. Веретеноклеточный тип рабдомиосаркомы схож с данной формой по протеканию болезненного процесса.
- Плеоморфная рабдомиосаркома встречается в единичных случаях. Форму раковый тип может приобретать паукообразную или ракеткообразную и полосовидную. По внешнему строению значительно отличается от поперечно-полосатых тканей. Формируется на туловище, верхних и нижних конечностях – страдают голени, локти и стопы.
- Ботриоидная напоминает скопление клеток, располагающихся внутри эпителия слизистой оболочки. По болезненному протеканию схожа с эмбриональной рабдомиосаркомой. Располагается в носоглотке – в зоне гайморовой пазухи, органах малого таза – мочевого пузыря, влагалище и других органах. Страдают дети в возрасте 8 лет.
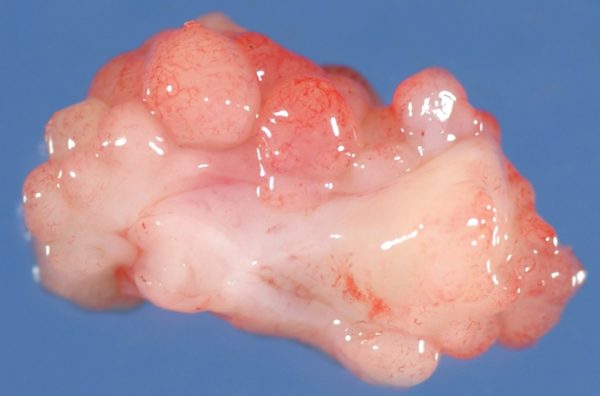

Эмбриональная рабдомиосаркома
Заболевание также классифицируют по группам:
- Первая группа (1А) характеризуется локализацией в полости поражённого органа, не пересекая границы.
- Подгруппа 1Б фиксирует присутствие раковых патогенов на соседних органах с тканями – требуется срочное и радикальное иссечение поражённого участка.
- Вторая группа протекает в две стадии: 2А определяется поражением ближайших тканей, но лимфатические узлы свободны от злокачественного поражения.
- Подгруппа 2Б характеризуется присутствием метастазов в соседние лимфатические узлы, проводится полное иссечение хирургическим вмешательством.
- 2В опухоль продолжает продвижение по линии лимфоузлов, также проводится удаление злокачественных тканей.
- Третья группа отличается увеличением размеров опухоли и выходом за пределы поражённого органа, удаление проводится частично.
- На четвёртой стадии присутствуют метастазы в отдаленных тканях с агрессивным ростом вторичных очагов.
Признаки болезни
Признаки присутствия патологии характеризуются расположением, поражённостью органа, степенью распространения метастазных ростков. Расположение опухоли на поверхности кожных покровов, костях в области лица с шеей визуализируется как плотное образование. Болевых ощущений на первых стадиях развития не наблюдается. Новообразование на отельных участках руг и ног может сопровождаться нарушениями в движениях и других функциональных способностях. Болезнь в тканях забрюшинного пространства при увеличении злокачественного узла сдавливает жизненно важные органы – желудка, кишечника, желчного пузыря. Больной чувствуют боль в области живота, наблюдаются нарушения в работе желудочно-кишечного тракта.
Рак в зоне средостения – фиксируется серьёзное нарушение в работе дыхательной системы, спровоцированное распространением метастазов в лёгкое. У больного наблюдаются проблемы с глотанием из-за сдавливания гортани, воспаления и кровотечения в носовой полости, гнойные выделения из носа, воспалительные процессы в ушных раковинах – отиты, паралич лицевого нерва.
Симптомы рабдомиосаркомы орбиты глаза вызывают зрительное косоглазие, снижение зрительных функций, опущение века – птоз. Поражение малого таза характеризуется запорами и проблемами с мочеиспусканием.
Патология простаты с мочевыводящими путями определяется отсутствием мочи и кровянистыми примесями в моче. Опухоль в тканях половых органов сопровождается маточным и влагалищным кровотечением. Гематогенные потери приводят к хронической анемии.
Метастазы в лимфатические узлы и другие органы сопровождаются соответствующими симптомами. Опухоль часто распространяет метастазные ростки в ткани костей, лёгкие. Достаточно редко выявляются вторичные очаги в почечных и печёночных патогенах, мозговых клетках, тканях поджелудочной железы и сердца.
Диагностика заболевания
Для уточнения диагноза требуется пройти подробное обследование организма. Диагностика включает ряд лабораторных и инструментальных мероприятий:
- Исследование опухоли с использованием МРТ позволяет получить визуальную 3D проекцию структуры злокачественной ткани.
- Риноскопия, фарингоскопия назначается для исследования органов дыхательной системы.
- Отоскопия требуется для изучения поражения орбиты глаза.
- Ультразвуковое исследование органов брюшины и малого таза назначается для выявления метастазов в данной области.
- Рентгенография груди требуется с патологией в зоне средостения.
- Нефросцинтиграфия с ультразвуковым исследованием почек с мочевым пузырем проводится для исследования злокачественного узла в мочевыводящих путях.
- Кровь и моча требуется для общего анализа – проводится для подтверждения отклонений в организме.


Лечение рабдомиосаркомы
После получения результатов диагностики врач подбирает курс терапии. Обычно используется облучение гамма-лучами, курсы химиотерапии с оперативным иссечением злокачественного узла. Лечение поражённых конечностей проводится с сохранением костей и тканей. Проникновение метастазов в кости требует ампутации больной конечности.
Патология в мочевом пузыре может пройти с частичным иссечением больного участка или требуется экстирпация с последующим подводом путей оттока мочевыделений. На матке проводится гистерэктомия, узел во влагалище удаляется вместе с органом.
Новообразование в полости носоглотки сложно удалить. Поэтому назначаются курсы химиотерапии. Очаги в области лёгких удаляют хирургическим методом. Метастазирование в костные ткани усложняет оперативное вмешательство. Обычно операция не проводится – это опасно летальным исходом. Новообразование на четвёртой стадии лечится химиотерапией и после этого проводится пересадка костного мозга.
Прогноз
Выживаемость пациентов после курса терапии зависит от возраста и физического состояния больного. Положительный результат наблюдается при эмбриональной форме заболевания – выживают больше половины пациентов. Также высокий процент выживаемости присутствует при опухоли на женских половых органах, на кожных покровах головы и шеи.
Неблагоприятным прогнозом отличаются злокачественные узлы глубокого проникновения в тканевые полости головы, ног и рук, кожных покровов туловища и шеи, мочевыводящих путей, органов грудной клетки и брюшной полости.
У маленького ребёнка шанс на полное выздоровление после лечения выше во много раз.
При первой группе заболевания пациенты живут минимум пять лет в 80% случаев, на второй стадии – процент пятилетней жизни у 65%, на третьей группе – 40%. На последней стадии пациенты часто не доживают до пяти лет с момента установления болезни.
После успешно проведённого курса терапии пациенту требуется постоянное наблюдение у врача – это позволит предотвратить рецидив и возможные осложнения.
Рабдомиосаркома у детей
Рабдомиосаркома — наиболее часто встречающаяся у детей, в том числе и грудных, саркома мягких тканей. Это высоко малигнизированная опухоль, которая сначала имеет локальный характер, но в конечном счете распространяется в самые отдаленные области гематогенным и лимфогенным путями. У взрослых пациентов рабдомиосаркома, как правило, возникает в области туловища или конечностей.В детском возрасте она может иметь практически любую локализацию. Как клинические проявления, так и лечение рабдомиосаркомы очень разнообразны и зависят от локализации опухоли, распространенности (ко времени постановки диагноза) и гистологического типа.
В данной главе обсуждается лечение детей с рабдомиосаркомой, основанное на клиническом опыте 116 наблюдений. Эти пациенты находились в одном и том же учреждении, занимающемся лечением детей с раковыми опухолями. Кроме того, при описании и оценке результатов мы пользовались данными Международной группы по изучению рабдомиосаркомы (Intergroup Rhabdomyosarcoma Studies), равно как и других больших педиатрических раковых центров.
Рабдомиосаркома встречается примерно с такой же частотой, как и опухоль Вильмса, а именно — на нее приходится 10—15% всех солидных опухолей и 6% всех раковых опухолей у детей. Рабдомиосаркома чаще возникает у мальчиков, чем у девочек (3 : 2), и в Соединенных Штатах чаще у белых людей, чем у чернокожих. Эта мягкотканная саркома более часто развивается у детей с нейрофиброматозом и синдромом базальноклеточного невуса.
Описан случай возникновения этой опухоли у отца и дочери. У родственников женского пола детей с рабдомиосаркомой отмечается высокая частота рака грудной железы. Частота рабдомиосаркомы выше также у сиблингов детей с опухолями мозга и коры надпочечников. У пациентов детского возраста с рабдомиосаркомой из вторичных злокачественных опухолей более часто возникают опухоли костей, что может быть связано с лечением (облучение этой зоны) либо с одинаковой генетической предрасположенностью к обеим этим опухолям.
Более высокая частота мягкотканных сарком отмечается у людей, подвергающихся воздействию хлорированных (phenoxy) гербицидов и хлорофенолов. В отличие от детей, в том числе и грудных, с нейробластомой, у пациентов с рабдомиосаркомой не выделены пока никакие специфические биологические опухолевые маркеры. Энзим креатинкиназа (мышечный тип) в какой-то степени позволяет отдифференцировать малодифференцированную рабдомиосаркому от других мелкокруглоклеточных (small round cell) опухолей. При альвеолярных опухолях выявлена последовательная хромосомная транслокация. Приведенные данные говорят о том, что специфические маркеры рабдомиосаркомы в последующем могут быть обнаружены.
Хотя рабдомиосаркома как вполне определенная патология известна уже более 100 лет, однако выживаемость при рабдомиосаркоме до конца 1960-х годов оставалась менее 10%. За последние два десятилетия достигнуто существенное повышение выживаемости детей при этой высоко малигнизированной опухоли. Главным фактором, способствовавшим этому, были разработка и внедрение комбинированных лечебных программ, включавших хирургическую резекцию, местную и регионарную лучевую терапию, а также длительные курсы полихимиотерапии.
В 1961 году было высказано предположение о том, что химиотерапия, по-видимому, может повысить выживаемость детей с рабдомиосаркомой. Однако обзор 75 наблюдений из клиники Мауо, опубликованный в 1967 году, показал, что ни химио-, ни лучевая терапия не привели к улучшению результатов. В 1969 году два независимых анализа показали, что комбинированное лечение значительно улучшает перспективы и прогноз при рабдомиосаркоме. Эти ранние работы и выводы были вскоре подтверждены рядом сообщений, основанных на изучении больших серий наблюдений, проведенных Группой по изучению рака у детей (Children’s Cancer Study Group).
В 1972 году была основана Международная группа по изучению рабдомиосаркомы (Intergroup Rhabdomyosarcoma Study-IRS). Эта группа сконцентрировала большое количество наблюдений. Было показано, что при комбинированном лечении отмечается хороший ответ на химиотерапию, что стимулировало разработку модифицированных методов лечения этой опухоли.
Дальнейшее повышение выживаемости было результатом: (1) тщательного изучения и оценки естественного течения рабдомиосаркомы разной локализации; (2) подразделения гистологических видов опухоли на благоприятные и неблагоприятные; (3) определения распространенности заболевания по стадиям во время первичной диагностики; (4) срочного направления пациентов детского возраста в педиатрические раковые центры, обладающие большим опытом лечения опухолей у детей, в том числе и в тяжелых осложненных случаях.
Общие аспекты. Пик частоты рабдомиосаркомы приходится на возраст от двух до пяти лет. Около 70% пациентов на момент постановки диагноза находятся в возрасте до 10 лет. Второй пик частоты опухоли возникает между 12 и 18 годами. В отличие от грудных детей с нейробластомой и опухолью Вильмса, у пациентов с рабдомиосаркомой в возрасте до года не отмечается повышения выживаемости. Возраст большинства выживших детей, по данным IRS — от 1 года до 5 лет.
Дети с рабдомиосаркомой выживают значительно лучше, чем взрослые, у которых обычно отмечаются более тяжелые, распространенные формы опухоли и более высокая летальность. Анализ 116 наблюдений рабдомиосаркомы у детей, лечившихся в детском госпитале (James Whitcomb Riley) в Индианаполисе, показал, что 22 из них были в возрасте до 2 лет, 31 — от 2 до 5 лет, 22 — от 6 до 9 лет и 41 — от 10 до 18 лет (рис. 70-1). По нашим данным, выживаемость статистически была примерно одинаковой в разных возрастных группах (табл. 70-1).
Таблица 70-1. Выживаемость при радбомиосаркоме в зависимости от возраста среди 116 детей (James Whitcomb Riley детский госпиталь, Индианаполис)
Тщательное определение стадии (стадирование), а значит и распространенности заболевания, имеет очень большое значение как для выбора метода лечения, так и для прогноза. Клиническая стадия опухоли очень тесно коррелирует с продолжительностью ремиссии и выживаемостью. Критерии, позволяющие определить стадию, основаны на классификации по группам IRS.
Группа I. Локализованная опухоль, которая полностью резецируется: (а) опухоль ограничена органом или мышцами, из которых она исходит и (в) контактное распространение опухоли — инфильтрация тканей, окружающих орган или мышцы, откуда исходит опухоль, без вовлечения регионарных лимфоузлов.
Группа II. Целиком удаленная опухоль с (а) микроскопически определяемой резидуальной опухолевой тканью и отсутствием поражения (микроскопически) лимфоузлов; (в) региональная опухоль полностью резецирована, но лимфоузлы микроскопически поражены; и (с) региональная опухоль с лимфоузлами полностью резецирована, но микроскопически остается резидуальная опухолевая ткань.
Группа III. Неполная резекция опухоли или биопсия с наличием значительной резидуальной опухоли.
Группа IV. Наличие метастазов при постановке диагноза (в легких, головном мозге, печени, отдаленных лимфоузлах, костном мозге).
Клиническая стадия заболевания связана с (1) объемом резидуальной опухоли, обнаруживаемой на операции, и (2) наличием или отсутствием метастазов в региональных лимфоузлах во время первичной операции, а также с распространением опухоли в отдаленные места. В исследовании IRS-1 только 13% из 552 случаев были включены в I группу, 23% — во II, 43%-в III и 21%-в IV (табл. 70-2).
Таблица 70-2. Рабдомиосаркома — данные IRS (Intergroup Rhabdomyosarcoma Study)
Среди наших 116 пациентов (Детский госпиталь James Whitcomb Riley) только у 11 была определена группа I, у 20 — II, у 43 — III и у 42 — IV (рис. 70-2). В 85 случаях (73,2%) имелись распространенные стадии заболевания (группы III и IV) уже при постановке диагноза. 5-летняя выживаемость у этих детей в зависимости от группы показана на рис. 70-2. В I группе выжили 10 из 11 детей (91%), во II — 16 из 20 (75%), в III -18 из 43 (41%) и в IV-только 3 из 42 (7,7%).

Рис. 70-1. Число и процентное соотношение случаев в каждой возрастной группе среди 116 детей, лечившихся в James Whitcomb Riley детском госпитале, Индианаполис, Индиана.

Рис. 70-2. Общее число случаев в каждой клинической группе и число выживших. У большинства детей были распространенные формы болезни, в том числе у 42 — метастазы. Общая выживаемость составила 39,6%.
Общая 5-летняя выживаемость составила 39,6% (46/116). 5-летняя выживаемость, по данным IRS-I, была 55%, хотя только 21% больных при постановке диагноза были включены в IV группу. В IRS-II 5-летняя выживаемость была несколько выше (63%).
Несмотря на тот факт, что выживаемость существенно различается в группах I, II и III, этот показатель в группе III может существенно меняться в зависимости от того, насколько активно и индивидуально хирург лечит первичную опухоль. Если вмешательство было ограничено биопсией в надежде на первичную химиотерапию, то заболевание относят к группе III (большая резидуальная опухоль). Если хирург резецировал опухоль, то может быть установлена группа I или II в зависимости от того, есть по краям резецированной опухоли ее остатки или нет.
Локализация первичной опухоли иногда может диктовать объем резекции, поскольку во многих случаях опухоль располагается в таких местах, где обширная экстирпация, которую по идее следует произвести при раковой опухоли, просто невозможна (голова и шея, желчные протоки и т. д.). По данным IRS, приблизительно у 60% пациентов III и IV групп резекция первичной опухоли была неосуществима. Еще у 25% даже после предпринятой попытки резекции микроскопически оставалась резидуальная опухоль.
В дополнение к классификации по группам, стадирование в IRS-IV проводится с учетом состояния до операции опухоли, лимфоузлов и наличия метастазов (TNM), как это принято в Европе. При дооперационном стадировании учитывается первичная локализация опухоли, ее инвазивность (распространенность), размеры, состояние лимфоузлов, метастазы и гистологический характер опухоли. Т означает размеры опухоли и ее инвазивность, N — состояние лимфоузлов и М — имеются ли гематогенные метастазы.
Стадия I. Опухоль ограничена органом или структурой (Т1), лимфоузлы не поражены (NO), явных отдаленных метастазов нет (МО). Опухоль может быть меньше (а) или больше (в) 5,0 см.
Стадия II. Опухоли, распространяющиеся локально (Т2), но без поражения лимфоузлов (NO) и без отдаленных метастазов (МО). Размеры опухоли могут быть а или в.
Стадия III. Первичная опухоль Т1 или Т2 часто больше 5,0 см (в), но может быть и меньше 5,0 см (а) с поражением лимфоузлов (N1), но без отдаленных метастазов (МО).
Стадия IV. Т1 или Т2, размеры а или в, NO или N1 и отдаленные метастазы (Ml).
TNM оценка более, чем 500 случаев, в IRS-II показала, что инвазивность опухоли тесно связана с ее размерами. Неинвазивные опухоли (Т1) обычно небольшие по размерам (<5,0 см), а инвазивньте (Т2) — значительно больше (>5,0 см). Очень благоприятный прогноз отмечался при опухолях Т1, МО. Состояние лимфоузлов N1 является неблагоприятным фактором, который часто наблюдается при первичных опухолях, больших по размерам (>5,0 см), более инвазивных, расположенных в «неблагоприятных» местах, включая конечности, туловище и ретроперитонеальное пространство. Кроме того, эти опухоли нередко имеют неблагоприятное гистологическое строение. Для опухолей Т1а нехарактерны метастазы в лимфоузлы (N1), в то время как опухоли Т2в часто сопровождаются метастазами в лимфоузлы (N1).
Рабдомиосаркома у детей может иметь самую разнообразную локализацию: голова и шея, включая орбиту, мочеполовой тракт, конечности, позвоночник, ретроперитонеальное пространство, грудная стенка, промежность и перианальная область. Кроме того, опухоль может располагаться в параспинальной области, на ягодицах, в зоне общего желчного протока, бронхов, передней брюшной стенки и т. д. (рис. 70-3).

Рис. 70-3. Различная локализация первичной рабдомиосаркомы у детей. Наиболее часто первичная опухоль располагается в области таза, головы, шеи и конечностей.
Выживаемость существенно различается в зависимости от локализации первичной опухоли. Благоприятный прогноз отмечается при расположении опухоли в области глазницы, влагалища, вульвы и при паратестикулярном поражении. «Промежуточный» прогноз характерен для опухолей конечности, мочевого пузыря, предстательной железы, матки, шеи и непараменингеальных областей головы.
Относительно плохой прогноз наблюдается при параменингеальном расположении опухоли в области головы, на шее, в зоне общего желчного протока, в забрюшинном пространстве, в области ягодиц, грудной стенки, туловища, промежности и в перианальной зоне, а также в области таза, но вне мочеполового тракта и, конечно же, при опухолях с метастатическим поражением других органов и структур, включая костный мозг и лимфоузлы.
5-летняя выживаемость в зависимости от локализации опухоли (в James Whitcomb Riley Детском госпитале) показана на рисунке 70-4. С наступлением эры комбинированной терапии большинство детей с вагинальным, орбитальным и паратестикулярным поражением стали выживать, в том числе и в нашем учреждении.

Рис. 70-4. 5-летняя выживаемость в зависимости от локализации первичной опухоли. Наиболее благоприятный прогноз отмечался при расположении первичной опухоли в области глазницы, паратестикулярных тканей и женских половых органов.
В то же время никто из детей не выживает при поражении первичной опухолью грудной стенки, ягодиц, забрюшинного пространства, параспинальной области или таза (вне мочеполового тракта). Эти данные соответствуют результатам, полученным при анализе большого числа наблюдений опухолей тех же локализаций в IRS. Таким образом, локализация опухоли является важным прогностическим фактором. Все выше изложенное было объединено при составлении современных систем стадирования и терапевтических программ для IRS-IV (табл. 70-3). Таблица 70-3. Схема стадирования рабдомиосарком — IRS-IV (Intergroup Rhabdomyosarcoma Study IV)

К.У. Ашкрафт, Т.М. Холдер
Опубликовал Константин Моканов
Рабдомиосаркома | Фонд «Подари жизнь»
Суть болезни
Рабдомиосаркома (РМС) – одна из злокачественных опухолей, характерных в основном для детского возраста. Понятие «саркома» означает, что речь идет о злокачестенной опухоли соединительной ткани, а приставка «рабдомио» означает, что это опухоль возникает из клеток-предшественников поперечно-полосатых, то есть скелетных, мышц («рабдо» — палочкообразный, «мио» — мышечный).
Рабдомиосаркома относится к саркомам мягких тканей. Существуют и другие мягкотканые саркомы: липосаркома, ангиосаркома, фибросаркома, синовиальная саркома и т.п. РМС выделяется среди них более частой встречаемостью в детском возрасте, поэтому именно это заболевание рассматривается здесь подробно.
РМС может обнаруживаться практически в любом участке тела, включая и области, не заполненные мышцами. Так, РМС может возникнуть в различных органах головы и шеи (включая мягкие ткани глазных орбит, носоглотку, придаточные пазухи носа, область возле шейного отдела позвоночника), в руках, ногах, мочеполовой системе, в брюшной полости и др. Метастазы могут обнаруживаться в легких, костном мозге, костях, лимфоузлах, головном мозге.
В соответствиии с международной классификацией выделяют различные типы РМС.
- Эмбриональная рабдомиосаркома – опухоль, характерная для детей раннего возраста. Большинство случаев РМС относится именно к этому варианту. Наиболее частые локализации опухоли при эмбриональной РМС – органы головы и шеи, органы мочеполовой системы. Выделяют также особые подтипы эмбриональной РМС – ботриоидный и веретеноклеточный; как правило, они связаны с лучшим прогнозом.
- Альвеолярная рабдомиосаркома (около 25% всех случаев РМС) чаще встречается в более старшем возрасте, включая подростковый. Название «альвеолярная» связано с тем, что внешний вид опухоли при ее микроскопическом исследовании напоминает вид легочных альвеол. Наиболее типичные локализации – мышцы конечностей и туловища, а также органы малого таза.
Выделяют также плеоморфную, или анапластическую РМС. Этот редкий вариант опухоли не характерен для детей (большинство заболевших – взрослые в возрасте от 30 до 50 лет) и обычно локализуется на конечностях. Также известны смешанные варианты и недифференцированные саркомы.
При РМС выделяют различные стадии опухолевого процесса и клинические группы. Так, согласно международной классификации IRS, выделяются 4 группы:
- Группа I: Опухоль может быть полностью удалена хирургически.
- Группа II: Опухоль может быть удалена хирургически, но опухолевые клетки обнаруживаются в окружающих тканях и/или в близлежащих лимфоузлах. Отдаленных метастазов нет.
- Группа III: Полное хирургическое удаление опухоли невозможно. Нет отдаленных метастазов.
- Группа IV: В момент установления диагноза обнаруживаются отдаленные метастазы.
Применяется также определение стадии болезни согласно общепринятой системе TNM, где T соответствует размеру опухоли, N – поражению регионарных (близлежащих) лимфатических узлов, а M – наличию отдаленных метастазов.
Частота встречаемости и факторы риска
Рабдомиосаркома составляет около 4% случаев злокачественных новообразований детского возраста; частота ее приблизительно равна 6 случаям на 1 миллион детского населения.
РМС – опухоль, характерная почти исключительно для детского возраста. После 20 лет она встречается уже крайне редко. Большинство больных младше 10 лет. Мальчики болеют несколько чаще девочек. Факторы внешней среды, которые могли бы повлиять на частоту возникновения РМС, неизвестны, как и для большинства других опухолей детского возраста.
Частота возникновения РМС, как и ряда д
что это такое, симптомы, лечение, выживаемость
Что такое рабдомиосаркома?
(рабдо = стержень, мио = мышца, саркома = рак соединительной ткани)
Мышцы нашего тела, которые позволяют нам передвигаться или поднимать объекты, называются скелетными мышцами. Примерами являются «квадрицепс», «бицепс» или «пресс». Если смотреть под микроскопом, биопсия скелетных мышц выглядит как стержень. Рабдо — это греческое название стержня, мио — мышца, а саркома — термин для обозначения рака соединительной ткани, поэтому рабдомиосаркома (РМС) — это рак скелетных мышц.
Рабдомиосаркома (РМС) представляет собой злокачественную опухоль («рак/карцинома»), которая возникает из нормальной клетки скелетных мышц. Не так много известно о том, почему нормальные клетки скелетных мышц становятся злокачественными. Поскольку клетки скелетных мышц находятся практически в каждом участке тела, РМС может развиваться практически в любой части тела.
Рабдомиосаркома является редким раком, но это самый распространенный тип саркомы мягких тканей у людей в возрасте до 21 года, приблизительно с 350 новыми случаями в год только в США. Существуют подтипы (или категории) рабдомиосаркомы. Подтип, альвеолярная рабдомиосаркома, поражает детей всех возрастов и чаще всего встречается в области рук, ног и туловища. Эмбриональная рабдомиосаркома, развивающаяся в мышцах головы, шеи и области половых органов, чаще встречается у детей до 10 лет.
Рабдомиосаркома очень редко встречается у взрослых. За последние 20-30 лет в крупных онкологических центрах Европы и США было замечено пять «больших» опубликованных серий, насчитывающих чуть более 400 случаев РМС у взрослых (включая некоторых «подростков»). Хотя «плеоморфная» гистология чаще встречается у взрослого населения (и редко встречается у детей), принципы лечения взрослых с РМС схож с терапией детей.
Признаки и симптомы рабдомиосаркомы
Симптомы рабдомиосаркомы зависят от локализации опухоли. Альвеолярная рабдомиосаркома поражает мышцы конечностей и туловища, и боль, связанную с этими опухолями, может быть ошибочно принята за глубокий синяк или травму. Другие симптомы могут включать общее чувство усталости или тошноты без определенной причины.
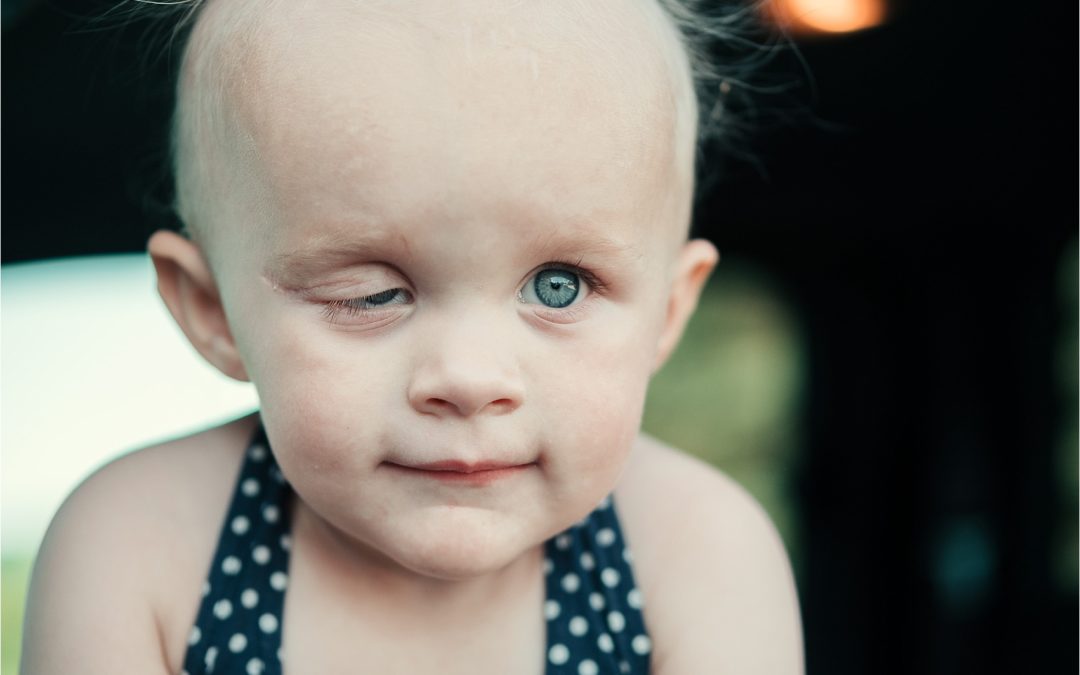
Дети с РМС глазницы (около 10% всех случаев рабдомиосаркомы) могут иметь выпуклый или опухший глаз (проптоз). Хотя её иногда можно принять за синусную инфекцию, у детей с опухолями в этой области обычно нет признаков синусовой инфекцией (боль, лихорадка, пурпурное изменение цвета глаз).
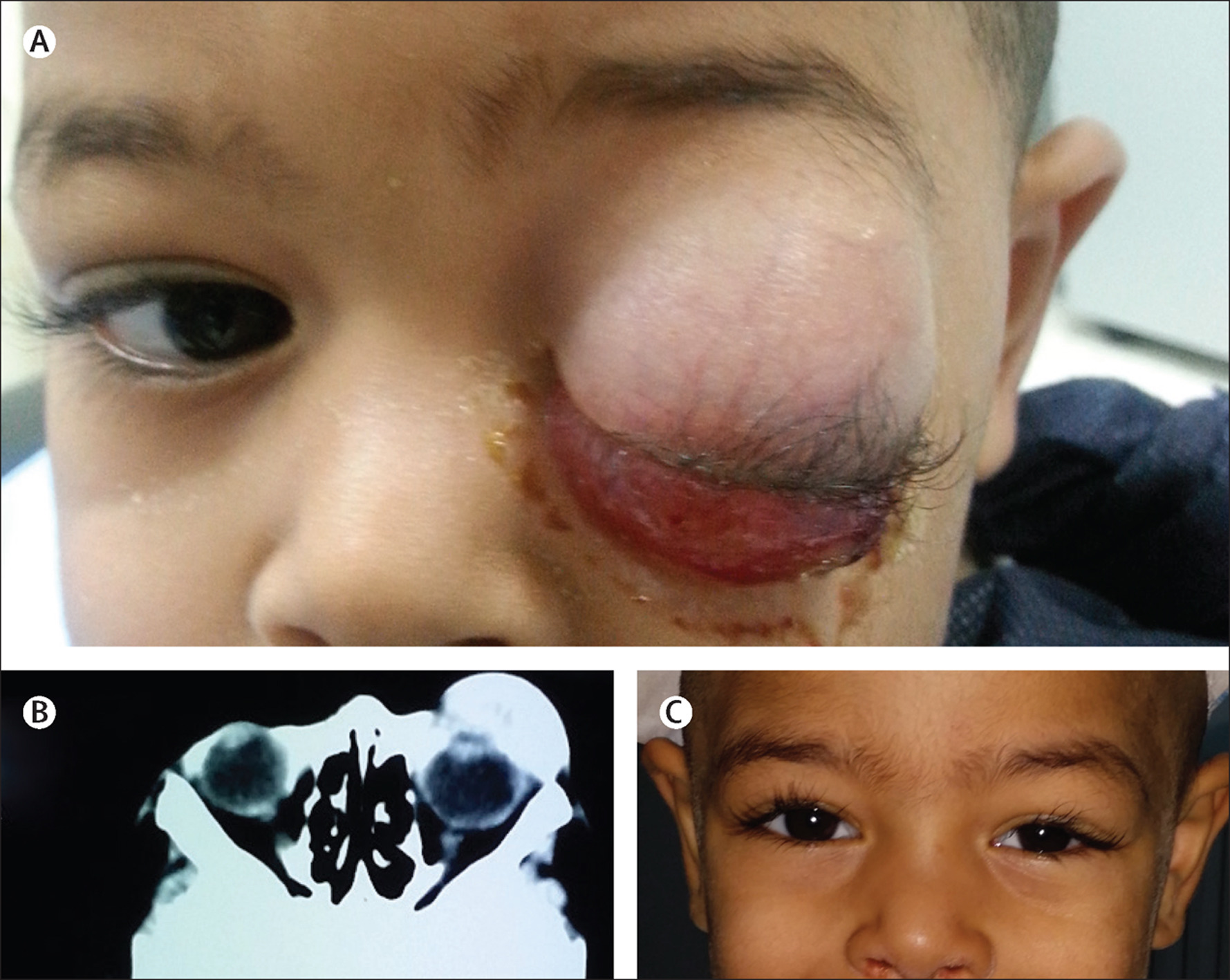
Люди с опухолями, возникающими в одном из параменингеальных мест (в основном, в пазухах, среднем ухе и задней части горла), могут жаловаться на заложенность носа в течение нескольких недель или месяцев, иногда с выделениями из носа; иногда масса может быть видна в ноздре или задней части горла.
В отличие от инфекций пазухи и горла, эти опухоли обычно не распространяются на лимфатические узлы шее. Если происходит эрозия в основании черепа, люди могут жаловаться на головную боль или черепную невропатию из-за инфильтрации или сдавления пораженных черепных нервов.
У детей с опухолями, возникающими в мочеполовом тракте, может наблюдаться безболезненная мошоночная масса (паратикулярные опухоли), выпуклая виноградоподобная масса во влагалище («ботриоидальная» рабдомиосаркома), кровь в моче (опухоли мочевого пузыря) или частое мочеиспускание, иногда с жжением.
Иногда опухоли, которые возникают в предстательной железе (не то же самое, что более распространенный тип рака простаты, которым болеют взрослые мужчины), могут становиться очень большими, прежде чем будут диагностированы; Эти опухоли могут присутствовать в виде видимой массы в области таза или живота, иногда с частотой и срочностью мочеиспускания, иногда с запором, тошнотой и рвотой из-за сдавления кишечника.
Причины рабдомиосаркомы
Медицине не известны причины рабдомиосаркомы, есть некоторые факторы риска и болезни, связанные с этой опухолью. Они включают:
- Лучевую терапию при лечении другого состояния;
- Синдром Ли-Фраумени;
- Плевропульмональная бластома;
- Нейрофиброматоз;
- Синдром Костелло;
- Синдром Беквита-Видемана;
- Синдром Нунана.
Хотя подавляющее большинство случаев РМС происходят спорадически, считается, что от 10 до 33% детей, у которых развивается РМС, имеют генетический фактор риска.
Развитие РМС было связано с рядом редких семейных «раковых синдромов», таких как синдром Ли-Фраумени, который включает семейную кластеризацию РМС и других опухолей мягких тканей у детей, с адренокортикальной карциномой и ранним началом рака молочной железы у взрослых родственников.
При исследовании детей с синдромом Костелло, вероятно, аутосомно-доминантным расстройством, характеризующимся задержкой послеродового роста, типичными грубыми лицами, дряблой кожей и задержкой развития, выявили повышенный риск развития солидных рабдомиосарком. В Европе было зарегистрировано десять случаев РМС приблизительно у 100 известных детей с синдромом Костелло.
Диагностика рабдомиосаркомы
Опухоль мягких тканей может первоначально подозреваться детским педиатром или врачом неотложной помощи, когда ребенок рассматривается на предмет того, что первоначально считалось травмой мышц, которая не заживала. На физическом осмотре может быть ком, который считается ненормальным. Дальнейшее диагностическое обследование необходимо, чтобы определить, может ли это быть опухолям мягких тканей.
| МРТ | МРТ позволяет врачам лучше видеть всю степень опухоли. Врачам важно знать, проникает ли опухоль в другие ткани, так как рассматриваются планы лечения (например, хирургические варианты). МРТ также используется, чтобы определить, было ли какое-либо распространение опухоли к мозгу. | |
| биопсия | Биопсия необходима для определения точного типа опухоли. Важно, чтобы биопсия была проведена специалистом, имеющим опыт проведения соответствующих биопсий опухолей конечностей. Неправильная биопсия может ограничить хирургические возможности, а в некоторых случаях сделать ампутацию единственным хирургическим вариантом. | |
| ПЭТ/КТ | Этот метод исследования является еще одним, необходимым обследованием для постановки рака. ПЭТ/КТ показывает, метастазировал ли рак в брюшную полость, мозг или другие области тела. |
Также важно знать, насколько агрессивна опухоль (степень опухоли), а также стадия рака (распространилась ли она на другие области тела). Поскольку рабдомиосаркома является такой агрессивной опухолью, ее всегда считают карциномой (т. е. раком) высокой степенью.
Стадирование рабдомиосаркомы
Стадирование любого типа рака включает определение того, находится ли рак только в той области, где он был первоначально обнаружен (локальный), или он распространился (метастазировал) на другие органы, например, легкие, головной мозг.
Знание стадии помогает лечащим врачам определить лучший подход к лечению. Стадирование рабдомиосаркомы немного сложнее, чем у многих других типов опухолей, поскольку имеет три различных аспекта опухоли, включая оценку опухоли после ее хирургического удаления (при условии, что она может быть удалена).
Во-первых, стадия, основанная на размере опухоли и, если рентгенологические исследования (МРТ, ПЭТ/КТ) показывают, что рак распространился:
- Стадия I — опухоль маленькая и не распространилась;
- Стадия II или III — опухоль распространилась на окружающие структуры;
- Стадия IV — опухоль распространилась на другие части тела.
Во-вторых, заболевание группируется на основании того, распространился ли рак и был ли весь рак удален хирургическим путем:
- I группа — все видимые опухоли удаляются во время операции, а края области отрицательные; не распространяется на другие районы.
- Группа II — все видимые опухоли удаляются во время операции, но края положительные; не распространяется на другие районы.
- III группа — все видимые опухоли не могли быть удалены полностью; опухоль распространилась на лимфу, но не на другие органы.
- Группа IV — рак уже показал признаки распространения на другие органы на момент постановки диагноза.
Группа риска — объединяя информацию о стадии и группе, врачи могут классифицировать опухоль ребенка по группе риска, основываясь на ее агрессивности. Назначение группы риска помогает назначить следующее лечение.
- Низкий риск — поскольку рабдомиосаркома представляет собой агрессивную опухоль, альвеолярная рабдомиосаркома не попадает в группу низкого риска;
- Промежуточный риск — включает детей со стадией 1,2 или 3 заболевания.
- Высокий риск — включает детей с 4 стадией болезни.
Лечение рабдомиосаркомы
Удаление опухоли является одним из наиболее важных аспектов лечения; поэтому хирургия является первым лечением для любого, у кого диагностирована рабдомиосаркома. Иногда опухоль находится в месте, где ее можно удалить хирургическим путем, если это так, то можно попробовать химиотерапию и/или облучение с целью сокращения опухоли, чтобы ее можно было удалить хирургическим путем.
Химиотерапия, или использование лекарств, также необходима всем, у кого диагностирована рабдомиосаркома. В идеале, химиотерапия начинается после удаления опухоли. Было показано, что химиотерапия снижает вероятность того, что опухоль вернется либо в область, где она была впервые обнаружена, либо в другие области тела.
Лучевая терапия или радиационная онкология (радиотерапия) могут быть необходимы, если всю опухоль нельзя удалить хирургическим путем. Радиотерапия также может быть рассмотрено, если результаты биопсии показывают, что опухоль является чрезвычайно агрессивным типом РМС.
Прогноз рабдомиосаркомы
Прогноз, или шанс на выживание, тесно связан с характеристиками опухоли — насколько она велика, сколько лет ребенку или взрослому, где началась опухоль, и является ли она метастазирующей… вся информация, которая входит в стадию рака.
Зачастую информацией, которой располагают лечащие врачи, — это 5-летняя выживаемость при типе рака определенной стадии, основанная на данных исследований большого числа людей, у которых был диагностирован этот тип рака. Выживаемость 5 лет означает процент пациентов, которые проживут по крайней мере 5 лет после того, как рак диагностируется. Общая статистика выживаемости по группам риска:
- Группа низкого риска: 5-летняя выживаемость составляет более 90% для детей в группе низкого риска.
- 5-летняя выживаемость в группе среднего риска колеблется от 60% до 80% для детей этой группы. Показатель варьируется в зависимости от локализации опухоли, стадии и возраста ребенка (дети в возрасте от 1 до 9 лет, как правило, показывают лучший прогноз, чем дети старшего или младшего возраста).
- 5-летняя выживаемость в группе высокого риска обычно составляет от 20% до 40%, потому что у детей в этой группе есть метастатическая болезнь в момент постановки диагноза. Дети от 1 до 9 лет, как правило, имеют лучшие перспективы на выживаемость, чем молодые или взрослые и пожилые пациенты.
Важно помнить, что показатели выживаемости в лучшем случае приблизительны. Уникальные обстоятельства ребенка или взрослого также способствуют его реакции на лечение и, в конечном счете, прогнозу.
Саркома мягких тканей у детей (рабдомиосаркома и нерабдомиосаркома) > Клинические протоколы МЗ РК
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения**: после гистологической верификации диагноза (оперативный этап в объеме биопсии или резекции), проведение курсов химио и лучевой терапии, с решнеием вопроса о возможности проведения второго этапа оперативного лечения.
Немедикаментозное лечение:
· Режим палатный (полупостельный) – ввиду риска развития септических осложнений, на фоне миелоаблативной химиотерапии и лучевой терапии.
· Диета: Стол №11.
Медикаментозное лечение: протокол cws-2009-guidlance.
Перечень основных лекарственных средств:
Риск-стратификация для рабдомиосаркомы (РМС)
| Риск-стратификация для опухолей РМС | ||||||
| Группа риска | Подгруппы | Гистология | Послеоперац. стадия (группа IRS) | Локализация | Л/у стадия | Размер и возраст |
| Низкий | A | Благоприятная | I | Любая | N0 | Благоприятные |
| Стандартный | B | Благоприятная | I | Любая | N0 | Неблагоприятн. |
| C | Благоприятная | II,III | Благоприятная | N0 | Любые | |
| D | Благоприятная | II,III | Неблагоприятн. | N0 | Благоприятные | |
| Высокий | E | Благоприятная | II, III | Неблагоприятн. | N0 | Неблагоприятн. |
| F | Благоприятная | II,III | Любая | N1 | Любые | |
| G | Неблагоприятн. | I, II, III | Любая | N0 | Любые | |
| Очень высокий | H | Неблагоприятн. | II,III | Любая | N1 | Любые |
Далее приведена краткая общая информация по стратификации и терапии рабдомиосаркомы.
РМС, группа низкого риска
| Группа риска | Подгруппа | Гистология | Группа IRS | Локализация | Л/у стадия | Размер и возраст |
| Низкий | A | Благоприятная | I | Любая | N0 | Favourable |
Стратификация: Благоприятная гистология (не альвеолярная), группа IRS I, любая локализация, N0, M0, благоприятный возраст (< 10 лет) и благоприятный размер опухоли (≤ 5 см) – Подгруппа A.
Операция: После первоначального полного удаления дальнейшие операции не проводятся.
Химиотерапия: Винкристин + актиномицин D (VA), 4 курса (22 недели).
Лучевая терапия: Не показана этим пациентам.
РМС, группа стандартного риска
| Группа риска | Подгруппы | Гистология | Группа IRS | Локализация | Л/у стадия | Размер и возраст |
| Стандартный | B | Благоприятная | I | Любая | N0 | Неблагоприятн. |
| C | Благоприятная | II,III | Благоприятная | N0 | Любые | |
| D | Благоприятная | II,III | Неблагоприятн. | N0 | Благоприятные |
Стратификация: В эту группу риска входят три различные подгруппы пациентов. У всех пациентов должна быть благоприятная гистология и отсутствие признаков вовлечения лимфоузлов или метастатической опухоли.
Подгруппа B: IRS группа I, любая локализация, неблагоприятные размер опухоли (> 5 см) и/или возраст пациента (≥ 10 лет).
Подгруппа C: IRS II или III, благоприятная локализация, любой размер опухоли, любой возраст.
Подгруппа D: группа IRS II или III, неблагоприятная локализация, но благоприятные размер (≤ 5 см) и возраст (< 10 лет).
Операция: В группах IRS I и II после первоначального удаления дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления [re-excision]). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Химиотерапия: Ифосфамид + винкристин + актиномицин D (IVA), 9 курсов (25 недель). Однако введение ифосфамида в подгруппе B после начальных 4 курсов не производится. То же самое относится к подгруппе C после 5 курсов, если используется ЛТ.
Лучевая терапия: Облучение не используют, когда опухоль полностью удалена (R0) при постановке диагноза (подгруппа B), а также у пациентов из подгруппы C со вторичным полным (R0) удалением и благоприятными размером и возрастом. Все прочие пациенты должны получать лучевую терапию согласно рекомендациям по ЛТ; в зависимости от состояния краев при удалении и ответа доза варьируется от 36 до 50.4 Гр. Исключения могут быть сделаны для пациентов самого младшего возраста (< 3 лет) или для пациентов с опухолями в особенно чувствительных областях.
РМС, группа высокого риска
| Группа риска | Подгруппа | Гистология | Группа IRS | Локализация | Л/у стадия | Размер и возраст |
| Высокий | E | Благоприятная | II,III | Неблагоприятн. | N0 | Неблагоприятн. |
| F | Благоприятная | II,III | Любая | N1 | Любые | |
| G | Неблагоприятн. | I, II, III | Любая | N0 | Любые |
Стратификация: Подгруппа E: Пациенты из группы IRS II или III с благоприятной гистологией, но неблагоприятной локализацией, неблагоприятным размером и/или возрастом.
Подгруппа F: Пациенты из группы IRS II или III с благоприятной гистологией, любой локализацией, любым размером опухоли и любым возрастом пациента, но с поражением лимфоузлов.
Подгруппа G: Все пациенты с неблагоприятной гистологией, кроме альвеолярной с N1.
Операция: После первоначального удаления в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления [re-excision]). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии или лучевой терапии.
Химиотерапия: Химиотерапия ифосфамидом, винкристином и актиномицином D (IVA), 9 курсов.
Лучевая терапия: Все пациенты должны получать лучевую терапию согласно рекомендациям по ЛТ; в зависимости от гистологии, состояния краев при удалении и ответа доза варьируется от 36 до 50.4 Гр.
РМС, группа очень высокого риска
| Группа риска | Подгруппа | Гистология | Группа IRS | Локализация | Л/у стадия | Размер и возраст |
| Очень высокий | H | Неблагоприятн. | II, III | Любая | N1 | Любые |
Стратификация: Неблагоприятная гистология (альвеолярная РМС) и поражение лимфоузлов (N1), но отсутствие метастазов (M0), вне зависимости от других факторов риска (ПОДГРУППА H).
Операция: После первоначального удаления в группах IRS I и II дальнейшие
операции не проводятся (но у пациентов из группы II следует рас
смотреть возможность первичного повторного удаления [re-
excision]). У пациентов из IRS группы III следует рассмотреть
возможность отложенной операции после первоначальной химио
терапии.
Химиотерапия: Режим VAIA III как продолжение протокола CWS-2002-P. Первые
два цикла включают в себя курс IVAd, чередующийся в каждом
цикле с IVA и IVAd. Последний цикл содержит 3 курса IVA (всего
25 недель).
Лучевая терапия: Пациенты получают лучевую терапию согласно рекомендациям по ЛТ; в зависимости от состояния краев при удалении и ответа доза варьируется от 41.4 до 50.4 Гр.
«РМС-подобные» опухоли: СинСар, внекостная СЮ/пПНЭО, недифференцированная саркома
Стратификация: Синовиальная саркома, внекостная саркома Юинга, периферическая примитивная нейроэктодермальная опухоли и недифференцированная саркома (бывшая «РМС-подобная» группа CWS) считаются опухолями с неблагоприятной гистологией. Для стратификации важна группа IRS.
Операция: После первоначального удаления в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления [re-excision]). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Химиотерапия: Режим VAIA III: Первые два цикла включают в себя курс IVAd, чередующийся в каждом цикле с IVA и IVAd. Последний цикл содержит 3 курса IVA (всего 25 недель). Пациенты с синовиальной саркомой из группы IRS I или II (кроме T2b) должны получать только 6 курсов (2 цикла).
Лучевая терапия: Пациенты из группы IRS I не получают облучения. Пациенты из группы IRS II или III получают лучевую терапию согласно рекомендациям по ЛТ. Доза составляет 50.4 Гр при обычном (конвенциональном) фракционировании или 44.8 Гр при гиперфракционированном ускоренном облучении.
«Не-РМС-подобные» опухоли
Стратификация: Отнесение к группе низкого, стандартного или высокого риска зависит от гистологии, размера опухоли, группы IRS и вовлечения лимфоузлов. Десмопластическая мелко-круглоклеточная опухоль и злокачественная рабдоидная опухоль считаются опухолями высокого риска.
Операция: После первоначального удаления в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления). У пациентов из IRS группы III следует рассмотреть возможность отложенной и более агрессивной операции после первоначальной химиотерапии.
Химиотерапия: Пациенты низкого и стандартного риска не получают химиотерапию (но могут быть исключения). Пациенты из группы высокого риска должны получать химиотерапию (режим VAIA III). Первые два цикла включают в себя курс IVAd, чередующийся в каждом цикле с IVA и IVAd. Последний цикл содержит 3 курса IVA (всего 25 недель).
Лучевая терапия: Пациенты из группы низкого риска не получают облучения. Пациенты из группы стандартного или высокого риска получают лучевую терапию согласно рекомендациям по ЛТ. Доза составляет 50.4 Гр при обычном (конвенциональном) фракционировании или 44.8 Гр при гиперфракционированном ускоренном облучении.
Метастатические мягкотканные опухоли (стадия IV):
Пациенты получают терапию CEVAIE плюс O-TIE.
Стратификация: Любая первично-метастатическая мягкотканная опухоль (M1) вне зависимости от всех прочих факторов риска.
Операция: Хирургические меры должны соответствовать инструкциям для локализованных мягкотканных опухолей. Первичное хирургическое удаление метастазов не всегда необходимо, кроме жизнеугрожающих ситуаций, но сомнительные очаги следует проанализировать посредством биопсии. Хирургические вмешательства по поводу первичной опухоли и метастатических очагов могут быть необходимыми после первоначальной системной терапии в зависимости от ответа или клинической ситуации.
Химиотерапия: Один цикл состоит из 1 курса I3VA, за которым следуют CEV и I3VE. Пациент получает 3 цикла (9 курсов) в течение 25 недель. За этим следует пероральная поддерживающая терапия трофосфамидом и идарубицином, чередующаяся с трофосфамидом и этопозидом (общая продолжительность терапии 51 неделя). Для пациентов >10 лет и/или метастазами в К/КМ следует рассмотреть экспериментальные варианты терапии.
Лучевая терапия: Пациенты получают лучевую терапию согласно рекомендациям по ЛТ; в зависимости от гистологии, состояния краев при удалении и ответа доза варьируется от 41.4 до 50.4 Гр.
ПЛАН ЛЕЧЕНИЯ ПРИ РАБДОМИОСАРКОМЕ (РМС)
Схема стратификации рабдомиосаркомы
| M-статус | N-статус | Патоморфо-логия | Группа IRS | Локализация | Размер и возраст | Под-группа | Группа риска |
| M0 | N0 | эРМС | I | Любая | £ 5 см и < 10 лет | A | Низкий |
| > 5 см или ³ 10 лет | B | Стандартный | |||||
| II, III | ORB, UG-non BP, HN-non PM | Любые | C | ||||
| EXT, UG-BP, HN-PM, OTH | £ 5 см и < 10 лет | D | |||||
| > 5 см или ³ 10 лет | E | Высокий | |||||
| N1 | эРМС | II, III | Любые | F | |||
| N0 | аРМС | Любые | G | ||||
| N1 | аРМС | Любые | H | Очень высокий | |||
| M1 | Метастатичес-кая опухоль (гл. 10) | ||||||
эРМС = эмбриональная рабдомиосаркома, аРМС = альвеолярная рабдомиосаркома, ORB = орбита, UG-non BP = опухоль мочеполовой системы, но не мочевого пузыря или простаты, HN-non PM = непараменингеальная опухоль головы или шеи, HN-PM = параменингеальная, UG-BP = мочеполовая система, опухоль мочевого пузыря или простаты, EXT = конечности, OTH = другие локализации.
Для RMS nos (без дополнительной характеристики = подтип нельзя определить): NOS означает, что можно поставить диагноз РМС, но нельзя провести дальнейшее отнесение к тому или иному подтипу (в том числе при централизованной экспертизе). Решение по поводу ведения таких пациентов приходится принимать на местах, учитывая клиническую информацию. Группа риска определяется исходя из благоприятных или неблагоприятных характеристик: возраста пациента, размера и локализации опухоли, вовлечения лимфатических узлов.
РМС, группа низого риска:
Все пациенты со следующими характеристиками:
· Локализованная неальвеолярная РМС,
· микроскопически полное удаление (группа IRS I),
· любая локализация,
· и отрицательный результат исследования лимфоузлов,
· и размер ≤ 5 см,
· и возраст пациента < 10 лет (благоприятные размер и возраст).
| Группа риска | Под-группа | Гистология | Группа IRS (послеопераци-онная стадия) | Локали-зация | Л/у стадия | Размер и возраст |
| Низкий | A | Благопри-ятная (не-альвеолярная РМС) | I (микрскопически полное удаление опухоли) | Любая | N0 | Благоприятные (размер ≤ 5 см и возраст < 10 лет) |
Примечание*:
Группу пациентов с РМС низкого риска нужно выделять очень осторожно, так как эти больные получают ограниченную химиотерапию. Поэтому необходимо быть очень внимательным при анализе адекватности краев резекции и обеспечить детальное обсуждение каждого случая с хирургом и патоморфологом, прежде чем будет принято решение о лечении согласно таковому для группы низкого риска.
Местное лечение:
После первоначального полного удаления не требуется дальнейшее местное лечение. Если первичное повторное удаление производится как минимум через 4 недели после гистологической диагностики, пациента относят к группе низкого риска и он получает соответствующее лечение, только если при анализе препарата удаленной опухоли подтверждаются «чистые» края, независимо от того, если ли в этом препарате остаточная опухоль. Первичное повторное удаление является оправданным, если его можно провести без существенного функционального или косметического ущерба и если цель достижения микроскопически полной резекции является реалистичной. Если есть какие-либо сомнения по поводу полноты резекции, пациента следует отнести к группе стандартного риска и лечить соответственно.
Химиотерапия:
После первоначальной операции (полная резекция R0 с микроскопически «чистыми» краями, группа IRS I) лечение должно состоять из 4 курсов винкристина и актиномицина D (VA), разделенных трехнедельными перерывами для восстановления. Винкристин вводится в дни 1, 8, 15 и 22 каждого курса, актиномицин D – в дни 1 и 22. Общая продолжительность химиотерапии – 22 недели.
Повторная оценка опухоли:
Рекомендуется полная клиническая и радиологическая повторная оценка по окончании химиотерапии (неделя 23).
Обратите внимание:
Пациентам с паратестикулярной опухолью и чрезмошоночным инициальным хирургическим доступом должна быть проведена гемискротэктомия. В противном случае они будут переведены в группу стандартного риска, подгруппу B
План лечения РМС в группе низкого риска
(схему таблицу смотри в оригинале протокола оригинал протокола CWS-2009)
▲повторная радиологическая оценка опухоли.
● BMA = аспирация костного мозга.
Курс VA
Винкристин (VCR): 1.5 мг/м2 винкристина вводится в виде единичной в/в болюсной инъекции (максимальная разовая доза 2 мг) в дни 1, 8, 15 и 22 каждого курса VA (с недельными интервалами).
Актиномицин D (AMD): 1.5 мг/м2 актиномицина D вводится в виде единичной в/в болюсной инъеции (максимальная разовая доза 2 мг) в дни 1 и 22 каждого курса VA (недели 1 и 4).
Курс терапии VA
| День | Винкрист |
Детская онкология. Рабдомиосаркома
Из различных морфологических вариантов сарком мягких тканей наиболее часто встречается рабдомиосаркома (РМС), на долю которой приходится, по единодушному мнению многочисленных авторов, около половины сарком мягких тканей у детей.По данным НИИ детской онкологии и гематологии РОНЦ им. Н. Н. Блохина РАМН (НИИ ДО), РМС занимает около 38 % сарком мягких тканей у детей, реже встречаются ангиогенные злокачественные опухоли (около 22 %) и синовиальные (19 %). Остальные виды новообразований мягких тканей, такие, как лейомиосаркома, фибросаркома, липосаркома и др., диагностируются значительно реже.
Рабдомиосаркома развивается из поперечнополосатой мускулатуры или эмбриональных зачатков мышечной ткани. Она состоит из миобластов, находящихся на разных этапах клеточной дифференцировки, в цитоплазме которых обнаруживаются миофибриллы.
Вопросам гистогенеза и эмбриогенеза РМС посвящено определенное количество исследовательских работ. Проблема происхождения этого вида опухоли детально изучалась Ю. Б. Бахтиным и И. Н. Швембергом. Авторы считают, что существует три основные теории происхождения рабдомиосаркомы, дающие рациональное объяснение постоянному обнаружению в подобных опухолях не только клеток миогенного типа, в различной степени проявляющих способность к цитодифференцировке, но и клеток соединительнотканного типа, синтезирующих коллаген и другие свойственные соединительной ткани белки, а также клеток, имеющих ярко выраженное морфологическое сходство с клетками эмбриональной мезенхимы.
По мнению Ю. Б. Бахтина и И. Н. Швемберга, с точки зрения теории дизонтогенетического происхождения РМС смешанный характер опухолей скелетных мышц обусловлен малигнизацией эмбриональных остатков, сохранивших плюропотентность. По существу эта теория основывается на общеизвестных представлениях Конгейма о развитии опухолей из эмбриональных остатков и дистопий. Однако сегодня имеются многочисленные экспериментальные факты, под давлением которых теория дизонтогенетического происхождения опухолей различных органов и тканей оттесняется на задний план.
К числу таких фактов нужно отнести прежде всего успешную индукцию у взрослых животных опухолей, развитие которых связывалось исключительно с малигнизацией дремлющих эмбриональных остатков. Хотя в настоящее время нет оснований считать, что большинство РМС имеет дизонтогенетическое происхождение, для отдельных видов опухолей, в состав которых входят клеточные или синцитиальные структуры, свойственные скелетным мышцам, отрицать возможность подобного происхождения довольно трудно. Это прежде всего относится к эктопическим рабдомиосаркомам и к участкам РМС, обнаруживаемых в тератоидных опухолях.
Говоря об эмбриональном происхождении эктопических РМС, можно с известной долей вероятности в качестве источников развития поперечнополосатых мышечных волокон, встречающихся в таких опухолях, назвать следующие эмбриональные клеточные элементы: дистопические клетки миотомов, мезенхимные клетки, детерминированные в направлении развития скелетных мышц, омнипотентные клетки герминативного зачатка, нефрогенные, а возможно также, нейроэктодермальные клеточные элементы.
Во всех этих случаях предполагается, что источником развития эктопических рабдомиосарком являются клетки, обособившиеся от участия в нормальном онтогенезе на одной из стадий эмбрионального развития, но до достижения ими зрелого, дифференцированного состояния. Принято считать, что эктопические РМС возникают из отщепившихся зачатков мышечной ткани и являются дизонтогенетическими новообразованиями — гамартобластомами поперечной мышечной ткани.
РМС в скелетных мышцах развиваются из клеточных элементов самой мышечной ткани — миобластов, соединительнотканных клеток и клеток мезенхимного типа, сохранившихся в эндомизии и адвентиции сосудов.
Морфологическая характеристика рабдомиосарком впервые была представлена R. С. Horn, Н. Т. Enterline в 1958 г. и стала основой для выделения вариантов рабдомиосарком в Международной классификации опухолей мягких тканей у детей (ВОЗ, Женева, 1969).
Как было изложено выше, в Международной классификации опухолей мягких тканей ВОЗ выделяют 4 типа РМС: эмбриональный (включая ботриоидный), альвеолярный, плеоморфный и смешанный. В последние годы в литературе стали выделять еще два других типа РМС: юингоподобный и недифференцированную мезенхимальную саркому.
Эмбриональная рабдомиосаркома может встречаться в участках, где нет поперечнополосатых мышц; она, вероятно, связана с дисэмбриоплазиями и является наиболее распространенным типом опухоли в детском возрасте. Среди эмбриональных рабдомиосарком выделяют миксоидный, круглоклеточный и пучковый варианты опухоли, что зависит от преобладания тех или иных клеток и волокон в анализируемых микроскопических участках.
Альвеолярная рабдомиосаркома характеризуется наличием псевдожелезистых и псевдоальвеолярных структур, возникающих в связи с наличием в опухоли соединительнотканных прослоек, которые окаймлены опухолевыми клетками.
Плеоморфная рабдомиосаркома имеет наиболее пестрый вид: мелкие, округлые, овальные или веретенообразные клетки в различных соотношениях с гигантскими многоядерными элементами.
По данным литературы, наблюдается следующая частота различных вариантов РМС: эмбриональный (включая ботриоидный) — 70 %, альвеолярный — 16 %, юингоподобный — 7 %, недифференцированная мезенхиальная саркома — 6 %, плеоморфный тип — 1 % случаев.
По данным НИИ ДОГ, выявлены различные типы РМС: эмбриональный (включая ботриоидный) — 73 %, альвеолярный — 9,3 %, смешанный — 2 %, юингоподобный вариант — 1,4 %. У 14,3 % детей вариант опухоли уточнить не удается. Таким образом, у детей наиболее частым является эмбриональный вариант рабдомиосаркомы.
В настоящее время все больший интерес вызывает роль генетических исследований в проблеме сарком мягких тканей. Это касается прежде всего вопросов происхождения данного вида новообразований. Так, С. S. Cooper, М. Straffon (1991) представили данные о наследственной предрасположенности к некоторым опухолям мягких тканей, как доброкачественым, так и злокачественным: липомам, лейомиоматозам, фиброматозам, рабдомиосаркоме и ряду других новообразований. Анализ цитогенетических данных, полученных при изучении опухолей мягких тканей, позволил выявить специфические перестройки хромосом, характерные для определенных типов опухолей мягких тканей.
Кроме того, было уделено пристальное внимание амплификации генов, опухолевым супрессорным генам при развитии новообразований мягких тканей.
Различные в гистогенетическом отношении саркомы мягких тканей имеют свои излюбленные локализации. Так, РМС чаще поражают область головы и шеи и мочеполовую систему, в то время как синовиальные саркомы и фибросаркомы чаще локализуются в области туловища и конечностей.
Установлена различная частота рабдомиосарком мягких тканей в зависимости от их локализации. По мнению большинства авторов, чаще всего (от 40 до 50 %) РМС локализуются в области головы и шеи, при этом наиболее часто поражаются орбита и ЛОР-органы. Рабдомиосаркома орбиты составляет, по данным различных исследователей, от 9 до 37 % случаев. Заболеваемость РМС ЛОР-органов варьирует от 40 до 60 % среди других злокачественных новообразований этой локализации. В области туловища и конечностей РМС наблюдается в 25—37 % случаев, причем нижние конечности поражаются в 2,6 раза чаще, чем верхние.
Частота поражения различных частей тела при рабдомиосаркоме, по данным НИИ ДОГ, представлена ниже.
Частота поражений различных частей тела при рабдомиосаркоме у детей
| Локализация | Частота поражения, % |
| Голова и шея | 35 |
| Конечности | 25 |
| Мочеполовая система | 20 |
| Туловище | 10 |
| Другие локализации | 10 |
Следует отметить, что в зависимости от локализации первичной злокачественной опухоли различают две прогностические группы:
1-я группа — с благоприятной локализацией: орбита, паратестикулярная зона, поверхностные области головы и шеи, влагалище, вульва, матка;
2-я группа — с неблагоприятной локализацией: туловище, конечности, мочевой пузырь, простата, забрюшинная область, брюшная и грудная полости, глубоко расположенные опухоли головы и шеи.
Рабдомиосаркомы диагностируются чаще (80 %) у детей до 5 лет, приблизительно одинаково часто у мальчиков и девочек, в то время как синовиальные саркомы и фибросаркомы чаще встречаются у детей в возрасте от 5 до 14 лет.
Клиническая картина
Клинические проявления рабдомиосаркомы у детей определяют главным образом локализацией процесса и стадией заболевания. Одним из самых ранних симптомов болезни, а иногда и первым случайно обнаруженным симптомом заболевания является опухоль. Однако, помимо местной симптоматики, практически у всех детей имеется общая симптоматика — так называемый общий опухолевый симптомокомплекс, развивающийся независимо от локализации новообразования.В процессе роста опухоль вызывает компрессию той области, где она расположена. Так, забрюшинные новообразования больших размеров нередко сдавливают нижнюю полую вену, что приводит к появлению пастозности в области передней брюшной стенки и образованию выраженной подкожной венозной сети на поверхности живота. При локализации опухоли в области грудной полости нередко наблюдается сдавление органов средостения, что вызывает нарушение функции внешнего дыхания. При компрессии мочевыводящих путей отмечаются дизурические явления, азотемия. Бурно растущая первичная или метастатическая опухоль, инфильтрируя окружающие органы и ткани, вызывает появление местных симптомов, а иногда приводит и к тяжелым, жизненно опасным осложнениям — разрыву опухоли, сопровождающемуся перитонитом, кровотечением, и т. д.
Наиболее важными симптомами опухолевого симптомокомплекса у детей являются вялость, снижение аппетита и массы тела.
Вялость при далеко зашедшем процессе, переходящая в адинамию, развивается достаточно быстро, уже на ранних стадиях злокачественного процесса. Синдром гиподинамии охватывает не только эмоциональную сферу, но и мышечную систему, которая утрачивает силу и двигательную активность как за счет снижения мышечной массы, так и за счет потери калия. Мышцы при общей адаптационной реакции одними из первых подвергаются катаболизму, используя аминокислоты в межорганном обмене с целью поддержания функционального и морфологического гомеостаза мозга, печени, почек, миокарда, костного мозга и других органов, имеющих первостепенное значение для жизнедеятельности.
Снижение аппетита, в той или иной степени выраженное у всех детей, больных злокачественными опухолями, входит в противоречие с повышенными запросами детского организма в средствах энергообеспечения. По данным литературы, гипорексия и анорексия возникают в результате торможения активности так называемого «центра аппетита» в гипоталамусе под влиянием определенных соединений, выделяемых опухолевой клеткой в процессе ее метаболизма. Выраженная анорексия при II—III стадии процесса наблюдается у 8—10 % больных.
Снижение массы тела представляет собой закономерное следствие метаболических процессов в результате системного воздействия злокачественного новообразования. Взвешивание детей не всегда отражает действительную динамику изменения массы тела, так как результат взвешивания почти всегда искажается массой самого новообразования. В большей степени объективными критериями снижения трофики являются постепенная атрофия мышечной системы, истончение кожи и подкожно-жирового слоя, потеря тургора кожи.
Однако именно знание общего опухолевого симптомокомплекса в его разнообразных проявлениях позволяет улучшить результаты ранней диагностики злокачественных опухолей у детей в тех случаях, когда при первичном осмотре больного врачу не удается распознать новообразование с помощью обычных клинических методов обследования. Иными словами, появление симптомов опухолевого симптомокомплекса (или опухолевого синдрома) заставляет врача подумать о наличии у больного злокачественного новообразования, даже если клинически опухоль и не визуализируется.
Клиническая картина рабдомиосаркомы у детей определяется главным образом локализацией процесса и стадией заболевания.
Рабдомиосаркома туловища и конечностей
Туловище и конечности являются достаточно частой локализацией РМС и, по данным НИИ ДОГ, могут конкурировать с частотой этого вида опухоли в области головы и шеи (по 35 %), хотя, по данным некоторых авторов, наиболее часто поражаются органы мочеполовой системы (51,4 %). При анализе причин запущенности процесса при саркомах мягких тканей, проведенном в НИИ ДОГ, было установлено, что подавляющее большинство ошибок были врачебными (85 %).Следует подчеркнуть, что РМС туловища и конечностей относится к группе новообразований с прогностически неблагоприятным течением, особенно если речь идет о распространенных формах заболевания — III—IV стадии.
Первым и важнейшим признаком заболевания является наличие опухоли, которая при наружном осмотре определяется как объемистая, чаще односторонняя припухлость округлой или овальной формы. Образование располагается в толще мышц, имеет нередко четкие границы, хотя на самом деле границы опухоли чаще только кажутся четкими, создавая впечатление инкапсулированности. Но в основном вследствие обширной инфильтрации окружающих тканей границы новообразования представляются расплывчатыми, нечеткими, поддаются лишь приблизительному определению. При попытке смещения новообразования отмечается, что опухоль легче сдвигается в поперечном направлении, в обе стороны. В продольном направлении новообразование практически не смещается. Если опухолевый узел располагается глубоко, то он может врастать в предлежащую кость, и тогда он становится совершенно неподвижным.
Поверхность опухоли пальпаторно чаще определяется как гладкая, но она может быть и бугристой. В этом смысле имеет значение глубина расположения опухоли: при глубоко расположенных новообразованиях поверхность опухолевых узлов выглядит, как правило, гладкой; поверхностные узлы определяются как бугристые.
Кожа над опухолью в большинстве случаев бывает неизмененной. Когда опухоль достигнет больших размеров, кожа над новообразованием может истончаться, приобретать багрово-синюшный оттенок. Наконец, может наступить момент, когда опухоль прорастает кожу и выходит на ее поверхность в виде опухолевых масс, иногда с изъязвлением, нередко кровоточащих.
Опухоль чаще бывает безболезненной и не вызывает каких-либо серьезных нарушений, особенно в начальных стадиях заболевания. По мере роста новообразования или при расположении опухоли в дистальных отделах конечностей появляются болезненные ощущения, которые могут нарастать с ростом образования, что связано со сдавлением или прорастанием нервных стволов. Обычно незначительная болезненность определяется при пальпации опухоли, иногда над новообразованием при пальпации определяется зона гиперестезии кожи. При прорастании опухоли в близлежащую кость или оболочки суставов появляется стойкая местная болезненность.
Температура над опухолью обычно незначительно повышена, что более четко определяется при сравнительной пальпации симметричных участков конечностей или туловища. Измерение температуры новообразования является важным диагностическим признаком активности злокачественного процесса и является обязательным в звене диагностических мероприятий. Консистенция опухолевых узлов при рабдомиосаркоме бывает обычно плотной или плотноэластической; иногда при больших опухолях вследствие образования зон распада могут прощупываться участки флюктуации, которые нередко ошибочно принимаются врачами за гнойно-воспалительный процесс, что приводит в дальнейшем к неоправданным хирургическим действиям (вскрытие и дренирование «абсцесса»).
Рабдомиосаркомы области головы и шеи наряду с симптомами, изложенными выше, могут иметь некоторые признаки, специфичные для данной локализации опухоли. При локализации опухоли в области орбиты наблюдается припухлость, которая определяется уже на ранних стадиях опухолевого процесса. Одновременно с припухлостью появляется экзофтальм, который нередко обнаруживается как первый симптом заболевания, причем чаще экзофтальм замечают родители ребенка, что является основанием для первичного обращения к врачу. По мере роста новообразования оно может постепенно заполнить полость орбиты, прорастать в глазное яблоко, вызывая вначале снижение, а потом и полную потерю зрения ребенка.
При локализации рабдомиосаркомы в области носоглотки, полости носа, околоносовых пазух и крылонебной ямки одним из первых симптомов является нарушение носового дыхания, сопровождающееся обычно слизисто-гнойным отделяемым с неприятным и даже зловонным запахом. У таких больных часто ощущается неприятный запах изо рта. Вследствие обтурации носовой полости появляется «гнусавость» голоса. Боли у детей возникают в случаях поражения костей, или при заполнении опухолью гайморовых верхнечелюстных (гайморовых) пазух, или при прорастании новообразования в полость черепа через клетки решетчатого лабиринта. Тогда же возможно появление симптомов внутричерепной гипертензии. Рабдомиосаркому носоглотки часто сопровождает серозный отит с соответствующей клинической симптоматикой.
При локализации опухоли в области среднего уха или сосцевидного отростка одними из первых проявлений заболевания являются боли в ухе, которые могут быть весьма интенсивными. При увеличении размеров новообразования оно может обтурировать слуховой проход, приводя к потере слуха. Экзофитный рост опухоли вскоре выявляется при визуальном осмотре: опухоль становится видна из наружного слухового хода. Рост рабдомиосаркомы сопровождается появлением припухлости в заушной области. Иногда наблюдается паралич лицевого нерва. В процессе роста образования появляются выделения из слухового прохода, слизисто-гнойные, с неприятным гнилостным запахом, сопровождающим распад опухоли.
При локализации новообразования в области языка, ротоглотки, гортани у больного рано появляются симптомы, связанные с нарушением глотания, что приводит к затруднению приема пищи; при росте опухоли нарушается дыхательная функция. Особенности кровоснабжения указанных зон приводят к ранней и бурной диссеминации патологического процесса — появлению метастазов.
Рабдомиосаркома влагалища чаще встречается у девочек младшего возраста (до 5 лет). На начальных стадиях заболевание имеет симптомы, которые трактуются как вульвит, вагинит, остроконечные кондиломы, полипы. Чаще всего первыми симптомами болезни являются выделения из половых путей различного характера (белесоватые, желтоватого цвета, с примесью гноя, иногда с неприятным запахом, кровянистые). По мере роста опухоли и обтурации уретры появляются симптомы затрудненного мочеиспускания, дизурические явления. Больных беспокоит зуд в области влагалища, позднее присоединяются боли в области наружных половых органов. При осмотре наружных половых органов родители ребенка иногда обнаруживают новообразование розового или красного цвета, иногда множественные, чаще небольших размеров, заставляющие обратиться к врачу.
Рабдомиосаркома мочевого пузыря является одной из самых тяжелых в прогностическом отношении локализаций. Чаще опухоль поражает мальчиков в возрасте до 5 лет. Новообразование в области мочевого пузыря имеет свои излюбленные локализации: шейка мочевого пузыря, область треугольника Литтля.
Особенностью рабдомиосаркомы мочевого пузыря является локализация, недоступная визуальной оценке. Поэтому так высока «запущенность» процесса именно при этом виде опухоли. Возникая под слизистой оболочкой, опухоль отличается быстрым экзофитным ростом с прорастанием стенки пузыря, предстательной железы, околопузырной клетчатки.
Ранними симптомами заболевания являются дизурические явления, которые имеют тенденцию к быстрому нарастанию. У больных появляются частые позывы к мочеиспусканию, вплоть до императивных позывов и тенезмов без мочеиспускания или с мочеиспусканием небольшими порциями. Вскоре возникает гематурия, которая иногда становится профузной, с большим количеством сгустков крови.
Пиурия является следствием присоединения вторичной инфекции. При появлении пиурии отмечается нарастание дизурических явлений, мочеиспускание становится болезненным. Наконец наступает частичная, а иногда и полная, острая задержка мочи, возникающая вследствие обтурации опухолью области шейки мочевого пузыря, причем даже при небольших размерах новообразования; по мере роста его в просвет мочевого пузыря и расположение в области шейки может наступить острая полная задержка мочи. Иногда острая задержка мочи является первым симптомом, заставляющим родителей обратиться к врачу.
Таких детей госпитализируют в стационары в экстренном порядке, чаще всего с подозрением на камень мочевого пузыря.
Рабдомиосаркома яичка встречается довольно редко. Новообразование чаще всего проявляется возникновением уплотнения в области ткани органа, чаще безболезненного. При этом наблюдается одностороннее увеличение яичка. По мере роста опухоли увеличиваются размеры яичка, которое становится плотным. При пальпации определяется неровность контуров, отсутствует четкость границы между новоообразованием и яичком. При выходе опухоли за пределы капсулы отмечаются инфильтрация окружающих тканей, отечность мошонки, области семенного канатика, надлобковой области. Наиболее часто рабдомиосаркома яичка принимается за гидроцеле, доброкачественные образования типа гонотиды или фибромы.
Рабдомиосаркомы грудной и брюшной полостей, забрюшинного пространства и малого таза встречаются значительно реже, чем опухоли этого вида, расположенные в области головы и шеи, туловища, конечностей и мочеполовой системы. Если при рабдомиосаркоме туловища и конечностей на первый план выделяются местные симптомы заболевания, то при новообразованиях, расположенных в грудной и брюшной полости, забрюшинном пространстве и малом тазе, превалируют симптомы общего порядка — общий опухолевый симптомокомплекс.
При локализации рабдомиосаркомы в грудной полости местные симптомы заболевания связаны с прорастанием опухоли в окружающие ее органы и ткани или сдавлением магистральных сосудов (синдром верхней полой вены: нарастающая одышка, акроцианоз, головокружение и т. д.).
При расположении рабдомиосаркомы в брюшной полости или забрюшинном пространстве местные симптомы болезни обусловлены чаще всего сдавлением магистральных сосудов (нижняя полая вена, мезентериальные сосуды, аорта). При росте опухоли могут возникнуть симптомы частичной, а иногда и полной непроходимости кишечника вследствие поражения кишечной трубки. При прорастании стенки кишечника возможно появление болевого синдрома, диспепсических явлений. Из-за присутствия примеси крови кал пациента окрашивается в темный или даже черный цвет (мелена).
Клинические классификации рабдомиосаркомы
Для оценки степени распространенности опухолевого процесса были предложены различные клинические классификации злокачественных новообразований мягких тканей, позволяющие в конечном итоге составить адекватный план терапии при злокачественной опухоли. Распространенность злокачественного новообразования соответствует той или иной стадии клинической классификации.В 1968 г. Даниель-Бек предложил клиническую классификацию, согласно которой злокачественные опухоли мягких тканей по стадиям распределялись следующим образом:
I стадия — опухоль менее 5 см в наибольшем своем размере, с четкими границами, подвижная, без вовлечения кожи и костей;
II стадия — опухоль более 5 см в наибольшем своем размере, с относительно четкими контурами, ограниченно подвижная, без вовлечения кожи и костей;
III стадия — опухоль любых размеров, со вторичными изменениями кожи, вплоть до ее изъязвления, или с деструкцией кости, неподвижная. Могут быть симптомы сдавления сосудов и нервных образований конечности: а) без регионарных метастазов; б) с регионарными метастазами;
IV стадия — опухоли обширные, изъязвленные, широко инфильтрирующие окружающие ткани с большим разрушением прилежащих костей, или опухоль любых размеров с отдаленными метастазами и кожной диссеминацией.
Приведенная классификация достаточно полно отражает возможные варианты течения первичных опухолей мягких тканей, а также характеризует выраженность их местного и инфильтративного роста, способность опухоли к гематогенному и лимфогенному метастазированию.
Рабочая классификация злокачественных опухолей мягких тканей, предложенная И. Т. Кныш и И. М. Кострыба (1972), также включает 4 стадии.
I стадия — опухоль диаметром до 5 см, не выходящая за границы анатомического образования, из которого она исходит, подвижная, без регионарных и отдаленных метастазов;
II стадия — опухоль, прорастающая в соседние ткани, но не выходящая за границы мышечно-фасциального футляра, диаметром до 10 см, подвижная, без регионарных и отдаленных метастазов;
III стадия — опухоль, прорастающая в соседние ткани, диаметром более 10 см, спаянная с окружающими тканями, с наличием регионарных (редко), но без отдаленных метастазов;
IV стадия — опухоль любых размеров, подвижная или неподвижная, с отдаленными метастазами — единичными или множественными.
Представленная классификация имеет ряд недостатков, связанных главным образом с нечеткостью разграничения стадий сарком мягких тканей, особенно начиная с момента выявления регионарных и отдаленных метастазов.
Безусловный интерес представляет, на наш взгляд, клиническая классификация, предложенная А. А. Клименковым (1971), в основу которой положена Международная классификация опухолей по системе TNM (Т — опухоль, N — регионарные метастазы, М — отдаленные метастазы). Классификация опухолей по системе TNM достаточно полно отражает возможные варианты сочетаний первичной опухоли с регионарными и отдаленными метастазами. Особенно четко раскрываются III и IV стадии опухолевого процесса, что имеет несомненные преимущества перед классификацией опухолей по стадиям.
Символы TNM в классификации А. А. Клименкова расшифровываются следующим образом:
Т1 — опухоль менее 5 см в наибольшем своем размере, с четкими границами, подвижная, без вовлечения кожи и костей;
Т2 — опухоль более 5 см в наибольшем своем размере, с относительно четкими границами, ограниченно подвижная, без вовлечения кожи и костей;
Т3 — опухоль любых размеров с нечеткими контурами, неподвижная, прорастающая кожу;
Т4 — опухоль любых размеров с изъязвлением кожи или прорастающая в кость. Могут быть симптомы сдавления сосудисто-нервных образований конечности;
N0 — метастазы в регионарные лимфатические узлы клинически не определяются;
N1 — пальпируется единичный, подвижный лимфатический узел более 2 см в диаметре или группа подвижных лимфатических узлов;
N3 — пальпируется неподвижный опухолевый узел или конгломерат неподвижных метастатических узлов;
М0 — отдаленные метастазы клинически не выявляются;
M1 — солитарные отдаленные метастазы;
М2 — множественные отдаленные метастазы.
В настоящее время предпочтение отдается использованию для установления клинической стадии заболевания Международной классификации TNM, четвертое издание (1987), которая была предложена для опухолей у взрослых, но с рекомендациями Международного союза онкологов-педиатров (S.I.O.P.). По этой классификации к опухолям детского возраста относятся нефробластома, нейробластома и саркомы мягких тканей.
Классификация преимущественно применяется при рабдомиосаркоме у детей (ICD-0 М 8900/3), но может использоваться и при других саркомах мягких тканей. Необходимо гистологическое подтверждение диагноза.
Для оценки категории Т, N и М применяются следующие методы:
Т-категории — физикальный осмотр и методы визуализации, применяемые при данной локализации;
N-категории — физикальный осмотр и необходимые методы визуализации;
М-категории— физикальный осмотр и методы визуализации (при рабдомиосаркоме рекомендуется производить исследование костного мозга).
Дополнительные методы могут использоваться с целью повышения точности стадирования до начала лечения.
Регионарные лимфатические узлы поражаются в зависимости от локализации первичной опухоли:
- голова и шея — шейные и надключичные лимфатические узлы;
- брюшная полость и таз — поддиафрагмальные, внутрибрюшные и пахово-подвздошные лимфатические узлы;
Представленные pTNM-категории были сгруппированы в следующие стадии (табл. 15.3).
Таблица 15.3. Стадии заболевания согласно pTNM-классификации
| Стадия | Классификация | ||
| I | рТ1 | pN0 | pM0 |
| II | рТ1 | pN1a | pM0 |
| рТ2 | pN0, pN1a | pM0 | |
| III | рТ3а | pN0, pN1a | pM0 |
| IIIb | рТЗb | Любая pN | pM0 |
| рТ3с | Любая pN | pM0 | |
| Любая рТ | pN1b | pM0 | |
| IV | Любая рТ | Любая pN | pMl |
Следует отметить также, что при всех локализациях опухолей категории M1 и рМ1 могут быть дополнены в зависимости от локализации метастазов:
| легкое PU | костный мозг MAR |
| кости OSS | плевра PLE |
| печень HEP | брюшина PER |
| головной мозг BRA | кожа SKI |
| лимфатические узлыLY | другие органы ОТН |
Любая классификация представляет собой только основу для работы, которая должна учитывать не только гистологическую характеристику опухоли, но сопоставлять ее с клиническими проявлениями болезни и результатами детального обследования. Это особенно важно в детской онкологии, где критерии злокачественности бывают относительными. Именно поэтому необходимо постоянно сопоставлять данные клинического, лабораторного, других общих и специальных методов диагностики и гистологического исследования, нередко прибегая к повторному гистологическому анализу.
Предложенная выше Международная классификация по системе TNM достаточно громоздкая, во всяком случае такой она представляется на первый взгляд. Но пока она единственная, с помощью которой детские онкологи разных стран могут сравнивать и анализировать свои результаты и, что главное, сопоставлять их между собой. Это является непременным условием того, чтобы проблема диагностики и лечения РМС у детей приблизилась к своему разрешению.
Л.А.Дурнов, Г.В.Голдобенко
Опубликовал Константин Моканов