влияние ферментов на старение организма!
Одной из причин старения организма считается способность клеток делиться лишь конкретное количество раз. Каждый раз после этого ДНК человека укорачивается. При этом защиту генам обеспечивают теломеры. Они представляют собой концевые участки хромосом, которые с каждым делением уменьшаются.
Что такое теломеры
Теломеры обеспечивают защиту главного фрагмента ДНК от поражения при репликации. Когда они заканчиваются, клетки не способны делиться. Однако некоторые из них не сталкиваются с подобными проблемами. Это обусловлено наличием в их составе другого фермента – теломеразы. Он все время удлиняет теломеры. Такие особенности характерны для раковых и стволовых клеток.

Теломеры находятся на 4 окончаниях хромосом и напоминают кончики шнурков. Эти элементы предотвращают склеивание хромосомных концов друг с другом. Также они помогают избежать слипания с остальными хромосомами. При нарушении этого процесса клетки погибают или трансформируются в опухоли. По мере деления клеток окончания теломеразы укорачиваются. Как следствие, клетки прекращают процесс деления. Эти изменения являются генетическими и эпигенетическими. Это значит, что они зависят от наследственной предрасположенности и воздействия внешних факторов.
Сохранение и регенерация теломеров зависит от активности теломеразы. Благодаря стимуляции синтеза фермента удается предотвратить истощение теломеров. Под ними находятся так называемые гены смерти. Они вызывают возникновение апоптоза. Этот процесс проявляется в виде гибели клеточных элементов. Данный процесс считается естественным и неотвратимым. Однако многочисленные научные исследования помогли установить, что у некоторых людей процесс укорачивания теломеров является слишком быстрым. Это становится причиной возникновения серьезных патологий и преждевременного старения.
Это означает, что существуют определенные отличия между физиологическим возрастом и реальной цифрой. Ткани бывают старше или моложе по сравнению с самим человеком. Чем сильнее укорачиваются теломеры, тем быстрее происходят процессы старения.
Методы защиты теломеров
Синтез фермента теломеразы, способного удлинять теломеры, тоже снижается по мере старения организма. Однако сегодня существуют медикаментозные средства, которые помогают скорректировать этот процесс. При этом они не имеют общедоступного характера и используются довольно редко.
Чтобы сохранить окончания теломеразы, необходима коррекция образа жизни. Согласно научным исследованиям, люди, которые часто медитируют, в меньшей степени подвергаются стрессовым факторам и воспалениям. У поклонников медитации концы хромосом обычно длиннее, чем у людей, которые не занимаются подобными практиками.

Стоит учитывать, что хронические воспаления провоцируют снижение активности теломеразы и ускоряют сокращение окончаний теломеров. Это обусловлено нарушением РН, поведением интерлейкинов и прочими процессами в организме.
Если человек хочет остановить старение и продлить долголетие, нужно приступать к лечению хронических воспалений в организме. Для этого необходимо своевременно устранять кариозное поражение зубов, простатит, воспаления в кишечнике, пародонтоз, гинекологические патологии.
Способы удлинения теломеров
Теломераза подвергается определенному воздействию. Активизация фермента достигается с помощью эстрогена. Количество данных гормонов увеличивается при беременности. Потому для многодетных женщин обычно характерна большая длина теломеров. Данная особенность является одним из обоснований большей продолжительности жизни у женщин.
Еще одним механизмом, которые способствует, удлинению теломеров, считается уменьшение калорийности рациона. Есть данные, что снижение количества потребляемых калорий лишь на 10 % от привычной нормы помогает увеличить продолжительность жизни на 5 лет. При этом переедание и существенное превышение веса снижает длину теломеров.

Эффективным методом удлинения теломеров считаются ежедневные прогулки. Их длительность должна составлять не меньше 40 минут. Еще одним действенным способом активизации синтеза теломеразы считается повышение уровня витамина D. Согласно многочисленным исследованиям, количество вещества на уровне 100 мг/л повышает длину теломеров на 19 %. Синтез теломеразы активизируют коэнзим Q10, ресфератрол. За этот процесс отвечают витамин С, омега-3 кислоты, а также другие антиоксиданты.
Нужно активизировать синтез теломеразы?
Есть мнение, что активизация продукции теломеразы может приводить к отрицательным последствиям. Это обусловлено тем, что данный фермент препятствует гибели опухолевых клеток. Но это не относится к коррекции образа жизни. Благодаря употреблению продуктов с омега-3 стимулируется синтез теломеразы в здоровых клетках. При этом выработка вещества в аномальных клетках наоборот замедляется.

Потому применение медикаментозных препаратов для активизации синтеза теломеразы осуществляется при наличии строгих показаний – к примеру, при развитии онкологических патологий. При этом коррекция образа жизни не может провоцировать отрицательные последствия. Потому врачи советуют употреблять полезные продукты, своевременно лечить воспаления и справляться с воздействием стрессовых факторов на организм.
Полезные продукты

Существуют продукты, которые стимулируют активность теломеразы. К ним относят следующее:
- лосось;
- авокадо;
- яйца;
- зеленый чай;
- мясо;
- бобовые;
- голубика;
- чеснок;
- грейпфрут.
Чтобы уменьшить выраженность воспалительных изменений в организме и улучшить питание клеток, нужно употреблять продукты, которые содержат много цинка. К ним относят говяжью печень и устрицы. Также стоит есть продукты из пшеницы. Для сокращения влияния стрессовых факторов полезно употреблять магний. Он присутствует в зеленых овощах, бобовых, растительных маслах. Также вещество включает шоколад и цельнозерновые каши.
В качестве антиоксидантов стоит использовать витамин Е. Элемент присутствует в авокадо, орехах, растительных маслах. Немаловажное значение имеют омега-3 жирные кислоты. Данные вещества входят в состав морепродуктов. Помимо этого, стимуляции синтеза теломеразы способствуют виноград и чай благодаря наличию полифенолов. Обязательно стоит добавлять в пищу куркуму, которая оказывает противовоспалительный эффект.

Очень полезно употреблять пищу с витамином А. Это вещество присутствует в тыкве, моркови, томатах. Также оно содержится в шпинате, болгарском перце. Немаловажное значение имеет и витамин D. Данное вещество содержится в печени трески, селедке, сардинах. Указанные элементы благоприятно влияют на нервную систему и структуру костных тканей.

Чтобы предотвратить преждевременное старение, необходимо употреблять аминокислоты. Особенно важно делать это по вечерам. Это обусловлено активным делением клеток в ночное время. Благодаря этим особенностям пептиды могут восстанавливать пораженные теломеры. 5 раз в неделю на ужин следует употреблять белковую пищу. Если человек занимается спортом, белок должен присутствовать в ежедневном рационе. При этом ужинать необходимо за 3 часа до сна. Количество пищи вечером не должно превышать 2/3 порции обеда.
Таким образом, активность теломеразы можно увеличивать. Улучшение функционирования фермента и увеличение длины теломер связано с умеренной физической нагрузкой. Также этому способствуют витамины и полиненасыщенные кислоты, которые присутствуют в здоровой пище.
Врачи уверяют, что длина теломеров у людей, которые привыкли вести здоровый образ жизни, намного больше. Этого нельзя сказать о тех, кто употребляет много алкогольных напитков, курит, не контролирует свой вес и ведет недостаточно активный образ жизни. Стремительное уменьшение длины теломеров наблюдается под воздействием стрессовых факторов и вирусных инфекций.
Использование активатора теломеразы
Со времени возникновения теломер-теломеразной теории старения начались поиски препарата, который способен стимулировать синтез теломеразы и замедлить возрастные изменения. В результате крупная биотехнологическая компания США Geron Inc сумела отыскать молекулу, которая стала базой первого активатора теломеразы, который называется ТА-65.
Особенности состава
Эта молекула была получена из корневища перепончатого астрагала. Это лекарственное растение с давних времен применяется в китайской медицине для профилактики раковых заболеваний. Состав данного средства включает больше 2000 молекул. При этом только одна может активизировать теломеразу. Ее назвали ТА-65.

Процесс получения и очищения этой молекулы является достаточно трудоемким и многоступенчатым. Вещество не только нужно отличить от остальных, но и максимально качественно очистить его от примесей. Молекула и метод ее получения была запатентованы. Чтобы получить минимальный объем ТА-65, нужно переработать примерно 5-6 т сырья. Потому доза активного компонента, которая находится в одной капсуле, может приравниваться к нескольким литрам экстракта.
Для достижения стойких результатов требуется применять средство минимум 3 месяца. Потому заменить препарат употреблением нескольких литров обыкновенного экстракта не удастся.
Механизм действия
При проникновении в системный кровоток молекула попадает в клетку и активизирует функции гена, который отвечает за временную активизацию теломеразы. Благодаря этому фермент начинает формировать конечные зоны хромосом. Это достигается за счет добавления оснований нуклеотидов. За счет наращивания теломеров клетка получает новую возможность к делению и функционированию. Таким образом продолжается ее жизнь. Можно сказать, что клетки из стареющих трансформируются в молодые и активные. Данный процесс влияет на работу всего организма.

Когда человек прекращает употреблять ТА-65, фермент теломераза снова снижает свою активность. Это значит, что стимулирование элемента носит временный и контролируемый характер. Предельный объем активного компонента в крови достигается спустя 3 часа после применения вещества. Исследования препарата проводились на клетках, животных и людях. Первая категория экспериментов помогла доказать, что добавление ТА-65 к структуре клеток продлевает их жизненный цикл и позволяет справиться с лимитом Хейфлика.
Первое свидетельство об обратимости возрастных процессов у млекопитающих под влиянием ТА-65 было представлено в 2011 году. Публикация появилась в журнале The Nature. Мыши, на которых проводились опыты, имели короткие теломеры. Для них была характерна минимальная активность теломеразы. Грызуны имели поражения ДНК, серьезные поражения мозга и дегенеративные процессы в органах. В результате у них присутствовали нарушения репродуктивных функций, преждевременное старение. Длительность жизни животных не превышала 43 недель.
В 30-35 недель ученые каждый день вводили грызунам активатор теломеразы. Такая терапия проводилась в течение 1 месяца. Как следствие, продолжительность жизни увеличивалась примерно до 80 недель. Применение средства способствовало удлинению теломеров, восстановлению активность теломеразы и уменьшению поражения ДНК в хромосомах. Также активатор ТА-65 обеспечивал уменьшение дегенеративных поражений органов. При этом страдала селезенка, мозг, кишечник, яички.

Благодаря применению вещества восстанавливались репродуктивные возможности грызунов. Это помогло добиться заметного омоложения мышей. При этом ни одно из животных не столкнулось с развитием злокачественных опухолей. Таким образом, ТА-65 можно назвать первым активатором теломеразы, который имеет подтвержденную эффективность и безопасность. Благодаря применению вещества удается добиться омоложения клеток за счет стимуляции теломеразы.
Удлинение теломеров позволяет увеличить длительность здоровой жизни. Применение вещества на долгие годы обеспечивает человека жизненной энергией. Благодаря этому удается изнутри остановить процессы старения и оставаться активным в любом возрасте.
Преимущества препарата
Активатор ТА-65 представляет собой натуральное средство, результативность которого подтверждена многочисленными исследованиями. Благодаря его применению удается стимулировать активность теломеразы и запустить восстановление коротких теломеров в организме. Это помогает существенно замедлить процессы старения.

Вследствие омоложения клеток на фоне применения ТА-65 удается получить такие эффекты:
- уменьшить вероятность возрастных заболеваний;
- сократить риск развития онкологии;
- увеличить эластичность кожи;
- улучшить функционирование иммунной системы;
- поддерживать в норме когнитивные функции;
- нормализовать состояние волос и ногтей;
- сохранить в норме сексуальную энергию;
- улучшить остроту зрения;
- повысить плотность костных структур.
Теломеры и теломераза – важные элементы, от которых напрямую зависят возрастные изменения в организме. Чтобы остановить процессы старения, можно применять активатор ТА-65, который имеет немало преимуществ.
Теломеры — Википедия
Материал из Википедии — свободной энциклопедии
 Схема расположения теломер на хромосоме
Схема расположения теломер на хромосомеТеломе́ры (от др.-греч. τέλος — конец и μέρος — часть) — концевые участки хромосом. Теломерные участки хромосом характеризуются отсутствием способности к соединению с другими хромосомами или их фрагментами и выполняют защитную функцию.
Термин «теломера» предложил Г. Мёллер в 1932 г[1].
У большинства эукариот теломеры состоят из специализированной линейной хромосомной ДНК, состоящей из коротких тандемных повторов. В теломерных участках хромосом ДНК вместе со специфически связывающимися с теломерными ДНК-повторами белками образует нуклеопротеидный комплекс — конститутивный (структурный) теломерный гетерохроматин.
Теломерные повторы — весьма консервативные последовательности, например повторы всех позвоночных состоят из шести нуклеотидов TTAGGG, повторы всех насекомых — TTAGG, повторы большинства растений — TTTAGGG.
Учёные из университета Кардиффа установили, что критическая длина человеческой теломеры, при которой хромосомы начинают соединяться друг с другом, составляет 12,8 теломерного повтора[2].
В каждом цикле деления теломеры клетки укорачиваются из-за неспособности ДНК-полимеразы синтезировать копию ДНК с самого конца. Она в состоянии лишь добавлять нуклеотиды к уже существующей 3’-гидроксильной группе.
По этой причине ДНК-полимераза нуждается в праймере, к которому она могла бы добавить первый нуклеотид.
Данный феномен носит название концевой недорепликации и является одной из важнейших причин биологического старения.
Тем не менее, вследствие этого явления теломеры должны укорачиваться весьма медленно — по несколько (3-6) нуклеотидов за клеточный цикл, то есть за количество делений, соответствующее пределу Хейфлика, они укоротятся всего на 150—300 нуклеотидов.
Впервые гипотезу, объясняющую экспериментальные данные Леонарда Хейфлика, в 1971 г. выдвинул советский учёный Алексей Матвеевич Оловников, предложив теорию маргинотомии — отсчёта клеточных делений и старения вследствие недорепликации последовательностей ДНК на концах хромосом (теломерных участков).
Теория предполагает, что «нестарение» бактерий обусловлено кольцевой формой ДНК, а теломерные последовательности в стволовых и раковых клетках защищены благодаря постоянному — при каждом делении клетки — удлинению особым ферментом — тандем-ДНК-полимеразой (современное название — теломераза).
В последующих двух статьях (1972, 1973) в советской и зарубежной печати он подробно рассмотрел разные биологические следствия своей гипотезы, в том числе применительно к объяснению старения, канцерогенеза и иммунных реакций.
Нобелевская премия за экспериментальное подтверждение изменения теломеразы[править | править код]
В 1998 году вывод о теломерном механизме ограничения числа делений клетки подтвердили американские исследователи-экспериментаторы, преодолевшие предел Хейфлика путём активации теломеразы[3].
Профессор Леонард Хейфлик утверждал в связи с этим, что «проницательное предположение Оловникова получило экспериментальное подтверждение»
В дальнейшем за открытие механизмов защиты хромосом от концевой недорепликации с помощью теломер и теломеразы в 2009 году присуждена Нобелевская премия по физиологии и медицине австралийке, работающей в США, Элизабет Блекберн, американке Кэрол Грейдер и её соотечественнику Джеку Шостаку.
Впоследствии подобное решение Нобелевского комитета вызвало ряд возмущённых откликов в научной среде[5][6].
в 2009 году отмечены работы по теломерам и теломеразе
В 2009 году Нобелевская премия по физиологии и медицине вручена трём американским учёным, разрешившим важную биологическую проблему: как хромосомы при делении клетки копируются
Длинная нитеобразная молекула ДНК — главный компонент хромосом, несущий генетическую информацию, — с обоих концов закрыта своего рода «заглушками» — теломерами. Теломеры представляют собой участки ДНК с уникальной последовательностью и защищают хромосомы от деградации. Это открытие принадлежит двум лауреатам Нобелевской премии по физиологии и медицине за 2009 г. — Элизабет Блэкберн (
Таинственная теломера
В хромосомах содержится наш геном, а «физическим» носителем генетической информации являются молекулы ДНК. Ещё в 1930 году Герман Мёллер (лауреат Нобелевской премии по физиологии и медицине 1946 года «за открытие появления мутаций под влиянием рентгеновского облучения») и Барбара Мак-Клинток (лауреат Нобелевской премии в той же категории 1983 года «за открытие транспозирующих генетических систем») обнаружили, что структуры на концах хромосом — так называемые
Позже, в 1950-х, когда уже было в общих чертах понятно, как копируются гены, возникла другая проблема. При делении клетки основание за основанием дублируется и вся клеточная ДНК, — при помощи ферментов ДНК-полимераз. Однако для одной из комплементарных цепей возникает проблема: самый конец молекулы не может быть скопирован (дело тут в «посадочном» сайте ДНК-полимеразы). Вследствие этого, хромосома должна укорачиваться при каждом делении клетки, — хотя на самом деле этого не происходит (на рисунке: 1).
И та, и другая проблема были со временем решены, за что в этом году и вручают премию.
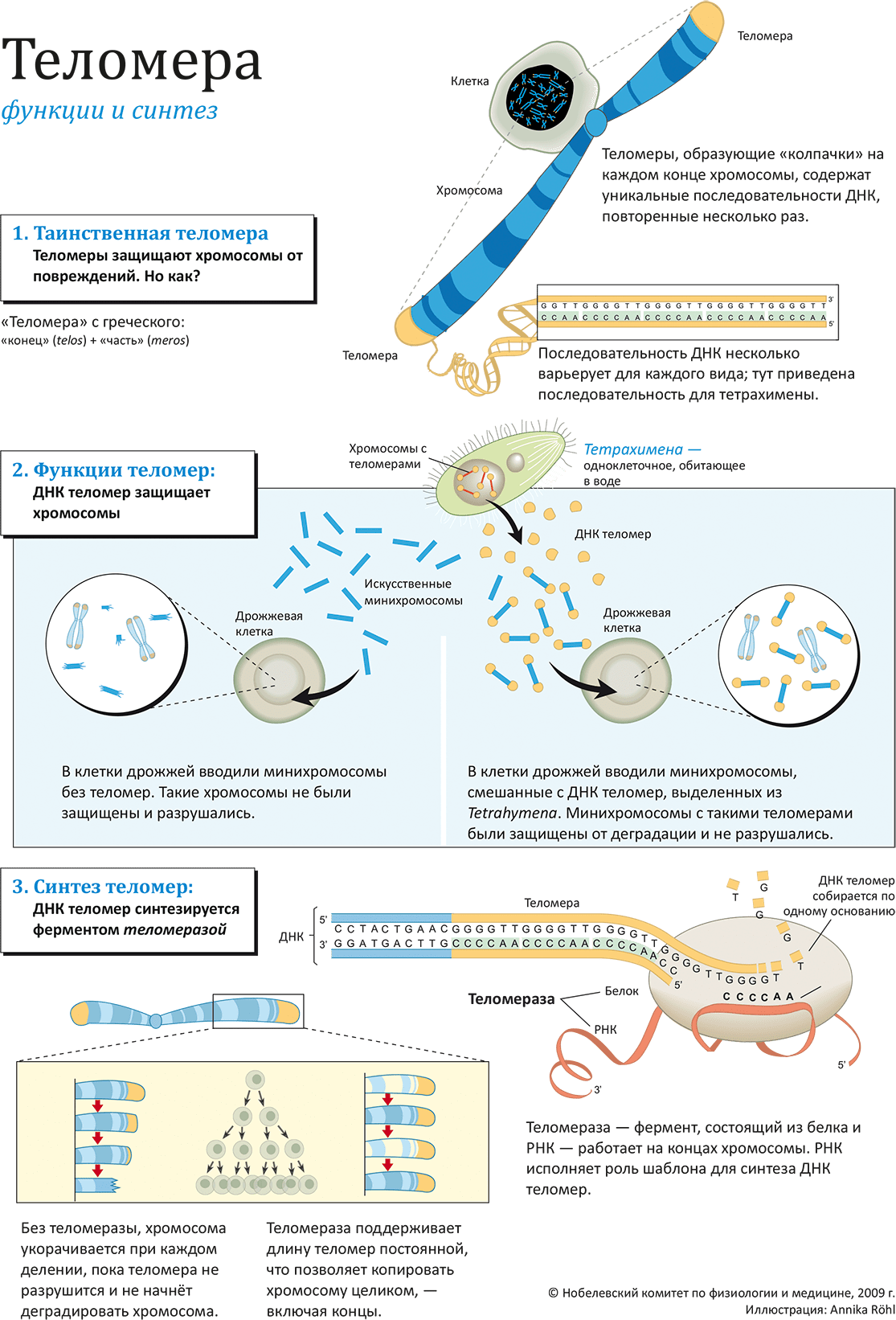
ДНК теломер защищает хромосомы
Исследователи встретились на конференции в 1980 г., где Блэкберн докладывала свои результаты, заинтересовавшие Шостака. Они решили провести совместный эксперимент, в основе которого было «растворение барьеров» между двумя эволюционно весьма далёкими видами (на рисунке: 2). Блэкберн выделила из ДНК тетрахимены последовательности CCCCAA, а Шостак присоединил их к минихромосомам, помещённым затем в клетки дрожжей. Результат, опубликованный в 1982 году, превзошёл ожидания: теломерные последовательности действительно защищали ДНК от деградации! Это явление наглядно продемонстрировало существование неизвестного ранее клеточного механизма, регулирующего процессы старения в живой клетке. Позже подтвердилось наличие теломер в подавляющем большинстве растений и животных — от амёбы до человека.
Фермент, синтезирующий теломеры
В 1980-х аспирантка Кэрол Грейдер работала под началом Элизабет Блэкберн; они начали изучение синтеза теломер, за который должен был отвечать неизвестный на ту пору фермент. В канун рождества 1984 года Грейдер зарегистрировала искомую активность в клеточном экстракте. Грейдер и Блэкберн выделили и очистили фермент, получивший название
Теломераза отсрочивает старение клетки
Учёные начали активно заниматься исследованием роли теломер в клетке. Лаборатория Шостака установила, что дрожжевая культура с мутацией, приводящей к постепенному укорачиванию теломер, развивается очень медленно и, в конце концов, вообще прекращает рост. Сотрудники Блэкберн показали, что в тетрахимене с мутацией в РНК теломеразы наблюдается в точности такой же эффект, который можно охарактеризовать фразой
Части головоломки: старение, рак и стволовые клетки
Описанные открытия имели самый сильный резонанс в научном сообществе. Многие учёные заявляли, что укорачивание теломер является универсальным механизмом не только клеточного старения, но и старости всего организма в целом. Однако со временем стало понятно, что теломерная теория не является пресловутым «молодильным яблоком», поскольку процесс старения на самом деле чрезвычайно сложен и многосторонен, и не сводится исключительно к «подрезанию» теломер. Интенсивные исследования в этой области продолжаются и сегодня.
Большинство клеток делится не так уж часто, так что их хромосомы не находятся в зоне риска чрезмерного укорачивания и, в общем-то, не требуют высокой теломеразной активности. Другое дело — раковые клетки: они обладают способностью делиться бесконтрольно и бесконечно, как бы не зная о бедах с укорачиванием теломер. Оказалось, что в опухолевых клетках очень высокая активность теломеразы, что и защищает их от подобного укорачивания и придаёт потенциал к неограниченному делению и росту. В настоящее время существует подход к лечению рака, использующий концепцию подавления теломеразной активности в раковых клетках, что привело бы к естественному исчезновению точек бесконтрольного деления. Некоторые средства с антителомеразным действием уже проходят клинические испытания.
Ряд наследственных заболеваний характеризуется сниженной теломеразной активностью, — например, апластическая анемия, при которой из-за низкого темпа деления стволовых клеток в костном мозге развивается анемия. К этой же группе относится ряд заболеваний кожи и лёгких.
Открытия, сделанные Блэкберн, Грейдер и Шостаком, открыли новое измерение в понимании клеточных механизмов, и, несомненно, имеют огромное практическое применение — хотя бы в лечении перечисленных заболеваний, а может быть (когда-нибудь) — и в обретении если не вечной, то хотя бы более длительной жизни.
По материалам пресс-релиза Нобелевского комитета.
Теломеры и их роль в процессе старения


Старение — это неотъемлемый процесс нашей жизни. Понимание того, почему мы стареем или что вызывает старение, является загадкой, которую ученые все еще пытаются решить. По данному вопросу существует множество теорий:
- Окислительный стресс повреждает ДНК
- Виновата глюкоза
- Наши клетки следуют заранее запрограммированному биологическому расписанию независимо от каких-либо других факторов.
Скорее всего, это сочетание всех этих факторов, а также некоторых других причин, которые мы еще не обнаружили.
Роль теломер в старении
Одна теория предполагает, что процесс старения хотя бы частично связан с нашими теломерами. Теломеры — это маленькие защитные колпачки на концах молекул ДНК. Их работа заключается в том, чтобы не допустить износа концов хромосом или прилипания друг к другу, подобно пластиковым наконечникам на концах шнурков.
Теломеры также играют важную роль в обеспечении правильного копирования нашей ДНК при делении клеток, но благодаря причуде механизма репликации ДНК, несколько нуклеотидов (строительные блоки ДНК) на самом конце цепи не передаются в новую копию ДНК, что приводит к потере некоторой генетической информации; это как если бы вы ксерокопировали один и тот же документ, каждый раз отрезая последнюю строчку текста на странице. Таким образом, нити ДНК становятся короче и короче с каждым делением клетки.
Но потеря этой генетической информации не критична, ведь теломеры состоят из одной и той же последовательности шести нуклеотидов, повторяющихся снова и снова, которые при делении клетки становятся короче; это защищает важную часть ДНК, которая несет генетический код.
В яйцеклетках и сперматозоидах есть фермент, называемый теломеразой, который добавляет эти повторяющиеся последовательности в конец цепей ДНК, поэтому, теломеры в этих клетках не укорачиваются. В других клетках теломераза менее активна, что приводит к постепенному укорочению теломер со временем.
Укорочение теломер — это одна из причин старения, потому что клетки больше не могут делиться, когда теломеры слишком короткие. Как только они достигают критической точки, клетка становится неактивной, медленно накапливает урон, который она не может восстановить и умирает. Этот предел деления клеток называется Пределом Хейфлика, после того, как исследователь Леонард Хейфлик обнаружил, что нормальные человеческие клетки делятся примерно 50-52 раза.
Удлинение теломер, как лекарство от старости
Слишком короткий теломер посылает сигнал о том, что в ДНК есть проблема. Проблемную ДНК нужно восстанавливать, а не непрерывно копировать, поэтому важно, чтобы сломанная ДНК была помечена и быстро восстановлена с помощью механизмов восстановления клеток. В этом смысле, теломеры играют важную роль в предотвращении рака, который является неконтролируемым делением клеток. Вот почему мы не можем просто продлить жизнь наших клеток, ускорив регенерацию теломер с помощью большего количества теломер-продуцирующей теломеразы: наши встроенные системы борьбы с раком перестали бы правильно функционировать.
Оказывается, важна не только длина теломера, но и форма и структура теломера. Здоровые теломеры образованы на окончаниях хромосом, это аккуратные маленькие петли в форме скрепки, конец которых спрятан и надежно защищен. Если вы когда-либо пытались сформировать петлю или узел с кусочком нити, вы будете знать, что по мере того, как кусочек нити становится все короче и короче, формировать его в петлю становится все труднее. То же самое с теломерами.
Когда эта петля разворачивается и обнажается конец — «звучит» сигнал тревоги, указывающий на поломку ДНК. Деление клетки прекращается и клетка начинает стареть, она больше не может должным образом реагировать на повреждения. Последующее медленное ухудшение функций является частью процесса старения.
Значит ли это, что длинные и здоровые теломеры = ключ к долгой жизни? Нам еще многое предстоит узнать, прежде чем мы сможем ответить на этот вопрос, но на текущий момент мы не можем с уверенностью это сказать. Тем не менее, мы знаем, что плохой образ жизни (курение или воздействие ультрафиолета) может ускорить деградацию наших теломер, поэтому для нас было бы разумно принять меры, чтобы замедлить этот процесс.
Нобелевская премия по физиологии и медицине 2009 года. Счётчик клеточного времени
В октябре 2009 года в Стокгольме объявлены имена лауреатов Нобелевской премии по физиологии и медицине. Это американские учёные Элизабет Блэкбёрн (Elizabeth H. Blackburn), Кэрол Грейдер (Carol W. Greider) и Джек Шостак (Jack W. Szostak), удостоившиеся самой престижной научной награды дословно «за открытие того, как теломеры и фермент теломераза защищают хромосомы». Попробуем разобраться, что такое теломеры и теломераза, почему и каким образом они защищают хромосомы?Элизабет Блэкбёрн.
Кэрол Грейдер.
Теломераза активна не во всех клеточных популяциях. Максимальная активность наблюдается в «вечно молодых» эмбриональных клетках. В стволовых клетках теломераза работает не в полную силу.
Теломеры: фунции и синтез.
‹
›
ХРОМОСОМЫ НУЖДАЮТСЯ В ЗАЩИТЕ
Генетическая информация хранится в ядрах клеток в виде дезоксирибонуклеиновой кислоты (ДНК), которая плотно упакована в линейные хромосомы. В середине 1970-х годов Джек Шостак в своей лаборатории в Медицинской школе Гарварда провёл эксперимент. Он добавил в дрожжевые клетки фрагменты чужеродных молекул ДНК и обнаружил, что они не могут долго оставаться в клетке в исходном виде и встраиваются в хромосомы. Так выяснилось, что обломки хромосом нестабильны: они постоянно обмениваются участками с другими хромосомами, перестраиваются, в их нуклеотидных цепочках образуются разрывы, в то время как сами хромосомы остаются в неизменном виде. К счастью, клетки обладают функцией репарации — в них имеется система молекулярной «починки» случайных разрывов в хромосомных цепочках.
Всё же оставалось неясным, почему ДНК в составе хромосом стабильна, а обломки без концевых последовательностей подвержены перестройкам. Исследования Пауля Германа Мюллера (лауреат Нобелевской премии по физиологии и медицине 1946 года) и Барбары Мак-Клинток (лауреат Нобелевской премии по физиологии и медицине 1983 года) в начале 1940-х годов показали, что концевые участки защищают хромосомы от перестроек и разрывов. Мюллер назвал эти особые участки теломерами — от двух греческих слов: telos — конец и meros — участок. Но что представляют собой эти участки и какую функцию они выполняют в клетке, учёные тогда ещё не знали.
ТЕЛОМЕРЫ СТАБИЛИЗИРУЮТ ХРОМОСОМЫ
В 1975 году Элизабет Блэкбёрн в лаборатории Джозефа Гала в Йельском университете, изучая внехромосомные молекулы ДНК инфузории, обнаружила, что концевые участки этих молекул содержат тандемные повторяющиеся последовательности, состоящие из шести нуклеотидов: на каждом конце таких повторов было от 20 до 70.
В дальнейших экспериментах Блэкбёрн и Шостак добавили в дрожжи молекулы ДНК с присоединёнными к ним повторами из инфузории и обнаружили, что молекулы ДНК стали стабильнее. В 1982 году в совместной публикации они предположили, что эти повторяющиеся последовательности нуклеотидов и есть теломеры.
Их догадка подтвердилась. Теперь уже точно известно, что теломеры состоят из повторяющихся нуклеотидных участков и набора специальных белков, особым образом организующих эти участки в пространстве. Теломерные повторы — весьма консервативные последовательности, например, повторы всех позвоночных состоят из шести нуклеотидов — TTAGGG, повторы всех насекомых из пяти — TTAGG, повторы большинства растений из семи — TTTAGGG. Благодаря наличию в теломерах устойчивых повторов клеточная система репарации не путает теломерный участок со случайным разрывом. Таким путём обеспечивается стабильность хромосом: конец одной хромосомы не может соединиться с разрывом другой.
ТЕЛОМЕРЫ ПОСТОЯННО УКОРАЧИВАЮТСЯ
Теломерные повторы не просто стабилизируют хромосомы, они выполняют ещё одну важную функцию. Как известно, воспроизведение генетического материала от поколения к поколению происходит за счёт удвоения молекул ДНК с помощью специального фермента (ДНК-полимеразы). Этот процесс называется репликацией. Проблему «концевой репликации» ещё в 1970-х годах независимо сформулировали Алексей Матвеевич Оловников и нобелевский лауреат Джеймс Уотсон. Она заключается в том, что ДНК-полимераза неспособна полностью скопировать концевые участки линейных молекул ДНК, она лишь наращивает уже имеющуюся полинуклеотидную нить.
Откуда же берётся начальный участок? Специальный фермент синтезирует небольшую РНК-«затравку». Её размер (<20 нуклеотидов) невелик по сравнению с размером всей цепи ДНК. Впоследствии РНК-«затравка» удаляется специальным ферментом, а образовавшаяся при этом брешь заделывается ДНК-полимеразой. Удаление крайних РНК-«затравок» приводит к тому, что «дочерние» молекулы ДНК оказываются короче «материнских». То есть теоретически при каждом цикле деления клеток должна происходить потеря генетической информации. Но так происходит далеко не во всех клеточных популяциях. Почему?
ТЕЛОМЕРАЗА НЕ ДАЁТ ТЕЛОМЕРАМ УКОРАЧИВАТЬСЯ
Чтобы клетки не растеряли при делении часть генетического материала, теломерные повторы обладают способностью восстанавливать свою длину. В этом и заключается суть процесса «концевой репликации». Но учёные не сразу поняли, каким образом наращиваются концевые последовательности. Было предложено несколько различных моделей. Российский учёный А. М. Оловников предположил существование специального фермента (теломеразы), наращивающего теломерные повторы и тем самым поддерживающего длину теломер постоянной.
В середине 1980-х годов в лабораторию Блэкбёрн пришла работать Кэрол Грейдер, и именно она обнаружила, что в клеточных экстрактах инфузории происходит присоединение теломерных повторов к синтетической теломероподобной «затравке». Очевидно, в экстракте содержался какой-то белок, способствовавший наращиванию теломер. Так блестяще подтвердилась догадка Оловникова и был открыт фермент теломераза. Кроме того, Грейдер и Блэкбёрн определили, что в состав теломеразы входят белковая молекула, которая, собственно, осуществляет синтез теломер, и молекула РНК, служащая матрицей для их синтеза.
БЕЗ ТЕЛОМЕРАЗЫ КЛЕТКА СТАРЕЕТ, А С ТЕЛОМЕРАЗОЙ — ПЕРЕРОЖДАЕТСЯ
Позднее в лаборатории Шостака обнаружили, что определённые мутации в некоторых генах дрожжей приводят к быстрому укорочению теломер после каждого цикла деления клеток, в результате чего хромосомы становятся нестабильными, а клетки переходят в состояние старения (сенессенса). Теперь мы знаем, что эти гены кодируют теломеразу. Полученные данные подтвердили ещё одну гипотезу А. М. Оловникова о том, что потеря длины теломерных повторов в каждом раунде репликации хромосом зависит от числа делений клетки.
Итак, теломераза решает проблему «концевой репликации»: синтезирует повторы и поддерживает длину теломер. В отсутствие теломеразы с каждым клеточным делением теломеры становятся короче и короче, и в какой-то момент теломерный комплекс разрушается, что служит сигналом к программируемой гибели клетки. То есть длина теломер определяет, какое количество делений клетка может совершить до своей естественной гибели.
На самом деле у разных клеток могут быть разные сроки жизни. В эмбриональных стволовых клеточных линиях теломераза очень активна, поэтому длина теломер поддерживается на постоянном уровне. Вот почему эмбриональные клетки — «вечно молодые» и способны к неограниченному размножению. В обычных стволовых клетках активность теломеразы ниже, поэтому укорачивание теломер скомпенсировано лишь отчасти. В соматических клетках теломераза вовсе не работает, поэтому теломеры укорачиваются с каждым клеточным циклом. Укорочение теломер приводит к достижению предела Хайфлика — к переходу клеток в состояние сенессенса. После этого наступает массовая клеточная смерть. Уцелевшие клетки перерождаются в раковые (как правило, в этом процессе задействована теломераза). Раковые клетки способны к неограниченному делению и поддержанию длины теломер.
Наличие теломеразной активности в тех соматических клетках, где она обычно не проявляется, может быть маркёром злокачественной опухоли и индикатором неблагоприятного прогноза. Так, если активность теломеразы появляется в самом начале лимфогранулематоза, то можно говорить об онкологии. При раке шейки матки теломераза активна уже на первой стадии.
Мутации в генах, кодирующих компоненты теломеразы или других белков, участвующих в поддержании длины теломер, являются причиной наследственной гипопластической анемии (нарушения кроветворения, связанные с истощением костного мозга) и врождённого Х-сцеплённого дискератоза (тяжёлое наследственное заболевание, сопровождающееся умственной отсталостью, глухотой, неправильным развитием слёзных каналов, дистрофией ногтей, различными дефектами кожи, развитием опухолей, нарушениями иммунитета и др.).
ЗАЧЕМ ИЗУЧАТЬ ТЕЛОМЕРЫ И ТЕЛОМЕРАЗУ
Сейчас многие учёные заняты поиском взаимосвязи между активностью теломеразы и старением. Тут необходимо осознать, что длина теломер может контролировать продолжительность жизни клеток, но не всего организма. Старение как биологическое явление — более сложный многофакторный процесс. Гораздо более важна взаимосвязь между активностью теломеразы и риском развития раковых заболеваний. Учёные ищут вещества, влияющие на активность теломеразы и на структуру теломер, с целью создания новых противоопухолевых лекарственных препаратов.
Вот мы и пришли к заключению, что «открытие того, как теломеры и фермент теломераза защищают хромосомы» — это, безусловно, великое достижение современной науки, позволяющее понять, как генетическая информация передаётся от материнской клетки к дочерней без потерь, чем определяется продолжительность жизни клеток, а также некоторые особенности их злокачественного перерождения. Обретённые знания помогут в будущем создать лекарственные препараты, избавляющие людей от неизлечимых болезней. Это действительно выдающееся научное открытие. Но не стоит забывать о выдающихся гипотезах русского учёного А. М. Оловникова, которые подтвердились в работах нынешних нобелевских лауреатов.
Структура и длина теломер: загадкам нет конца
Хотя теломерной биологии по современным меркам уже немало лет и по этой теме имеется большой экспериментальный материал, вопросов со временем становится больше, чем ответов. Являются ли теломеры «молекулярными часами», отсчитывающими время жизни? Почему у слона они короткие, а у мыши длинные? Почему они могут быть разными у идентичных близнецов? Связан ли размер теломер с размером организма? А от чего зависит активность фермента теломеразы, способного восстанавливать теломеры?
Все же кое-какие закономерности ученым удалось выявить, несмотря на то что эта область науки постоянно преподносит новые сюрпризы
Теломерная биология – это область науки, которая изучает теломеры – концевые районы хромосом, неспособные к соединению с другими хромосомами и в силу этого играющие роль «защитных колпачков». Широкий же интерес к этим структурным элементам хромосм был вызван появлением теории старения, согласно которой этот процесс – следствие укорачивания теломер с возрастом из-за их неполного копирования в процессе удвоения ДНК.
Я вся такая… внезапная, такая противоречивая!
 История теломерной биологии началась в 1930-е гг., когда Г. Мюллер и Б. Мак-Клинток описали теломеры как особые структуры хромосом, не позволяющие им слипаться друг с другом. Понятно, что во времена, когда еще не знали, как закодирована наследственная информация в клетке, установить природу теломер было невозможно. Период активного изучения теломер начался в 1980-х гг. и увенчался Нобелевской премией 2009 г. (Зверева и др., 2010).
История теломерной биологии началась в 1930-е гг., когда Г. Мюллер и Б. Мак-Клинток описали теломеры как особые структуры хромосом, не позволяющие им слипаться друг с другом. Понятно, что во времена, когда еще не знали, как закодирована наследственная информация в клетке, установить природу теломер было невозможно. Период активного изучения теломер начался в 1980-х гг. и увенчался Нобелевской премией 2009 г. (Зверева и др., 2010).
Первым организмом, у которого определили последовательность нуклеотидов теломерной ДНК, была инфузория тетрахимена (Блекберн, 1978). Оказалось, что теломерная ДНК этого простейшего состоит из шести нуклеотидов TTGGGG, повторяющихся четыре-пять раз – такие структуры называют короткими повторами (мини- и микросателлитами). Затем структуру теломерных районов определили у других организмов из разных таксономических групп. Оказалось, что у большинства позвоночных это короткий повтор TTAGGG, у членистоногих (Arthropoda) – TTAGG, у круглых червей (Nematoda) – TTAGGC, у растений – TTTAGGG.
Со временем короткие повторы стали называть согласно таксономической группе, у которой они впервые были прочитаны. В результате TTAGGG стал «позвоночным» или «человеческим» типом теломер, TTAGG – «артроподным», TTAGGC – «нематодным», а TTTAGGG – «арабидопсисным» – по названию растения Arabidopsis thaliana. Позже выяснилось, что эти названия не соответствуют реальному положению вещей. «Позвоночный» тип теломер широко распространен среди беспозвоночных животных – кишечнополостных, плоских червей, моллюсков, встречается у некоторых простейших, членистоногих, растений и грибов, характерен для самого примитивного многоклеточного животного – трихоплакса. Во избежание путаницы было бы разумнее назвать этот теломерный повтор, например, базовым или первичным, но он остался «человеческим». Правда остальные типы повторов, за некоторым исключением, действительно характерны для тех организмов, в честь которых названы.

На путанице в названиях дело не закончилось. Достаточно обескураживающим открытием стало то, что не у всех организмов теломеры состоят из микросателлитов. Прежде считалось, что только короткие повторы ДНК консервативной структуры могут защищать концы хромосом, но у двукрылых насекомых и некоторых растений были выявлены теломерные структуры, значительно отличающиеся от типичных коротких повторов.
Так, у комаров рода Chironomus и Anopheles в роли теломер выступает сателлитная ДНК, представляющая собой повторы из нескольких сотен пар нуклеотидов, которые образуют теломерные области в несколько сотен тысяч пар нуклеотидов. У дрозофилы теломеры состоят из перемещающихся по геному мобильных элементов – ретротранспозонов HeT-A, TART и TAHRE. Один из них, TART, был также обнаружен на концах хромосом мухи Rhinchosciara americana. Возможно, нетипичные теломеры характерны для всех представителей многочисленного (более 150 тыс. видов) отряда двукрылых насекомых. Среди растений нетипичные теломеры найдены у некоторых видов подсемейств Alliaceae (луковые), Asphodelaceae (асфоделовые) и семейства Solonaceae (пасленовые): на концах их хромосом локализуются последовательности рибосомальной или сателлитной ДНК.

Более того, существуют промежуточные типы теломер: например, у тутового шелкопряда Bombyx mori теломерная ДНК состоит как из повторов TTAGG, так и из ретротранспозонов TRAS и SART – это говорит об эволюционной связи разных теломерных структур. У некоторых организмов определить структуру теломерных регионов пока не удалось: это тихоходки и поденки среди животных и, например, ульвовые и красные водоросли среди низших растений. Так что, возможно, существуют и другие варианты структуры теломерных районов.
Не только по структуре, но и по длине теломерные участки очень вариабельны. Размер теломер может отличаться на разных плечах одной хромосомы, у гомологичных и негомологичных хромосом, в разных клетках, тканях, органах, у близнецов, у разных индивидов, принадлежащих одному виду, у разных видов. С чем такая изменяемость связана и каково ее функциональное значение, до сих пор не понятно. При этом в исследованиях вариабельность обычно не учитывают, используя в анализе средние значения размера теломер, который определяют, расщепив ДНК изучаемой ткани ферментами рестриктазами, не трогающими теломерную ДНК. Оставшуюся ДНК метят, визуализируют и с помощью специального прибора определяют длину фрагмента самой многочисленной фракции – это и будет средний размер теломер.

Длина теломер всегда вызывала и продолжает вызывать много вопросов. Почему у слона она составляет всего 14 тыс. пар нуклеотидов, а у некоторых линий лабораторных мышей – в 10 раз больше? Есть ли какая-нибудь связь с размером тела? С продолжительностью жизни? С приспособленностью к меняющимся условиям окружающей среды? С болезнями? С наследственностью? Со скоростью старения? Это лишь небольшой перечень вопросов, возникающих в отношении размера теломер, правда на некоторые из них ученые уже нашли ответы.
Размер теломер, размер тела и продолжительность жизни – есть ли связь?
Как уже упоминалось выше, существует теория старения, согласно которой этот процесс происходит вследствие укорачивания теломер с возрастом из-за их неполного копирования в процессе удвоения ДНК. Теломеры называли (а некоторые до сих пор называют) митотическими часами клеток, хронометрами, счетчиками клеточных делений, потому что у человека в клетках тела они укорачиваются с возрастом. Рождается человек с длиной теломер 15—20 тыс. пар нуклеотидов, а умирает с длиной 5—7 тыс. Сейчас известно, что зависимость размера теломер от возрастных изменений не универсальна, длина теломерной ДНК у разных организмов (а иногда и у одного и того же организма) может со временем не только уменьшаться, но и расти, а у многих организмов такой зависимости вообще нет.

Какие теломеры считать длинными, а какие не очень? Все известные значения размеров теломер условно можно разделить на четыре группы. Очень короткие – десятки пар нуклеотидов, характерные для большинства простейших; короткие – меньше 20 тыс. пар нуклеотидов; длинные – больше 20 и меньше 100 тыс. пар нуклеотидов; экстрадлинные, или мегателомеры, – больше 100 тыс. пар нуклеотидов
Но все же объяснить различия в длине теломер у разных организмов разной продолжительностью их жизни – красиво и логично. Может быть, долгожители имеют необычайно длинные теломеры? К сожалению, по пальцам одной руки можно пересчитать организмы-долгожители с длинными теломерами. Это некоторые виды долгоживущих (сто и больше лет) черепах с теломерами длиной 50—60 тыс. пар нуклеотидов, аллигаторы, живущие больше полувека с теломерами размером около 30 тыс. пар нуклеотидов. Но у большинства других долгоживущих организмов теломеры довольно скромного размера. Например, у деревьев-долгожителей (более тысячи лет) сосны Pinus longaeva и гинкго Ginkgo biloba длина теломер составляет, соответственно, около 13 и 5 тыс. пар нуклеотидов. То есть длина теломер и продолжительность жизни не имеют явной связи. Другой вопрос, что эти организмы имеют активный механизм поддержания теломерных районов – фермент теломеразу, способную удлинять спонтанно укорачивающиеся при делении клетки теломерные участки ДНК, но это совсем другая история.

Больше повезло ученым, которые искали связь между размером теломер и размером организма. Сначала некоторая зависимость была обнаружена у грызунов: оказалось, что большинство крупных видов имеет короткие теломерные районы (10—18 тыс. пар нуклеотидов), а теломеры небольших грызунов могут достигать 72 тыс. пар (Seluanov et al., 2007). Возникла гипотеза, что эти данные отражают имеющийся у крупных организмов механизм защиты от рака в виде репликативного старения, когда клетки теряют способность делиться. Ведь чем больше в организме клеток, тем больше риск, что какая-то из них переродится в раковую. Тогда все логично: теломерная ДНК должна иметь достаточно небольшую длину, чтобы при постепенном укорочении вовремя запустилось репликативное старение, при этом теломераза, которая может поддерживать длину теломер (как в нормальных клетках, так и в раковых) должна быть неактивна.

Исследования на других видах млекопитающих частично подтвердили данные, полученные на грызунах: длина теломерной ДНК действительно имеет отрицательную корреляцию с продолжительностью жизни и массой тела, и массивные животные с короткими теломерами не имеют активной теломеразы. Возможно, репрессия теломеразы и наличие более коротких теломер у крупных животных могут быть адаптацией к теплокровности, так как с увеличением температуры тела увеличивается частота мутаций и, следовательно, вероятность возникновения рака (Gomes et al., 2011). У небольших млекопитающих репликативного старения, видимо, нет, а физиологические процессы регулируются иным образом.
Конечно, предложенные объяснения имеют гипотетический характер, они не могут быть универсальными. Подтверждением этому служит, например, исследование длины теломер у байкальских планарий и моллюсков, при котором была обнаружена противоположная картина: более крупные животные имели более длинные теломеры, хотя не без исключений из правила.


Анализ динамики теломерной ДНК с учетом особенностей этих животных поможет оценить влияние на нее внешних и внутренних факторов. По предварительным данным, во-первых, более крупные виды имеют более длинную теломерную ДНК. Во-вторых, длина теломерной ДНК с возрастом у разных видов животных меняется по-разному: у одних она увеличивается, а у других – уменьшается.


Такая видовая специфичность размера и динамики теломерной ДНК может иметь как адаптивный характер, так и наследственный, определяемый филогенетическим родством. А исследование активности теломеразы, которое тоже планируется осуществить, может пролить свет на внутреннюю причину различий в возрастной динамике теломерной ДНК у разных видов
Нет сомнений, что теломеры вовлечены во многие процессы в клетке, поэтому так трудно найти закономерность в распределении их размеров, и тем более предложить теорию, которая бы обладала предсказательными свойствами. Пока остается лишь перечислять те взаимосвязи, которые все же удалось обнаружить в разных исследованиях.
Одно из таких открытий относится к экстрадлинным (до 1 млн пар нуклеотидов) теломерным районам, которые были обнаружены у некоторых видов птиц. В кариотипах у них присутствуют микрохромосомы, и, возможно, такие аномально длинные теломеры нужны для их стабилизации.

Выше мы затронули лишь некоторые возможные варианты объяснений изменчивости размеров теломер и роли их длины в жизни организма, не коснувшись внутривидовых отличий, связанных с полом, репродуктивным успехом, условиями обитания, образом жизни и т. п. Но даже то, что уже сказано, дает представление о всей сложности и многогранности этой актуальной области биологии.
Литература
Зверева М., Рубцова М. Нобелевская премия по физиологии и медицине 2009 года. Счетчик клеточного времени // Наука и жизнь. 2010. № 1. С. 2—5.
Bombarova M., Vitkova M., Spakulova M. et al. Telomere analysis of platyhelminths and acanthocephalans by FISH and Southern hybridization // Genomes. 2009. V. 52. P. 897—903.
Fulneckova J., Sevcikova, Fajkus J. et al. A broad phylogenetic survey unveils the diversity and evolution of telomeres in eukaryotes // Genome Biol. Evol. 2013. V. 5, N. 3. P. 468—483.
Gomes N., Ryder O., Houck M. et al. Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination // Aging Cell. 2011. V. 10. P. 761—768.
Seluanov A., Chen Z., Hine C. et al. Telomerase activity coevolves with body mass, not lifespan // Aging Cell. 2007. V. 6(1). P. 45—52.
Zellinger B., Riha K. Composition of plant telomeres // Biochim. et Biophys. Acta. 2007. N 1769 (5–6). P. 399—409.
Zhdanova N., Minina J., Karamisheva T. et al. The very long telomeres in Sorex granarius (Soricidae, Eulipothyphla) contain ribosomal DNA // Chromosome Res. 2007. V. 15. P. 881—890
Теломеры и продолжительность жизни — dolgo-jv.ru

Теломеры – это концевые участки хромосом, которые поддерживают стабильность генома и от состояния которых зависит продолжительность жизни.
nature.com/articles/350569a0
Они представляют собой элементы жертвенной ДНК, которые защищают жизненно важную кодирующую ДНК от потерь генетического материала в результате репликации при делении клетки.
sciencedirect.com/science/article/pii/S0014482712003977
Длина теломер сокращается с возрастом. Предполагается, что укорочение теломер может играть причинную роль в старении.
Истощение теломер является одним из признаков старения.
ncbi.nlm.nih.gov/pubmed/28887594
ncbi.nlm.nih.gov/pubmed/23746838
Нормальные соматические клетки имеют конечную продолжительность жизни и теряют теломерную ДНК, присутствующую на концах хромосом, каждый раз, когда делятся.
При достижении критической длины теломер клетка теряет способность делиться.
nature.com/articles/nature02118
В конечном итоге это означает, что с возрастом мы становимся все менее способными заменить старые или поврежденные клетки, и это может увеличить риск возникновения возрастных заболеваний.
Прямая связь между укорочением теломер и риском заболеваний была недавно подчеркнута в рандомизированных исследованиях.
Критическое укорочение теломер вызывает индукцию клеточного старения или постоянную неспособность клеток к дальнейшему делению, что является основой различных заболеваний.
Таким образом, длина теломер представляет собой как биомаркер клеточного возраста, так и потенциальную мишень против старения.
nature.com/articles/ng.2528

Считается, что истощение теломер является ключевым событием не только в процессе старения млекопитающих, но и в нарушении чувствительности к питательным веществам, что может привести к многочисленным нарушениям обмена веществ.
mdpi.com/2073-4425/8/7/176/htm
Длина теломер влияет на продолжительность жизни и является одним из предикторов возрастных заболеваний, включая ишемическую болезнь сердца и ожирение.
academic.oup.com/jnci/article/107/6/djv074/871011
Теломераза – это фермент, компенсирующий укорочение теломер.
В результате деятельности теломеразы длина теломерных участков хромосом клетки увеличивается или поддерживается на постоянном уровне, позволяя клетке делиться неограниченное количество раз.
Интересно, что воспаление и укорочение теломер показывают двунаправленную связь: провоспалительное состояние, по-видимому, способствует старению и дисфункции теломер, а истощение теломер, в свою очередь, способно вызывать воспаление слабой степени.
В нескольких независимых исследованиях сообщалось об уменьшении длины теломер и повышенных уровнях циркулирующих воспалительных цитокинов при различных расстройствах настроения (стресс, депрессия, пессимизм, гнев, ненависть, враждебность, раздражительность, вспыльчивость, неуживчивость … и т.д.), что свидетельствует о сложной взаимосвязи между воспалительно-иммунными реакциями и динамикой теломер.
ncbi.nlm.nih.gov/pubmed/30650526
Одним из факторов, влияющих на динамику теломер, является психологический стресс.

Нервные расстройства ассоциированы с повышенным риском заболеваний, связанных со старением, и в значительной степени способствуют избыточной заболеваемости и смертности.
Недавние исследования связывают психологический стресс с преждевременным старением клеток, о чем свидетельствует уменьшение длины теломер лейкоцитов.
cebp.aacrjournals.org/content/18/2/551
ncbi.nlm.nih.gov/pubmed/22055018
Существуют также исследования где выработка гормона стресса кортизола связана с более короткими теломерами.
ncbi.nlm.nih.gov/pubmed/22138440
Все негативные психологические характеристики (депрессия, хронический стрессс, гнев, раздражительность, вспыльчивость, неуживчивость и т.д.) коррелируют с более короткими теломерами.
ncbi.nlm.nih.gov/pubmed/21974787
ncbi.nlm.nih.gov/pubmed/19111922
Потенциально защитные психосоциальные факторы (оптимизм, социальная поддержка, более высокий уровень образования… и т.д.) напротив, были связаны с более длинными теломерами.

ncbi.nlm.nih.gov/pubmed/22293459
ncbi.nlm.nih.gov/pubmed/21536122
ncbi.nlm.nih.gov/pubmed/22229928
Таким образом, теломеры оказывают непосредственное влияние на продолжительность жизни и длина теломер является многообещающим биомаркером возрастных заболеваний и потенциальной мишенью против старения.
В ряде исследований была изучена генетическая архитектура длины теломер и потенциал Лития как антивозрастного лекарства.
Было подтверждено, что применение Лития у больных с биполярным расстройством связано с увеличением длины теломер.
ncbi.nlm.nih.gov/pubmed/27084304
В качестве дополнительных доказательств регуляции длины теломер с помощью Лития данные были проверены на червях нематодах и также было обнаружено увеличение продолжительности жизни.
Как выяснилось, длительное лечение Литием ассоциируется с более длинными теломерами.
Литий может оказывать омолаживающее действие, смягчая экспрессию генов, ответственных за регуляцию длины теломер и может катализировать активность эндогенных механизмов, способствующих удлинению теломер.
nature.com/articles/s41386-018-0289-0
ncbi.nlm.nih.gov/pubmed/27084304
Пациенты с психическими расстройствами демонстрируют высокую частоту сопутствующих возрастных заболеваний и более короткую длину теломер по сравнению со здоровыми людьми.
Длина теломер является в высшей степени наследуемым признаком.
ncbi.nlm.nih.gov/pmc/articles/PMC1918314/
nature.com/articles/npp2017239
Однако, чаще всего психические расстройства у взрослых возникают вследствие воздействия факторов окружающей среды, следовательно, стратегии вмешательств, ориентированных на окружающую среду, могут быть особенно полезны для предотвращения чрезмерного укорочения теломер среди групп высокого риска и, возможно, даже среди населения в целом.
sciencedirect.com/science/article/pii/S0165032716317657
doi.org/10.3389%2Ffgene.2018.00468
sciencedirect.com/science/article/pii/S0165032716317888
В дополнение к формированию стрессоустойчивости, лекарственные препараты могут влиять на скорость укорочения теломер, что позволяет предположить, что в определенной степени мы можем таким образом влиять на процесс старения.
Это даёт осознание того, что мы можем фармакологически снизить укорачивание теломер путем применения препаратов против старения (или укорочения теломер).
Тем не менее, одна из ловушек, при нацеливании на теломеры фармакологически, заключается в том, что чрезмерная длина теломер и чрезмерная активность фермента, удлиняющего теломеры — теломеразы, связаны с повышенным риском развития рака!!!
jamanetwork.com/journals/jamaoncology/fullarticle/2604820
Таким образом, вполне вероятно, что эффективные антивозрастные стратегии должны оказывать очень тонкие воздействия на теломеры на протяжении всей жизни, но ни в коем случае не оказывать быстрого воздействия, которое может одновременно увеличить риск развития рака!!!
doi.org/10.3389%2Ffgene.2018.00468
sciencedirect.com/science/article/pii/S0165032716317888
pnas.org/content/101/49/17312
nature.com/articles/d41586-017-08387-y
jamanetwork.com/journals/jamaoncology/fullarticle/2604820
Литий является природным металлом, естественным образом содержащимся в питьевой воде.

Исследования показывают, что население, употребляющее воду с более высоким содержанием Лития, имеет меньшую смертность от всех причин, более длинные теломеры, большую продолжительность жизни и меньшие риски нейродегенеративных заболеваний.
То есть, низкие дозы Лития на протяжение всей жизни обеспечивают более долгую и здоровую жизнь.
content.iospress.com/articles/journal-of-alzheimers-disease/jad170744
cambridge.org/core/journals/the-british-journal-of-psychiatry/article/lithium-in-drinking-water-and-suicide-mortality/681D92C1B8FF112958A92C2D6D373F80
sciencedirect.com/science/article/pii/S0165032715002888
link.springer.com/article/10.1007%2Fs00394-011-0171-x
Антивозрастные преимущества Лития не ограничиваются людьми. Эффекты увеличения продолжительности жизни отмечались и у червей нематод и у мух Дрозофил.
jbc.org/content/283/1/350
cell.com/cell-reports/fulltext/S2211-1247(16)30297-2
academic.oup.com/ijnp/article/18/7/pyv002/676042
Помимо того, что Литий является природным металлом в питьевой воде, он также имеет клиническое применение и в настоящее время является препаратом первой линии для лечения биполярного расстройства, действуя как эффективный стабилизатор настроения.
journals.sagepub.com/doi/10.1177/1359786806063072
Исследования показывают, что использование Лития связано с увеличением длины теломер у пациентов с биполярным расстройством, в особенности у тех, кто принимает Литий долгосрочно.
nature.com/articles/tp201337
sciencedirect.com/science/article/pii/S0924977X16300189
Литий представляет интерес ещё и потому, что его правильное использование связано не только с более длинными теломерами, но с уменьшенным риском развития рака.
ncbi.nlm.nih.gov/pubmed/27388574

Все эти данные по увеличению длины теломер и продолжительности жизни вызывают большой интерес к Литию, как к антивозрасному препарату!
Из-за способности лития воздействовать на множество биологических систем, необходимы дополнительные исследования, чтобы полностью понять его механизм действия против старения.
У людей, как известно, изменение длины теломер сдерживается множеством факторов, таких, например, как окислительный стресс и воспаление, причем, пожалуй, наиболее важным фактором является активность фермента теломеразы.
thelancet.com/journals/lancet/article/PIIS0140-6736(05)66630-5/fulltext
journals.plos.org/plosone/article?id=10.1371/journal.pone.0017837
cell.com/current-biology/fulltext/S0960-9822(98)70109-5
На сегодняшний день пока не ясно действуют ли эффекты Лития по удлинению теломер и увеличению продолжительности жизни на всех без исключения и какие последствия может иметь такая антивозрастная терапия Литием. Для этого требуются дополнительные исследования.
Поэтому, принимая решение об использовании препаратов Лития для геропротекции, вы берете на себя ответственность за возможные последствия.
Всё может быть как лекарством, так и ядов, в зависимости от дозировки.
Литий в терапевтических дозах опасен возможностью развития почечной недостаточности. В то время, как малые дозы Лития защищают от той же самой почечной недостаточности.

Более подробно о препаратах Лития – в статье «Препараты Лития для здоровья и долголетия».
По имеющимся данным, препараты Лития сейчас нельзя купить в аптеке без рецепта, но можно купить по интернету >>> ЗДЕСЬ.
Подробная инструкция как сделать заказ и получить его >>> ЗДЕСЬ.
Рекомендую также прочесть:
Физетин против старения
Наттокиназа
Геропротекторные свойства Мелатонина
Роль калия в регуляции кальцификации сосудов
Таурат магния против сосудистой кальцификации
Роль магния в организме
Что такое сенолитики?