причины заболевания, симптомы и признаки, методы лечения, особенности проявления у детей

Роландическая эпилепсия (РЭ) относится к доброкачественному парциальному типу заболевания. Впервые характеристику патологии дал итальянский врач Л. Роланд.
Манифест болезни приходится на детский возраст от 3 до 13 лет. В 90% случаев недуг проходит по мере взросления.
Некоторые доктора склоняются к тому, что не необходимости лечить болезнь противосудорожными препаратами.
Суть патологии
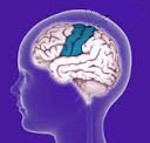
Роландическая (височная) эпилепсия — это генетически обусловленное заболевание, связанное с гипервозбудимостью коры головного мозга в височной зоне.
Нейроны, находящиеся в этой области, производят нервные импульсы слишком часто, это приводит к возникновению эпиприступа.
Болезнь встречается в 15% из всех случаев эпилепсии, мальчики болеют в 1,5 раз чаще девочек. По МКБ 10 патология обозначается номером G40.9.
Лишь в очень редких случаях недуг трансформируется в другой тип эпилепсии и имеет неблагоприятный прогноз.
Причины болезни
 Точные причины возникновения роландической эпилепсии до сих пор не определены.
Точные причины возникновения роландической эпилепсии до сих пор не определены.
Врачи считают, что в основе развития РЭ лежит нарушение созревания мозговой коры в височной области.
Этому способствуют следующие обстоятельства:
- Наследственная предрасположенность. Наличие эпилепсии у родителей повышает вероятность развития болезни у ребенка.
- Внутриутробные аномалии развития головного мозга.
- Нейроинфекции (энцефалит, менингит).
- Травма головы.
- Неправильный режим дня с недостатком сна.
- Стресс.
По мере взросления ребенка нейроны мозга созревают, снижается их возбудимость, симптомы сходят на нет. Поэтому РЭ называется «возрастозависимой болезнью».
Зафиксированы случаи РЭ у взрослых как следствие заболеваний, перенесенных в детском возрасте. У малышей до 1 года болезнь не возникает.Клиническая картина и симптомы
Симптомы болезни возникают, в основном, в ночное время. Приступы носят парциальный характер, генерализованные припадки встречаются только у 20% заболевших.
Основные признаки роландического приступа:
- Появление ауры (предшественника приступа) в виде покалывания, онемения языка, губ.
- Судороги на одной половине лица.
- Выделение слюны.
- Закатывание глаз.
- «Булькающие» и «хрюкающие» звуки из горла.
- Заторможенность речи.
- Редко возникает рвота.

Днем практически не встречаются. Припадки могут повторяться несколько раз за ночь с разной интенсивностью. Длительность приступа не превышает 5 минут.
В 20% развиваются генерализованные эпиприступы. Обычно они характерны для заболевания с ранним дебютом (до 3 лет).
Эти случаи имеют менее благоприятный прогноз и плохо поддаются лечению. У ребенка генерализованные припадки проявляются в следующем:
- Тонические судороги по всему телу.
- Мышечные спазмы.
- Потеря сознания.
- После окончания припадка ребенок не помнит, что с ним было, крепко засыпает, при пробуждении чувствует вялость и головную боль.
Таким образом, выделяют следующие особенности роландической эпилепсии:
- Нарастание эпилептической активности в фазе медленного сна.
- Появление предшественников приступа (ауры).
- Кратковременность приступов.
- Благоприятный исход болезни.
В медицине зафиксированы случаи (не более 5%) атипичного течения РЭ. У больных диагностирован эпилептический статус.
Приступы имели многократный ежедневный характер с потерей сознания и внезапными падениями больных. Однако, даже в этих случаях не отмечалось изменений в психическом развитии и поведении пациентов.Неврологический статус

До недавнего времени считалось, что у таких пациентов нет органических поражений головного мозга.
Однако, при внедрении высокотехнологичных методов диагностики (МРТ, КТ) были выявлены случаи структурных изменений в мозге.
У 4% детей были диагностированы следующие патологии:
- ДЦП;
- задержка психического развития легкой формы;
- микроцефалия;
- мозжечковая недостаточность;
- нарушение речевого развития;
- синдром гиперактивности.
Наследственный фактор
Существует концепция влияния наследственного фактора на возникновение РЭ.
При этом у родственников всех пациентов на ЭЭГ зафиксированы роландические спайки, а приступы возникали лишь у 40%.
Таким образом, РЭ относится к идиопатическому виду заболевания, наследуемому по доминантному признаку. Болезнь наследуется через поколения представителями одного пола.То есть, если болеет отец, то его дети будут здоровы, а внук, вероятно, унаследует патологию. Внучка же будет являться только субклиническим носителем гена эпилепсии.
Этот ген будет передаваться другим поколениям и невозможно предсказать, когда он себя проявит.
 Не у всех носителей данного гена в последствие разовьется эпилепсия.
Не у всех носителей данного гена в последствие разовьется эпилепсия.
Для активации болезни требуются сопутствующие условия в виде травмы, нейроинфекции, тяжелых родов.
Но почти у половины детей, больных РЭ, данные о провоцирующих факторах отсутствуют.
По этой причине исследования по выявлению генов, ответственных за возникновение эпилепсии, ведутся до сих пор.
Диагностика
Предварительный диагноз врач-эпилептолог ставит на основании жалоб ребенка и родителей.
Она обнаруживает роландические спайки, фиксирует повышенную нейронную активность в лобно-височной доле головного мозга.
Поскольку приступы возникают в ночное время, это может осложнить диагностику. Поэтому дополнительно назначают ночную ЭЭГ (полисомнографию).Для дифференциации этого вида эпилепсии от других неврологических заболеваний (опухолей, кист) проводится МРТ или КТ головного мозга.
Лечение
До сих пор среди врачей не утихают споры по поводу необходимости лечения роландической эпилепсии противосудорожными препаратами.
Противники применения лекарств руководствуются возрастным характером болезни. В большинстве случаев болезнь проходит к 15-17 годам, не зависимо от приема препаратов.
Сторонники лекарственной терапии утверждают, что существует большая вероятность ошибочной постановки диагноза.
 Кроме того, есть риск перехода заболевания в атипичную или злокачественную форму.
Кроме того, есть риск перехода заболевания в атипичную или злокачественную форму.
Если приступы повторяются слишком часто, у ребенка развивается бессонница, что негативно сказывается на его психическом состоянии.
Поэтому противоэпилептические препараты обязательно назначаются при повторных приступах РЭ.
Первая помощь больному
Невыраженные эпиприступы часто остаются незамеченными родителями, так как возникают в ночное время.
При появлении судорог нужно приподнять ребенка, чтобы предотвратить западание языка и чтобы малыш не захлебнулся слюной.Больного следует уложить на мягкую поверзность, чтобы голова была чуть выше туловища. Нельзя сдерживать ребенка, фиксировать руки или ноги.
При длительном тяжелом приступе необходимо вызвать скорую.
Читайте о других формах эпилепсии:Особенности терапии у детей
Для лечния РЭ в детском возрасте используют монотерапию, то есть назначают только один из препаратов в минимальной дозировке. Обычно применяют препараты вальпроевой кислоты (
Детям старше 7 лет при возникновении приступов только ночью, показан однократный прием Фенитоина в малых дозах перед сном. С помощью этого средства обычно достигается длительная ремиссия.
 Для лечения детей более старшего возраста в случаях генерализованных припадков назначается Карбамазепин.
Для лечения детей более старшего возраста в случаях генерализованных припадков назначается Карбамазепин.
Однако, следует быть осторожным с этим средством из-за большого количества побочных эффектов.
Барбитураты (Фенобарбитал) оказывают негативное влияние на интеллект ребенка, поэтому в терапии детской РЭ не используются.
Большинство врачей считают, что нецелесообразно использовать антиконвульсанты дольше двух лет. При раннем дебюте болезни терапия может быть продолжена до 10 лет.
Даже если на ЭЭГ фиксируется повышенная эпилептическая активность, но припадки не возвращаются длительное время, продолжать противосудорожную терапию не стоит.Прогноз
Роландическая эпилепсия отличается благоприятным прогнозом. У 95% детей приступы исчезают к 16 годам и больше не возвращаются.
Излечение зависит от возраста начала болезни и частоты припадков. Резистентность к терапии и ремиссия заболевания наблюдаются при раннем и позднем дебюте (младше 4 и старше 10 лет).
Вероятность рецидива во взрослом возрасте не превышает 4%. Это может произойти под влиянием экзогенных факторов: гормональной перестройки (беременность), стресса, тяжелой болезни или вследствие сохранения структурных изменений в мозге.
 Как таковой профилактики роландической эпилепсии не существует, принимая во внимание преимущественно наследственный характер возникновения.
Как таковой профилактики роландической эпилепсии не существует, принимая во внимание преимущественно наследственный характер возникновения.
РЭ относится к идиопатическим доброкачественным формам эпилепсии.
Дебют болезни приходится на детский возраст, у взрослых патология возникает очень редко.
Отличительной чертой недуга является возможность полного излечения по мере взросления пациента.
Роландическая (височная, ночная) эпилепсия у детей / Mama66.ru
Доброкачественная роландическая эпилепсия у детей (височная эпилепсия) – это одна из наиболее часто встречающихся эпилепсии, которая возникает в связи с формированием очага судорожной готовности в нервных клетках коры центрально-височной области мозга.


Эта форма эпилепсии может проявляться у детей от 2 до 14 лет и характеризуется короткими и редкими судорожными приступами одной половины лица, языка и глотки, которые чаще возникают в ночное время. Заболевание имеет благоприятный прогноз.
Причины заболевания
Развитие роландической эпилепсии в 20–60% случаев обусловлено наследственными факторами в сочетании с незрелостью нервных клеток и других структур мозга ребенка с формированием зоны судорожной готовности в области роландовой борозды (центральной височной области головного мозга). Поэтому височная эпилепсия считается возрастзависимым заболеванием — по мере созревания нейронов головного мозга малыша происходит снижение их возбудимости с постепенным исчезновением очагов эпилептогенности (судорожной готовности) при доброкачественной роландической эпилепсии. В процессе роста ребенка отмечается уменьшение количества эпилептических припадков и в большинстве случаев наблюдается полное выздоровление пациентов до подросткового возраста.
Как проявляется роландическая эпилепсия
Клинические симптомы роландической эпилепсии проявляются в виде двух видов приступов:
- простые парциальные (сенсорные или моторные и реже вегетативные) припадки – непродолжительные судороги с одной стороны лица или короткие односторонние подергивания, онемения или обездвиживания мышц губ и/или языка, гортани и глотки;
- сложные парциальные приступы в виде моторных (судороги отдельных групп лица с тоническими судорогами языка и глотки, которые часто сопровождаются нарушениями речи и/или повышенным слюноотделением) или вторично-генерализованные (типичный приступ роландической эпилепсии переходит в генерализованный судорожный припадок).
Роландическая эпилепсия у детей имеет характерные черты:
- приступы возникают во время сна — чаще при засыпании и пробуждении;
- припадок развивается с ауры: ощущений онемения, покалывания, пощипывания в области десен, глотки или языка, а затем начинается сам приступ;
- наиболее характерным проявлением простого приступа этого вида эпилепсии являются своеобразные звуки (типа «хрюканья», бульканья в виде «полоскания горла»). Минимальные проявления кратковременных приступов родители могут и не заметить;
- небольшая продолжительность припадков: от 5–10 секунд до 2–3 минут;
- у детей раннего возраста заболевание протекает сложнее с частыми приступами (еженедельными или даже ежедневными) с некоторым учащением припадков в возрасте 1–2 лет, что связано с перестройкой нервной системы и повышенной выработкой специфических веществ, активирующих передачу нервных импульсов, с течением времени, по мере дифференцировки нервной системы малыша припадки возникают все реже;
- течение этого вида эпилепсии благоприятное, заканчивается спонтанной ремиссией практически во всех случаях (кроме тяжелой злокачественной формы) и имеет хороший прогноз.
Диагностика заболевания
Диагностика роландической эпилепсии проводится на основании жалоб, осмотра пациента, проведении специфических тестов и инструментальных методов (электроэнцефалография).


Электроэнцефалография (ЭЭГ) является на сегодняшний день главным методом диагностики роландической эпилепсии. Основным признаком наличия которой является обнаружение высокоамплитудных острых пиков и волн в центрально-височных отведениях («роландический комплекс»), которые локализуются на стороне, противоположной судорожным приступам.
Осложняет диагностику ночное время наступления приступов, поэтому при типичной симптоматике и повторяющихся приступах и нормальной дневной ЭЭГ — дополнительно проводится ночной ЭЭГ-мониторинг (полисомнография).
При необходимости, для дифференциальной диагностики с другими неврологическими заболеваниями (кистами, опухолями, нарушениями кровообращения, абсцессами в области центральной височной области мозга) назначается проведение МРТ (магниторезонансной томографии) или КТ мозга (компьютерная томография).
Лечение роландической эпилепсии
На сегодняшний день среди ведущих детских неврологов и эпилептологов ведутся дискуссии о целесообразности лечения доброкачественной роландической эпилепсии антиэпилептическими препаратами — в связи с большой вероятностью выздоровления пациентов по мере роста и полного созревания нервной системы даже без проведения лечения. Всегда существует вероятность перехода этого вида эпилепсии в сложные судорожные припадки, особенно при воздействии неблагоприятных факторов, поэтому специфическое лечение в большинстве случаев проводится при возникновении повторных эпиприступов. Также обязательно назначается противосудорожная терапия у детей раннего возраста, что связано с вероятностью осложненного течения роландической эпилепсии в возрасте от года до трех лет.
Что делать во время припадка
Редкие и единичные приступы зачастую не сразу замечаются родителями в связи с тем, что они возникают в ночное время. Но как любая форма эпилепсии эта патология требует динамического наблюдения врача-невролога или эпилептолога, своевременной диагностики и при необходимости медикаментозного лечения, что определяется в каждом случае индивидуально. Наиболее пристального наблюдения требует доброкачественная роландическая эпилепсия с «дебютом» заболевания в раннем возрасте в связи с возможным учащением приступов на фоне значительной незрелости нервных клеток.
При развитии сложного припадка с моторными нарушениями (мышечными подергиваниями или тоническими судорогами лица, языка, глотки и гортани) необходимо приподнять ребенка, особенно если это возникает во время еды, питья или во сне и успокоить малыша. Для профилактики западения языка (особенно при присоединении «большого» судорожного припадка) нужно положить голову ребенка набок и вложить ему в рот какой-то мягкий предмет или носовой платок. При длительном судорожном приступе вызвать бригаду «скорой» помощи или обратиться в медицинское учреждение самостоятельно.
Автор: Cазонова Ольга Ивановна, педиатр
Рекомендации по предотвращению припадков
Советуем почитать: Особенности проявления и лечения абсансной эпилепсии у детей
Доброкачественная роландическая эпилепсия — причины, симптомы, диагностика и лечение
Доброкачественная роландическая эпилепсия — генетически детерминированная фокальная эпилепсия, связанная с возрастной гипервозбудимостью коры центрально-височной области головного мозга. Доброкачественная роландическая эпилепсия проявляется редкими, возникающими преимущественно в ночное время, судорожными приступами в одной половине лица, языка и глотки; в отдельных случаях — генерализованными эпиприступами. Диагноз устанавливается на основании клинических особенностей заболевания и данных ЭЭГ, при необходимости проводится полисомнография и МРТ головного мозга. Доброкачественная роландическая эпилепсия не приводит к нарушениям психо-физического развития ребенка и бесследно проходит к концу подросткового периода.
Общие сведения
В педиатрии доброкачественная роландическая эпилепсия является наиболее распространенной патологией из группы доброкачественных фокальных эпилепсий. На ее долю приходится 15% от всех случаев эпилепсии у детей в возрасте до 15 лет и около 20% случаев судорожного синдрома у детей. Доброкачественная роландическая эпилепсия встречается с частотой 21 случай на 100 тыс. детей. Доброкачественная роландическая эпилепсия может возникнуть в возрасте от 2 до 14 лет, но в 85% случаев она манифестирует в возрастном периоде от 4 до 10 лет. Доброкачественное течение классической роландической эпилепсии характеризуется отсутствием психо-неврологических изменений и полным исчезновением эпиприступов к 15-18 годам.

Доброкачественная роландическая эпилепсия
Причины
Точные причины появления доброкачественной роландической эпилепсии пока не установлены. В некоторых случаях (по разным данным 20-60%) прослеживается наследственный характер заболевания, однако прямое аутосомно-рецессивное или аутосомно-доминантное наследование не наблюдается. Это послужило основанием для полигенной теории наследования доброкачественной роландической эпилепсии, согласно которой заболевание детерминируется двумя разными генами.
В современной неврологии и эпилептологии доминирующим является представление о том, что доброкачественная роландическая эпилепсия возникает вследствие нарушения созревания коры головного мозга в центрально-височной области. Доброкачественная роландическая эпилепсия является возраст-зависимым заболеванием и вероятно связана с повышенной возбудимостью мозга у детей. Последнее обусловлено целым рядом факторов: функциональными и структурными особенностями эпилептогенных областей (неокортекса, гиппокампа, амигдалы), превалированием возбуждающих нейротрансмиттеров, низким содержанием ГАМК, незрелостью ГАМК-рецепторов, увеличенным числом возбуждающих возвратных синапсов. По мере созревания головного мозга ребенка происходит снижение его возбудимости и постепенное исчезновение эпилептогенности очагов доброкачественной роландической эпилепсии. В результате наблюдается уменьшение числа эпилептических припадков и полное выздоровление пациентов при достижении ими пубертатного периода.
Симптомы роландической эпилепсии
Наиболее типичными для классической доброкачественной роландической эпилепсии являются простые парциальные эпиприступы, протекающие без утраты сознания. Как правило, приступу предшествует сенсорная аура в виде одностороннего чувства пощипывания, покалывания или онемения на лице, губах, деснах, языке и в глотке. Далее возникает моторный пароксизм, который может быть представлен как тоническими, так и клоническими мышечными сокращениями, а также их сочетанием. В зависимости от локализации судорог приступы доброкачественной роландической эпилепсии могут быть гемифациальными и фарингооральными. Гемифациальный приступ протекает с судорогами в мышцах половины лица. Фарингооральный приступ характеризуется односторонними судорогами в мышцах языка, губ, глотки и гортани. Он сопровождается гиперсаливацией и нарушением речи. Судорожные сокращения мышц гортани приводит к появлению характерных горловых звуков, напоминающих бульканье, полоскание горла или хрюканье. По мере развития доброкачественной роландической эпилепсии судорожные приступы могут «поменять» сторону.
80% эпиприступов, которыми сопровождается доброкачественная роландическая эпилепсия, возникают в ночное время и тесно связаны с периодами засыпания и пробуждения. Гораздо реже наблюдается сочетание ночных приступов с припадками, происходящими в дневное время. В 20% случаев доброкачественная роландическая эпилепсия протекает с брахиофациальными приступами, во время которых судороги лицевой области распространяются на гомолатеральную руку. В 8% случаев наблюдается вовлечение гомолатеральной нижней конечности. В некоторых случаях доброкачественная роландическая эпилепсия сопровождается сложными парциальными эпиприступами, для которых типична кратковременная потеря сознания. Примерно у 20% больных возникают вторично-генерализованные эпиприступы, во время которых судороги захватывают все мышцы тела. Такие приступы протекают с полной потерей сознания.
Течение
Доброкачественная роландическая эпилепсия характеризуется малой продолжительностью эпиприступов (до 2-3 минут) и их небольшой частотой. Приступы бывают единичными или наблюдаются несколько раз в году. Иногда в начале заболевания приступы могут быть более частыми, однако по мере взросления ребенка наблюдается их урежение.
В отличие от эпилепсии, описанной Джексоном, классическая доброкачественная роландическая эпилепсия не сопровождается задержкой психо-моторного развития ребенка и не приводит к олигофрении. Однако нельзя сказать об абсолютном отсутствии неврологических нарушений, поскольку примерно у 3% больных после приступов возникает преходящий гемипарез.
Диагностика
Основным способом диагностики доброкачественной роландической эпилепсии является ЭЭГ. Поскольку у некоторых больных изменения ЭЭГ наблюдаются лишь в период сна, при нормальной дневной ЭЭГ дополнительно необходимо проведение ночного ЭЭГ-мониторинга или полисомнографии.
Патогномоничным признаком доброкачественной роландической эпилепсии считается обнаружение на фоне нормальной основной активности высокоамплитудных острых волн или пиков, расположенных в центрально-височных отведениях. Зачастую после пика следуют медленные волны, вместе с пиком они составляют так называемый «роландический комплекс» длительностью до 30мс. Визуально такие комплексы напоминают комплексы QRST на электрокардиограмме. Обычно «роландические комплексы» локализуются на стороне, противоположной судорожным приступам, но могут иметь и двусторонний характер. К особенностям ЭЭГ-паттернов доброкачественной роландической эпилепсии относится их изменчивость от одной записи ЭЭГ к другой.
В первую очередь доброкачественная роландическая эпилепсия нуждается в дифференцировке от симптоматических эпилепсий, возникающих при внутримозговых опухолях, черепно-мозговых травмах, воспалительных поражениях головного мозга (абсцессе, энцефалите, гнойном менингите). В подтверждение роландической эпилепсии говорит отсутствие патологических изменений в неврологическом статусе и расстройств поведения, сохранность интеллекта, анамнестические данные, нормальная основная активность на ЭЭГ. В некоторых случаях для уточнения диагноза проводится МРТ головного мозга.
Большие сложности представляет дифференциальная диагностика доброкачественной роландической эпилепсии и ночной эпилепсии со сложными парциальными эпиприступами. Это связано с тем, что типичные для приступа доброкачественной роландической эпилепсии нарушения речи могут интерпретироваться как нарушения сознания. С другой стороны достаточно трудно адекватно диагностировать ночные расстройства сознания. В таких случаях в постановке диагноза решающую роль играют данные ЭЭГ, которые при лобной и височной эпилепсии демонстрируют очаговые изменения активности головного мозга в соответствующих отведениях.
Определенные затруднения вызывает дифференцировка классической доброкачественной роландической эпилепсии от синдрома псевдоленнокса, который наблюдается у 5% больных с симптомами роландической эпилепсии. Сочетание типичных роландических эпиприступов с атипичными абсансами, миоклоническими и астеническими приступами, интеллектуально-мнестическими нарушениями, а также выявление на ЭЭГ диффузной пиковой активности или медленных комплексов, характерных для синдрома Леннокса — Гасто, свидетельствуют в пользу синдрома псевдоленнокса.
Лечение доброкачественной роландической эпилепсии
Для детских неврологов и эпилептологов вопрос целесообразности лечения доброкачественной роландической эпилепсии является весьма дискутабельным. Поскольку даже без проведения лечения доброкачественная роландическая эпилепсия заканчивается выздоровлением, то, по мнению некоторых авторов, она не является показанием к назначению антиэпилептической терапии. Другие неврологи, указывая на вероятность диагностической ошибки при постановке диагноза «доброкачественная роландическая эпилепсия» и учитывая возможность ее перехода в синдром псевдоленнокса, рекомендуют проводить антиэпилептическую терапию при повторных эпиприступах.
В лечении детей с доброкачественной роландической эпилепсией всегда используется только 1 противоэпилептический препарат (монотерапия). Лечение обычно начинают назначением одного из препаратов вальпроевой кислоты. При его непереносимости или неэффективности, как правило, переходят на прием топирамата или леветирацетама. У детей старше 7 лет возможно применение карбомазепина, однако следует помнить, что в некоторых случаях он может привести к феномену аггравации, т. е. к учащению приступов.
Роландическая эпилепсия, полезные статьи медицинской клиники Невро-Мед
К.Ю. Мухин, П.А. Темин, Е.А. Рыкова
Луиджо Роландо (1773-1831 г.), итальянский врач и анатом, дал классическое топографическое описание центральной борозды коры головного мозга. При идиопатической парциальной эпилепсии детского возраста, характеризующейся короткими гемифациальными моторными ночными приступами, часто с предшествующей соматосенсорной аурой и типичными изменениями ЭЭГ (полифазные спайки с локализацией в центральной и срединной височной областях) [14], эпилептогенной зоной являются нижние отделы роландической борозды. Изучение этой разновидности идиопатической парциальной эпилепсии начато более 40 лет назад. Первоначально были описаны специфические изменения ЭЭГ у определенной группы детей. В 1952 г. H.Gastaut [25] впервые обратил внимание на особые эпилептические изменения ЭЭГ у некоторых детей: полифазные спайки со строгой локализацией в перироландической области. Первое клиническое описание симптомов эпилепсии с роландическими спайками (1958 г.) принадлежит Р.Nayras и М.Веаussart [40]. В последующем Е.Gibbs и F.Gibbs [27], С.Lombroso [36], Р.Loisea и соавт. [35] провели клинический анализ симптомов при эпилепсии с роландическими спайками и предложили называть данную форму эпилепсии роландической. Авторы отметили ее благоприятный прогноз и отсутствие симптомов органического поражения центральной нервной системы.
Частота
Роландическая эпилепсия (РЭ) — одна из наиболее частых форм эпилепсии детского возраста. Распространенность ее составляет 21 на 100 тыс. здорового детского населения [29]. Частота РЭ среди всех форм эпилепсии с дебютом до 13 лет варьирует по разным данным от 11,5% [15] до 25% [5]. Из 360больных эпилепсией детей, наблюдавшихся Р.Lerman [34],у 14,4% была диагностирована роландическая эпилепсия. Для сравнения заметим, что одна из наиболее частых форм эпилепсии детского возраста — пикнолепсия — была диагностирована лишь у 10,5% пациентов. Не исключено, что истинная частота роландической эпилепсии в популяции значительно выше, так как у многих больных отмечаются единичные ночные приступы, часто остающиеся без внимания родителей и врачей [34].
Большинство авторов отмечают преобладание мальчиков среди больных роландической эпилепсии [3]. Соотношение мальчиков и девочек в среднем составляет 6:4 [11].Среди 100 бальных, наблюдавшихся Р.Lerman [34], было 62 мальчика и 38 девочек.
Клиника
Дебют роландической эпилепсии варьирует в возрастном интервале 2 — 14 лет. В 83% случаев РЭ дебютирует в возрасте 4 — 10 лет[5]. У подавляющего большинства пациентов приступы начинаются между 5-м и 10-м годом жизни с максимумом в возрасте 9 лет [9]. Средний возраст появления приступов — 9,9 года [33]. Начало заболевания в возрасте до 2 лет отмечается не чаще чем в 8% случаев [15]. Имеются единичные описания начала РЭ на 1-м году жизни [17], однако отнесение данных случаев к РЭ дискутируется [21].Начало заболевания после 11 лет также является редкостью, а после 14 лет такие случаи не наблюдаются [9].
Клиническая симптоматика приступов при роландической эпилепсии, как правило, типична. Наблюдаются простые парциальные (моторные, сенсорные, вегетативные), сложные парциальные (моторные) и вторично генерализованныс приступы. Наиболее типичны простые парциальные моторные и/или сенсорные пароксизмы [2].
Простые парциальные приступы составляют «ядро» роландической эпилепсии и наблюдаются у 70 — 80% больных. Наиболее типично начало приступа с соматосенсорной ауры: ощущение покалывания, онемения, «прохождения электрического тока» унилатерально в области глотки, языка, десны. Вслед за аурой развивается парциальный приступ. Возможны следующие варианты: гемифациальные приступы; унилатеральные тонические, клонические или тонико-клонические судороги мышц лица; фарингооральные приступы; унилатеральные судороги губы, языка, глотки, гортани, часто сочетающиеся с анартрией и гиперсаливацией. Гемифациальные приступы имеютместо у 37% больных, фарингооральные — у 53% [91. Часто во сне больные издают своеобразные горловыезвуки типа «бульканья», «хрюканья», «полоскания горла». Истинную частоту соматосенсорных приступов (щечная парестезия по терминологии J.Aicardi [5]) определить сложно, так как дети, особенно маленькие, затрудняются описать свои ощущения во время приступов.
У 20% больных судороги могут распространяться с мышц лица на гомолатеральную руку (брахиофациальные приступы) и примерно в 8%случаев вовлекать и ногу (унилатеральные приступы). По мере развития заболевания приступы могут менять сторонность. Вторично генерализованные судорожные приступы отмечаются у 20-25% больных роландической эпилепсии. Они наиболее характерны для младших детей, и возникновение генeрализованных приступов «жестко» приурочено ко сну. Наличие у пациентов длительное время только генерализованных судорожных приступов нехарактерно для РЭ, как и наличие абсансов, психомоторных приступов и приступов с психическими симптомами [5].
Продолжительность приступов при роландической эпилепсии, как правило, небольшая [5] от нескольких-секунд до 2-3мин. У 11% [16] — 22% [5] больных продолжительность пароксизмов превышает 10-15 мин, у 16% [5] отмечаются тяжелые продолжительные приступы ,заканчивающиеся постприступным гемипарезом (паралич Тодда). Частота приступов при РЭ обычно невысока — в среднем 2 в год [5]. В первые 1-2 года с момента дебюта заболевания приступы могут быть более частыми, однако с течением времени они возникают все реже. После 13-16 лет возможно полное исчезновение приступов. У 10-40% детей наблюдается единичный приступ за все время болезни, даже если они не получают антиконвульсантов [41].Еженедельные и более частые, ежедневные приступы наблюдаются лишь в 6% [35] — 20% [34] случаев. Серийные приступы и повторные в течение одной ночи редки и наблюдались в 3% случаев, описанных Т . Deonna и со авт.[17].
В редких публикациях [15,16,23,34] сообщается о развитии эпилептического статуса при РЭ. Часто та его при РЭ составляет около 11% [16]. Подробное описание эпилептического статуса у больных РЭ представлено в работе N . Fejerman и А.Di Blasi [23]. Авторы наблюдали 2 мальчиков 8 лет с дебютом РЭ в 3 года, у которых возник длительный статус гемифациальных приступов. Сознание было сохранено, однако констатировались анартрия и выраженное слюнотечение. Пероральное назначение антиконвульсантов в высоких дозах, как и парентеральное введение диазепама или лоразепама, не оказало влияния на эпилептический статус. Лишь назначение гормональных препаратов(дексаметазон) полностью купировало судороги.Вызывает сомнение, однако, отнесение данныхслучаев к роландической эпилепсии. У одного из этих пациентов наблюдались типичные абсансы, у другого -приступы с джексоновским маршем; у обоих приступы были резистeнтны к антиконвульсантам . Возможно, данные случаи представляют собой атипичную форму РЭ. Е.Roulet и соавт. [42] описал иэпилептический статус у мальчика 6 лет с роландической эпилепсии. Единственным его проявлением было длительное слюнотечение в сочетании с оролингвомоторной диспраксией. На ЭЭГ во время слюнотечения регистрировались спайк-волновые комплексы ,включая роландические. При увеличении дозы карбамазепина слюнотечение прекратилось. По мнению авторов, длительное перманентное слюнотечение у больных роландической эпилепсии может быть единственным симптомом эпилептического статуса.
Пароксизмы РЭ связаны с ритмом сон -бодрствование. Наиболее типичны ночные приступы ,возникающие преимущественно при засыпании и пробуждении. При ночных приступах пароксизмы возникают в период пробуждения (35%), реже — все редине ночи (25%) и при засыпании (20%). У 25-30%больных приступы наблюдаются как во сне, так и всостоянии бодрствования [5]. Лишь у 5-25% пациентов они возникают исключительно со время бодрствования [5,34]. Имеется некоторое различие картины приступов в зависимости от ритма сон — бодрствование. Дневные приступы практически всегда простые парциальные, чаще гемифациальные ,короткие, ночные, как правило, более тяжелые, продолжительные, обычно унилатеральные или вторично генерализованные. Провести оценку сознания у пациентов с ночными приступами сложно; феномен анартрии часто симулируетклинику выключения сознания. Сложные парциальные приступы при роландической эпилепсии редки и составляют лишь около 5% всех случаев [15]. Возможно, на протяжении приступа у некоторых больных имеет место «флюктуация» уровня нарушения со знания.
J.Aicatdi и J.Сhevrie [4] была выделена группа больных сосвоеобразным эпилептическим синдромом ,клиническая симптоматика которого была схожа с роландической эпилепсией. У больных отмечались простые парциальные гемифациальные и гемиклонические приступы,однако в сочетании с миоклонически-астатическими, атоническими приступами и в ряде случаев с абсансами. Данная группа наблюдений классифицирована какатипичный вариант РЭ. Частота его, согласно Т.Deonnaи соавт. [16], составляет 5% среди всех больных РЭ.Таксономическое положение данного синдрома спорно. По мнению J.Aicatdi и J.Сhevrie [5], данная форма эпилепсии является нозологически самостоятельным синдромом с четко очерченными клиникой, изменениями ЭЭГ и прогнозом. Другие авторы предполагают наличие атипичного варианта в рамках РЭ [17]. Подробное описание данного синдрома представлено Т.Deonna и соавт. [16] на примере 6 пациентов. Среди обследованных больных преобладали мальчики. Приступы дебютировали в возрастном интервале от 2 до 7 лет у неврологически нормальных детей с сохранным интеллектом. Клинические симптомы включали различные виды приступов. Характерными были ночные простые парциальные приступы, подобные таковым при РЭ, миоклонически-астатические и атонические приступы. У ряда больных отмечались атипичные абсансы. Приступы во всех случаях были частыми, ежедневными и приводили к многократным падениям пациентов и тяжелым ушибам. На ЭЭГ типичные роландические спайки сочетались с медленными комплексами пик-волна, характерными для синдрома Леннокса — Гасто. Отмечалось нарастание эпилептической активности в фазе медленного сна.
Клиническая симптоматика атипичной роландической эпилепсии носит черты целого ряда эпилептических синдромов: РЭ (простые парциальные ночные приступы в сочетаниис типичными роландическими спайками), синдрома Леннокса — Гасто (частые атонически-астатические приступы, атипичные абсансы в сочетании с медленными комплексами пик-волна) и эпилепсии смиоклонически-астатическими приступами,описанной Н.Doose [19]. Однако кардинальным отличием атипичной роландической эпилепсии от синдрома Леннокса — Гасто и эпилепсии с миоклоничeски-астатическими приступами являются отсутствие у пациентов нарушений интеллекта и хороший прогноз. Р.Loisea и соавт. [35] провели катамнестическое исследование13 пациентов с атипичной РЭ в течение не менее 9лет. Спустя разный промежуток времени во всех случаях была достигнута полная ремиссия, при этом большая часть пациентов (10) не применяли регулярной противоэпилептической терапии. Авторы не отметили ни отставания в психическом развитии, ни серьезных нарушений поведения как в наиболее активный период заболевания, так и в период ремиссии, что сближает данные случаи с типичной РЭ. По мнению авторов, при данном синдроме следует избегать «агрессивной» противоэпилептической терапии ввиду хорошего прогноза.
O.Dulac и соавт. [21] проанализировали случаи парциальной эпилепсии с ранним дебютом — между 8днями и 3 годами жизни. Среди 442 больных выявлено 17с парциальной эпилепсией с ранним дебютом .Приступы характеризовались как простые парциальные с частой вторичной генерализацией. По мнению авторов, данные случаи являются переходной формой между доброкачественной эпилепсией новорожденных и РЭ. В отличие от двух указанных синдромов прогноз был неблагоприятными приступы не поддавались медикаментозной терапии. Последующие исследования покажут, являются ли случаи парциальной эпилепсии с дебютом в первые 3 года жизни нозологически самостоятельным синдромом или еще одним» атипичным вариантом» РЭ.
Неврологический статус
Неврологический статус у детей, страдающих роландической эпилепсии, изучен достаточно подробно. Роландическая эпилепсия относится к идиопатическим формам эпилепсии, при которых отсутствуют признаки органического поражения головного мозга, что подтверждается большинством публикаций. Более того, по мнению А. Веаumanoir и соавт. [8] наличие таких симптомов противоречит критериям диагноза роландической эпилепсии. Однако в последние годы благодаря внедрению в клиническую практику высокоэффективных нейрорадиологических методов исследования(компьютерная томография, ядерно-магнитный резонанс, позитронная эмиссионная томография) появились единичные сообщения об обнаружении структурных изменений в головном мозге у больных РЭ.
Из 100 больных, наблюдавшихся Р.Lerman и S.Kivity [33], у 4 констатированы симптомы органического поражения центральной нервной системы: детский церебральный паралич (гемипаретическая и тетраплегическая формы), микроцефалия, умеренная задержка умственного развития. Во всех этих случаях диагноз РЭ не вызывал сомнения и был подтвержден как клинически, так и нейрофизиологически. Пневмоэнцефалография не выявила нарушений у данных больных. S.Blom и J.Heijbet [11]в 3 (7,5%) из 40 случаев РЭ обнаружили у больных центральный гемипарез. E.Roulet и соавт. [42] отметили проявления оролингвомоторной диспраксии у больного РЭ. Такие симптомы, как микроцефалия, косоглазие, мозжечковая недостаточность, задержка психического и речевого развития, констатировали у ряда больных РЭ Р.Santanelli и соавт.[43]. Синдром гиперактивности был обнаружен у 16,7%больных РЭ [34].
Генетика
Р.Вrау и W.Wiser [13] первыми констатировали наличие семейных случаев роландической эпилепсии и предположили аутосомно-доминантную модель наследования с неполной пенетрантностью и возрастной зависимостью. В последние десятилетия проведены многочисленные клинико-генеалогические исследования при роландической эпилепсии, подтверждающие правомерность данной концепции. Согласно обобщенным данным литературы, 8,9% [35] — 68% [29]больных РЭ имеют родственников, страдающих эпилепсией или имеющих приступы в анамнезе, и до 30% [13] — родственников с наличием на ЭЭГ роландических спайков при отсутствии приступов. Частота обнаружения спайков у сибсов пробандов и детей, родители которых страдали РЭ, составляет25-36% (в популяции здорового населения — 1,4-5% [З7]).Однако лишь у малой части из них (12% в исследовании Р.Вrау и W.Wiser [13]) отмечались приступы: остальные были клинически здоровы. Характер приступов у родственников больных роландической эпилепсии может быть различным. Типичные приступы, характерные для РЭ, констатируются у 13%родственников, абсансная эпилепсия — у 10%, гснсрализованные судорожные приступы — у 3%,фокальная эпилепсия — у 1% [9].
В ряде исследований изучена конкордантность монозиготных близнецов по РЭ. Обнаружена высочайшая конкордантность по наличию на ЭЭГ роландических спайков, но не по развитию самой РЭ. T.Kajitani и соавт. [30] изучили 3 пары монозиготных близнецов в возрасте 5-11 лет, в которых один из сибсов страдал РЭ. Во всех случаях констатирована типичная роландическая эпилептическая активность на ЭЭГ, но ни у одного из здоровых сибсов не было никаких проявлений РЭ.
В последние годы была выдвинута гипотеза о мультифакторном наследовании роландической эпилепсии [29]. Она основывается на том факте, что лишь у небольшой части детей, имеющих на ЭЭГ роландические спайки, в дальнейшем развивается РЭ. Предполагается, что роландические спайки и развитие РЭ детерминированы двумя различными, но сцепленными генами. В 1982 г. O.Eeg-Olofsson и соавт. [22] обнаружили, что у родителей, сибсов и других родственников детей, больных РЭ, низкая встречаемость гаплотипа А1В8 антигенов лейкоцитарной гистосовместимости. Частота его в общей популяции крайне высока [22]- Возможно, что данный гаплотип играет роль протектора или ингибирующего фактора, препятствующего развитию РЭ.
Интересны исследования, раскрывающие взаимосвязь РЭ с фебрильными судорогами. E.Frantzen и соавт. [24] сообщили, что у 20% детей с фебрильными судорогами в дальнейшем на ЭЭГ появляется фокальная эпилептическая активность, идентичная роландическим спайкам. Ни у одного из этих пациентов не отмечалось в дальнейшем эпилептических приступов. Исследования на монозиготных близнецах также показали возможное генетическое сцепление между РЭ и фебрильными судорогами. M.Lennox-Buchthul [32] изучила 24 пары монозиготных близнецов, в которых по крайней мере у 1 из пары имелись фебрильные судороги, и выявила, что 20% их сибсов имели редкие ночные приступы. У 2 из 24 обнаружено сочетание ночных приступов с фебрильными судорогами. К сожалению, автор не идентифицировала данные ночные приступы, однако по характеру их течения и возрасту дебюта можно предположить, что это случаи РЭ. В исследовании T.Kajitani и соавт. [31] среди 3 пар монозиготных близнецов 3 имели РЭ и 5 — фебрильные судороги. Данные работы могут свидетельствовать о генетическом сцеплении РЭ и фебрильных судорог. Подтверждением этой гипотезы служит и клиническая схожесть двух данных синдромов: высокая генетическая детерминированность, «жесткий» возрастзависимый дебют, доброкачественный прогноз [1] .
Остается неясной роль экзогенных, средовых факторов в развитии роландической эпилепсии. H.Doose и W.Baier [18] предположили, что генетические факторы при РЭ детерминируют низкий порог судорожной готовности головного мозга. При этом здоровых детей, имеющих на ЭЭГ роландические спайки, они расценили как субклинических носителей с низким судорожным порогом. По мнению авторов, воздействие различных экзогенных факторов в онтогенезе, а также сцепление с другими генами может способствовать у таких пациентов клинической манифестации заболевания и оказывать некоторое влияние на его течение. Т.Каjitani и соавт. [30] описали 3 родных сибсов, у каждого из которых на ЭЭГ имелись типичные роландические спайки. У одного из сибсов РЭ дебютировала в 4 года во время лихорадочного заболевания, у другого отмечался единственный приступ в возрасте 10 лет при просмотре телепередач, третий миновал «критический период» для дебюта и был здоров. Данное наблюдение иллюстрирует полиморфизм клинических проявлений заболевания, что может зависеть от различных экзогенных воздействий.
Факторами, трансформирующими субклиническое носительство в РЭ, могут быть патология беременности и родов, травмы головы, нейроинфекции и пр. [5]. Однако более чем у половины детей, страдающих РЭ, указание на наличие данных факторов в анамнезе отсутствует[15].
Электроэнцефалография
Необходимым исследованием для объективизации диагноза РЭ является электроэнцефалография [14].На ЭЭГ в межприступном периоде при РЭ обнаруживаются характерные, типичные «роландические» или «центровисочные» комплексы при обязательно сохранной основной активности. Эти комплексы представляют собой медленные дифазные высокоамплитудные пики или острые волны (100 — 300 мВ), нередко с последующими медленными волнами, общей продолжительностью около 30 мс (см. рисунок). Они имеют тенденцию к возникновению группами. Данные комплексы напоминают зубцы QRST ЭКГ. Роландические комплексы «жестко» локализованы: центральная и центровисочная области. Роландические комплексы могут наблюдаться как унилатерально (обычно контралатерально гемифациальным приступам) — 60% больных, так и билатерально — 40% [29].Эпилептические комплексы, как правило, независимы друг от друга, лишь в редких случаях наблюдается их билатерально-синхронное распространение с амплитудным преобладанием с одной стороны [26,34].
D.Gregory и Р.Wong [28] провели изучение точной локализации роландических спайков, используя метод компьютеризированного топографического картирования. Авторы обнаружили, что максимум «позитивности» электрического диполя при РЭ находится в центрально-височной области, а максимум «негативности» — в лобной. Предположено, что специфические ЭЭГ-паттерны при РЭ исходят из зоны, расположенной в нижних отделах роландической борозды, на границе с сильвиевой бороздой. Типичной особенностью изменений ЭЭГ при РЭ является нестойкость паттернов, их вариабельность от одной записи к другой. Роландические спайки могут исчезать, а затем появляться вновь, менять стройность, конфигурацию даже при двух последующих записях ЭЭГ через короткий промежуток времени. Нестойкость ЭЭГ-паттернов при РЭ свидетельствует, по мнению J.Aicardi [5], об отсутствии органических изменений в головном мозге при РЭ. В связи с этим отсутствие роландических спайков при однократном злектроэнцефалографическом исследовании не может считаться убедительным аргументом для исключения диагноза РЭ при наличии типичной картины приступов [15]. Крайне важным для подтверждения диагноза РЭ является исследование ЭЭГ во время сна. Около 30% детей, страдающих РЭ, имеют роландические спайки исключительно во время сна [29]. Во время дремоты и на всех стадиях сна отмечается тенденция к переходу унилатеральных роландических комплексов в билатеральные [34].
Интересной находкой при РЭ является обнаружение на ЭЭГ наряду с типичными роландическими комплексами и других эпилептических паттернов. От 10 до 20% детей с РЭ имеют на ЭЭГ пик-волновые комплексы в других зонах коры, главным образом в затылочной области [41]. Морфология «затылочных комплексов «близка к роландическим и к наблюдаемым при доброкачественной фокальной эпилепсии с затылочными пароксизмами [10]. По мнению J.Aicardi [5],частота «затылочных комплексов» при Рэо братно пропорциональна возрасту ребенка и является нередкой у больных до 3 лет жизни. От 7% [34]до 20% [5] пациентов с РЭ демонстрируют на ЭЭГ типичную генерализованную пик-волновую активность с частотой 3-4 Гц, нередко возникающую при гипервентиляции. У отдельных больных возможно появление медленных пик-волновых комплексов. Большинство авторов придерживаются однозначного мнения об отсутствии корреляции между частотой и выраженностью пик- волновыхкомплексов на ЭЭГ и особенностями течения заболевания.
Исследование ЭЭГ во время приступа представляется довольно сложным ввиду низкой частоты приступов при РЭ. B.Dalla-Bernardina и соавт. [15]описали во время ночного приступа появление на ЭЭГ низкоамплитудной быстрой активности в центрально-височной области, переходящей в роландические комплексы с распространением на всю гемисферу и с последующим охватом всего полушария.
Нейрорадиологическое исследование
Сведения о нeйрорадиологическом исследовании у больных РЭ единичны. H.Gastaut [25] одним из первых изучил данные компьютерной томографии у 15 больных РЭ и не нашел патологических изменений ни в одном случае. В последующем при нейрорадиологическом исследовании у больных РЭ были обнаружены некоторые структурные изменения в головном мозге: расширение сильвиевой щели, наличие полости прозрачной перегородки (2 из 13случаев) [39], вентрикуломегалия, арахноидальные кисты (3 из 17 случаев) [38]. Р.Santanelli и соавт. [43] представили подробное клиническое и нейрорадиологическое описание 3 случаев РЭ, сочетающейся со структурными изменениями головного мозга. У одного больного была выявлена липома мозолистого тела, у другого (соспондилоторакальной дисплазией) — агенезия мозолистого тела с вентрикуломегалией, у третьего — множество церебральных, преимущественно перивентрикулярных, кальцификатов (врожденный токсоплазмоз). У всех этих больных наблюдались типичная клиническая картина РЭ и роландические спайки на ЭЭГ.
Обнаруженные при нейрорадиологическом исследовании у единичных больных РЭ органические симптомы поражения головного мозга трудно интерпретировать однозначно. Не исключено, что эти нарушения не имеют непосредственной причинно-следственной связи с РЭ и могут быть вызваны сочетанием РЭ с другими заболеваниями — детским церебральным параличом, микроцефалией, токсоплазмозом, эктомезодермальными дисплазиями. Как и в популяции в целом, у больных РЭ могут наблюдаться перинатальное поражение центральной нервной системы, постнатальные черепно-мозговые травмы. Частота перинатальных поражений центральной нервной системы среди больных РЭ составляет 6% [16]- 13% [34], сотрясения головного мозга — 4 — 5% [34], что не превышает статистических данных в популяции здоровых детей. Принципиально важный и до конца не решенный вопрос — влияют ли данные экзогенные факторы на возникновение и течение РЭ. По мнению J.Aicardi [5], нарушения, обнаруженные в головном мозге у больных РЭ, не могут быть причиной эпилепсии, а являются случайными находками. С другой стороны, нельзя игнорировать тот факт, что у ряда больных РЭ структурные изменения с головном мозге локализуются в нижних отделах роландической борозды [43], а это не исключает полностью возможность существования «симптоматической» формы эпилепсии.
Лечение
За последние годы в лечении РЭ апробирован целый ряд противоэпилептических препаратов. Большинство авторов рекомендуют применять препараты, преимущественно воздействующие на парциальные формы эпилепсии: карбамазепин (финлепсин, тегретол) и дифенин (фенитоин). При лечении РЭ необходимо избегать политерапии, а также на значения противосудорожных препаратов в высоких дозах. Доброкачественное течение РЭ, отсутствие интеллектуально-мнестических нарушений у пациентов не дают оснований рекомендовать «агрессивную» антиконвульсантную политерапию для лечения данной формы эпилепсии ввиду возможности развития тяжелых побочных эффектов.
По мнению P.Lerman [34], а также В. Dalla-Bermardina и соавт.[15], одним из препаратов выбора влечении РЭ является фенитоин в низких и средних дозах. При возникновении приступов исключительно в ночное время или в период пробуждения рекомендован однократный прием фенитоина на ночь. Во всех наблюдавшихся авторами случаях применение средних терапевтических доз фенитоина приводило к полной клинической ремиссии приступов. Согласно данным P.Lerman и S.Kivity [33], эффективность фенитоина в лечении РЭ превышает таковую карбамазепина и фенобарбитала.
Карбамазепин также высокоэффективен в лечении РЭ [41] и отличается от дифенина минимальной выраженностью побочных эффектов терапии.
Сультиам (осполот) эффективен и хорошо переносится больными РЭ [19]. Применение барбитуратов (фенобарбитал, бензонал) лимитировано частым и тяжелым побочным влиянием на интеллектуально-мнестическис функции и поведение детей [5] и не может быть рекомендовано для лечения РЭ.
В последние годы появились публикации, свидетельствующие об эффективности препаратов вальпроевой кислоты (депакин, конувулекс) при РЭ[6,15,29]. Важной особенностью их является позитивное влияние на интеллектуально-мнестические функции пациентов и хорошая переносимость [12]. Однако, катамнестические исследования эффективности применения вальпроатов при РЭ отсутствуют.
Большинство авторов считают, что продолжительность применения антиконвульсантов при РЭ не должна превышать 2 лет с момента последнего приступа [35]. В среднем продолжительность медикаментозного лечения при РЭ составляет 3,2 года [33]. Однако в случае раннего дебюта приступов (2-3 года) лечение должно быть продолжено до 10-летнего возраста, независимо от длительности ремиссии [4]. Лечение рекомендуется назначать только после повторного приступа. Сохранение на ЭЭГ типичной эпилептической активности не может являться причиной продолжения антиконвульсантной терапии, если у больного имеется длительная ремиссия.
Прогноз
Особенностью РЭ является хороший прогноз заболевания [20]. По данным P.Loisea и соавт. [35], после 13лет приступы РЭ исчезли у 93,5% из 168 обследованных больных, а после 16 лет — у 98,8%. P.Loisea и соавт. [35] подробно исследовали влияние отдельных клинических симптомов РЭ на прогноз заболевания. В качестве возможных факторов, влияющих на прогноз, были проанализированы пол пациентов, возраст дебюта эпилепсии, частота и характер приступов, их суточное распределение, особенности неврологического статуса. У всех 168 пациентов с РЭ прослежен катамнез в течение не менее 4 лет с момента последнего приступа. Выделены факторы, влияющие на прогноз РЭ: возраст дебюта и частота приступов. Обнаружено, что лишь возраст дебюта эпилепсии статистически достоверно коррелирует с прогнозом РЭ. Установлено, что продолжительность заболевания и резистентность к терапии увеличиваются при раннем (до 4 лет) и позднем (после 10 лет) дебюте эпилепсии. Все остальные факторы существенно не влияют на прогноз РЭ.
Длительное наблюдение больных в катамнезе обнаружило возможность рецидивов приступов при РЭ после продолжительной ремиссии. Частота рецидивов приступов во взрослом возрасте при РЭ невысока — от 1,8% [35] до 4% [34]. Рецидив приступов чаще наблюдается у женщин в период гормональной перестройки, через 3 — 10 лет с момента наступления ремиссии, и не связан с приемом антиконвульсантов [35]. В большинстве случаев появляются генерализованные судорожные приступы, единичные или редкие. Важной особенностью является отсутствие на ЭЭГ типичных роландических спайков; по мнению P.Loisea и соавт. [35], ЭЭГ у данных пациентов обычно в пределах нормы.
Учитывая генерализованный характер приступов, появление их спустя длительное время после наступления ремиссии, отсутствие роландических спайков на ЭЭГ, P.Lerman [34] предположил, что данные случаи не имеют отношения к РЭ и представляют собой возникновение эпилепсии de novo. Противоречит данной концепции тот факт, что частота рецидивов при РЭ (2-4%) значительно превышает популяционную частоту эпилепсии (0,8%). Возможно, в возникновении приступов во взрослом возрасте при РЭ играет роль взаимодействие экзогенных факторов с генетически детерминированным снижением порога судорожной готовности. Одним из «разрешающих» факторов может явиться нарушение гормонального баланса в организме.
Другой возможной причиной рецидивов приступов может быть существование стойких структурных изменений в головном мозге с локализацией в нижних отделах роландической или сильвиевой борозды. G.Ambrosetto и соавт. [6] описали рецидив типичных «роландических» приступов у больного в возрасте 21 года. Пациент страдал РЭ с 10 лет: ночные простые парциальные и вторичногенерализованные приступы. С 13 лет наступила ремиссия, с 16 детой прекратил прием антиконвульсантов. В 21 год без видимой причины у больного развились точно такие же парциальные и вторично генерализованные приступы в ночное время с частотой 1-4 в месяц. При компьютернойтомографии патологии не выявлено. На ЭЭГ в 21 год ив 30 лет (в динамике) — правосторонний фокустипичной роландической активности. Уникальностьданного наблюдения состоит в том, что у больного РЭ приступы вновь возникли спустя 8 лет после наступления ремиссии и носили типичный для РЭ характер, являясь, однако, резистентными к антиконвульсантам. По мнению авторов, в данном случае имеется высокая вероятность наличия у больного структурных изменений в роландической области, что может быть выявлено при более тщательном нейрорадиологическом обследовании (ядерно-магнитный резонанс, позитронная эмиссионная томография).
Дальнейшие исследования покажут соотношение генетических и экзогенных факторов в детерминации РЭ и возможность существования «симптоматических» форм РЭ, обусловленных структурными изменениями, локализованными в роландической области. Необходимо также проведение молекулярно-генетических исследований с целью поиска генов, ответственных за развитие РЭ. Это позволит определить взаимосвязь РЭ с другими формами идиопатической эпилепсии, такими как доброкачественная затылочная эпилепсия Гасто, детская абсанс-эпилепсия и др.
ЛИТЕРАТУРА
I. Бадалян Л.О., Темин П.А., Мухин К.Ю. Фебрильныесудороги. Методические рекомендации. М. 1987; 24.
2. Карлов В.А. Эпилепсия. М. 1990; 219 — 223.
3. Сараджишвили П.М., Геладзе Т.Ш. Там же 1977, 148 — 149.
4. Aicardi .J., Chevrie J.-J. Dev Med Child Neurol 1982, 24: 281 — 292.
5. Aicardi J. Epilepsy in children 1986; 4.
6. Ambrosetto G., Tenuper P., Baruzzi A. J Neural Neurosurg Psychiat 1985; 48: 90.
7. Bancaund J., Collomb D., Dell M.B. Rev Neurol 1958; 99: 206 — 209.
8. Beaumanoir A., BallisT.,Varfis G., Ansai K. Epilepsia l974; 15: 301 — 315.
9. Beaussart M., Favou R. Ibid 1978; 19: 337 — 342.
10. Beydoun A»index.html» Garofalo E.A»index.html» Drury I. Ibid 1992; 33: 1091 — 1096.
11. Blom S., Heijbel J. Ibid 1982: 23: 629 — 631.
12. Bourgeois B.F.D. Ibid 1994. 35: 2: 18 — 23.
13. Bray P.P., Wiser W.C. Pediatrics 1965; 36: 207 — 211.
14. Comissionon Classification and Terminology of the ILAE. Epilepsia 1989; 30: 389 -399.
15. Dalla-Bermardina В., Sgro V., Fontana E. Epileptic syndromes in infancy, childhoodand adolescence. Paris 1992; 173 — 186.
16. DeonnaTh., ZieglevA-L., Despland P.-A. Neuropediatrics 1986; 17: 144 — 151.
17. Deonna Th., Zieglev A.-L., Despland P.-A. Guyvan Меllе. Epilepsia 1986; 27: 241- 247.
18. Doose Н., Baier W.K. Еuгор J Pediatr 1989; 149: 152 — 158.
19. Doose H. Epileptic syndromes in enfancy, childhood and adolescence. Paris 1992; 103- 114.
20. Dreifuss F.E. Epilepsia 1994; 35: 2: 30 — 34.
21. Dulac O., Cusmai R., Olivera K.de. Ibid 1989; 30: 798 — 801.
22. Eeg-Olofsson O., Safwenbery J., Wigrtz A. Ibid 1982; 23: 27 — 34.
23. Fejerman N., Di Blasi A.M. Ibid 1987; 28: 351 — 355.
24. Frantzen E., Lennox-Buchthal M., Nygaakt A. Electroen-cephalogr Clin Neurophysiol1968; 24: 197 — 212.
25. Gastaut H. Rev Neurol 1952; 87: 488 — 490.
26. Gastaut H., Gastaut J.L. Epilepsia 1976; 17: 325 — 326.
27. Gibbs E.L., Gibbs F.A. Ibid 1960; 1: 448 — 453.
28. Gregory D.L., Wong P.K. Ibid 1984, 25: 705 — 711.
29. Heijbel J. Pediatric Epilepsy. Helsinky 1989.
30. Kajitani Т., Nakaltmra M., Llcaka K., Kobuchi S. Advances in Epileptology 1980; 4:171 — 175.
31. Kajitani Т., Kimura Т., Sumita M., Kaneco M. Brain Dev 1992; 14: 230 — 234.
32. Lennox-Buchthul M. Epilepsia 1971, 12: 197 — 212. 33. Lerman P., Kivity S. ArchNeural 1975; 32: 261 — 264.
34. Lerman P. Epileptic syndromes in infancy, childhood and adolescence. Paris 1992;173 — 186.
35. Loisea P., Duche В., Cordova S. et al. Epilepsia 1988; 29: 229 — 235.
36. Lombroso C.T. Arch Neurol 1967; 17: 52 — 59.
37. Luders Н.O., Lesser R.P., Dinner D.S., Morris H.H. Epilepsy — electroclinicalsyndromes. Berlin 1987; 303 — 346.
38. Mambelli M., Moscano F., Maroni P. et al. Bulll. Liga Int. Epilepsy 1985; 51/52: 79- 80.
39. Morikawa Т., Osawa Т., Ishihara O., Seino M. Brain Dev 1979; 1: 303 — 346.
40. Nayrac P., Beaussart M. Rev Neurol 1958; 99: 201 — 206.
41. Panayiotopoulos С.Р. J Neurol Neurosurg Psychiat 1993; 56: 2 — 5.
42. Roulet E., Deonna Th., Despland P.A. Epilepsia 1989; 30. 564 — 568.
43. Santanelli P., Вureau M., Magaudda A. et al. Ibid 1989; 30: 182 — 188.
симптоматика заболевания, статистика регресса в период взросления
Доброкачественную роландическую эпилепсию относят к генетическим неврологическим заболеваниям. У пациентов отмечается повышенная возбудимость височной коры больших полушарий, что обуславливает возникновение симптомов. Основные клинические проявления — судорожные приступы, имеющие локальный или генерализованный характер. Для подтверждения диагноза необходимо проведение ЭЭГ. Как правило болезнь самостоятельно проходит у детей при взрослении.
Этиология заболевания

Причина развития болезни неизвестна. У 40-70% пациентов отмечается наследование патологии. Оно носит мозаичный характер, т. е. встречается не у всех родственников. На сегодняшний день в неврологии считают, что за развитие роландической эпилепсии ответственны два гена, определяющих работу нейронов коры больших полушарий.
Основная теория объясняет возникновение болезни незрелостью корковых отделов головного мозга, преимущественно центральной части височной доли. Эпилепсия связана с возрастом пациента и возникает преимущественно у детей. Кора больших полушарий в детском возрасте отличается рядом особенностей:
- большое количество возбуждающих нейромедиаторов, превосходящих по количеству тормозящие молекулы;
- µ-аминомасляная кислота и рецепторы к ней выявляются в небольшом количестве;
- большая часть синапсов носит возбуждающий характер;
- эпилептогенные области ЦНС (гиппокамп, лимбическая система) имеют высокий уровень активности.
Указанные факторы по мере взросления ребенка устраняются, что приводит к снижению частоты приступов роландической эпилепсии и полному выздоровлению. У взрослых заболевание не встречается.
Клинические проявления
Парциальные приступы без утраты сознания — основной симптом роландической эпилепсии при ее классическом течении. У больных до возникновения эпиприступа отмечается сенсорная аура: чувство покалывания или онемения в области лица, губ, языка или глотки. После этого появляется моторный компонент в виде тонических, клонических судорог или их сочетания.
Приступы роландической эпилепсии бывают двух форм: фарингооральный и гемифациальный.
- При фарингооральном судороги возникают в мышечных группах глотки, гортани, языка и губ. Они носят односторонний характер и приводят к изменению речи, а также к повышенному слюноотделению. Во время эпиприступа ребенок может издавать неприятные звуки.
- Гемифациальный сопровождается односторонним сокращением мимической и жевательной мускулатуры.
У большинства детей приступы эпилепсии возникают перед сном или сразу после пробуждения. Специалисты считают, что это связано с особенностями работы головного мозга в ночное время. Припадки днем встречаются редко. У 15-25% детей возможно распространение судорог на руку, а у 5% — на ногу.
На фоне парциальных эпиприступов возможно развитие вторично-генерализованных судорожных припадков, которые сопровождаются тоническими и клоническими сокращениями мускулатуры всего тела и потерей сознания.
При атипичной роландической эпилепсии возникают полиморфные приступы. Они могут носить характер фокальных моторных, атонических припадков, атипичных абсансов, генерализованных судорог и эпилептического статуса.
Диагностические мероприятия

Обследование больных проводится по определенному алгоритму:
- Беседа с родителями ребенка и с самим больным, в ходе которой выясняется давность появления приступов, их характер и особенности возникновения — время появления, длительность, сохранение сознания и др. Важно установить подробности течения беременности и родов, так как органические повреждения головного мозга в эти периоды могут быть причиной вторичной эпилепсии.
- Неврологический осмотр направлен на выявление симптомов поражений центральной нервной системы. Специалист может выявить нарушения чувствительности, мышечной силы и другие симптомы, свидетельствующие о поражении структур головного мозга.
- ЭЭГ (электроэнцефалография) — «золотой стандарт» диагностики роландической эпилепсии. Больным проводится ЭЭГ-мониторинг в течение ночи или полисомнография, позволяющие выявить изменения активности отдельных участков головного мозга.
- Для исключения органических повреждений ЦНС (внутримозговых опухолей, изменений, связанных с черепно-мозговыми травмами, абсцессов, менингитов) проводится магнитно-резонансная томография.
На ЭЭГ отмечаются волны и пики острой формы, говорящие о высокоамплитудной активности. После них могут фиксироваться медленные волны. Два указанных изменения объединяются под названием «роландический комплекс», который выявляется у 80-90% больных. При повторных проведениях электроэнцефалографии картина меняется, что свойственно для данной формы эпилепсии.
Отличия от других заболеваний
При проведении дифференциальной диагностики необходимо исключить органические поражения головного мозга, ночную эпилепсию и синдром псевдо-Леннокса.
Внутримозговые опухоли, изменения при черепно-мозговых травмах, менингите и энцефалите могут привести к появлению эпилептических приступов. Для подобных заболеваний характерно наличие стойкой неврологической симптоматики (снижение мышечной силы, появление парастезий, нарушения зрения и др.). При роландической эпилепсии на ЭЭГ всегда присутствует нормальная основная активность.
У 3-7% больных возможно развитие синдрома псевдо-Леннокса. В этом случае помимо классических приступов возникают абсансы, нарушения памяти и мышления и другие симптомы, что приводит к трудностям в диагностике. При синдроме псевдо-Леннокса при проведении электроэнцефалографии возникают медленные комплексы или диффузная пиковая активность.
Ночная эпилепсия со сложными парциальными приступами — патология, сопровождающаяся схожими симптомами в ночное время. Основное отличие связано с тем, что больные теряют сознание, а на ЭЭГ имеются изменения в активности лобных отделов головного мозга.
Интерпретировать результаты проводимых исследований должен только врач. Попытки самостоятельной постановки диагноза, а также изменение назначенного специалистом лечения может стать причиной прогрессирования патологии или развития побочных эффектов от применения медикаментов.
Подходы к лечению

Однозначного ответа о том, лечить или нет роландическую эпилепсию нет. Патология является доброкачественной и проходит самостоятельно без использования каких-либо медикаментозных средств. Исходя из этого, ряд специалистов отказывается от назначения противоэпилептических препаратов.
Большая часть неврологов считает, что использование лекарственных средств все же необходимо. У больных есть риск развития атипичной фокальной эпилепсии, характеризующейся частыми приступами без тенденции к самостоятельному выздоровлению. Кроме того, под диагнозом роландических эпиприступов могут скрываться другие типы эпилепсии в случае неправильной диагностики. В отсутствии противоэпилептических препаратов, данные патологии способны быстро прогрессировать.
В лечении используют медикаменты на основе вальпроевой кислоты — Депакин, Энкорат хроно и др. Их применяют в виде монотерапии, т. е. не комбинируют с другими средствами. Если вальпроевая кислота не эффективна, то ее заменяют на Леветирацетам. При возрасте ребенка старше 7 лет возможно использование Карбамазепина.
Помимо указанных лекарственных препаратов, специалисты не рекомендуют использовать другие медикаменты с противосудорожной активностью или обладающие психостимулирующим действием. Это может стать причиной развития побочных эффектов, затрудняющих терапию заболевания.
Современные научные исследования показывают, что большое значение в профилактике эпилепсии имеет питание. Положительный эффект наблюдается при переходе на кетогенную диету. Рацион подбирается индивидуально, в зависимости от возраста ребенка, его веса, а также уровня физической и интеллектуальной нагрузки в течение дня. Питание при кетодиете основывается на повышенном потреблении жиров, которые в организме трансформируются в кетоновые тела, улучшающие работу головного мозга. Следует отметить, что во время перехода на диету необходимо постоянно находится под присмотром врача. При этом больному ежедневно определяют уровень кетоновых тел в крови, оценивая эффективность диеты.
Правила первой помощи
Эпилептические приступы у детей возникают в вечернее или утреннее время, так как связаны со сном. Родителям необходимо знать, как оказать первую помощь.
При появлении признаков ауры – слабости, ощущение больным неприятного запаха, его следует уложить на мягкую кровать. Это позволяет предупредить травмы при развитии вторично-генерализованного приступа.
Во время эпиприпадка маленького ребенка нужно приподнять, крепко удерживая его за тело и голову. Это необходимо для предупреждения развития травм в результате ударов о твердые предметы: стену, элементы мебели и др. Ни в коем случае не стоит пытаться удержать больного крепко, сжав ноги и руки. В этом случае имеется риск травматизации мышц и связочного аппарата.
Вызвать скорую медицинскую помощь нужно в том случае, когда приступ носит генерализованный характер и сопровождается потерей сознания.
Предупреждение заболевания

Первичная профилактика патологии отсутствует.
Для профилактики судорожных приступов выделяют ряд рекомендаций:
- Обеспечить ребенку постоянный режим дня с достаточным временем на отдых. Одна из причин развития эпиприпадка — нарушение сна в виде его малой продолжительности.
- Спать больной должен в общей с родителями комнате, так как его нежелательно оставлять одного. Если это невозможно, следует использовать радионяню. Родители, находящиеся рядом с ребенком, могут своевременно заметить ауру и оказать необходимую первую помощь.
- За 1-2 часа до сна необходимо исключить игры за компьютером, смартфоном, а также любую нагрузку, стимулирующую работу головного мозга. Кроме того, не следует плотно кормить детей перед сном.
Прогноз
Прогноз при роландической эпилепсии благоприятный. В возрасте 15 лет у 90% больных наблюдается полное выздоровление без каких-либо остаточных симптомов. У 1-3% подростков эпизодические эпилептические приступы сохраняются, однако, их число не увеличивается.
Неблагоприятный прогноз с прогрессированием патологии возможен в тех случаях, когда первые эпизоды болезни возникают до 4 или после 10 лет жизни. При этом у детей имеется склонность к вторично-генерализованным эпиприпадкам, сопровождающимися потерей сознания. Эффективность медикаментов при этом снижена.
Рецидивы возможны спустя несколько лет бессимптомного периода. Если заболевание сохраняется во взрослом возрасте, то приступы носят единичный характер. Больной может не придавать им значение, так как они возникают в ночное время и могут оставаться незамеченными.
Медицинское наблюдение и применение противоэпилептических средств позволяет предупредить прогрессирование болезни и развитие осложнений. При первых симптомах эпилепсии следует обращаться за профессиональной медицинской помощью к врачу.
Статья по теме: Эпилепсия у детей
Роландическая эпилепсия: дорокачественого вида болезни
Роландическая эпилепсия – заболевание, характерное для детского возраста. Оно относится к доброкачественным видам и не наносит критического урона здоровью. Но иногда приступы бывают довольно тяжелыми, потому не исключается получение травм. В любом случае припадки нарушают повседневную жизнь ребенка.
Особенности болезни
Роландический тип входит в категорию фокальных эпилепсий. Его название означает, что проблемный участок расположен в роландовой борозде мозга. Поэтому очаг припадков сконцентрирован в нейронах височных областей. По МКБ заболевание имеет код G40.
Такая эпилепсия считается самой распространенной из всех доброкачественных, которые могут возникать у детей. На нее приходится примерно 15% случаев подобных болезней в возрасте до 15 лет и более 20% от любых проявлений судорожных припадков. В большинстве случаев начальные симптомы эпилепсии появляются в возрасте от 4 до 10 лет, а пик симптоматики сосредоточен на периоде между 7 и 9 годами жизни. Иногда болезнь впервые проявляется у 2-3 летних детей или подростков, возраст которых не превышает 11-12 лет. Сталкиваются с роландической эпилепсией чаще мальчики – соотношение по частоте заболевания с девочками составляет 6 к 4.
Зачастую болезни на ранних этапах предшествуют легкие судороги у новорожденных в возрасте до 18 месяцев. Также могут наблюдаться фебрильные приступы у детей до 2 лет, которые позже переформируются в эпилепсию. Взрослые с таким заболеванием не сталкиваются никогда.
Из 100 тысяч детей с такой эпилепсией хотя бы раз сталкивался 21 ребенок.
Точных первопричин возникновения этой патологии до сих пор выявить не удалось. Предполагается, что большую роль может играть наследственность. Если от эпилепсии страдает мама или папа, то риск ее появления у ребенка значительно возрастает. Основной причиной, к которой склоняются ученые, стали дефекты генов. Исследования показали, что болезнь развивается при нарушениях на этапе формирования головного мозга. Также ее появление отчасти обусловлено ростом возбудимости отдельных нейронов. Это связывают с увеличением нейромедиаторов, падением уровня ГАМК и повышением количества возбуждающих возвратных синапсов.

Главным проявлением доброкачественной эпилепсии у детей стали судорожные припадки. По их особенностям заболевание классифицируют на несколько видов:
- простые припадки – кратковременные подергивания или судороги с левой или правой стороны лица, сопровождаемые онемением, а также потерей контроля над мышцами губ, языка, гортани и глотки;
- сложные парциальные припадки – судороги одной или нескольких мышц лица с непрерывным напряжением языка или глотки, часто сочетающиеся с нарушением речи и повышенным слюноотделением;
- вторично-генерализованные припадки – обычные судороги с задействованием мышц на лице, онемением и обездвиживанием, перерастающие в генерализованный судорожный припадок.
Возможен атипичный тип эпилепсии в сочетании с роландическим. Он классифицируется на: ночные припадки, миоклонические и астатические приступы, атонические судороги и атипичные абсансы. В некоторых случаях такая эпилепсия возникает вне роландического типа, но имеет сходство с ним.
Судороги могут быть частью идиопатических приступов. В таком случае эпилепсия не относится к роландической и может сопровождаться множеством других симптомов, включая длительную потерю сознания и остановку дыхания. Очень важно дифференцировать эти два типа болезни, чтобы получить правильное лечение.
Симптомы
Заболевание всегда начинается с проявления простых и парциальных припадков. Они случаются в любое время суток, но чаще всего ночью, когда ребенок уже спит или начинает просыпаться. Очень часто после такого сна появляются необычные ощущения на коже и слизистых.
Первичные симптомы:
- судороги на одной части лица;
- чувства онемения или покалывания во рту;
- нарушения речевой функции;
- увеличенное слюноотделение;
- закатывание глазных яблок;
- подергивание ресниц;
- рвота по завершении приступа.
Позднее, если болезнь не была выявлена на первых этапах, приступы перерастают во вторично-генерализованные и становятся более тяжелыми. Изначально они затрагивают только лицевые мышцы, но через несколько секунд или минут также вызывают судороги вообще по всему телу. Возможны спазмы туловища на небольшие периоды или возникновение ступора. Когда приступ заканчивается, ребенок теряет ориентацию в пространстве и времени.

Припадок обычно длится от нескольких секунд до трех минут. Парциальные могут проявляться с большой частотой – до нескольких десятков или даже сотен за один день. Вторично-генерализованные же обычно беспокоят ребенка до нескольких раз в месяц. С взрослением частота снижается до пары раз за год.
Незадолго до проявления симптомов роландической эпилепсии у детей может появиться необычная аура. Их кожа начнет неметь, появится ощущение покалывания, некоторым кажется, что их пощипывают за десны, язык или глотку. Многие дети, страдающие от такой эпилепсии, также регулярно сталкиваются с приступами мигрени, которые порой предшествуют припадку.
Если пароксизмы появляются в младенчестве, то они могут быть несколько иными. Первый раз эпилепсия у новорожденных обычно возникает вследствие повышения температуры тела или сильного испуга, хотя это и не становится первопричиной болезни. Зачастую у малышей припадки не так заметны и маскируются под другие патологии. Тем не менее, врачам удалось выявить основные признаки заболевания в таком возрасте.
Как распознать эпилепсию у младенца:
- хаотичные подергивания конечностей;
- быстрые сокращения мышц на одной стороне лица с переходом в руку или ногу;
- кратковременные зависания взгляда или тела;
- повороты головы с отведением руки в ту же сторону.
Некоторые малыши могут периодически вздрагивать, при этом их руки будут сильно дрожать. Возможны беспричинные вскрикивания. При появлении подобной симптоматики нужно сразу обратиться к доктору.
Потеря сознания во время приступа наблюдается только в 30% случаев и носит разовый характер.
Прогнозы и лечение
Эпилепсия роландического типа относится к категории излечимых заболеваний. В большинстве случаев прогнозы крайне благоприятны, а вылечиваться удается за несколько месяцев. Но даже при отсутствии какой-либо терапии болезнь постепенно уходит сама. С взрослением частота приступов будет сокращаться, пока они не исчезнут полностью. Обычно припадки прекращаются к 12-13 годам. Иногда симптомы могут сохраняться дольше, но к совершеннолетию все равно исчезают. При прекращении приступов в раннем возрасте нельзя рассчитывать на то, что они уже никогда не повторятся. Известны случаи, когда эпилепсия начинала проявляться вновь спустя 4 года после нормализации состояния. Повлиять на это может ранее и позднее развитие болезни – когда ребенку 4 года или 9 лет.
Важной особенностью заболевания считается отсутствие осложнений. При любых припадках ребенок не получает серьезного вреда здоровью. Его головной мозг и нервная система остаются полностью здоровыми, а интеллектуальные способности не снижаются. Единственной опасностью можно назвать сами припадки, которые порой вызывают сильный испуг у малышей и могут привести к случайному получению травм.

Несмотря на то, что заболевание уходит само со временем, лечение доброкачественной роландической эпилепсии все же необходимо. Перед этим ее нужно не только выявить, что бывает затруднительно из-за преимущественно ночных проявлений, но и подтвердить на обследовании. Главным инструментом для этого становится ЭЭГ.
Обследование помогает зарегистрировать активность головного мозга, определив наличие нарушений. При проведении диагностики болезнь обычно подтверждается выявлением повышенной активности в височных зонах, которая чередуется с затихающими волнами. Иногда отмечается наличие паттернов в темпоральных или затылочных отведениях. Также характерной чертой болезни считается вероятность обнаружения повышенной активности на стороне, которая противоположна той, где проявляются припадки. Дополнительно пациенту могут назначить МРТ, КТ или ПСГ.
Некоторые врачи настаивают на том, что необходимости лечить такую эпилепсию нет. Но делать это все же нужно, так как иначе есть риск ее перерастания в другую форму заболевания, хотя прямых доказательств этого до сих пор представлено не было. Для лечения врач назначает только один вид препаратов с минимальной дозировкой. Чаще всего выписывают таблетки на основе вальпроевой кислоты. К ним относятся «Конвулекс» и «Конвульсофин». Если они не дают нужного эффекта, то вместо них назначают «Топирамат» или «Кеппра».
Детям старше семи лет предпочтителен препарат «Фенитоин», который порой заменяется усиленным средством «Карбамазепин». Чаще всего сроки терапии не превышают двухлетнего периода, чтобы не нанести вреда здоровью ребенка. Но при раннем дебюте болезни она может быть растянута до 5-10 лет. Прием лекарств отменяется сразу с прекращением припадков. Это касается даже тех случаев, когда на электроэнцефалографии показана повышенная эпилептическая активность.
Первая помощь и профилактика
При проявлении простых припадков, которые не сопровождаются серьезными симптомами, никаких специальных действий от родителей не требуется. Они проходят без постороннего вмешательства в кратчайшие сроки. Но при более сложных проявлениях все же следует оказать малышу помощь, так как он может легко травмироваться. Известны случаи, когда происходило западение языка, что могло привести к летальному исходу.
Как действовать во время приступа доброкачественной формы эпилепсии:
- Уложить ребенка в горизонтальное положение на твердую поверхность.
- Освободить шею и талию от стесняющей движения и дыхание одежды.
- Убрать все ближайшие предметы, которыми ребенок может травмироваться.
- Постараться успокоить ребенка, исключить панику и хаотичные движения.
- Голову повернуть вбок, чтобы предотвратить западание языка и дать выход для слюны.
- Удерживать ребенка на боку, если у него начнется внезапная рвота.
- Оставаться рядом до тех пор, пока приступ не закончится.
Если у ребенка начался генерализированный приступ, нужно сразу же вызывать скорую, параллельно оказывая первую помощь. Во время конвульсий запрещено использовать посторонние предметы для сохранения открытого положения полости рта. Также нельзя давать никаких таблеток, так как ребенок не сможет их проглотить, а действие все равно наступает спустя полчаса-час. Также нельзя трогать больного после завершения приступа. Он должен поспать, если этого захочет.
Особое внимание к детям, страдающим от эпилепсии, следует проявлять во время их купания в ванне или водоеме.
Избежать развития роландической эпилепсии или предотвратить ее повторное появление можно с помощью профилактических мер. Важнейшей из них считается режим дня. Очень важно следить, чтобы малыш не засиживался допоздна и качественно спал. Он должен ложиться не позднее 23 часов, а продолжительность сна при этом не может быть менее 8-9 часов. Желательно, давать ему возможность немного поспать днем. Во время сна комната ребенка должна быть наполнена тишиной, покоем и темнотой. Это очень важно для отдыха и восстановления нервной системы.

Второй составляющей профилактики считается кетогенная диета. Она назначается только врачом и применяется далеко не для всех детей. Такой режим питания отличается преобладанием количества жиров и сокращением уровня углеводов. Перед применением диеты малыша могут проверить на ее переносимость в условиях стационара, после чего ее потребуется соблюдать дома.
Также к профилактике будущей эпилепсии относят образ жизни мамы в период беременности. Она должна полностью отказаться от алкоголя, курения, а также вредной пищи. Запрещено заниматься любой деятельностью, которая хотя бы немного связана с токсичностью. При этом женщина должна соблюдать правильный режим дня, хорошо питаться и умеренно нагружать себя физически.
Детская доброкачественная эпилепсия совсем не страшна. Она не вызывает никаких осложнений и полностью проходит самостоятельно без какого-либо вмешательства. Тем не менее, для ускоренного избавления от ее симптомов все же рекомендуется посетить врача и заняться лечением своего ребенка. Также не стоит забывать о профилактике повторных приступов, которая имеет большое значение для восстановления нервной системы.
Доброкачественная детская эпилепсия (роландическая эпилепсия)
Русский Медицинский Сервер / Лечение эпилепсии / Доброкачественная детская эпилепсия (роландическая эпилепсия)
Доброкачественная детская эпилепсия — одна из форм эпилепсии. Характерной особенностью этой формы болезни является то, что судороги затрагивают лицо и иногда тело. Другое название этого вида эпилепсии — доброкачественная эпилепсия с центрально-височными пиками. Термин «доброкачественная» в названии заболевания указывает на благоприятный прогноз течения этой формы эпилепсии, так как у большинства пациентов заболевание проходит подростковом возрасте.
Термин «роландическая» в названии этой болезни указывает на то, что эпилептический очаг возникает в роландовой области головного мозга. Подобные приступы относятся к парциальным, так как их природа связана только с данной областью головного мозга.
Кто страдает доброкачественной роландической эпилепсией?
Доброкачественная роландическая эпилепсия встречается у 15% детей, страдающих эпилепсией. В среднем, первые приступы роландической эпилепсии встречаются в возрасте от 6 до 8 лет. У взрослых данная форма эпилепсии не встречается.
Какова причина доброкачественной роландической эпилепсии?
Причины возникновения роландической эпилепсии неизвестны. У детей, чьи близкие родственники страдают эпилепсией, риск развития роландической эпилепсии чуть выше.
Проявления доброкачественной роландической эпилепсии
Как и все формы эпилепсии, для доброкачественной роландической эпилепсии характерны приступы. Обычно они носят умеренный характер. Чаще всего при этом затрагивается лицо:
- Подергивание лица или щеки
- Покалывание или необычные ощущения в области лица или языка
- Затруднение речи
- Слюнотечение ввиду нарушения контроля мышц рта
Примерно у каждого второго ребенка с доброкачественной роландической эпилепсией патологический очаг с роландической области переходит на остальные области мозга. В таком случае говорят о вторично генерализованных приступах. Они также называются тонико-клоническими. Проявление этих судорог следующее:
- Пациент застывает, не отвечает на вопросы
- Сжимание мышц всего тела на короткий период
- Ритмические судороги всего тела
- Спутанность и дезориентация после того, как сознание вернулось
Обычно при доброкачественной роландической эпилепсии приступы начинаются во время сна. Поэтому они могут оставаться незамеченными другими. Часто родители узнают о приступе эпилепсии из-за ночного шума в комнате ребенка.
У некоторых детей с доброкачественной роландической эпилепсией могут также отмечаться затруднения в обучаемости и нарушения в поведении. Таким детям требуется дополнительное внимание и лечение. Однако, в большинстве случаев дети хорошо справляются со школьными заданиями.
Диагностика доброкачественной роландической эпилепсии
При легкой степени проявлений приступов, и если они появляются только в ночное время, диагноз доброкачественной роландической эпилепсии может быть легко нераспознан. Зачастую родители приводят ребенка к врачу после тонико-клонических судорог во время сна.
Диагностика доброкачественной роландической эпилепсии основана на типе приступов. Также применяются инструментальные методы исследований: ЭЭГ, МРТ, неврологические тесты.
Лечение доброкачественной роландической эпилепсии
Зачастую при доброкачественной роландической эпилепсии не требуется никакого лечения. Приступы при этой форме болезни обычно легкие и нечастые. Фактически, ребенок может сам вырасти из болезни.
Лечение может назначаться в случае, если доброкачественная роландическая эпилепсия сопровождается затруднением учебы в школе, нарушениями мышления или внимания, поведенческими расстройствами, дневными приступами или частыми судорогами. Лечение обычно медикаментозное.
Чаще всего приступы данной формы эпилепсии контролируются такими противоэпилептическими препаратами, как карбамазепин, ламотриджин или вальпроат натрия. Их принимают ежедневно, а курс лечения длится в среднем два года.
+7 (925) 50 254 50 – Лечение эпилепсии
ЗАПРОС в КЛИНИКУ