причины, симптомы, диагностика и лечение
Лимфатические узлы в организме человека выполняют роль биологического и механического фильтра. Лимфа собирает вредные вещества и бактерии, которые после уничтожаются лимфоузлами. Их в организме насчитывается около 500. Рак лимфоузлов – достаточно редкое заболевание, которое занимает 4% от всех видов онкологии. Оно развивается в виде самостоятельной патологии или при распространении метастазов от опухоли другой локализации.
Классификация рака лимфоузлов
При наличии в организме какого-либо воспалительного или инфекционного процесса лимфатические узлы реагируют на него увеличением, а иногда даже болезненностью. Если такое состояние не проходит длительное время, то это повод обратиться к врачу, поскольку патологию важно обнаружить на ранней стадии.
Рак лимфоузлов может развиваться в одной из двух форм:
- лимфома Ходжкина (лимфогранулематоз). Наиболее распространенный вариант развития рака лимфатических узлов, встречается в 1/3 случаев обнаружения подобной онкологии как у взрослых, так и у детей.

- неходжкинская лимфома. Это более серьезная форма рака лимфоузлов, встречаемая в 2/3 случаев. Болезнь быстро прогрессирует, рано появляются метастазы, которые распространяются по всему организму.
Причины возникновения и факторы риска
Рак лимфоузлов имеет несколько возрастных пиков, в которые болезнь диагностируют чаще. Это период с 15 до 30 лет, еще в группу риска попадают люди старше 50 лет. Именно в это время риск развития лимфомы выше. Точные причины появления заболевания неизвестны. Врачи приводят лишь факторы риска, увеличивающие вероятность развития лимфомы:
- длительное взаимодействие с вредными веществами;
- ВИЧ-инфекция и прочие виды иммунодефицита;
- курение и злоупотребление алкоголем;
- радиационное облучение;
- проживание в условиях неблагоприятной экологии;
- беременность в возрасте старше 35 лет;
- вирус Эпштейна-Бара;
- генетическая наследственность.

Стадии
Лимфомы разного вида могут иметь разную степень распространения по организму. С учетом этого выделяют 4 стадии рака лимфоузлов.
- Первая. Поражена только одна область, развивается рак лимфоузлов подмышкой, в области шеи и пр.
- Вторая. Опухолевый процесс распространяется уже на 2 и более групп лимфатических узлов.
- Третья. Кроме лимфоузлов оказываются поражены диафрагма и один орган вне лимфатической системы.
- Четвертая. На последней стадии поражаются ткани вне лимфатической системы, причем сразу в нескольких частях организма. Болезнь захватывает жизненно важные органы, поэтому лечение становится менее результативным.
Виды рака лимфоузлов
Кроме разделения по типу лимфомы, рак лимфоузлов имеет классификацию по месту локализации поражения. По этому критерию выделяют онкологию разных типов лимфатических узлов:
- подмышечных;
- шейных;
- легочных;
- подвздошных;
- надключичных;
- паховых.

В процентном соотношении чаще всего возникает рак лимфоузлов в пазовой области (35%), далее – на шее (31%) и подмышками (28%). На прочие локализации онкологии приходится 6%. Наиболее благоприятный прогноз наблюдается при раке узлов в паху, подмышечных впадинах и под челюстью.
Симптомы и признаки рака лимфоузлов
Рак лимфоузлов может проявляться по-разному в зависимости от формы заболевания, которая развивается у пациента. При лимфогранулематозе наблюдаются следующие симптомы:
- сильное увеличение лимфатических узлов над ключицей и в области шеи;
- увеличение узлов средостения со специфическим кашлем, одышкой и набуханием вен в области шеи;
- болезненные ощущения в области поясницы, чаще всего проявляющиеся в ночное время.
Болезнь вызывает разные симптомы при поражении конкретной группы лимфатических узлов. Если патология развивается в острой форме, то у пациента сразу возникают увеличенная степень потливости и резкое повышение температуры тела.
- лихорадочное состояние;
- сильный зуд кожи;
- слабость;
- очаги красного или темного оттенка на коже;
- диарея, склонность к отрыжке;
- частые мигрени, головокружение;
- болезненность в области эпигастрия и пупка.
Когда следует обратиться к врачу
Рак лимфоузлов требует своевременного обнаружения на самой ранней стадии, поскольку от этого зависит прогноз выздоровления. При наличии факторов риска или симптомов заболевания необходимо немедленно обратиться к врачу для проведения соответствующих диагностических мероприятий. В случае с онкологией лимфатической системы пациенту требуется помощь онколога. В нашем онкоцентре «София» на 2-м Тверском-Ямском пер. дом 10 работают лучшие специалисты, которые специализируются на диагностике и лечении онкологии разного типа.
Диагностика рака узлов в онкоцентре
При подозрении на рак лимфоузлов врач начинает с общего осмотра для обнаружения характерных признаков заболевания. Очень важно ответить на все вопросы специалиста, поскольку любые жалобы и проявления, а также перенесенные ранее заболевания могут дать врачу необходимую информационную базу для назначения успешного лечения в дальнейшем.
Важный этап осмотра – пальпация лимфатических узлов, что позволяет выявить их увеличение и болезненность. Также в онкоцентре «София» практикуются все современные методы диагностики, позволяющие с точностью 100% выявить заболевание. Пациенту могут быт назначены:
- сцинтиграфия;
- ПЭТ/КТ;
- магнитно-резонансная томография;
- лимфография;
- анализ крови на онокмаркеры;
- вакуумно-аспирационная биопсия тканей новообразования;
- ОФЭКТ (однофотонная эмиссионная компьютерная томография).

Лечение рака лимфоузлов
Схема лечения при лимфоме зависит от множества факторов: локализации опухоли, ее распространения по организму, размеров и наличия метастазов в других тканях и органах. Наилучшие результаты дает комплексный подход, при котором сочетают несколько способов лечения.
Химиотерапия
Метастазы лимфоузлов при раке требуют обязательного проведения химиотерапии. Она считается универсальным методом лечения и используется как самостоятельно, так и в сочетании с другими способами. Суть химиотерапии – внутривенное введение специальных противоопухолевых препаратов, которые уничтожают раковые клетки. Такие лекарства действуют и на здоровые ткани, что ведет к появлению побочных эффектов, но при распространении метастазов это единственный способ лечения.
Хирургия
Лечение рака лимфоузлов хирургическим методом заключается в их полном удалении. Такой способ также считается достаточно эффективным, поскольку позволяет минимизировать риск рецидива заболевания. Операция при раке лимфоузлов проводится с резекцией нескольких узлов регионального типа, что необходимо для уменьшения вероятности повторной онкологии.
Операция при раке лимфоузлов проводится с резекцией нескольких узлов регионального типа, что необходимо для уменьшения вероятности повторной онкологии.
Шейные, подчелюстные, паховые и подмышечные лимфоузлы удаляют под местной анестезией, а более глубокие – под общим наркозом. Иссеченные части могут использоваться для проведения гистологии и постановки правильного диагноза.
Лучевая терапия
Применение лучевой терапии рекомендовано совместно с оперативным лечением. Данный метод позволяет уничтожить раковые клетки, которые, возможно, остались после хирургического вмешательства. Также лучевая терапия применяется на ранней стадии в качестве подготовки к операции с целью уменьшения размеров опухоли.
Пересадка костного мозга
В лечении рака лимфоузлов сегодня используется еще один новый метод – трансплантация костного мозга донора. Эта операция позволяет давать очень оптимистичные прогнозы, особенно на ранней стадии заболевания.
Прогнозы лечения
Прогноз при раке лимфоузлов достаточно благоприятный. При таком заболевании лечение оказывается крайне успешным в 70-83% случаев, в которых наблюдается 5-летняя выживаемость. Число рецидивов составляет 30-35%. Чаще заболевание рецидивирует у мужчин, что объясняется более тяжелыми условиями труда и вредными привычками. В целом прогноз зависит от того, насколько рано была диагностирована болезнь и начато лечение. Не меньшее значение имеет возраст пациента.
Как записаться к специалисту в онкоцентре «София»
Чтобы получить консультацию специалиста в нашем онкоцентре, вам нужно воспользоваться любым удобным способом записи. Заполните онлайн-форму на сайте, введя все необходимые данные, или позвоните нам по контактному номеру +7 (495) 775-73-60.
Онкоцентр «София» открыт для вас не только в будние, но и в выходные дни, поэтому вы можете выбрать удобное для себя время приема. Мы находимся на 2-м Тверском-Ямском переулке, 10, недалеко от станций метро Тверская, Новослободская, Чеховская, Белорусская и Маяковская. Заботьтесь о своем здоровье и вовремя обращайтесь к врачу, не дожидаясь ухудшения состояния.
Заботьтесь о своем здоровье и вовремя обращайтесь к врачу, не дожидаясь ухудшения состояния.
Метастазы в лимфоузлах | Прогноз, лечение
Метастазы в лимфоузлах при раке свидетельствуют о развитии злокачественного процесса до III или IV стадии. В процессе роста первичной опухоли от нее отделяются патологические клетки и попадают в лимфоток и кровеносные сосуды. В зависимости от того, лимфа или кровь стала путем распространения, это называется лимфогенным или гематогенным метастазированием. Сначала поражаются регионарные лимфоузлы — расположенные вблизи от опухоли. Позже раковые клетки могут мигрировать в отдаленные органы и, оставаясь там, провоцировать появление вторичных очагов.
Госпитализация онкологических больных. Ежедневно. Круглосуточно
Нам доверяют 9500 пациентов ежегодно.
До сих пор однозначно не выявлено, что служит спусковым крючком для агрессивного роста новообразования и его распространения на другие органы, но после появления метастазов в лимфоузлах прогноз по выживаемости заметно снижается.
На скорость роста метастатических опухолей влияют такие факторы, как разновидность, размеры, расположение первичного новообразования, возраст и состояние иммунитета больного, анамнез.
Поскольку первичные злокачественные опухоли на ранних стадиях не дают выраженной симптоматики, во многих случаях сначала диагностируется именно метастатическое поражение лимфатической системы, а уже потом определяется основной диагноз. По степени тяжести выделяют 3 стадии:
- легкая — 1–3 узла;
- средняя — 4–9;
- тяжелая — 10 и более.
Симптомы болезни:
- снижение иммунитета, частые простуды и т. д.;
- повышенная утомляемость, слабость;
- температура выше нормальной, на которую не влияют жаропонижающие средства;
- мигрени и невротические расстройства;
- увеличение лимфатических узлов в размерах, их болезненность.
Наш эксперт в этой сфере:
Иванов Антон Александрович
Медицинский директор, врач онколог-хирург, к. м.н
м.н
Связь лимфотока и локализации вторичных новообразований
На метастазирование влияет ход тока лимфы. Например, метастазы в лимфоузлах от опухолей легких и молочной железы — это в основном зона над ключицей, от крестца, ног и наружных половых органов — в паховой области. При опухолях языка, глотки, гортани, щитовидной железы обычно развиваются метастазы в лимфоузлах шеи. Однако на IV стадии это правило не работает, поскольку раковые клетки уже распространились по всему организму — новые раковые образования могут разрастаться в любом органе.
Учитывая интенсивность лимфотока в различных органах, метастазы в лимфоузлах чаще всего приводят к поражениям печени, легких, надпочечников. Подобные локализации свидетельствуют о терминальной стадии рака, в том время как регионарные лимфатические узлы могут поражаться и на третьей, когда шансы на восстановление выше.
Метастазы в лимфоузлах — лечение и прогнозы
Для диагностики используют МРТ, КТ, биопсию и гистологические исследования лимфы. Делать это необходимо при первых же подозрениях на диагноз, чтобы при необходимости начать лечение как можно раньше.
Отправьте документы на почту [email protected]. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, кмн
Одновременно с хирургическим удалением первичной опухоли обычно удаляют пораженные узлы. При этом делается все необходимое, чтобы раковые клетки не мигрировали в кровь. Как правило, используется и химиотерапия — препараты эффективно уничтожают агрессивные клетки или препятствуют их дальнейшему делению. Радиотерапия применяется реже, но позволяет уничтожить фрагменты опухолей, локализация которых хорошо определяется.
В каждом случае используемые методы определяются индивидуально. Клиника НАКФФ обладает всеми ресурсами, чтобы по возможности быстро и эффективно провести диагностические и лечебные мероприятия, организовать реабилитацию после лечения или оказать паллиативную помощь.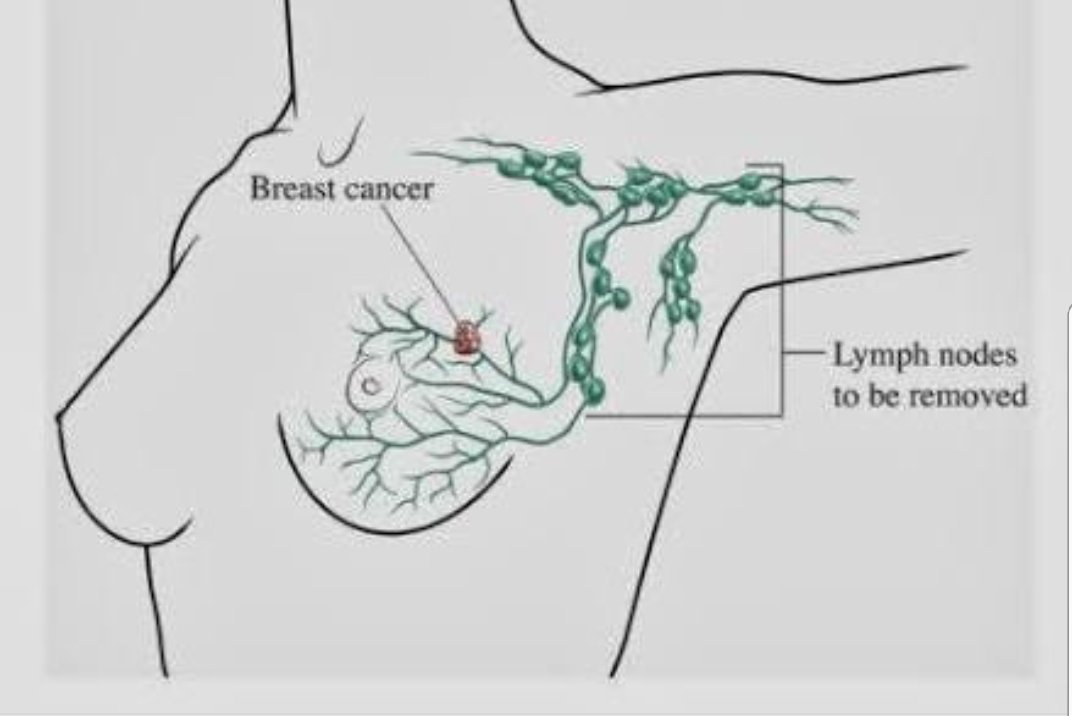 Запишитесь на первичную консультацию по телефону +7 (495) 259-44-44.
Запишитесь на первичную консультацию по телефону +7 (495) 259-44-44.
Первые симптомы и прогноз с метастазами
Рак в лимфатических узлах появляется 2 способами.
- Начинает расти в лимфатическом узле – это лимфома.
- Попадает в лимфатические узлы из опухоли других органов и образует метастазы.
Чаще лимфатические узлы поражаются метастазами. Именно такое, вторичное поражение лимфоузлов рассмотрим в этой статье.
- Что такое лимфатические узлы
- Почему увеличиваются лимфатические узлы
- Как рак распространяется по лимфатическим узлам
- Как обнаруживают метастазы в лимфатических узлах
- В лимфоузлах нашли раковые клетки – что это значит
- Как меняется стадия рака при обнаружении метастазов в лимфоузлах
- Эффект от удаления лимфатических узлов
Что такое лимфатические узлы
Вместе с кровеносной системой в нашем теле есть лимфатическая система. Она состоит из лимфы, лимфатических капилляров, сосудов и лимфатических узлов.
Она состоит из лимфы, лимфатических капилляров, сосудов и лимфатических узлов.
Лимфа выходит из сосудов и омывает клетки организма, с ее помощью кислород и питательные вещества поступают в клетки, а углекислый газ и продукты метаболизма – покидают клетки. Также в лимфе содержится много лейкоцитов, которые необходимы для борьбы с инфекциями. При воспалении лимфатическая жидкость может накапливаться в тканях, вызывая отек.
Лимфатическая система человекаЛимфа по лимфатическим капиллярам, затем сосудам попадает в лимфатические узлы. Они представляют собой скопления клеток разного размера, которые фильтруют вредные вещества, поступающие из лимфы. В них находится большое количество лейкоцитов и других иммунных клеток, которые атакуют вредоносные объекты, уничтожая их.
Почему увеличиваются лимфатические узлы
Любой патологический процесс в организме: инфекция, травма или рак вызывает увеличение и воспаление лимфатических узлов.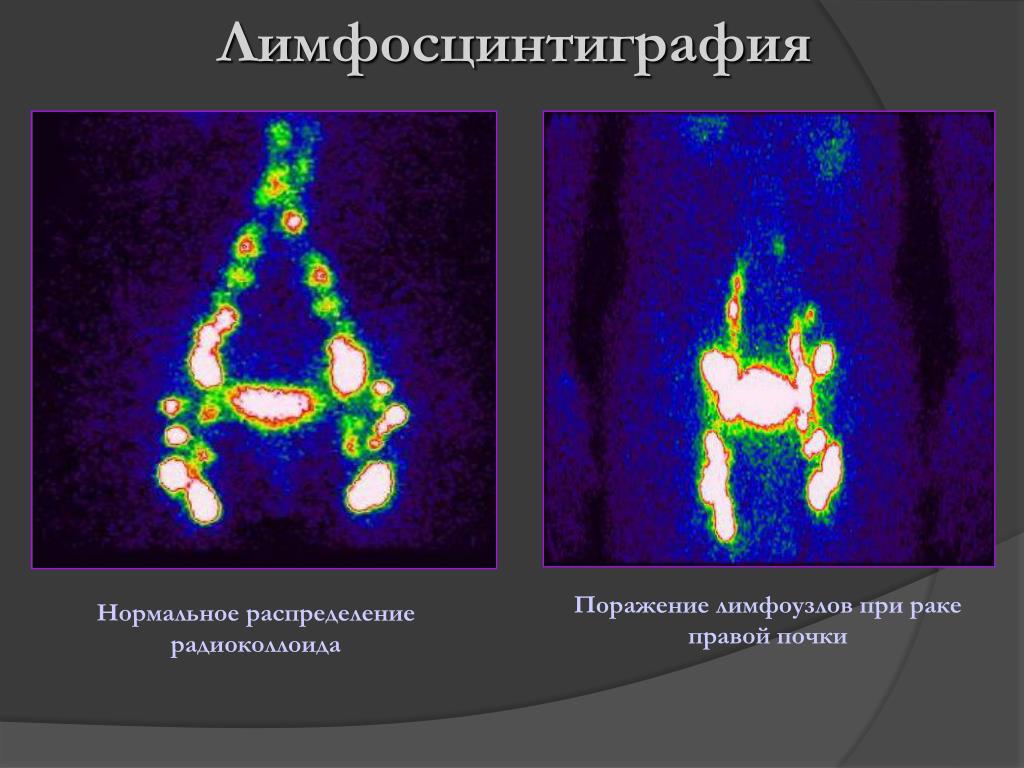 Это связано с их активной работой, лимфатические клетки уничтожают поступающие патологические объекты.
Это связано с их активной работой, лимфатические клетки уничтожают поступающие патологические объекты.
Увеличение лимфатических узлов называется лимфоаденопатией.
Лимфоаденопатия сигнализирует о патологическом процессе в организме, а сопутствующие синдромы помогают определить где он находится.
Например, боль в ушах, температура и увеличение заушных лимфатических узлов указывают на воспаление уха.
Как рак распространяется по лимфатическим узлам
По мере роста опухоли раковые клетки распространяются по организму образуя метастазы.
Не все опухоли образуют метастазы. Для образования метастаза нужно чтобы опухоль, выработала клетки которые могут оторваться от первичного новообразования. Затем эти клетки должны попасть в кровеносный или лимфатический сосуд, закрепиться на новом месте и начать размножаться. Только тогда образуется метастаз.
Только тогда образуется метастаз.
Обычно по мере роста опухоли, воспаляются и увеличиваются близкие лимфатические узлы. Эти лимфатические узлы отфильтровывают и уничтожают раковые клетки, которые попадают в них с током лимфы, из-за чего и возникает воспаление.
Как обнаруживают метастазы в лимфатических узлах
В норме лимфатические узлы маленького размера, их не видно при осмотре и они не пальпируются. Но если в организме есть инфекция или новообразование, то лимфатические узлы могут увеличиться. Подкожные лимфатические узлы иногда увеличиваются до такой степени, что их можно прощупать при пальпации или даже увидеть при осмотре.
Если в лимфатический узел попали раковых клетки недавно, то он может визуально не увеличиваться в размерах. В этом случае требуется дополнительные обследования.
Для оценки состояния лимфатических узлов, берут образцы клеток на гистологическое исследование. Образцы клеток берут специальной иглой – проводится биопсия узла.
Образцы клеток берут специальной иглой – проводится биопсия узла.
Гистологическое исследование взятой при биопсии ткани проводит патологоанатом. Под микроскопом раковые клетки из лимфатических узлов, выглядят также, как клетки из первичной раковой опухоли.
Например, при распространении опухоли молочной железы на лимфатические узлы, клетки, взятые из узлов выглядят как клетки опухоли молочной железы.
Составляется подробный отчет с описанием клеток и места их обнаружения. Если в образце были обнаружены раковые клетки, в отчете описывается их вид и количество.
Во время хирургической операции по удалению первичной раковой опухоли, могут удалить один или несколько лимфатических узлов, рядом с опухолью. Удаленные лимфатические узлы обязательно проверяют на наличие раковых клеток.
Распространение раковых клеток по организму и поражение далеких лимфатических узлов указывает на высокий риск рецидива рака после операции. Поражение лимфатических узлов говорит о необходимости использовать дополнительные методы лечения – химиотерапию или лучевую терапию после операции.
Также для диагностики метастазов используют УЗИ, МРТ с контрастом, КТ, ПЭТ-КТ. С их помощью определяется состояния лимфатических узлов, которые находятся глубоко в теле.
В лимфоузлах нашли раковые клетки – что это значит
При обнаружении раковых клеток в лимфоузлах оценивается их количество и степень развития опухоли. Иногда в лимфоузлах патологических клеток так мало, что они обнаруживаются только с помощью специальных тестов. В таких случаях их обнаружение никак не будет влиять на лечение и прогноз заболевания.
Если раковые клетки обнаруживаются только в близлежащих лимфатических узлах. То во время операции по удалению основной опухоли, их тоже удаляют. Они не оказывают сильного влияния на прогноз лечения и состояние больного.
То во время операции по удалению основной опухоли, их тоже удаляют. Они не оказывают сильного влияния на прогноз лечения и состояние больного.
Если в лимфоузлах обнаруживается большое количество раковых клеток, увеличение лимфоузлов видно невооруженным глазом, это может говорить о быстром росте первичной опухоли и распространении рака по организму.
При распространении рака на дальше расположенные лимфатические узлы, могут быть рекомендованы дополнительные методы лечения: химиотерапия или лучевая терапия.
Возможен рост опухоли из лимфатического узла, когда он прорастает через окружающую узел соединительную ткань (капсулу), такой рост называют экстракапсулярным расширением.
Как меняется стадия рака при обнаружении метастазов в лимфоузлах
Выбор лечения рака зависит от типа опухоли и стадии ее развития. Для определения стадии врачи используют систему TNM.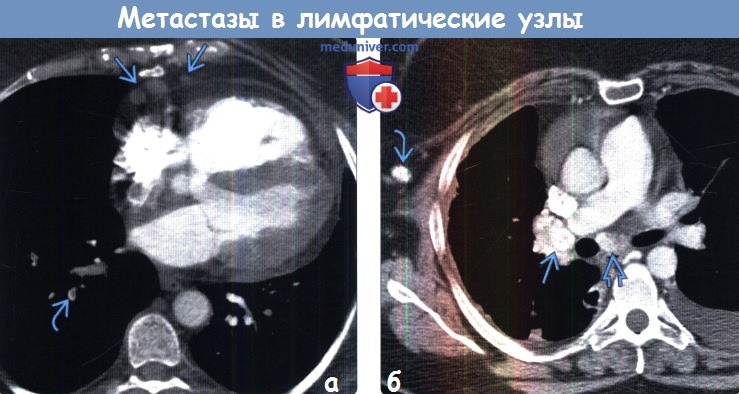
В этой системе T – обозначает размер первичной опухоли, М – наличие метастазов, а N – поражение лимфатических узлов.
N0 – означает, что в лимфатических узлах рядом с первичной опухолью, раковые клетки не обнаружены.
При обнаружении раковых клеток в ближайших или отдаленных лимфоузлах, стадию обозначают N 1,2 или 3.
Число (1,2,3) зависит от того сколько узлов поражены, насколько сильно и как далеко они расположены от основной опухоли. Для каждого типа рака классификация своя.
Чем ниже значения TNM, тем легче лечить такой рак и тем более благоприятный прогноз.
Эффект от удаления лимфатических узлов
После удаления лимфатических узлов нарушается движение лимфы. Часть лимфатической жидкости начнет поступать в другие сосуды, а часть иногда накапливаться в тканях тела. Из-за этого образуется отек или лимфедема. Чем больше удаляется лимфатических узлов, тем выше риск возникновения осложнения.
Чем больше удаляется лимфатических узлов, тем выше риск возникновения осложнения.
Статьи по теме:
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
БИОПСИЯ СИГНАЛЬНЫХ («СТОРОЖЕВЫХ») ЛИМФАТИЧЕСКИХ УЗЛОВ: МОДНОЕ УВЛЕЧЕНИЕ ИЛИ СТОЛБОВАЯ ДОРОГА ОРГАНОСОХРАНЯЮЩЕГО ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ?
В.Ф. Семиглазов, С.В. Канаев, В.В. Семиглазов, С.Г. Петровский,
В.Г. Иванов, К.Ш. Нургазиев, А.С. Арзуманов
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
ЦНИРРИ МЗ РФ, Санкт-Петербург
Существуют два основных коллектора оттока лимфы из молочной железы: подмышечно-подключичный и межреберно-парастернальный. На подмышечный путь приходится около 75% лимфооттока, на парастернальный — 20%, на оставшиеся направления — 5%. Неудивительно, что подмышечные лимфатические узлы являются нередким пристанищем для метастазов рака молочной железы (РМЖ) и, соответственно, состоянию их придается важное прогностическое значение. Подмышечно-подключичная лимфаденэктомия как необходимая процедура при хирургическом лечении РМЖ начинает свою историю со второй половины XIX века с работ Холстеда, когда ранними считались опухоли, которые мы сейчас относим к III стадии.
Благодаря достижениям маммографического скрининга (там, где он широко практикуется) и определенным успехам ранней диагностики РМЖ, объем хирургического вмешательства сузился до квадрантэктомии или даже секторальной резекции (по крайней мере, у больных с опухолями, не превышающими 3 см в диаметре). Это органосохраняющее направление онкохирургии не касалось до последних лет характера и объема хирургического вмешательства на регионарных лимфатических коллекторах метастазирования (подмышечно-подключичной и парастернальной зон).
В немалой мере изменение хирургической тактики в сторону сужения вмешательства и сохранения большей части молочной железы связано с более широким восприятием онкологами биологической системной модели РМЖ Б. Фишера и, соответственно, с отказом от механистической «центробежной» модели В. Холстеда о поэтапном распространении РМЖ.
С точки зрения Б. Фишера, вид и объем местного лечения (тип операции + лучевая терапия) не играет ведущей роли в конечном исходе скрытого системного заболевания даже при минимальном размере первичной инвазивной опухоли. Действительно, основной причиной преждевременной гибели больных РМЖ являются отдаленные метастазы опухоли, а не местный рецидив заболевания, встречающийся к тому же относительно редко (не более чем у 20% больных) даже при III стадии рака. При длительном (20-25 лет) наблюдении за пациентками после «радикального» лечения определено, что причиной смерти 70-85% больных операбельными формами РМЖ являются отдаленные метастазы опухоли.
Поэтому было бы нелогичным воспринимать только одну сторону системной модели Фишера, сократив объем удаляемых тканей молочной железы до секторальной резекции, и никак не отреагировав на целесообразность изменения тактических подходов в отношении удаления лимфатических узлов различных уровней и зон регионарного метастазирования. Получилось так, что многие онкологические учреждения приняли только часть концепции Фишера, касающуюся необходимости системного (химио-гормонального) адъювантного лечения и допустимости органосохраняющих операций, оставаясь при этом на позициях Холстеда в отношении объема и уровней удаления регионарных лимфатических узлов.
Сторонники «классического» подхода (т.е. полного удаления регионарных зон метастазирования) видят в нем не только лечебный эффект (профилактика регионарного рецидива), но и основной способ получения прогностической информации от N0 до N3, являющейся важным критерием в планировании последующей адъювантной химиотерапии, гормонотерапии и лучевого лечения.
С другой стороны, оказывается, что независимо от того, поражены ли метастазами лимфоузлы (N+) или нет (N0), выполняется одна и та же хирургическая процедура, являющаяся к тому же для многих пациенток калечащим вмешательством, явно увеличивающим число функциональных нарушений, отеков верхней конечности и т.п.
Существуют ли надежные прогностические критерии, определяющие вероятность регионарного метастазирования? Основным признаком остается размер первичной опухоли. По различным данным частота регионарных метастазов даже при минимальных опухолях (менее 1 см) колеблется от 10% до 24%. Таким образом, угроза регионарного метастазирования даже при клинически не пальпируемых лимфоузлах (N0) вполне реальна. Именно поэтому появились ряд методик более точного дооперационного и субоперационного определения состояния регионарных лимфатических узлов: прямая и непрямая лимфосцинтиграфия, цветная лимфоэхография, субоперационная сцинтиграфия с операционным радиощупом, цветная лимфография лимфозурином и другими красителями лимфоколлекторов.
Таблица 1.
Частота поражения регионарных лимфоузлов при размерах опухоли до 0,5 см и 0,6-1,0 см.
| Авторы | Число больных | Метастазы в регионарных лимфоузлах (%) |
|||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0-0,5 см | 0,6-1,0 см | ||||||||||||||||||||||||||||||||||||||||||||
| Recht & Houlihan, 1995, [32]* | 164 | 5 | 17 | ||||||||||||||||||||||||||||||||||||||||||
| (138-604)↑ | (0-11)↑ | (7-20)↑ | |||||||||||||||||||||||||||||||||||||||||||
| Cataliotti, 1995, [8] | 934 | 8.7 | 15.6 | ||||||||||||||||||||||||||||||||||||||||||
| Dowlatshahi, 1995, [12] | 241 | 0‡ | 10‡ | ||||||||||||||||||||||||||||||||||||||||||
| Metzger, 1996, [28] | 980 | 5 | 12 | ||||||||||||||||||||||||||||||||||||||||||
| Mustafa, 1997, [30] | 2185 | 11 | 17 | ||||||||||||||||||||||||||||||||||||||||||
| Visser, 1997, [39] | 915 | 5,1§ | 14,2§ | ||||||||||||||||||||||||||||||||||||||||||
| 8,7 | 24,4 | ||||||||||||||||||||||||||||||||||||||||||||
| White, 1996, [40] | 1126 | 9,8 | 19,4 | ||||||||||||||||||||||||||||||||||||||||||
| Семиглазов В.— диапазон;
‡ — верхние данные: размер опухоли измерялся на маммограммах; нижние данные: размер опухоли измерялся патологоанатомом; § — верхние данные: средние значения у постменопаузальных больных; нижние данные: средние значения у пременопаузальных больных. Существующие прогностические факторы (размер опухоли, рецепторный статус, HER2/neu) оказались ненадежными критериями определения статуса регионарных лимфоузлов. Хотя при минимальных опухолях низкой степени злокачественности, ЭР+, HER2/neu(-) вероятность метастатического поражения лимфоузлов невелика (не выше 11%), все же в каждом конкретном случае не представляется возможным исключить наличие метастазов. Неинвазивные методы диагностики метастазов в лимфоузлах (клинический, ультразвуковой, рентгенографический) характеризуются низкой специфичностью и недостаточной чувствительностью. Таким образом, с одной стороны, благодаря маммографическому скринингу резко возрастает число больных с непораженными метастазами лимфоузлами, у которых «классическое» удаление всех уровней лимфоузлов является избыточной калечащей процедурой, а с другой — нет точного неинвазивного метода определения их статуса. В этих условиях и сформировалась методология биопсии сигнальных (sentinel) лимфатических узлов. В большинстве сообщений о биопсии сигнальных лимфоузлов первой исторической датой называется 1992 г., когда Morton сообщил о методике интраоперационной окраски sentinel lymph nodes с целью определения регионарных метастазов у больных с меланомой кожи. На самом деле первое исследование сигнальных лимфоузлов было проведено за 30 лет до этого. Gould со своими коллегами в 1960 г. [17] опубликовал работу, посвященную сигнальным лимфоузлам при опухолях околоушной железы. Они доказали, что лимфатический узел в месте слияния передней и задней лицевых вен является сигнальным в отношении распространения этих опухолей в лимфоузлы шеи. Cabanas [6] применил концепцию сигнальных лимфоузлов при исследовании лимфооттока при раке полового члена у 100 пациентов и добровольцев. Сигнальный лимфоузел находился в месте пересечения поверхностной эпигастральной вены и вены saphena. Сигнальным считался первый лимфатический узел, куда попадают опухолевые клетки из зоны лимфооттока. В настоящее время эффективность и надежность биопсии сигнальных лимфатических узлов изучается в онкологических центрах мира при солидных опухолях практически всех локализаций. До сих пор биопсия сигнальных лимфатических узлов в основном выполнялась у больных РМЖ с клинически непораженными лимфоузлами (N0), когда вероятность их фактического вовлечения не превышает 25%. Ряд исследователей (Greco, Costa) склонны вообще отказаться не только от подмышечной диссекции, но даже и от биопсии сигнальных лимфоузлов при клинически ранних РМЖ (T1N0M0). По их мнению, характер системного лечения (адъювантная химиотерапия и/или гормонотерапия) в большей степени зависит от биологических свойств первичной опухоли (степени злокачественности, уровня рецепторов стероидных гормонов [ЭР, ПР], наличия HER2/neu) и мало чем отличается при pN0 с признаками высокого риска по классификации San-Gallen consensus (2001) и при pN1. Несомненно, это крайняя позиция. Английское прилагательное «sentinel» обычно переводится как «сторожевой», подразумевая очевидно защитную роль этих лимфатических узлов на пути распространения раковых клеток по лимфатическим коллекторам. Это в известной мере соответствует основным принципам механистической «центробежной» модели РМЖ Холстеда о поэтапном распространении рака и лимфоколлекторах как «сторожевых» бастионах на этом пути. Действительно при отсутствии метастазов в sentinel lymph nodes невысока вероятность их нахождения и в остальных лимфоузлах. Но в принципе они могут быть, в том числе и в других коллекторах (парастернальном и др.). В этом смысле, на наш взгляд, более точным является другой перевод прилагательного «sentinel» — «сигнальный». Скорее это сигналы регионарного благополучия (pN0) или, наоборот, неблагополучия (pN1). Существуют два способа идентификации сигнальных лимфоузлов. При контрастно-визуальном способе рядом с опухолью вводится специальная краска — 1% раствор синего изосульфана (Lymphazurin). Происходит прокрашивание лимфоузлов, и сигнальные лимфоузлы выявляются наглядно во время хирургической операции. При изотоп-ассоциированном методе изотопный препарат (Nanocoll) вводится подкожно рядом с опухолью за день до операции. При лимфосцинтиграфии место на коже с наибольшей ?-активностью (hot spot) как проекция сигнального лимфоузла маркируется. Во время операции для облегчения обнаружения и диссекции сигнального лимфоузла используется ручной ?-детектор. С целью определения обоснованности метода всем пациентам после биопсии сигнальных лимфоузлов выполнялась стандартная подмышечная лимфаденэктомия. В процессе освоения метода надёжность биопсии сигнальных лимфоузлов значительно увеличилась. Результаты нескольких исследований приведены в таблице 2 [2, 3, 5, 15, 16, 27, 35, 38]. Таблица 2.
Окраска — инъекция специальной краски (синий изосульфан). Выводы 1. Биопсия сигнальных лимфатических узлов является ключевым направлением в поиске точных методов оценки состояния лимфатических коллекторов при основных формах злокачественных опухолей. 2. Предложенные в процессе становления метода биопсии сигнальных лимфатических узлов новые методики морфологического исследования (гистохимическая окраска для поиска кератин-положительных клеток, многоступенчатые срезы и т.п.) позволили точнее и качественнее оценивать состояние лимфатических узлов вплоть до выявления микрометастазов опухоли, не различаемых при использовании прежних рутинных методов. 3. Развитие методики биопсии сигнальных лимфоузлов направлено на повышение ее надёжности благодаря использованию молекулярных и иммуногистохимических маркеров при определении микрометастазов в сигнальных лимфоузлах. Определение различных маркеров (иммуногистохимический анализ, полимеразно-цепная реакция) осуществимо в практической деятельности при исследовании ограниченного числа срезов одного лимфоузла. Таким образом, только при точном срочном гистологическом исследовании с использованием полного набора современных методов определения метастазов в лимфоузле и при количестве исследованных срезов одного лимфоузла более 30 биопсия сигнальных лимфоузлов может быть надёжной процедурой. Внедрение более чувствительных методов морфологического анализа даст возможность с помощью биопсии сигнальных лимфоузлов определять статус аксиллярных лимфатических узлов более точно, чем стандартная подмышечная диссекция. Список литературы: 1. Семиглазов В.Ф., Нургазиев К.Ш., Арзуманов А.С. Опухоли молочной железы (лечение и профилактика). Алмата. -2001. — 344 с. 2. Albertini JJ, Cox C, Yeatman T, et al: Lymphatic mapping and sentinel node biopsy in the patient with breast cancer. // Proc Am Soc Clin Oncol.- 1995. — Vol. 14. — A.99 (abstr). 3. Albertini JJ, Lyman GH, Cox C, et al: Lymphatic mapping and sentinel node biopsy in the patient with breast cancer. // JAMA.- 1996. — Vol.276. — P. 1818-1822. 4. Baxter N, McCready D, Chapman JA, et al: Clinical behavior of untreated axillary nodes after local treatment for primary breast cancer. //Ann Surg Oncol. — 1996. — Vol.3. — P. 235-340. 5. Beitsch PD, Kirgan DM, Guenther JM, et al: Improved microstaging of axillary lymph nodes in breast cancer. // Breast Cancer Res Treat. -1994. — Vol. 32. — P. 94 (suppl. abstr) 6. Cabanas RM. An approach for the treatment of penile carcinoma. // Cancer. — 1977. — Vol. 39. — P. 456-66. 7. Cady B, Stone MD, Schuler JG, et al: The new era in breast cancer: Invasion, size, and nodal involvement dramatically decreasing as a result of mammographic screening. // Arch Surg. — 1996. -Vol. 131. — P. 301-308. 8. Cataliotti L, Distante V, Rontini M, et al: Role of axillary dissection in breast carcinoma. // Chir Ital. — 1995. — Vol. 47. — P. 23-31. 9. Chilosi M, Lestani M, Pedron S, et al: A rapid immunostaining method for frozen sections. // Biotechnic Histochem. — 1994. -Vol. 69. — P. 235-239. 10. Clarke D, Mansel R: Sentinel node biopsy in breast cancer. // Eur J Surg Oncol. — 2001. -Vol. 27. — P. 4-8. 11. De Laurentiis M, Gallo C, De Placido S, et al: A predictive index of axillary nodal involvement in operable breast cancer. // Br J Cancer. — 1996. -Vol. 73. — P. 1241-1247. 12. Dowlatshahi K, Snider HC Jr, Kim R.: Axillary node status in nonpalpable breast cancer. // Ann Surg Oncol. — 1995. — Vol. 2. — P. 424-428. 13. Fein DA, Fowble BL, Hanlon AL, et al: Identification of women with T1-T2 breast cancer at low risk of positive axillary nodes. // J Surg Oncol. — 1997. — Vol. 65 — P. 34-39. 14. Fraile M, Rull M, Julian F, et al: Sentinel node biopsy as a practical alternative to axillary lymph node dissection in breast cancer patients: An approach to its validity. // Ann Oncol. — 2000. — Vol. 11. — P. 701-705. 15. Giuliano AE, Jones RC, Brennan M, et al: Sentinel lymphadenectomy in breast cancer. // J Clin Oncol. — 1997. — Vol. 15. — P. 2345-2350. 16. Giuliano AE, Kirgan DM, Guenther JM, Morton DL: Limphatic mapping and sentinel lymphadenectomy for breast cancer. // Ann Surg. — 1994. -Vol. 220. — P. 391-401. 17. Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a «Sentinel Node» in cancer of the parotid.// Cancer. — 1960. -Vol. 13. — P. 77-78. 18. Green SE, Butler TH, Higgs MN, et al: Should axillary node dissection be performed in all women with invasive breast cancer? // Br J Cancer. — 1995. — Vol. 72. — P. 5 (suppl. 25, abstr.) 19. Haagensen C. Diseases of the Breast. Philadelphia, PA, Saunders. — 1986. 20. Halsted WS: The result of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894. // Johns Hopkins Hosp Bull. -1895. — Vol. 4 -P. 297. 21. Hladiuk M, Huchcroft S, Templ W, et al: Arm function after axillary dissection for breast cancer: A pilot study to provide parameter estimates. // J Surg Oncol. — 1992. — Vol. 50. — P. 47-52. 22. Kambiz Dowlatshahi, Tomas R Witt et al: Detection of occult micrometastases by 0.25 mm sectioning and cytokeratin staining of sentinel nodes in early breast cancer. // ASCO. — 2000. — 305. (abstr). 23. Kambouris AA: Axillary node metastases in relation to size and location of the breast cancer: Analysis of 147 patients. // Am Surg. — 1996. — Vol. 62. — P. 519-524. 24. Krag DN, Weaver DL, Alex JC, Fairbank JT: Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. // Surg Oncol. — 1993. -Vol. 2. — P. 335-339. 25. Leonard C, Chen B, Tenny C, et al: Clinical implications of axillary dissections for tubular carcinoma of the breast in a community setting. // Proc Am Soc Clin Oncol. — 1996. — Vol. 15. — A. 233. (abstr.). 26. Maunsell E, Brisson J, Deshenes L: Arm problems and psychological distress after surgery for breast cancer. // Can J Surg. — 1993.- Vol. 36. — P. 315-320. 27. Meijer S, Collet GH, Pijpers HJ, et al: Less axillary dissection necessary due to sentinel node biopsy in patients with breast carcinoma. // Ned Tijdschr Geneesk. -1996. — Vol. 140. — P. 2239-2243. 28. Metzger U, Mosseri V, Clough KB, et al: Axillary node involvement in breast carcinomas less than 3 cm in diameter. // Breast Cancer Res Treat. — 1996. — Vol. 37. — P. 42. (suppl., abstr.) 29. Morton DL, Wen D-R, Wong JH, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. // Arch Surg. — 1992.- Vol. 127. — P. 392-399. 30. Mustafa IA, Cole B, Wanebo HG, et al: The impact of histopathology on nodal metastases in minimal breast cancer. // Arch Surg. — 1997. -Vol. 132. — P. 384- 391. 31. Ravdin PM, De Laurentiis M, Vendely T, et al: Prediction of axillary lymph node status in breast cancer patients by use of prognostic indicators. // J Natl Cancer Inst. — 1994. — Vol. 86. — P. 1771-1775. 32. Recht A, Houlihan MH: Axillary lymph nodes and breast cancer: A review. // Cancer. — 1995. — Vol. 76. — P. 1491-1512. 33. Shetty MR, Reiman HM Jr: Tumor size and axillary metastasis, a correlative occurrence in 244 cases of breast cancer between 1980 and 1995. // Eur J Surg Oncol. — 1997. — Vol. 23. — P. 139-141. 34. Silverstein MJ, Gamagami P, Masetti R, et al: Results from a multidisciplinary breast center. Analysis of disease discovered. // Surg Oncol Clin North Am. — 1997. — Vol. 6. — P. 301-314. 35. Statman RD, Jones RC, Cabot MC, et al: Sentinel lymphadenectomy. A technique to eliminate axillary dissection in node-negative breast cancer. // Proc Am Soc Clin Oncol. — 1996. — Vol. 15. — A167 (abstr). 36. Turner RR, Ollila DW, Drasne DL, et al. Histopathological validation of the sentinel node hypothesis in breast cancer. // Ann Surg. — 1997. — Vol. 226. -P. 271-278. 37. Van der Veen H, Hoekstra OS, Paul MA, et al: Gamma-probe-guided sentinel node biopsy to select patients with melanoma for lymphadenectomy. // Br J Surg. — 1994. — Vol. 81.(12) — P. 1769-1770. 38. Veronesi U, Paganelli G, Galimberti V, et al: Sentinel node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph nodes. // Lancet. — 1997. — Vol. 349. — P. 1864-1867. 39. Visser TH, Haan M, Keidan R, et al: T1a and T1b breast cancer: A twelve-year experience. // Am Surg. — 1997. — Vol. 63. — P.621-626. 40. White RE, Vezeridia MP, Konstadoulakis M, et al: Therapeutic options and results for the management of minimally invasive carcinoma of the breast: Influence of axillary dissection for treatment of T1a and T1b lesions. // J Am Coll Surg. — 1996. — Vol. 183.- P. 575-582. МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯVI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯК ВОПРОСУ О ДОПОЛНЕНИЯХ К КЛАССИФИКАЦИИ ПО ТNМ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В.П. Летягин Система ТNМ для классификации злокачественных опухолей разработана Р. Denoix (Франция) в период с 1943 по 1952 гг. В 1950 г. с целью выработки критериев по клиническому определению местного распространения злокачественных новообразований Международный противораковый союз (МПРС) организовал Комитет по номенклатуре и статистике опухолей. Во время Международного конгресса радиологов (Копенгаген, 1953 г.) было принято соглашение об основных технических моментах классификации по анатомическому распространению опухолей согласно системе ТММ. В связи с этим в 1954 г. МПРС основал специальный Комитет по клинической классификации и применению статистики с целью исследований в этой области и использованию общих правил классификации для всех злокачественных опухолей любых локализаций. Уже в 1958 г. Комитет опубликовал первые рекомендации по клинической классификации рака молочной железы и гортани, которые в 1959 г. были пересмотрены, дополнены и рекомендованы для клинического использования и оценки в последующий 5-летний период. Между 1960 и 1967 гг. Комитетом опубликованы 9 брошюр с предложениями по классификации злокачественных опухолей 23 локализаций и рекомендациями по использованию этой классификации для ретроспективных и перспективных исследований в течение 5 лет. В 1968 г. эти брошюры были объединены в книгу «Livre de poche», изданную через год и переведенную на 11 языков, в том числе и на русский. Последняя классификация (5-е издание, 1997 г.) одобрена всеми национальными Комитетами ТNМ, так как только при общей классификации можно иметь «единый язык», позволяющий достоверно сравнивать результаты исследований. Основная цель Международной классификации первичного рака молочной железы заключается в определении степени распространенности опухолевого процесса с учетом локализации, степени вовлечения регионарного лимфатического аппарата и отдаленных органов и тканей. Точное знание стадии опухолевого процесса позволяет адекватно и наиболее эффективно выработать план лечебных мероприятий, оценить результаты лечения и определить индивидуальный прогноз. В настоящее время наряду с традиционными методами, исследованием опухолевых маркеров, рецепторов стероидных гормонов в опухоли, маркеров активности синтеза ДНК и т.д. внедряются эндоскопические, эндохирургические методики, позволяющие наиболее точно определить метастазы в регионарных лимфатических узлах труднодоступных областей. Прежде всего, речь идет об исследовании лимфоузлов парастернального коллектора. Топографо-анатомическое расположение загрудинной лимфатической цепочки создает объективные сложности в диагностике ее реального состояния на дооперационном этапе ведения больных. Предложенная в 1952 г. Н. Fischgold et al. методика чрезгрудинной рентгенокон-трастной флебографии, основанная на оценке деформации внутренних грудных вен при изменении парастернальных лимфатических узлов, утратила в настоящее время свою практическую значимость ввиду относительно высокого показателя ошибочных заключений (цит. по Триголосову А.В., 2001). Внедрение в клиническую практику методов радиоизотопной диагностики, основанных на избирательном накоплении радиофармпрепарата в опухолевой ткани (непрямая лимфосцинтиграфия), позволило повысить показатель идентификации поражения парастернального коллектора до 64,7% (Триголосов А.В., 2001). В последние годы получила широкое распространение рентгеновская компьютерная и магниторезонансная томография. Однако отсутствие четких диагностических критериев поражения парастернальных лимфатических узлов и относительная дороговизна не позволяют включить эти методы исследования в разряд рутинных. В последние годы развитие эндохирургической техники предоставило возможность выполнять различные операции и диагностические манипуляции при онкологических заболеваниях грудной полости и средостения с высоким радикализмом и минимальной травматичностью. Одним из таких вмешательств является видеоторакоскопическая парастернальная лимфаденэктомия как дополнение радикальной мастэктомии при раке молочной железы центральной и медиальной локализации, впервые предложенная Е.И. Сигалом в 1996 г. Эта операция заслуживает самого пристального внимания как наиболее удовлетворяющая требованиям полноты диагностики поражения парастернальных лимфатических узлов и обеспечивающая необходимый радикализм хирургического лечения, а также ввиду относительной простоты и доступности. Предметом настоящего исследования послужили 190 больных раком молочной железы всех стадий и локализаций, перенесших радикальную мастэктомию с сохранением грудных мышц и одномоментным удалением парастернального лимфатического коллектора видеоторакоскопическим способом (видеоторакоскопическую парастернальную лимфодиссекцию — ВТПЛ). Исследование проводилось на базе отделения радиохирургии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в период с 1998 по 2000 гг. Большинство женщин имело наружную локализацию опухоли — 73 больных, что составило 38,4% от общего количества пациентов. В 45 случаях (23,7%) опухоль располагалась во внутренних квадрантах, в 24 наблюдениях (12,6%) — в центральном отделе, а по границам верхних и нижних квадрантов — 39 (20,5%) и 9 (4,7%) случаев соответственно. Carcinoma in situ диагностирована у 3 больных, что составило 1,6% от всей группы наблюдения. I стадия — у 39 пациентов (20,5%), IIА стадия — у 56 (29,4%), IIБ стадия — у 43 (22,6%), IIIА — у 34 (17,9%), IIIБ — у 15 (7,9%) больных. Все больные с IIIА и IIIБ стадиями опухолевого процесса в предоперационном периоде подвергались химиолучевому лечению по общепринятой методике. При изучении гистологических препаратов выявлено, что в подавляющем большинстве случаев первичные опухолевые очаги имели строение инфильтрирующего протокового, долькового или смешанного рака. Редкие формы злокачественных новообразований молочной железы не превысили 4% от общего числа наблюдений. Для оценки эффективности удаления парастернальной лимфатической цепочки видеоторакоскопическим способом были использованы методы сцинтимаммографии с 99mТс-технетрилом в до- и послеоперационном периоде, а также прямой подсчет лимфатических узлов при морфологическом исследовании препарата парастернальной зоны. Таким образом, точность дооперационной диагностики метастазов в парастерналь-ный лимфоколлектор с помощью сцинтимаммографии с 99mТс-технетрилом составила 90,9%, что соответствует литературным данным. При гистологическом исследовании препарата парастернального лимфоколлектора у 190 больных, перенесших ВТПЛ, обнаружилось от 1 до 10 лимфатических узлов (в среднем 3,42+0,14). Средние показатели количества лимфатических узлов по межреберьям практически одинаковы как с правой, так и с левой стороны. В равной степени наблюдается достоверная тенденция к снижению вероятности обнаружения лимфоузлов в дистальном направлении (р<0,05, кроме 2 и 3 межреберных промежутков). Количественный подсчет лимфатических узлов парастернальной цепочки полностью коррелирует с данными мировой литературы, что косвенным образом доказывает, что ВТПЛ по объему удаляемых тканей адекватна расширенной мастэктомии Урбана-Холдина, Послеоперационные осложнения отмечены у 13 из 190 больных (6,8%). Метастазы в парастернальный лимфоколлектор встретились в 50 из 190 случаях, что составило 26,3%. Изучение частоты обнаружения гистологических изменений в парастернальном лимфоколлекторе показало возможность метастазирования рака молочной железы практически во все межреберные промежутки. В клетчатке 1 межреберья поражение встретилось в 27 случаях, 2 межреберья — в 26, 3 межреберья — в 17 и 4 межреберья — в 9 наблюдениях. Таким образом, количество метастатических изменений, так же, как общее количество обнаруживаемых лимфоузлов, достоверно убывает в дистальном направлении парастернального лимфоколлектора. Парастернальный лимфатический коллектор поражается чаще в группе женщин моложе 40 лет (30,7%), что согласуется с данными большинства научных исследований. В целом же статистически значимого различия в возрастных группах не получено. Одним из спорных вопросов является влияние локализации опухоли в молочной железе на частоту метастатического поражения парастернального лимфоколлектора. В нашем исследовании наиболее неблагоприятным фактором явилось расположение опухоли в центральных отделах молочной железы (50% метастазирования), а также по границам верхних и нижних квадрантов (30,8% и 33,3% случаев соответственно). В группе больных с наружной локализацией опухоли (73 человека) поражение парастернального лимфоколлектора выявлено в 13 (17,8%) случаях. В группе больных с внутренней локализацией (45 человек) метастазы обнаружены у 10, что составило 22,2%. В последние годы с получением моноклональных антител (МКА) к антигенам лимфоцитов и эпителиальных клеток, а также разработкой новых иммунологических методов появились возможности для детального изучения иммунофенотипа опухолевых клеток и субпопуляций интратуморальных лимфоцитов (Барышников А.Ю., 1997). МКА к антигенам опухолевых клеток позволяют проводить более точное обнаружение метастазов у больных раком молочной железы. При помощи иммуногистохимической методики показана возможность определения 1-3 опухолевых клеток, морфологическая идентификация которых невыполнима. Нами была проведена комплексная оценка иммунофенотипа метастазов рака молочной железы в регионарные лимфоузлы по экспрессии злокачественными клетками Леда, эпителиальных маркеров (панэпителиального антигена Egp 34-МКА НЕА 125, антигена мембран жировых глобул молока НМFG-1-МКА IСО-25, раково-эмбрионального антигена РЭА-МКА НЕА 19, цитокератинов 7, 8; САМ 5, 2) и сопоставление полученных данных с иммунофенотипом первичной опухоли (Паниченко А.В., 2002). Материалом для настоящего исследования послужили данные клинического и иммуногистохимического (ИГХ) обследования 50 больных первичным раком молочной железы, получавших лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в 1998-99 гг. Морфологически были охарактеризованы на наличие метастазов 584 регионарных подмышечных лимфатических узла (РЛУ) различных уровней: нижне-подмышечные лимфоузлы, расположенные латерально по отношению к малой грудной мышце (I уровень), центральные аксиллярные лимфоузлы, расположенные позади малой грудной мышцы (II уровень), апикальные (подключичные) лимфоузлы, расположенные медиально по отношению к малой грудной мышце (III уровень). Лечение всех пациенток начиналось с хирургического вмешательства различного объема, которое зависело от локализации опухоли и технических возможностей: радикальная резекция молочной железы была произведена в 9 случаях (18%), радикальная мастэктомия с сохранением грудных мышц была выполнена 41 больной (82%). В 25 случаях (50%) опухоли содержали рецепторы к эстрогенам, аналогичное количество опухолей были рецепторнегативными. Тактика адъювантного лечения складывалась на основании морфологических данных удаленной опухоли и регионарных лимфоузлов. Иммунологические исследования проведены на криостатных срезах 50 первичных опухолей и 253 РЛУ, полученных интраоперационно при выполнении хирургического этапа лечения. Лимфатические узлы, так же, как и при морфологическом исследовании, были охарактеризованы ИГХ на наличие метастатического поражения по уровням в зависимости от расположения по отношению к малой грудной мышце. В ИГХ анализе использовалась реакция прямой и непрямой иммунофлуоресценции. Иммунофенотип первичного и метастатического рака молочной железы изучен у 50 больных. Во всех случаях была исследована первичная опухоль. С наибольшей частотой на раковых клетках выявлялся панэпителиальный антиген НЕА-125 (100%), далее по мере убывания частоты экспрессии следовали СD71 (59,6%), НLА-I (51%), РЭА (25%) и молекулы НLА-DR (19,1%). Была оценена интенсивность макрофагальной и Т-клеточной инфильтрации опухолевой ткани на основании количества присутствующих в срезах клеток в реакции с МКА D11 (СD163) и IСО-87 (СD7) соответственно. Преобладали случаи с незначительной и умеренной макрофагальной реакцией (45,8% — 22 из 48 и 29,2% — 14 из 48 соответственно). Выраженная макрофагальная реакция макрофагов с наличием лишь единичных клеток в срезах была крайне редкой: 3 случая (6,3%). Количество Т-клеток в срезах рака молочной железы в большинстве случаев (33 из 49 — 67,3%) было небольшим, в 20,4% — умеренным. Минимальная, также как и резко выраженная реакция, отмечены редко (по 3 наблюдения). Для более точного определения метастазов РМЖ в лимфатические узлы были применены 2 метода: морфологический и иммуногистохимический. В работе мы применили 4 эпителиальных антигена для более полной идентификации раковых клеток в РЛУ. Морфологически обнаружены метастазы в РЛУ у 20 из 50 больных (40%): 11 -ИПР, 5 — ИДР, 2 — тубулярный рак, 1 — смешанный рак и 1 — рак с метаплазией. При морфологическом исследовании удаленные РЛУ были охарактеризованы на наличие метастатического поражения по уровням в зависимости от расположения по отношению к малой грудной мышце. Лимфатические узлы I уровня изучены морфологически у 49 больных. В 19 случаях (38,8%) обнаружены метастазы. Аксиллярные лимфатические узлы II уровня изучены у 49 больных. Метастатическое поражение имело место в 11 случаях (22,4%). Апикальные лимфатические узлы III уровня исследованы у 41 пациентки. Метастазы выявлены у 5 больных (12,2%). Частота выявления метастазов в лимфатические узлы I уровня была достоверно более высокой в сравнении с частотой выявления метастазов в лимфатических узлах III уровня (t=3,08; p<0,05). Различия в частоте метастазирования между I и II, а также II и III уровнями были недостоверными. При морфологическом исследовании лимфатических узлов в рассматриваемой нами группе больных не наблюдалось случаев обнаружения метастазов во II и III зонах при их отсутствии в I зоне. Общее количество метастатически измененных РЛУ по данным стандартного гистологического исследования составило 1-2 из 584 (17,5%). На I уровне было исследовано 240 РЛУ, 57 из которых (23,8%) содержали метастазы РМЖ. На II уровне было выявлено 28 метастатически измененных лимфоузлов из 226 исследованных (12,4%). На III уровне были охарактеризованы 104 лимфоузла, 14 из которых содержали метастазы РМЖ (13,5%). Иммунологические исследования проведены нами на свежезамороженных срезах 50 первичных опухолей и 253 РЛУ. Лимфатические узлы I уровня изучены ИГХ у 47 больных, В 22 случаях (46,8%) обнаружены метастазы. Аксиллярные лимфоузлы II уровня изучены у 47 больных. Метастатическое поражение имело место в 20 случаях (42,6%). Апикальные и подключичные лимфатические узлы исследованы у 31 пациентки. Метастазы выявлены у 13 больных (41,9%). Частота выявления метастазов в лимфатических узлах I, II и III уровня была одинакова. Общее количество метастатически измененных РЛУ по данным ИГХ исследования составило 91 из 253 (36%). На I уровне было исследовано 115 РЛУ, 46 из которых (40%) содержали метастазы РМЖ. На II уровне было выявлено 28 метастатически измененных лимфоузлов из 96 исследованных (29,2%). На III уровне были охарактеризованы 34 лимфоузла, 13 из которых содержали метастазы РМЖ (38,2%). Различия в проценте выявляемых ИГХ метастатически измененных лимфоузлов между уровнями были недостоверными. В РЛУ I уровня диагностика метастазов в большинстве случаев (17) базировалась на данных иммуногистохимии и морфологии одновременно. В 5 наблюдениях метастатическое поражение было установлено только ИГХ и в 2 — только морфологически. Различия не являются статистически значимыми (p=0,453). Установлена достоверная связь между ИГХ и морфологическими данными (p=0,001, критерий ?2). Следовательно, ИГХ диагностика не дает преимуществ в сравнении с морфологической диагностикой в РЛУ I уровня. Частота морфологической диагностики метастазов рака молочной железы в I зоне составила 40,4% (19 из 47), частота иммуногистохимической диагностики метастазов составила 46,8% (22 из 47). Эти данные не различаются статистически (t=0,6; p>0,05), что свидетельствует о равной эффективности морфологической и ИГХ диагностики метастатического поражения РЛУ I уровня при раке молочной железы. Иными словами, проведение дорогостоящей ИГХ диагностики метастазов при изучении лимфоузлов I уровня не является обязательным, так как не ведет к улучшению обнаружения опухолевых клеток. При определении метастазов в РЛУ II уровня у 47 больных метастазы достоверно чаще выявлялись иммуногистохимически, чем морфологически (20 из 47 и 10 из 47 соответственно). Аналогичная ситуация отмечена в лимфоузлах III уровня: преобладающим типом метастатического поражения были микрометастазы, выявляемые только ИГХ (12 из 29 и 3 из 29 соответственно). Эти данные убедительно свидетельствуют о недостаточной эффективности морфологического метода диагностики метастазов РМЖ в лимфоузлах II и III уровней. Частота морфологического обнаружения метастазов убывала в направлении РЛУ I > II > III уровня (40,4% > 21,3% > 10,3%), а частота ИГХ диагностики оставалась практически неизменной (46,8% > 42,6% > 41,4%), причем на том же уровне, что и морфологическая диагностика метастазов в РЛУ I уровня. Следовательно, можно считать, что на момент проведения операции по поводу рака молочной железы в РЛУ всех трех уровней примерно в 43% случаев обнаруживаются метастазы. В лимфоузлах I уровня практически все метастазы обнаруживаются морфологически, во II зоне морфологически обнаруживается лишь половина метастазов, а в РЛУ III уровня — лишь четверть. Зная, что чувствительность морфологического метода обусловлена в первую очередь размером метастатических очагов, можно считать, что пропорция микрометастатических отсевов в лимфоузлах первого уровня близка к 0, II уровня — 50%, а III уровня — 75%. Метастатическое поражение лимфатических узлов II и III уровней в анализируемой группе больных морфологическим методом выявлялось лишь в тех случаях, когда имели место метастазы в лимфоузлы I уровня. При использовании МКА для иммунодетекции мы наблюдали случаи изолированного метастазирования в лимфоузлы II и III уровня при отсутствии метастазов в РЛУ I уровня. Сопоставление метастатического поражения РЛУ I и II уровней проведено у 45 больных, из которых в 23 случаях метастазы не были обнаружены ни одним методом в РЛУ I уровня. У 3 из этих больных ИГХ были установлены метастазы в РЛУ II уровня (13%). Из оставшихся 20 иммуногистохимически негативных случаев при проведении сопоставлений II и III зон изучено 18, в 6 из которых на III уровне присутствовали метастазы (33%). Для объяснения столь высокой частоты микрометастазирования в апикальную группу РЛУ при отсутствии метастазов в РЛУ II уровня, мы проанализировали, насколько часто в этих случаях отсутствовали метастазы в РЛУ I уровня. Из 28 больных, у которых параллельно изучены РЛУ I и III уровней, отсутствие метастазов в РЛУ I уровня двумя методами подтверждено у 17. Из числа этих больных у 6 (35,3%) ИГХ обнаружены метастазы в РЛУ III уровня. Эти данные указывают на то, что частота метастазирования в лимфатические узлы I и II уровней примерно одинакова, и микрометастазы в лимфатических узлах II уровня при их отсутствии в РЛУ I уровня являются редкими. В то же время примерно в 35% случаев микрометастазы обнаруживаются в лимфоузлах III уровня при их отсутствии в лимфоузлах I и II уровней. Эти результаты являются косвенным подтверждением существования дополнительных путей лимфооттока из молочной железы в подключичную группу лимфатических узлов, связывающих молочную железу непосредственно с III уровнем лимфатических узлов (через межпекторальные лимфоузлы), минуя РЛУ I и III уровней. Проведено сопоставление изолированного метастазирования в РЛУ III уровня с локализацией опухоли в молочной железе. У 5 больных микрометастазы в подключичные лимфоузлы обнаружены при их отсутствии в лимфатических узлах I и II уровней. У этих пациенток опухоль локализовалась центрально (у 2 из 5 больных), в верхне-наружном квадранте (у 2 из 19 больных) и в наружном отделе молочной железы (у 1 из 4 больных). Ни у одной из обследованных нами больных изолированное микрометастазирование в РЛУ III уровня не наблюдалось при локализации опухоли во внутренних или нижних отделах молочной железы. Результаты наших исследований дают основание считать необходимым исследование лимфатических узлов III уровня на предмет ИГХ обнаружения микрометастазов при локализации опухоли в центральных отделах молочной железы. Установление степени гематогенной диссеминации рака молочной железы на основании обнаружения метастатического поражения костного мозга высокочувствительными иммуноцитологическими методами с применением специфических моноклональных антител к цитокератинам является еще одной возможностью уточнения стадии рака молочной железы. Иммуноцитологическое исследование на наличие метастатических клеток в костном мозге проведено 52 больным раком молочной железы различных стадий, находившимся на лечении в хирургическом отделении опухолей молочных желез ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Больным проводилось стандартное обследование, а также морфологическое исследование костного мозга. Материал для исследования получали при стернальной пункции. Изучение костного мозга проводилось как стандартным цитологическим, так и иммуноцитологическим методом с применением моноклональных антител САМ 5.2 и КL-1. Оценку содержания клеток проводили на цитоцентрифужных препаратах. Положительной считали реакцию при наличии 1 метастатической клетки на 1 млн. миелокариоцитов. При стандартном цитологическом исследовании метастазы в костный мозг были выявлены у 2 из 52 больных (3,85%). С помощью иммунопатологического метода микрометастазы в костный мозг были обнаружены у 28 из 52 (53,85%) больных. Частота выявления метастазов возрастает по мере увеличения степени распространенности опухолевого процесса от I к IV стадии (от 40% до 62,5%) (Крохина О.В., 2001). Важным является то, что количество опухолевых клеток, определяемых иммуноцитологически, было очень низким: от 1 до 12 на 1 млн. миелокариоцитов. Таким образом, использование иммунопатологического метода позволяет более точно судить о степени гематогенной диссеминации рака молочной железы в костный мозг по сравнению со стандартным цитологическим исследованием (Крохина О.В., 2000). Как известно, существующая в настоящее время классификация рака молочной железы и система ТNМ (1997 г.) не учитывает размер пораженного органа. Однако трудно представить степень распространения опухолевого процесса одинаковым в молочных железах маленького и большого объема при наличии опухоли идентичной величины. В маленькой молочной железе (диаметр основания менее 15 см) объемное образование даже небольших размеров (до 2 см) занимает значительную часть органа, кроме того, опухоль приближается к регионарным лимфатическим коллекторам, попадает в более интенсивную зону их дренирующего влияния, вследствие чего и не исключается ускорение процесса метастазирования. Для объективизации критериев определения стадии заболевания при раке молочной железы мы считаем целесообразным применять не абсолютное значение размеров опухоли, а относительное. В этой связи была создана математическая модель распространенности опухолевого процесса по соотношению объемов опухоли и молочной железы. Молочная железа по своей конфигурации сходна с полусферой, опухоль же зачастую почти сферическая. Объем молочной железы и опухоли можно определить по общепринятым математическим формулам: Vm=πD3/12 и Vо=πd3/6, где Vm — объем молочной железы; Vо — объем опухоли; π — константа, равная 3,14; D -диаметр основания молочной железы; d — диаметр опухоли. С целью определения процентного соотношения объемов молочной железы и опухоли следует найти относительное значение вышеуказанных параметров: К=2d3/D3 х 100%, где К — индекс соотношения объемов опухоли и молочной железы (индекс «К»). При определении пороговых значений индекса «К» для идентификации со значением категории «Т» мы условно приняли средний диаметр основания молочной железы 25 см. В результате получены следующие пороговые значения: К1 — до 0,1% (для опухолей до 2 см), К2 — до 1,0% (для опухолей до 5 см), К3 — до 10% (для опухолей до 10 см), К4 — более 10% (для опухолей более 10 см). Для мультицентрического рака молочной железы формула получила следующий вид: Определение значения индекса «К» проведено нами в 107 случаях первичного рака молочной железы. При значении К1 до 0,1% метастазы в регионарные лимфоузлы не отмечены, при К2 до 1,0% у 37,5% больных отмечены регионарные метастазы, и при К3 до 10% — у 86,7% диагностированы метастазы в регионарные лимфоузлы. При изучении общей 5- и 10-летней выживаемости с учетом значения индекса «К» получены следующие данные: при К1 выживаемость составила 100% и 100% соответственно, при К2 — 86,7% и 74,3% и при К3 — 33,7% и 29,9% соответственно. В заключение следует подчеркнуть, что использование видеоторакоскопической парастернальной лимфодиссекции позволяет объективно определить метастазы в парастернальные лимфоузлы не только при центральной и внутренней, но и при наружной локализации опухоли. Одновременное использование морфологического и имму-ногистохимического методов позволяет наиболее полно диагностировать метастазы рака молочной железы в регионарные лимфатические узлы, а иммуноцитологический метод — метастазы в костный мозг. Применение математического метода с использованием индекса «К» позволяет наиболее точно определить стадию процесса и прогнозировать 5- и 10-летнюю выживаемость. Список литературы:
1. Барышников А.Ю., Тоневицкий А.Г. // М., ВНИТЦ, 1997, с.99-105. ВЫЯВЛЕНИЕ СТОРОЖЕВЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ ПРИ РАКЕ ГОРТАНИ И ГОРТАНОГЛОТКИ | Синилкин1. Рожнов В.А., Андреев В.Г., Мардынский Ю.С. и др. Сравнительные результаты хирургического и комбини-рованного лечения местно-распространенного рецидивного рака гортани (rT3N0M0) // Сиб. онколог. журн. 2008. № 5 (29). С. 23–26. 2. Чижевская С.Ю., Чойнзонов Е.Л. Современные возможности и перспективы комбинированного лечения рака гортани и гортаноглотки // Сиб. онколог. журн. 2007. № 4 (24). С. 127–133. 3. Чойнзонов Е.Л., Мухамедов М.Р., Балацкая Л.Н. Рак гортани. Современные аспекты лечения и реабилитации. Томск: Изд-во НТЛ, 2006. 280 с. 4. Клиническая онкология / под ред. Н.Н. Блохина, Б.Е. Петерсона. М.: Медицина, 1979. 5. Arigami T., Natsugoe S., Uenosono Y. et al. Evaluation of sentinel node concept in gastric cancer based on lymph node micrometastasis determined by reverse transcription-polymerase chain reaction // Ann. Surg. 2006. V. 243. P. 341–347. 6. Byers R.M., Clayman G.L., McGill D., Andrews T., Ka re R.P., Roberts D.B. et al. Selective neck dissections for squamous carcinoma of the upper aerodigestive tract: patterns of regional failure // Head Neck. 1999. № 21. Р. 499–505. 7. Gretschel S., Bembenek A., Hunerbein M. et al. Efficacy of Different Technical Procedures for Sentinel Lymph Node Biopsy in Gastric Cancer Staging // Ann. Surg. Oncol. 2007. V. 14, № 7. P. 2028–2035. 8. Goerkem M., Braun J., Stoeckli S.J. Evaluation of clinical and histomorphological parameters as potential predictors of occult metastases in sentinel lymph nodes of early squamous cell carcinomas of the oral cavity // Ann. Surg. Oncol. 2009, in press. 9. Alkureishi L.W., Ross G.L., Shoaib T., Soutar D.S., Robert-son A.G., Sorensen J.A. et al. Does tumor depth affect nodal upstaging in squamous cell carcinoma of the head and neck // Laryngoscope. 2008. № 118. Р. 629–634. 10. Pitman K.T., Johnson J.T., Myers E.N. Effectiveness of se-lective neck dissection for management of the clinically negative neck // Arch. Otolaryngol. Head Neck. Surg. 1997. № 123. Р. 917–922. 11. Lindberg R. Distribution of cervical lymph node metastases from squamous cell carcinoma of the upper respiratory and digestive tracts // Cancer. 1972. № 29. Р. 1446–1449. 12. Чернов В.И., Афанасьев С.Г., Синилкин И.Г. и др. Радио-нуклидные методы исследования в выявлении «сторожевых» лимфатических узлов // Сиб. онколог. журн. 2008. № 4. С. 5–10. 13. Schauer A.J. et al. The Sentinel Lymph Node Concept. Springer, Berlin; Heidelberg; New York, 2005. P. 565. 14. Афанасьев С.Г., Августинович А.В., Чернов В.И., Синилкин И.Г. Возможность определения сторожевых узлов у больных раком желудка // Сиб. онколог. журн. 2009. № 4. С. 27–32. 15. Kim M.C., Kim H.H., Jung G.J., Lee J.H., Choi S.R., Kang D.Y., Roh M.S., Jeong J.S. Lymphatic mapping and sentinel node biopsy using 99mTc tin colloid in gastric can-cer // Ann. Surg. 2004. № 239. P. 383–387. 16. Hayashi H., Ochiai T., Mori M., Karube T., Suzuki T., Gunji Y., Hori S., Akutsu N., Matsubara H., Shimada H. Sentinel lymph node mapping for gastric cancer using a dual proce-dure with dyeand gamma probe-guided techniques // J. Am. Coll. Surg. 2003. № 196. Р. 68–74. 17. Koyama T., Tsubota A., Nariai K. et al. Detection of sentinel nodes by a novel redfluorescent dye, ATX-S10Na (II), in an orthotopic xenograft rat model of human gastric carcinoma // Lasers Surg. Med. 2007. V. 39. P. 76–82. 18. Osaka H., Yashiro M., Sawada T. et al. Is a lymph node de-tected by the dye-guided method a true sentinel node in gastric cancer? // Clin. Cancer. Res. 2004. V. 10. P. 6912–6918. Идентификация сторожевых лимфатических узлов при раке простатыПрофессор Пьер Моно совместно с руководителем Центра радионуклидной диагностики Максимом Смолярчуком выполнили уникальную процедуру идентификации сторожевых лимфатических узлов при раке предстательной железы. Для этого был использован диагностический изотоп технеция, который безвреден для человека и способен избирательно накапливаться в лимфатических узлах. У больных раком предстательной железы первичное метастазирование (распространение опухоли) осуществляется в лимфатические узлы таза или так называемой подвздошной ямки. Эти «сторожевые» лимфоузлы являются первым барьером к дальнейшему распространению опухолевого процесса по организму. Именно эти лимфатические узлы во время операции радикальной простатэктомии (полное удаление предстательной железы) подлежат удалению у больных с подозрением на метастазы в лимфатические узлы по данным КТ или МРТ. К сожалению, помимо подвздошных лимфоузлов, распространение опухоли может происходить и в другие лимфатические узлы таза. И если эти распространения не заметить, это может привести к прогрессированию злокачественной опухоли и возникновению опасности для жизни пациента. Чтобы этого избежать, был разработан метод радиоизотопного отслеживания и выявления лимфоузлов, в которые опухоль может распространиться в первую очередь. Пациенту в простату ввели изотоп технеция, затем, с помощью специального детектора излучения, прямо на операционном столе определили, в каких лимфоузлах он накапливался. Именно эти лимфоузлы были удалены с помощью роботической хирургической системы Da Vinci. В их числе оказались и абсолютно нетипичные для распространения рака простаты лимфоузлы – пресакральные. Если бы врачи не применили данную методику, пораженные лимфоузлы были бы оставлены в организме, что с высокой вероятностью создало бы риск для здоровья и жизни пациента. Пациент был выписан из клиники, как это обычно бывает после радикальной роботической простатэктомии, уже на 3-и сутки. Вовлечение лимфатических узлов | Breastcancer.orgLeer esta página en español Перед или во время операции по удалению инвазивного рака груди врач удаляет один или несколько подмышечных лимфатических узлов, чтобы их можно было исследовать под микроскопом на предмет раковых клеток. Присутствие раковых клеток известно как поражение лимфатических узлов . Лимфатические узлы — это маленькие бобовидные органы, которые действуют как фильтры вдоль каналов лимфатической жидкости.Когда лимфатическая жидкость покидает грудь и в конечном итоге возвращается в кровоток, лимфатические узлы пытаются поймать и уловить раковые клетки, прежде чем они достигнут других частей тела. Наличие раковых клеток в лимфатических узлах под мышкой предполагает повышенный риск распространения рака. Когда лимфатические узлы свободны или не поражены раком, результаты теста отрицательны. Если в лимфатических узлах есть раковые клетки, они называются положительными. В вашем отчете о патологии будет указано, сколько лимфатических узлов было удалено и сколько из них дали положительный результат на наличие раковых клеток.Например, 0/3 означает, что 3 узла были удалены и 0 были положительными, в то время как 2/5 означает, что 5 были удалены, а 2 были положительными. Ваши результаты также покажут вам, сколько рака находится в каждом узле — от нескольких крошечных клеток до множества клеток, которые можно легко увидеть. Вы можете увидеть это в отчете как:
Чем больше лимфатических узлов содержит раковые клетки, тем серьезнее может быть рак. Поэтому врачи используют количество пораженных лимфатических узлов, чтобы принять решение о лечении. Ваше руководство по отчету о патологии рака молочной железы — это оперативный справочник, который вы можете заполнить вместе со своим врачом или медсестрой, чтобы отслеживать результаты вашего отчета о патологии.Закажите бесплатный буклет по почте или загрузите буклет в формате PDF, чтобы распечатать его дома. Эта статья была полезной? Да / Нет Эта статья была полезной? Последнее изменение 21 сентября 2020 г., 7:36 лимфатических узлов и ракаЧто такое лимфатическая система?Лимфатическая (или лимфатическая) система — это часть иммунной системы вашего организма.Он включает сеть лимфатических сосудов и лимфатических узлов. Лимфатические сосуды во многом похожи на вены, которые собирают и переносят кровь по телу. Но вместо крови эти сосуды несут прозрачную водянистую жидкость, называемую лимфой. Лимфатическая жидкость также содержит лейкоциты, которые помогают бороться с инфекциями. Лимфатическая жидкость могла бы накапливаться и вызывать отек, если бы ее каким-либо образом не слить. Лимфатические сосуды собирают лимфатическую жидкость вокруг клеток, чтобы направить ее в грудную клетку.Там лимфатическая жидкость собирается в большой сосуд, который стекает в кровеносный сосуд рядом с сердцем. Лимфатические узлы и их функцииЛимфатические сосуды отправляют лимфатическую жидкость через узлы по всему телу. Лимфатические узлы — это небольшие структуры, которые работают как фильтры для посторонних веществ, таких как раковые клетки и инфекции. Они содержат иммунные клетки, которые могут помочь бороться с инфекцией, атакуя и уничтожая микробы, которые переносятся через лимфатическую жидкость. Лимфатические узлы расположены во многих частях тела, включая шею, подмышку, грудь, живот (живот) и пах.Они содержат иммунные клетки, которые могут помочь бороться с инфекцией, атакуя и уничтожая микробы, которые переносятся через лимфатическую жидкость. В теле есть сотни лимфатических узлов. Каждый лимфатический узел фильтрует жидкость и вещества, улавливаемые ведущими к нему сосудами. Лимфатная жидкость из пальцев, например, движется к груди, присоединяясь к жидкости из руки. Эта жидкость может фильтроваться через лимфатические узлы в локте или под мышкой. Жидкость из головы, волосистой части головы и лица течет вниз через лимфатические узлы на шее.Некоторые лимфатические узлы находятся глубоко внутри тела, например, между легкими или вокруг кишечника, чтобы фильтровать жидкость в этих областях. Увеличение лимфатических узловПри возникновении проблемы, например инфекции, травмы или рака, лимфатические узлы в этой области могут набухать или увеличиваться, поскольку они отфильтровывают «плохие» клетки. Увеличение лимфатических узлов (лимфаденопатия) говорит о том, что что-то не так, но другие симптомы помогают определить проблему. Например, боль в ухе, лихорадка и увеличенные лимфатические узлы возле уха могут указывать на то, что у вас инфекция уха или простуда. Некоторые области, где обычно увеличиваются лимфатические узлы, находятся в области шеи, паха и подмышек. В большинстве случаев набухает только одна область узлов. Когда увеличивается более одной области лимфатических узлов, это называется генерализованной лимфаденопатией . Некоторые инфекции (такие как стрептококковая ангина и ветряная оспа), некоторые лекарства, заболевания иммунной системы и такие виды рака, как лимфома и лейкемия, могут вызывать такой отек. Ваш лечащий врач запросит дополнительную информацию, чтобы выяснить причину отека. Набухание лимфатических узлов часто вызвано не раком, а чем-то другим. Рак лимфатических узловРак может появиться в лимфатических узлах двумя способами: он может либо начаться там, либо распространиться откуда-то еще. Рак, который начинается в лимфатических узлах, называется лимфомой . Подробнее о лимфоме при лимфоме Ходжкина и неходжкинской лимфоме. Чаще рак начинается где-то еще, а затем распространяется на лимфатические узлы.Это основное внимание в этом разделе. Как рак распространяется на лимфатические узлы?Рак может распространяться от того места, где он возник (первичный очаг), на другие части тела. Когда раковые клетки отделяются от опухоли, они могут перемещаться в другие области через кровоток или лимфатическую систему. Если они проходят через лимфатическую систему, раковые клетки могут попасть в лимфатические узлы. Большинство уцелевших раковых клеток умирают или погибают, прежде чем смогут начать расти где-нибудь еще.Но один или два могут поселиться на новом месте, начать расти и образовывать новые опухоли. Это распространение рака на новую часть тела называется метастазом . Чтобы раковые клетки распространились на новые части тела, они должны претерпеть несколько изменений. Они должны иметь возможность отделиться от исходной опухоли и прикрепиться к внешней стенке лимфы или кровеносного сосуда. Затем они должны пройти через стенку сосуда, чтобы течь с кровью или лимфой к новому органу или лимфатическому узлу. Когда рак действительно распространяется на лимфатические узлы, он обычно распространяется на узлы рядом с самой опухолью. Это узлы, которые выполняют большую часть работы по фильтрации или уничтожению раковых клеток. Как обнаруживается рак в лимфатических узлах?Нормальные лимфатические узлы крошечные, и их трудно найти, но при инфекции, воспалении или раке узлы могут увеличиваться. Те, что находятся у поверхности тела, часто становятся достаточно большими, чтобы их можно было почувствовать пальцами, а некоторые даже можно увидеть.Но если в лимфатическом узле всего несколько раковых клеток, он может выглядеть и чувствовать себя нормально. Лимфатические узлы глубоко в теле не прощупываются или не видны. Поэтому врачи могут использовать сканирование или другие визуализационные тесты, чтобы искать увеличенные узлы в глубине тела. Часто предполагается, что увеличенные лимфатические узлы рядом с раком содержат рак. Единственный способ узнать, есть ли рак в лимфатическом узле, — это сделать биопсию. Врачи могут удалить лимфатические узлы или взять образцы одного или нескольких узлов с помощью игл. Удаленная ткань рассматривается под микроскопом патологом (врачом, который диагностирует болезнь с помощью образцов ткани), чтобы выяснить, есть ли в ней раковые клетки.Патологоанатом составляет отчет, в котором подробно описывается обнаруженное. Если в узле обнаружен рак, в отчете описывается, как он выглядит и сколько было замечено. Когда хирург выполняет операцию по удалению первичного рака, он может также удалить один или несколько близлежащих (региональных) лимфатических узлов. Удаление одного лимфатического узла считается биопсией, но когда удаляются многие лимфатические узлы, это называется диссекцией лимфатических узлов . Когда рак распространился на лимфатические узлы, существует более высокий риск того, что рак может вернуться после операции.Эта информация помогает врачу решить, может ли потребоваться дополнительное лечение, такое как химиотерапия, иммунотерапия, таргетная терапия или лучевая терапия после операции. Что означает рак лимфатического узла?Если рак обнаружен в одном или нескольких лимфатических узлах, это может означать, что необходимы дополнительные тесты, чтобы узнать, насколько далеко распространился рак. Эта информация используется для определения стадии вашего рака и наилучших вариантов лечения. Для получения дополнительных сведений о стадиях см. «Стадия рака» или найдите свой тип рака для получения более подробной информации. Эффекты удаления лимфатических узловПри удалении лимфатических узлов он может покинуть пораженный участок без возможности оттока лимфатической жидкости. Многие лимфатические сосуды теперь заходят в тупик там, где раньше находился узел, и жидкость может возвращаться обратно. Это называется лимфедема , , которая может стать проблемой на всю жизнь. Чем больше удалено лимфатических узлов, тем больше вероятность, что это произойдет. Чтобы узнать больше о том, на что обращать внимание, как снизить риск и как справиться с этим побочным эффектом, см. Лимфедема. Удаление лимфатических узлов во время онкологической хирургии маловероятно, чтобы ослабить иммунную систему человека, поскольку иммунная система большая и сложная и расположена по всему телу. рака, который распространяется на лимфатические узлы | Знаки, процедурыЛимфатическая система организма помогает бороться с болезнями и инфекциями. Лимфатические узлы, также называемые лимфатическими узлами, являются ключевой частью этой сети сосудов, тканей и органов. Лимфатические узлы — это небольшие органы в форме бобов, которые производят и хранят клетки крови, фильтруют отходы и вредные микробы из тканей организма и несут иммунные клетки, которые борются с инфекциями. Сотни лимфатических узлов разбросаны группами по всему телу, с большим скоплением желез в шее, подмышках, животе и паху. Лимфатическая система является частью иммунной системы организма, вырабатывающей лейкоциты — В-лимфоциты (В-клетки) или Т-лимфоциты (Т-клетки), которые борются с инфекцией. Лимфатическая система также включает миндалины, селезенку и тимус. Лимфатическая система является частью системы кровообращения. Лимфатические сосуды похожи на вены сердечно-сосудистой системы.Вместо крови лимфатические сосуды несут прозрачную водянистую жидкость, называемую лимфой (произносится как лимф). Эта лимфатическая жидкость доставляет кислород и другие питательные вещества к тканевым клеткам и выводит из них продукты жизнедеятельности. Каждый лимфатический узел фильтрует лимфатическую жидкость, стекающую из сосудов, которые к нему ведут. Лимфатическая жидкость, фильтруемая лимфатическими узлами, независимо от того, где они расположены, движется к грудной клетке, где собирается в большой сосуд, который стекает в кровеносный сосуд рядом с сердцем.Оттуда отфильтрованная жидкость вместе с солями и белками попадает в кровоток. Каждая группа лимфатических узлов фильтрует определенный участок тела. Увеличение лимфатических узлов: что они означают?Увеличение лимфатических узлов или лимфатических узлов — это симптом многих болезней — от простуды до некоторых форм рака — и признак того, что с телом что-то не так. Набухание или увеличение, называемое лимфаденопатией, возникает в лимфатических узлах, когда они фильтруют клетки, пораженные каким-либо заболеванием, таким как инфекция, травма или рак.Наиболее частая причина увеличения лимфатических узлов — инфекция, особенно вирусная, например, простуда. Гораздо реже увеличенные лимфатические узлы становятся симптомом более серьезного заболевания, например рака. Лимфатические узлы могут увеличиваться в одной конкретной области в зависимости от заболевания. Обычно это происходит в области шеи, подмышек или паха. Реже наблюдается увеличение лимфатических узлов в нескольких регионах одновременно. Это состояние может быть вызвано инфекциями, такими как ангина или мононуклеоз, реакцией на определенные лекарства, расстройством иммунной системы, таким как ревматоидный артрит, и такими формами рака, как лимфома и лейкемия. Когда опухоль лимфатических узлов сохраняется и сопровождается другими симптомами, такими как лихорадка или ночная потливость, или когда явной инфекции нет, возможно, пришло время обратиться за медицинской помощью или обследованием к врачу. При прикосновении к пораженному участку опухшие лимфатические узлы могут казаться мягкими и круглыми, как комки размером с горошину, арахис или виноград. Если они болезненны при прикосновении, это может быть признаком воспаления. Поскольку лимфатические узлы расположены параллельно, например, на обеих сторонах шеи, вы можете прощупать лимфатические узлы с обеих сторон, чтобы увидеть, нормального ли они размера с одной стороны и увеличены ли они с другой, что может быть признаком инфекционное заболевание. При постановке диагноза врачам важно учитывать другие симптомы или факторы. Увеличение лимфатических узлов возле уха может указывать, например, на ушную инфекцию. Увеличение лимфатических узлов в области шеи возле ключицы в сочетании с болью в горле и кашлем может быть признаком инфекции верхних дыхательных путей. Если несколько областей лимфатических узлов увеличены, это может указывать на заболевание всего тела, требующее немедленного внимания. Помимо изучения вашей истории болезни, врачи могут использовать некоторые из следующих методов для диагностики причины увеличения лимфатических узлов:
Рак лимфатических узловВ редких случаях опухоль лимфатических узлов может быть связана с раком.Некоторые виды рака начинаются в лимфатических узлах. Неходжкинская лимфома и лимфома Ходжкина являются типами рака лимфатической системы, как и острый лимфолейкоз. Чаще рак может появиться в лимфатических узлах в виде метастазов, распространяющихся из других частей тела. Некоторые раковые клетки отрываются от опухоли и метастазируют в другом месте. Эти раковые клетки могут путешествовать по кровотоку и достигать других органов или проходить через лимфатическую систему и достигать лимфатических узлов. Однако, по данным Американского онкологического общества (ACS), большинство раковых клеток, проходящих через кровоток или лимфатическую систему, умрут или погибнут, прежде чем у них появится шанс метастазировать. Когда рак присутствует в лимфатическом узле, биопсия помогает определить, какой это рак, когда удаленная ткань или узел исследуется под микроскопом. Раковые клетки будут выглядеть как раковые клетки опухоли, из которой они возникли, поэтому клетки рака груди в лимфатической системе по-прежнему будут выглядеть как рак груди. Лимфатические узлы и стадия ракаОнкологи используют стадию рака для определения степени рака в организме.Лимфатические узлы играют важную роль в одной из наиболее часто используемых систем стадирования, называемой TNM. Система TNM основана на размере опухоли (T), степени ее распространения на близлежащие лимфатические узлы (N) и наличии метастазов (M). Каждой букве присвоено числовое значение на основании клинических наблюдений. Если рак не обнаружен в лимфатических узлах рядом с опухолью, N присваивается значение 0. Если в ближайших или отдаленных узлах обнаружен рак, N присваивается число, которое увеличивается в зависимости от количества пораженных узлов, размера и степень рака, насколько велики узлы и где они расположены.Числа для каждого инициала складываются. Чем выше сумма, тем более запущен рак. Чем ниже оценка TNM, тем легче будет вылечить. Лечение рака лимфатических узловЛечение рака лимфатических узлов зависит от размера и расположения опухоли, а также от метастазов рака в другие части тела. Хирургическое вмешательство может использоваться для лечения некоторых форм метастатического рака, который распространился на лимфатические узлы.Другие варианты лечения рака лимфатических узлов могут включать химиотерапию, лучевую терапию, трансплантацию стволовых клеток, иммунотерапию или таргетную терапию. Существует более высокий риск рецидива рака после операции, когда рак распространился на лимфатические узлы. В этих случаях после операции может быть рекомендована химиотерапия или лучевая терапия. Удаление лимфатических узлов во время онкологической хирургии «маловероятно» ослабит иммунную систему пациента, поскольку она «большая и сложная и расположена по всему телу», — говорится в сообщении ACS.Удаление лимфатического узла может привести к тому, что пораженная часть тела не сможет отвести лимфатическую жидкость, что может привести к образованию резервной жидкости (лимфедема) и может стать постоянной проблемой. Чем больше удалено лимфатических узлов, тем больше вероятность возникновения лимфедемы. Стадия рака молочной железы | Состояние лимфатического узлаПонятно, что вы можете нервничать по поводу этих тестов, однако они являются необходимой частью процесса. И будьте уверены, мы сделаем все, чтобы вы чувствовали себя комфортно.Эти тесты позволяют вашей онкологической бригаде RMCC увидеть, распространился ли рак и, если да, то на какие части вашего тела. Когда рак груди распространяется, раковые клетки часто обнаруживаются в лимфатических узлах под мышкой (подмышечные лимфатические узлы). Рак груди также может распространяться практически на любую другую часть тела, например, на кости, легкие, печень и мозг. Важно понимать, что когда рак груди распространяется из исходного места в другую часть тела, новая опухоль имеет тот же тип аномальных клеток и то же название, что и первичная (исходная) опухоль.Например, если рак груди распространяется на кости, раковые клетки в костях на самом деле являются клетками рака груди. Следовательно, это метастатический рак груди, а не рак костей. По этой причине его лечат как рак груди, а не как рак костей. Эту новую опухоль обычно называют «отдаленной» или метастатической болезнью. Стадии рака молочной железыЧтобы понять, как ваш онколог RMCC определяет стадию вашего рака, полезно немного узнать о так называемой системе TNM.Система стадирования TNM — это система классификации, разработанная Американским объединенным комитетом по раку для описания степени прогрессирования заболевания у онкологических больных. TNM означает:
Любой диагноз любой стадии рака груди может вызвать у вас чувство страха и подавленности.Тем не менее, понимание своего рака и знание того, чего ожидать, может помочь вам и вашим близким почувствовать себя лучше и справиться со своим диагнозом. Стадия рака груди обычно выражается числом по шкале от 0 до IV, причем стадия 0 описывает неинвазивные виды рака, которые остаются в пределах своего исходного местоположения, а стадия IV описывает инвазивные виды рака, распространившиеся за пределы груди на другие части тела. . Стадии рака груди следующие:Стадия 0 иногда используется для описания аномальных клеток, которые не являются инвазивным раком.Например, стадия 0 используется для протоковой карциномы in situ (DCIS). DCIS диагностируется, когда аномальные клетки находятся в слизистой оболочке протока молочной железы, но аномальные клетки не вторглись в близлежащие ткани груди и не распространились за пределы протока. Хотя многие врачи не считают DCIS раком, DCIS иногда становится инвазивным раком груди, если его не лечить. Стадия I — это ранняя стадия инвазивного рака груди. Раковые клетки проникли в ткань груди за пределы того места, где начался рак, но клетки не распространились за пределы груди.Опухоль не превышает 2 сантиметров (три четверти дюйма) в поперечнике. Stage II является одним из следующих:
Стадия III — местнораспространенный рак. Он разделен на этапы IIIA, IIIB и IIIC.
Стадия IV — отдаленный метастатический рак. Рак распространился на другие части тела, такие как кости или печень. Рецидив рака молочной железыК сожалению, бывают случаи, когда рак возвращается к пациенту после того, как он, казалось бы, был уничтожен лечением.Это называется рецидивирующим раком. Рецидив рака обычно возникает из-за того, что необнаруженные раковые клетки остались где-то в вашем теле после лечения. Ваш рак груди может вернуться в грудь или грудную клетку. Или он может вернуться в любую другую часть тела, например, в кости, легкие, печень или мозг. Роль лимфатических узлов в раке молочной железыОдно из первых мест, где рак груди может распространяться и расти, — это близлежащие лимфатические узлы, которые являются частью лимфатической (лимфатической) системы организма.Ваша иммунная система — защита организма от инфекций и болезней — в значительной степени зависит от лимфатической системы, которая состоит из трех частей:
Основная функция лимфатической системы — циркуляция лимфы, которая содержит белые кровяные тельца, борющиеся с инфекциями, по всему телу и выведение из организма токсинов, шлаков и других нежелательных материалов. По мере размножения клеток рака груди они могут проникать в лимфатические сосуды, расположенные в ткани груди женщины. Затем лимфатическая жидкость разносит клетки по всему телу. Часто лимфатические узлы в области подмышек являются первым местом, где начинает расти рак груди, поскольку они находятся ближе всего к груди. Обследование, которое проводит онколог из онкологического центра Рокки Маунтин для определения наличия клеток рака груди в лимфатических узлах, называется оценкой лимфатических узлов. Определение поражения лимфатических узловЧтобы определить, вовлечены ли лимфатические узлы в рак груди, ваш хирург удалит один или несколько лимфатических узлов подмышек (во время удаления опухоли), чтобы их можно было биопсировать, а затем исследовать под микроскопом. Лимфатические узлы можно проверить двумя способами. Наиболее распространенный и наименее инвазивный метод называется биопсия сторожевого лимфатического узла. Другой называется диссекция подмышечных лимфатических узлов. В большинстве случаев операция на лимфатических узлах проводится как часть основной операции по удалению рака груди.Однако иногда это может выполняться как отдельная операция. Биопсия сторожевого лимфатического узла (SLNB)Сторожевой лимфатический узел определяется как первый лимфатический узел, в который раковые клетки с наибольшей вероятностью распространятся из первичной опухоли. Бывают случаи, когда присутствует более одного сторожевого лимфатического узла. Во время операции по удалению рака груди на ранней стадии определяется и удаляется сторожевой узел, чтобы его можно было отправить патологу, который изучает причины и последствия заболеваний.Патологоанатом определит, есть ли в нем рак. Эта процедура по удалению сторожевого лимфатического узла, чтобы его можно было исследовать, называется биопсией сторожевого лимфатического узла (SLNB). Чтобы идентифицировать сторожевой узел, ваш хирург рака молочной железы будет:
Результаты патологического обследования помогают определить стадию рака груди и спланировать лечение. Если рак не обнаружен в сторожевых узлах (отрицательные лимфатические узлы), операция по удалению большего количества лимфатических узлов не требуется, поскольку маловероятно, что другие лимфатические узлы имеют рак. Однако, если рак обнаружен в сторожевых узлах (положительный лимфатический узел), можно удалить больше лимфатических узлов с помощью процедуры, называемой подмышечной диссекцией. Диссекция подмышечных лимфатических узлов (ALND)Подмышечные лимфатические узлы проходят от ткани груди до подмышечной впадины. Эта область под мышкой называется подмышечной впадиной. Во время диссекции подмышечных лимфатических узлов удаляются и исследуются от 10 до 40 лимфатических узлов. Эти узлы обычно удаляются во время лампэктомии или мастэктомии. Состояние лимфатических узлов и лечение рака грудиПосле того, как ткань вашей биопсии будет исследована, онколог вашего онкологического центра Скалистых гор изучит результаты (так называемый отчет о патологии). В отчете о патологии будет показано, сколько лимфатических узлов было удалено и сколько было «вовлечено» (положительный результат теста на рак).Это называется статусом лимфатических узлов. Рак молочной железы, не распространившийся на близлежащие лимфатические узлы, называется статусом отрицательного лимфоузла. Если в отчете указано, что рак присутствует в лимфатических узлах, это называется положительным статусом лимфатических узлов. Положительные результаты также означают, что рак, возможно, уже распространился или мог распространиться на другие органы, такие как кости, легкие, печень и мозг. Чтобы определить это, вашей онкологической бригаде RMCC потребуется провести дополнительные тесты. Отчет о патологии также покажет, сколько рака находится в каждом узле.Раковые клетки могут варьироваться от маленьких по размеру и небольшому количеству до больших по размеру и множеству. Эту информацию можно передать как:
На решения и прогноз (перспективы) лечения рака груди может влиять статус лимфатических узлов. Однако важно помнить, что продолжительность жизни и лечение постоянно улучшаются. Если в лимфатических узлах обнаружен рак, ваш специалист по раку груди может порекомендовать химиотерапию в дополнение к операции, поскольку химиотерапия может атаковать раковые клетки по всей лимфатической системе. Ключевым моментом является раннее обнаружение. Вот почему мы настоятельно рекомендуем вам проводить самообследование дома и регулярно делать маммографию.Если у вас есть какие-либо опасения по поводу здоровья груди, обязательно поговорите со своим лечащим врачом или гинекологом. Чем раньше обнаружен рак груди, тем меньше вероятность его распространения на лимфатические узлы. Лимфатические узлы и рак — ответы на общие вопросы | Онкологический центр Fox ChaseЧто такое лимфатические узлы и какова их роль в распространении рака? Знание того, как они связаны, может помочь пациентам и их близким лучше понять свой диагноз и варианты лечения.Здесь Джеффри Фарма, доктор медицины, FACS, хирург-онколог онкологического центра Fox Chase, дает обзор основ. Какую роль лимфатические узлы играют в организме?Тело имеет сеть лимфатических каналов и лимфатических узлов, которые действуют как система фильтрации для жидкостей, отходов и микробов. Сосуды подобны магистрали, по которой циркулирует лимфа — прозрачная водянистая жидкость, которая доставляет питательные вещества к клеткам. Узлы похожи на узлы или остановки на шоссе, которые очищают лимфу, отбиваясь от вредных веществ.Являясь неотъемлемой частью иммунной системы, лимфатические узлы играют большую роль в борьбе с инфекциями и болезнями. По всему телу расположены тысячи лимфатических узлов, которые сгруппированы вместе и соединены лимфатическими сосудами по всему телу, в таких областях, как пах, подмышки (подмышки), грудь, живот и т. Д. Почему иногда увеличиваются лимфатические узлы?Лимфатические узлы могут увеличиваться, когда они пытаются отфильтровать вредные вещества, вызванные травмой, инфекцией или раком. Даже такая простая вещь, как простуда или укус насекомого, может вызвать увеличение лимфатических узлов.Это важно помнить, потому что, хотя рак может вызвать опухание лимфатических узлов , это , а не , самая частая причина увеличения узлов. Как рак попадает в лимфатические узлы?Рак может начаться в лимфатических узлах, как в случае лимфомы, но он также может распространяться на лимфатические узлы из других частей тела. Когда раковые клетки отделяются от опухоли, они могут перемещаться по лимфатической системе в лимфатические узлы или через кровоток и вторгаться в ткани и органы в другой области тела.Это называется метастазированием. Как диагностируется рак лимфатических узлов?Когда узлы увеличены, врач может выбрать выполнение биопсии, при которой для исследования удаляется только образец узла. Затем патолог будет искать раковые клетки в этом лимфатическом узле. Раковые узлы также могут быть обнаружены, когда пациенту проводят операцию по удалению всей или части опухоли. Во время процедуры врач может удалить один или несколько близлежащих лимфатических узлов. Затем узлы исследуются на предмет злокачественности.Один из методов оценки лимфатических узлов называется биопсия сторожевого узла. Это обычно используется при раке груди и меланоме. Как влияет лечение, если рак поражает лимфатические узлы?У разных пациентов разная. Рак, который переместился в лимфатические узлы, обычно более развит. Часто риск рецидива у этих пациентов выше, чем у пациентов без поражения лимфатических узлов. Варианты лечения могут включать удаление лимфатических узлов в этой области или дополнительные методы лечения, такие как иммунотерапия, химиотерапия и / или облучение. Есть ли риск удаления раковых лимфатических узлов?Удаление злокачественных лимфатических узлов может помочь предотвратить дальнейшее распространение рака или его рецидив. Но иногда это может привести к лимфедемой — состоянию, при котором лимфатическая жидкость скапливается в той части тела, где раньше находился узел. Лимфедема может вызывать отек и нервный дискомфорт или дисфункцию, но хорошая новость заключается в том, что лимфедему часто можно контролировать или даже вылечить. Ваш врач может помочь вам взвесить преимущества и риски удаления раковых узлов. Рак у всех индивидуален, и когда поражаются лимфатические узлы, ваш врач учтет это, предлагая вам варианты лечения. Понимание рака молочной железы с положительным лимфоузлом для стадии I-IIIAЕсли вам недавно был поставлен диагноз ранней стадии инвазивного рака груди, характеризуемой как стадия I – IIIa, с поражением лимфатических узлов, вы, скорее всего, беспокоитесь и беспокоитесь о том, какой курс лечения вам подходит.В прошлом наличие раковых клеток в одном или нескольких лимфатических узлах всегда означало, что пациенту будет назначена химиотерапия, чтобы предотвратить распространение рака. Однако недавние достижения в исследованиях рака груди показывают, что не все пациенты с положительными лимфатическими узлами получат пользу от химиотерапии 1 . Поэтому вам необходимо узнать все, что можно о биологии вашего индивидуального рака, прежде чем принимать решение о лечении. Что такое рак молочной железы с положительным узлом?Если у женщины диагностирован рак груди, это означает, что рак распространился из исходной опухоли груди на подмышечные лимфатические узлы на стороне рака груди.Состояние лимфатических узлов определяется, когда ваш врач удаляет один или несколько ваших лимфатических узлов, чтобы их можно было исследовать под микроскопом на наличие раковых клеток. В вашем отчете о патологии будет указано, сколько лимфатических узлов было удалено и сколько из них дали положительный результат на наличие раковых клеток. Чем больше лимфатических узлов содержит раковые клетки, тем серьезнее может быть рак. Эта информация, наряду с размером и степенью вашего рака, являются важными клиническими факторами при принятии решения о том, какое лечение выбрать после операции.Следующим важным шагом является определение вероятности возврата рака. Эта ключевая биологическая информация, а также ваш возраст, история болезни и личные приоритеты могут помочь вам и вашему врачу решить, не следует ли вам проходить химиотерапию. Химиотерапия: риски и преимуществаИсторически сложилось так, что пациенты с раком молочной железы с положительным лимфоузлом автоматически получали химиотерапию, при которой используются сильнодействующие препараты для уничтожения раковых клеток, оставшихся в организме после операции.Однако обратная сторона этого подхода значительна, поскольку лечение химиотерапией может привести к побочным эффектам, таким как выпадение волос, симптомы менопаузы, инфекции, потеря памяти, проблемы с сердцем, проблемы с фертильностью, усталость, тошнота и диарея. Могут ли пациенты с раком груди с положительным узлом избежать химиотерапии?Если у вас рак груди на ранней стадии, положительный по рецепторам эстрогена (ER +), с положительными лимфатическими узлами, существует тест, который может сказать вам о риске рецидива рака и о том, получит ли вы пользу от химиотерапии.Тест Oncotype DX Breast Recurrence Score выявляет основную биологию вашего рака, измеряя активность определенных генов в вашей индивидуальной опухоли. Этот тест может помочь вам и вашему врачу понять, какие варианты лечения подходят вам, в том числе можно ли безопасно отказаться от химиотерапии. Женщины с высокими результатами по шкале рецидивов были уверены в выборе химиотерапии как потенциально спасающего жизнь варианта, в то время как женщины с низкими показателями могли проводить только гормональную терапию, избавляя их от побочных эффектов ненужной химиотерапии. Как метастатические опухолевые клетки растут в лимфатических узлах? Опухолевые клетки в качестве топлива используют жирные кислоты, а не глюкозу; метаболическая адаптация дает представление о новой платформе для лечения метастазов — ScienceDailyРаспространение рака на новую часть тела составляет около 90% смертей от рака. Раковые клетки могут распространяться из места своего рождения в другие части тела либо через кровеносные сосуды (метастазы с кровью), либо через лимфатическую систему (метастазы в LN). Проникая в окружающие лимфатические сосуды, раковые клетки мигрируют в соседние лимфатические узлы и становятся колонизированной опухолью, ведущей к другим органам.Если они адаптируются и разрастаются в лимфатических узлах, раковые клетки могут легко достичь других органов, что ухудшает перспективы выживания пациента. Медицинский онколог д-р Чунг-кун Ли, биолог-онколог д-р Гоу Ён Ко и их коллеги из Центра сосудистых исследований Института фундаментальных наук (IBS) и Корейского передового института науки и технологий (KAIST) в Тэджоне, на юге страны. Корея обнаружила механизм подавления роста и распространения раковых клеток в лимфатических узлах, предотвращая любой шанс их вторжения на новые территории тела. Лимфатические узлы — это крошечные структуры, содержащие иммунные клетки, которые борются с вредными веществами, такими как рак. Несмотря на основной механизм иммунитета, раковые клетки могут адаптироваться и расти в лимфатических узлах. Этот статус метастазов в лимфатические узлы имеет решающее значение для определения стадии рака и прогноза. Исследователи IBS предположили, что мигрировавшие раковые клетки должны иметь альтернативный механизм выживания и роста в лимфатических узлах, отличный от того, где они начинаются. Исследователи использовали модели животных с меланомой и раком груди, которые, как считается, в первую очередь распространяются на лимфатические узлы.При сравнении раковых клеток, выращенных в лимфатических узлах, с клетками, выращенными на первичном участке, исследователи обнаружили, что метастатические раковые клетки в лимфатических узлах повышают экспрессию генов, связанных с расщеплением жирных кислот с целью производства энергии, известной как окисление жирных кислот (ФАО ). Между тем, раковые клетки, растущие на первичном участке, способствуют экспрессии генов, участвующих в глюкозе, используемой в качестве источника энергии (что хорошо известно как «эффект Варбурга»). Кроме того, они также обнаружили, что, в отличие от других органов, лимфа узлы богаты разнообразными липидами.Доктор Ли говорит: «Эти неожиданные результаты вселили в меня твердую уверенность в том, что метастатические опухолевые клетки в лимфатические узлы предпочтительно используют жирные кислоты, а не глюкозу в качестве источника топлива в богатой липидами микросреде лимфатических узлов». Он подтвердил результаты почти полного подавления метастазов в лимфатические узлы путем лечения клинически испытанным ингибитором окисления жирных кислот меланомы или мышей с раком груди. Исследователи задались вопросом, какой внутриклеточный сигнал отвечает за запуск такой метаболической адаптации метастатических опухолевых клеток к использованию жирных кислот в качестве топлива.Используя обширный скрининг и анализы, они определили, что «да-ассоциированный белок (YAP)» является важной движущей молекулой для стимуляции окисления жирных кислот в метастатических опухолевых клетках в лимфатических узлах. Доктор Кох говорит: «Нам повезло обнаружить связь между этой необычной метаболической адаптацией и активацией YAP в метастатических раковых клетках лимфатических узлов. Активация YAP также была обнаружена в метастатических лимфатических узлах пациентов с меланомой». Чтобы определить главный стимулятор активации YAP в метастатических опухолях лимфатических узлов, исследователи изучили биологические образцы.Они показали, что количество нескольких видов желчных кислот, которые, как известно, обнаруживаются только в печени и кишечном тракте, где они способствуют перевариванию пищевых жиров, резко увеличилось в метастатической меланоме лимфатических узлов. Доктор Ли подчеркивает: «Было очень интригующим то, что желчные кислоты сильно накапливаются в метастатическом лимфатическом узле, но не в нормальном здоровом лимфатическом узле или первичной опухоли». Предварительные анализы предполагают, что метастатическая опухоль в лимфатический узел сама может продуцировать желчные кислоты, которые могут активировать YAP и стимулировать дальнейший рост метастатической опухоли в лимфатический узел.«Это требует дальнейшей тщательной проверки. Желчные кислоты из крови и лимфатической циркуляции могут сильно накапливаться в лимфатических узлах во время метастазирования по определенному механизму», — предупреждает доктор Кох. Раковые клетки умнее, чем мы ожидаем, в своем распространении в организме. Доктор Кох говорит: «Это исследование показывает, как они приспосабливаются к сложной среде, такой как лимфатические узлы, путем переключения своего источника энергии на локально распространенные молекулы, такие как жирные кислоты и желчные кислоты, чтобы проникнуть в другие органы.«В настоящее время доступны или активно разрабатываются методы лечения, нацеленные на ФАО и YAP. Используя связь между FAO / YAP и метастазами в лимфатических узлах, обнаруженную в ходе этого исследования, врачи могут подавить последующие отдаленные метастазы у пациентов с меланомой и раком груди. Кох добавляет: «Это определенно требует более обширных исследований у пациентов с метастатическим раком до их клинического применения». История Источник: Материалы предоставлены Институтом фундаментальных наук . Примечание. Содержимое можно редактировать по стилю и длине. . | |||||||||||||||||||||||||||||||||||||||||||||

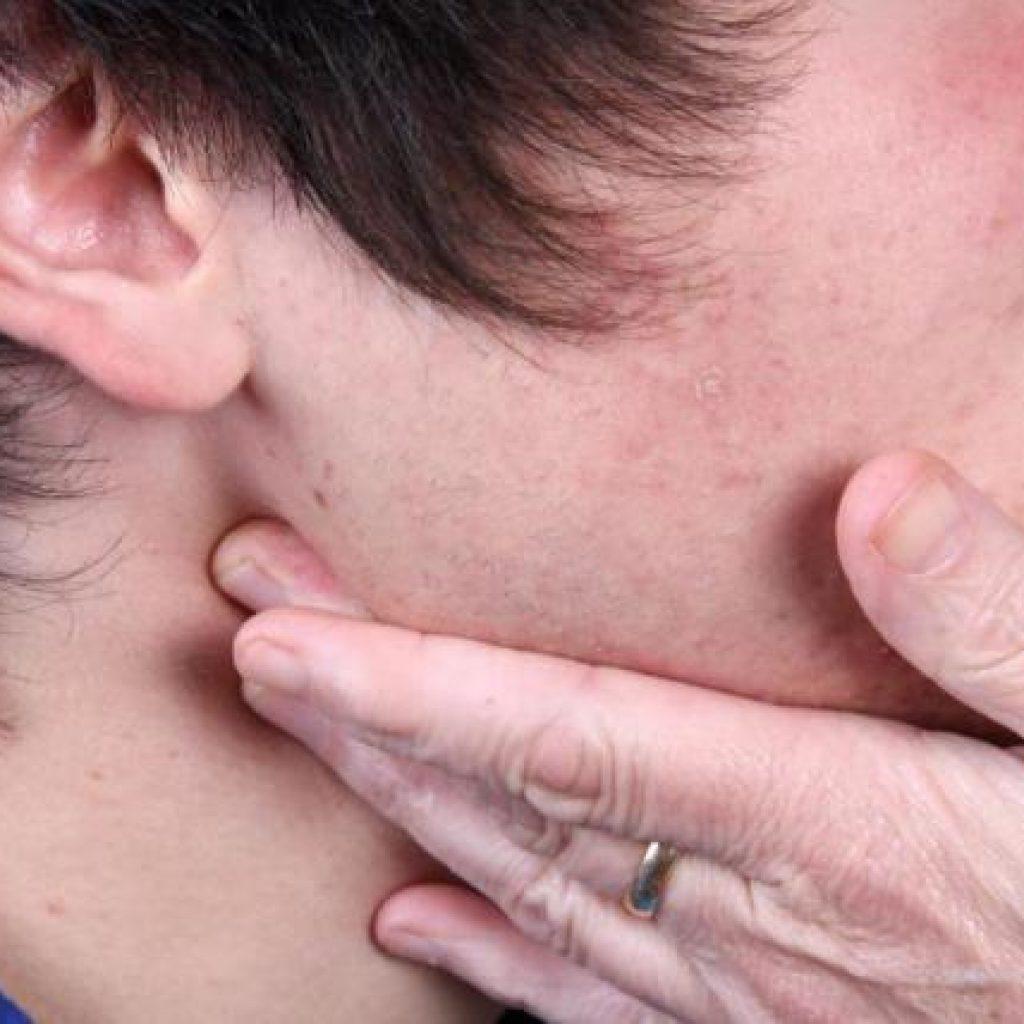

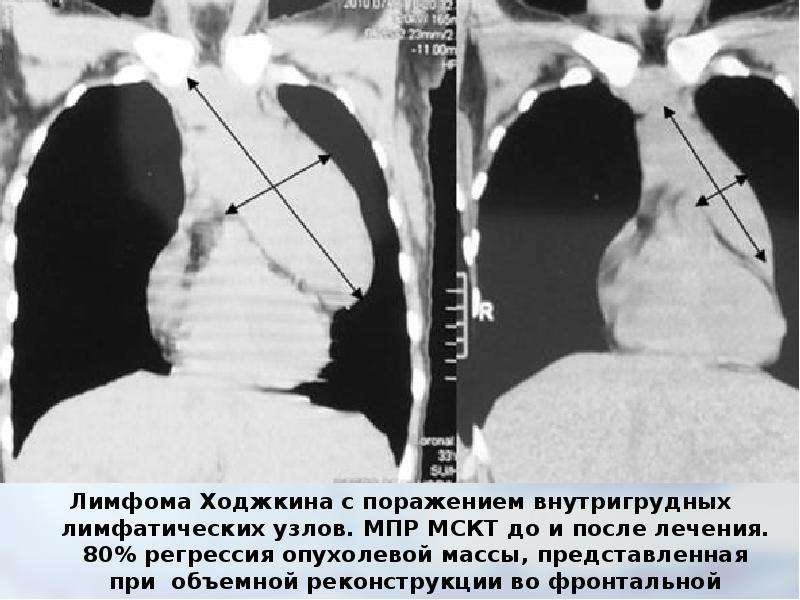
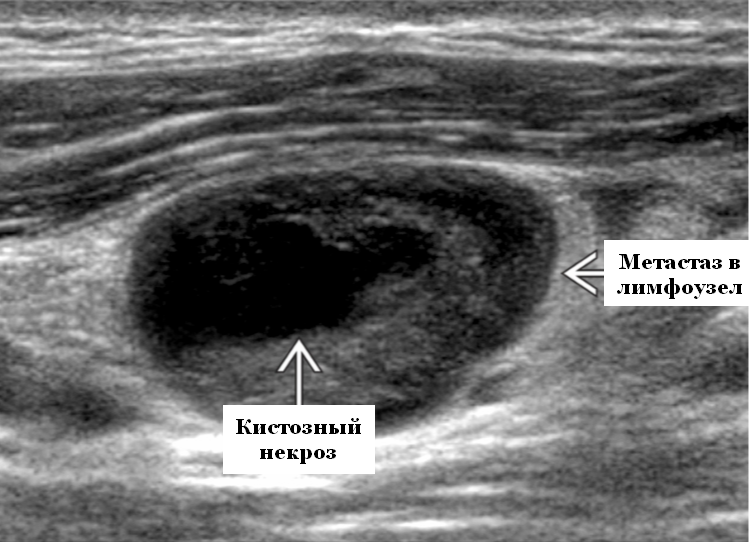 На скорость роста метастатических опухолей влияют такие факторы, как разновидность, размеры, расположение первичного новообразования, возраст и состояние иммунитета больного, анамнез.
На скорость роста метастатических опухолей влияют такие факторы, как разновидность, размеры, расположение первичного новообразования, возраст и состояние иммунитета больного, анамнез.