что это такое, как проводится исследование, методы диагностики заболеваний
Высокотехнологичные лабораторные методы диагностики дают возможность выявить множество заболеваний на самых ранних стадиях. Метод полимеразной цепной реакции (ПЦР) — один из самых новых и точных способов диагностики. За его разработку ученый Кэри Муллис получил в 1993 году Нобелевскую премию. Сегодня этот метод хотя и считается экспериментальным, но уже широко и успешно применяется в медицине.
ПЦР-диагностика: суть подхода
Метод ПЦР использует принципы молекулярной биологии. Его суть заключается в применении особых ферментов, которые многократно копируют фрагменты РНК и ДНК возбудителей болезни, которые находятся в пробах биоматериала, например в крови.
После этого работники лаборатории сверяют полученные фрагменты с базой данных, выявляют тип возбудителя болезни и его концентрацию.
ПЦР проводят в амплификаторе — приборе, охлаждающем и нагревающем пробирки с пробами биоматериала. Нагрев и охлаждение необходимы для проведения репликации. Точность температурного режима влияет на точность результата.
Сферы применения метода
Диагностические возможности метода ПЦР огромны, с его помощью можно выявить самые разные инфекции. Чаще всего ПЦР-метод применяют для диагностики:
- ВИЧ;
- герпеса;
- различных половых инфекций, в частности хламидиоза, уреаплазмоза, гарднереллеза, микоплазмоза и трихомониаза;
- кандидоза;
- гепатитов;
- мононуклеоза;
- листериоза;
- цитомегаловируса;
- туберкулеза;
- вируса папилломы человека;
- клещевого энцефалита.
Это далеко не полный список, метод ПЦР-анализа используется в разных областях медицины.
Кстати
Метод ПЦР применяется не только в медицинских целях. В наши дни он используется и в иных сферах, например в криминалистике, в тех случаях, когда требуется определить, кому принадлежит найденный на месте преступления биоматериал. ПЦР иногда используется также при установлении отцовства.
Преимущества и недостатки подхода
У диагностики методом ПЦР много плюсов:
Высокая чувствительность. Метод позволяет выявить возбудителя болезни даже при наличии нескольких молекул его ДНК, то есть на очень ранних стадиях, при хронической форме заболевания, а так же в случаях, когда болезнь никак себя не проявляет, протекая латентно.
Универсальность. Для проведения ПЦР анализа подходит почти любой биоматериал — от крови и слюны до клеток кожи.
Широкий охват. Исследование одного образца может выявить сразу нескольких возбудителей болезни.
Оперативность. Результат, как правило, готов через 5–7 часов, то есть получить заключение можно уже на следующий день после забора биоматериала.
Точность. Метод ПЦР практически никогда не дает ложноположительных или ложноотрицательных результатов, если была соблюдена технология проведения этого анализа.
Невысокая стоимость. По цене ПЦР-анализ сравним с любыми другими лабораторными анализами крови.
Однако следует понимать, что совершенных методов анализа не бывает. У ПЦР есть и минус — высокие требования к соблюдению технологии и к профессионализму лаборантов. Если образец был загрязнен, анализ может дать ложный результат. Поэтому проводить ПЦР-диагностику лучше только в самых лучших лабораториях, где внедрены системы контроля качества работы.
Исследуемый биоматериал
Для ПЦР-диагностики заболеваний на анализ берут разные виды биоматериала. Выбор зависит от типа инфекции. При анализе на ЗППП методом ПЦР берут соскоб или мазок из шейки матки или уретры, а также мочу. Для выявления герпеса, цитомегаловируса, гепатита, токсоплазмоза и ВИЧ на анализ берут кровь. При анализе на мононуклеоз и цитомегаловирус берут мазок из зева. Спинномозговая жидкость используется для анализа при поражениях нервной системы, для диагностики внутриутробных инфекций исследуются ткани плаценты, для выявления легочных инфекций — мокрота или плевральная жидкость.
Подготовка к исследованию
Методы ПЦР-диагностики заболеваний
Существует немало различных методик ПЦР-диагностики: ПЦР в реальном времени, секвенирование, пиросеквенирование, микрофлюидные технологии. Сейчас наиболее распространенным способом проведения анализа является ПЦР в реальном времени — этот метод практически не допускает ложноположительных результатов, к тому же срок обработки образцов при исследовании таким способом сокращается — результат можно получить уже через час.
Расшифровка результатов
Для пациента результат ПЦР-анализа может быть либо положительным, либо отрицательным. Отрицательный означает, что следов враждебной ДНК не обнаружено и человек здоров. Положительный подразумевает наличие фрагментов ДНК возбудителя болезни — это значит, что человек заражен и ему требуется лечение.
Нередко ПЦР-диагностика дает положительный результат, но пациент не чувствует никакого недомогания, а признаки болезни отсутствуют. Однако это означает не ошибку, а очень раннюю стадию заболевания. В этом случае необходимы дополнительные исследования и лечение. Если заболевание было диагностировано на столь ранней стадии, следует начинать терапию как можно скорее, ведь чем дальше зайдет болезнь, тем сложнее будет ее вылечить.
ПЦР-диагностика инфекций невероятно точна — она позволяет обнаружить возбудителя болезни, даже если в пробе находится всего одна-единственная молекула его ДНК. Именно это качество сделало ПЦР-анализ одним из эффективнейших диагностических инструментов как для определения наличия инфекции, так и для контроля за ходом лечения.
Полимеразная цепная реакция в реальном времени — Википедия
В молекулярной биологии, ПЦР в реальном времени (или количественная ПЦР, англ. Real-time PCR, qPCR, qRT-PCR) — лабораторный метод, основанный на методе полимеразной цепной реакции, используется для одновременной амплификации и измерения количества данной молекулы ДНК. Метод ПЦР в реальном времени включает в себя одновременно детекцию и количественное определение (измерение непосредственно количества копий, либо измерение копий относительно внесённой ДНК или дополнительных калибровочных генов) специфической последовательности ДНК в образце
Метод использует общие принципы ПЦР. Основное отличие состоит в том, что измеряется количество амплифицированной ДНК в реальном времени после каждого цикла амплификации. Для количественного определения используют два метода — флюоресцентные красители, интеркалирующие в двуцепочечные молекулы ДНК, и модифицированные олигонуклеотиды (ДНК-зонды), которые флюоресцируют после гибридизации с комплементарными участками ДНК.
Часто ПЦР в реальном времени комбинируют с ОТ-ПЦР (обратная транскрипция) для измерения малых количеств мРНК, что позволяет исследователю получать количественную информацию о содержании данной мРНК в клетке и, соответственно, позволяет судить об уровне экспрессии данного гена в отдельной клетке или ткани
Процедура очень похожа на процедуру классической ПЦР, то есть присутствуют все стадии реакции — плавление или денатурация двухцепочечных ДНК при температуре 95˚C, отжиг праймеров (температура отжига зависит от используемых праймеров) и элонгация при температуре 72˚С, если используется Taq-полимераза. Принцип ПЦР в реальном времени заключается в детекции ПЦР-продукта по мере его накопления. Сегодня это возможно сделать благодаря высокоспецифичным флуоресцентным зондам. Существует два основных подхода генерации света у таких зондов — во время элонгации и отжига, но, в обоих случаях флуоресценция усиливается с каждым новым циклом. Таким образом, сила сигнала говорит о первоначальном количестве интересующей молекулы[3].
На начальных этапах флуоресценция слабая, так как продукта ещё не очень много, поэтому её трудно отличить от фона. По мере накопления продукта, сигнал растёт сначала экспоненциально, а затем выходит на плато. Выход на плато объясняется нехваткой того или иного компонента реакции — могут закончиться праймеры, нуклеотидилтрифосфаты, метка. Если продукта реакции накопилось слишком много, то лимитирующим фактором может стать фермент, и тогда зависимость количества продукта от цикла станет линейной. Стоит отметить, что в стандартной реакции ПЦР в реальном времени все образцы выйдут на плато и достигнут примерно одного уровня сигнала. Таким образом, конечная точка ничего не скажет о начальном количестве исследуемого образца. С другой стороны, в экспоненциальной фазе можно проследить отличия в скорости роста продукта. Различия в начальном количестве молекул влияют на количество циклов, необходимых для поднятия уровня флуоресценции выше уровня шума[4].
Количество циклов, необходимое для того, чтобы флуоресценция достигла порогового уровня (над шумом) называется СТ-величиной. Пороговый уровень — не строго определённая величина, может подбираться для каждого случая отдельно.
Однако СТ-величина может зависеть от многих случайных факторов, например чувствительности детектора, качество фильтра и так далее. Поэтому точно начальное количество интересующего продукта померить нельзя. Для решения этой проблемы существуют методы нормировки. Измеряют отношение количеств двух молекул в пробе. Нормируют обычно на продукты генов домашнего хозяйства — таких генов, количество которых в клетке всегда примерно одинаковое (Пример — ген infA, кодирующий фактор инициации трансляции у бактерий). Соотношение определяют по следующей формуле: [N0 ]A/[N0 ]B = (1+E)(CTB-CTA)
Где [N0 ]A и [N0 ]B — начальные количества двух образцов, CTB и CTА — соответствующие CT-величины, а E — эффективность ПЦР, которая часто приравнивается к 1 или 0.9[4].
Разнообразие зондов[править | править код]
Мечение двуцепочечной ДНК[править | править код]
В данном случае меткой служит химическое соединение, способное интеркалировать в двойную спираль ДНК. Такой зонд меняет свою конформацию при взаимодействии с продуктами ПЦР и становится флуорофором. Детекцию можно проводить в конце каждого цикла, перед стадией денатурации. Примером такой краски может служить широко используемый SYBR Green.
Метка, работающая в фазу элонгации[править | править код]
Существует другой способ использования зондов, к которым с 5’ и 3’ концов пришиты флуорофор и его гаситель. Если последовательность зонда не очень длинная, то даже в связанном с ДНК состоянии два химических реагента будут взаимодействовать друг с другом, и не будет испускаться флуоресценция. Во время элонгации ДНК полимераза, обладающая 5’-3’-экзонуклеазной активностью, по одному нуклеотиду диссоциирует зонд от ДНК-мишени. В результате этого процесса и флуорофор и его гаситель попадут в раствор, где вероятность нахождения этих веществ рядом будет небольшой, и флуоресценция восстановится[3].
Метки, работающие в фазу отжига[править | править код]
Флуорогенная шпилька[править | править код]
Флуорогенная шпилька — небольшая одноцепочечная молекула ДНК, которая в свободном состоянии способна образовывать [пространственную структуру| вторичная структура ДНК] — шпильку. На один конец цепочки пришивают флуорофор, а на второй — вещество, его гасящее. Последовательность зонда комплементарна ДНК-мишени, которую нужно детектировать. В таком случае те молекулы зонда, которые плавают в растворе, не будут давать флуоресцентный сигнал, а связавшиеся с молекулами ДНК будут претерпевать конформационные изменения, в результате которых произойдет пространственное разнесение флуроофора и его гасителя и восстановление флуоресценции. Детекцию целесообразно проводить после денатурации[3].
Метка, основанная на методе FRET[править | править код]
Другой вариант мечения вновь-образующегося ПЦР-продукта основывается на методе FRET. Основа этого метода — наличие двух зондов, которые связываются с ДНК-мишенью на небольшом расстоянии друг от друга. На 5’-конец одного зонда и 3’-конец второго пришиты флуорофор-донор и флуорофор-акцептор соответственно. При их близком расположении происходит следующее: флуорофор-донор поглощает свет определённой длины волны и испускает свечение в более длинноволновом спектре. Эту волну, в свою очередь, поглощает флуорофор-акцептор и испускает свет, который можно детектировать[3].
Можно также использовать несколько зондов, у которых флуорофоры имеют разные спектры испускания. В таком случае появляется возможность в одной пробирке детектировать сигнал от разных молекул ДНК. Метод носит название множественный ПЦР (multiplex PCR).
ПЦР в реальном времени с реакцией обратной транскрипции[править | править код]
Метод был изобретён для детекции количества ДНК в пробе, однако, последнее время все чаще используется немного видоизменённый количественный ПЦР для детекции РНК. Метод носит название ПЦР в реальном времени с реакцией обратной транскрипции (ОТ-кПЦР , RT-qPCR). Этот метод широко используется для характеризации или сравнения уровней мРНК в разных популяциях[5].
Прежде, чем проводить стандартный ПЦР в реальном времени, нужно провести реакцию обратной транскрипции, для синтеза кДНК. Реакция обратной транскрипции проводится с помощью фермента — обратной-транскриптазы (РНК-зависимой ДНК полимеразы, ревертазы). Реакцию можно проводить без добавления праймера, однако наибольшая эффективность достигается, когда праймер добавлен. Существует три основных типа праймеров:
- Олиго dT праймеры — гибридизуются с polyA последовательностью, которая есть на 3’ -конце многих эукариотических мРНК.
- Случайная последовательность. Обычно используют либо гексамеры, либо нонамеры. Такие последовательности могут транскрибировать все мРНК
- Ген-специфичные праймеры используются, когда исследуется мРНК, экспрессируемая с определённого гена[4].
Реакция обратной транскрипции — ключевой этап в данном подходе, так как количество кДНК должно соответствовать количеству изучаемой мРНК. РНК-молекула менее стабильна, чем ДНК, поэтому при выделении РНК и проведении ОТ-кПЦР нужно тщательно следить за чистотой процедур и не допускать попадания большого количества РНКаз.
Полуколичественная ПЦР[править | править код]
Полуколичественная ПЦР (semi-quantitative PCR) — немного модифицированный метод количественного ПЦР с реакцией обратной транскрипции. Он часто используется для сравнения экспрессии нескольких генов. В данном случае измеряют количество накопленного продукта только в одной точке — после остановки реакции. ПЦР реакция останавливается, когда предполагается, что накопление продукта находится в экспоненциальной фазе роста и ПЦР-продукт можно детектировать. Далее, после электрофореза или саузерн-блота, можно измерить разницу в экспрессии нескольких образцов[5]. Использование данного метода критикуется в профессиональной среде, т.к. данный метод подразумевает оценку «на глазок».
ПЦР в реальном времени широко используется для решения многих исследовательских задач в лабораториях. Кроме того, этот метод нашёл применение в медицине (для диагностики заболеваний) и в сфере биотехнологий (для определения содержания микроорганизмов в продуктах питания и растительных материалах; для детекции ГМО). Также кПЦР используется для генотипирования вирусов и других патогенов человека и определения их количественного содержания.
Диагностические исследования[править | править код]
Количественная ПЦР применяется для быстрого выявления генов или фрагментов ДНК, являющихся маркерами инфекционных заболеваний, генетических отклонений и т. д. Внедрение этого метода в клинические лаборатории значительно улучшило качество диагностики инфекционных заболеваний[6]. Кроме того, кПЦР используется в качестве инструмента для детектирования вновь возникающих заболеваний. Например, новых штаммов гриппа[7].
Использование кПЦР также позволяет проводить количественные измерения и генотипирование (характеристика штаммов) вирусов, например, вируса гепатита B[8]. Степень инфекции, которая оценивается, как число копий вирусного генома на единицу ткани пациента, имеет большое значение во многих случаях. Например, вероятность реактивации вируса простого герпеса типа 1 зависит от количества инфицированных ганглиев[9]. В зависимости от того, интегрировал ли вирус в геном пациента (как, например, в случае вируса папилломы человека) или нет, количественный анализ осуществляется с применением обратной транскрипции или без неё.
Количественная ПЦР также широко используется для детекции опухолевых клеток в материале из со́лидных опухолей[10][11] и даже при некоторых формах лейкемии[12][13].
Выявление циркулирующих опухолевых клеток[править | править код]
Рак молочной железы все ещё является наиболее частой причиной смерти среди раковых больных. Причём, часто смерть вызвана не только самой опухолью, но и возникшими метастазами. Сами метастазы возникают в результате того, что особенные клетки, способные к пролиферации, отделяются от опухоли, выходят в кровяное русло и вторично поселяются в какой-то части организма. Эти клетки называются циркулирующими стволовыми клетками (ЦСТ). Присутствие таких клеток в крови пациентов, больных раком молочной железы, как правило, связано с плохим прогнозом исхода терапии и выживаемости в целом, поэтому является очень важным диагностическим параметром. Но из-за очень низкого количества, выявление ЦСТ — является довольно трудной задачей. И кПЦР, как высокочувствительный метод, может быть использован для решения этой проблемы. Дело в том, что, как и все раковые клетки, ЦСТ имеют эпителиальной происхождение и, следовательно экспрессируют определённый набор генов, отличающийся от окружающих их клеток крови, имеющих мезенхимальное происхождение. Для применения этого метода необходимо определить набор генов-маркеров ЦСТ и оценить их уровень экспрессии[14].
В микробиологии[править | править код]
ПЦР в реальном времени также применяется для микробиологических работ в сфере безопасности продуктов питания, для оценки качества вод (питьевых и сточных) и в сфере здравоохранения[15]. Кроме того, данный метод используется для идентификации кишечной микрофлоры[16].
Научные исследования[править | править код]
В ходе проведения исследований, кПЦР в основном используется для проведения количественных измерений транскрипции генов. Данный метод широко применяется для оценки изменений во времени экспрессии определённого гена, например, в ответ на введение лекарственного средства или изменения условий окружающей среды . Он также используется для определения зиготности трансгенных животных, используемых в исследовании. Для решения некоторых задач данный метод специально модифицируется
кПЦР для определения количества малых ядрышковых РНК (мяРНК)[править | править код]
мяРНК отличаются по свойствам от мРНК тем, что имеют очень малую длину (около 22 нуклеотидов), не имеют консервативной последовательности на концах, при этом мяРНК одной популяции могут отличаться на один или несколько нуклеотидов. Для решения этих проблем используют подходы, основанные на добавлении небольшого участка ДНК (линкера) к кДНК в реакции обратной транскрипции. Затем проводится ПЦР в реальном времени стандартными способами с использованием праймеров, комплементарных линкеру[17].
ПЦР в реальном времени для измерения количества белка[править | править код]
Для измерения количества белка в клетке используют следующий подход:
- Создают два вида антител к целевому белку с пришитыми последовательностями ДНК таким образом, что при взаимодействии с белком, 3’ конец одной последовательности оказывается недалеко от 5’-конца второй ДНК последовательности.
- Получается, что каждой молекуле белка соответствует известная нам последовательность ДНК, количество которой потом можно анализировать с помощью классического кПЦР-анализа[18].
Обнаружение фитопатогенов[править | править код]
Агропромышленность стремится производить семена и рассаду, не содержащую патогенных микроорганизмов, с целью предотвращения экономических потерь и увеличения срока хранения. Поэтому были разработаны системы, позволяющие обнаружить небольшие количества ДНК фитофторы (Phytophthora ramorum), оомицетов и некоторых других патогенов, которые приводят к гибели дубов и других видов растений, в смеси с ДНК растения-хозяина. Возможность различить ДНК возбудителя и растения-хозяина основана на амплификации последовательностей ITS (internal transcribed spacer), внутренних транскрибируемых участков, расположенных в кодирующей области гена рибосомной РНК, которые характерны для каждого таксона[19].
Детекция генетически модифицированных организмов[править | править код]
кПЦР (с использованием обратной транскрипции) может быть использована для детекции ГМО (генетически модифицированных организмов), так как является более чувствительным по сравнению со многими другими методами. При этом специфические праймеры используются для амплификации промотора, терминатора или даже промежуточных последовательностей, используемых в процессе создания вектора. Так как процесс создания трансгенного растения обычно приводит к вставке более, чем одной копии трансгена, его количество также обычно оценивается с помощью кПЦР. При этом в качестве контроля используют растение, содержащее данный ген в единственном экземпляре[20][21].
- ↑ VanGuilder H. D., Vrana K. E., Freeman W. M. Twenty-five years of quantitative PCR for gene expression analysis (англ.) // Biotechniques (англ.)русск. : journal. — 2008. — Vol. 44. — P. 619—626. — doi:10.2144/000112776. — PMID 18474036.
- ↑ Nolan T., Hands R. E., Bustin S. A. Quantification of mRNA using real-time RT-PCR. (англ.) // Nat. Protoc. (англ.)русск. : journal. — 2006. — Vol. 1. — P. 1559—1582. — doi:10.1038/nprot.2006.236. — PMID 17406449.
- ↑ 1 2 3 4 Provenzano M., Mocellin S. Complementary techniques: validation of gene expression data by quantitative real time PCR. (англ.) // Advances In Experimental Medicine And Biology. — 2007. — Vol. 593. — P. 66—73. — doi:10.1007/978-0-387-39978-2_7. — PMID 17265717. [исправить]
- ↑ 1 2 3 Kubista M., Andrade J. M., Bengtsson M., Forootan A., Jonák J., Lind K., Sindelka R., Sjöback R., Sjögreen B., Strömbom L., Ståhlberg A., Zoric N. The real-time polymerase chain reaction. (англ.) // Molecular Aspects Of Medicine. — 2006. — April (vol. 27, no. 2-3). — P. 95—125. — doi:10.1016/j.mam.2005.12.007. — PMID 16460794. [исправить]
- ↑ 1 2 Bustin S. A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. (англ.) // Journal Of Molecular Endocrinology. — 2002. — August (vol. 29, no. 1). — P. 23—39. — PMID 12200227. [исправить]
- ↑ Sails AD (2009). «Applications in Clinical Microbiology». Real-Time PCR: Current Technology and Applications. Caister Academic Press. ISBN 978-1-904455-39-4
- ↑ FDA Authorizes Emergency Use of Influenza Medicines, Diagnostic Test in Response to Swine Flu Outbreak in Humans. FDA News, April 27, 2009.
- ↑ Yeh S. H., Tsai C. Y., Kao J. H., Liu C. J., Kuo T. J., Lin M. W., Huang W. L., Lu S. F., Jih J., Chen D. S., Chen P. J. Quantification and genotyping of hepatitis B virus in a single reaction by real-time PCR and melting curve analysis. (англ.) // Journal Of Hepatology. — 2004. — October (vol. 41, no. 4). — P. 659—666. — doi:10.1016/j.jhep.2004.06.031. — PMID 15464248. [исправить]
- ↑ Sawtell N. M. The probability of in vivo reactivation of herpes simplex virus type 1 increases with the number of latently infected neurons in the ganglia. (англ.) // Journal Of Virology. — 1998. — August (vol. 72, no. 8). — P. 6888—6892. — PMID 9658140. [исправить]
- ↑ Cen P., Ni X., Yang J., Graham D. Y., Li M. Circulating tumor cells in the diagnosis and management of pancreatic cancer. (англ.) // Biochimica Et Biophysica Acta. — 2012. — December (vol. 1826, no. 2). — P. 350—356. — doi:10.1016/j.bbcan.2012.05.007. — PMID 22683404. [исправить]
- ↑ Young R., Pailler E., Billiot F., Drusch F., Barthelemy A., Oulhen M., Besse B., Soria J. C., Farace F., Vielh P. Circulating tumor cells in lung cancer. (англ.) // Acta Cytologica. — 2012. — Vol. 56, no. 6. — P. 655—660. — doi:10.1159/000345182. — PMID 23207444. [исправить]
- ↑ Brüggemann M., Gökbuget N., Kneba M. Acute lymphoblastic leukemia: monitoring minimal residual disease as a therapeutic principle. (англ.) // Seminars In Oncology. — 2012. — February (vol. 39, no. 1). — P. 47—57. — doi:10.1053/j.seminoncol.2011.11.009. — PMID 22289491. [исправить]
- ↑ DiNardo C. D., Luger S. M. Beyond morphology: minimal residual disease detection in acute myeloid leukemia. (англ.) // Current Opinion In Hematology. — 2012. — March (vol. 19, no. 2). — P. 82—88. — doi:10.1097/MOH.0b013e3283501325. — PMID 22314322. [исправить]
- ↑ Andergassen U., Kölbl A. C., Hutter S., Friese K., Jeschke U. Detection of Circulating Tumour Cells from Blood of Breast Cancer Patients via RT-qPCR. (англ.) // Cancers. — 2013. — 25 September (vol. 5, no. 4). — P. 1212—1220. — doi:10.3390/cancers5041212. — PMID 24202442. [исправить]
- ↑ Filion, M (editor) (2012). Quantitative Real-time PCR in Applied Microbiology.Caister Academic Press. ISBN 978-1-908230-01-0.
- ↑ Nobre Giselle, S. Miglioranz Lucia Helena. Probiotics: The Effects on Human Health and Current Prospects (англ.) // Probiotics. — 2012. — 3 October. — ISBN 9789535107767. — doi:10.5772/50048. [исправить]
- ↑ Benes V., Castoldi M. Expression profiling of microRNA using real-time quantitative PCR, how to use it and what is available. (англ.) // Methods (San Diego, Calif.). — 2010. — April (vol. 50, no. 4). — P. 244—249. — doi:10.1016/j.ymeth.2010.01.026. — PMID 20109550. [исправить]
- ↑ Swartzman E., Shannon M., Lieu P., Chen S. M., Mooney C., Wei E., Kuykendall J., Tan R., Settineri T., Egry L., Ruff D. Expanding applications of protein analysis using proximity ligation and qPCR. (англ.) // Methods (San Diego, Calif.). — 2010. — April (vol. 50, no. 4). — P. 23—26. — doi:10.1016/j.ymeth.2010.01.024. — PMID 20215017. [исправить]
- ↑ Baldwin B. G. Phylogenetic utility of the internal transcribed spacers of nuclear ribosomal DNA in plants: an example from the compositae. (англ.) // Molecular Phylogenetics And Evolution. — 1992. — March (vol. 1, no. 1). — P. 3—16. — PMID 1342921. [исправить]
- ↑ Holst-Jensen A., Rønning S. B., Løvseth A., Berdal K. G. PCR technology for screening and quantification of genetically modified organisms (GMOs). (англ.) // Analytical And Bioanalytical Chemistry. — 2003. — April (vol. 375, no. 8). — P. 985—993. — doi:10.1007/s00216-003-1767-7. — PMID 12733008. [исправить]
- ↑ Brodmann P. D., Ilg E. C., Berthoud H., Herrmann A. Real-time quantitative polymerase chain reaction methods for four genetically modified maize varieties and maize DNA content in food. (англ.) // Journal Of AOAC International. — 2002. — May (vol. 85, no. 3). — P. 646—653. — PMID 12083257. [исправить]
- Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. — Москва: Мир, 2002. — 589 с. — ISBN 5030033289.
ПЦР с обратной транскрипцией — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2016; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 декабря 2016; проверки требуют 5 правок. Запрос «RT-PCR» перенаправляет сюда; если вас интересует ПЦР в реальном времени (Real-time PCR), или количественная ПЦР (quantitative PCR), см. ПЦР в реальном времени.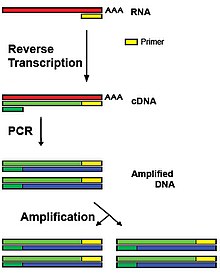
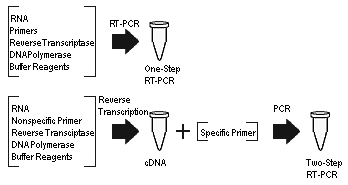 Одноступенчатая против двухступенчатой RT-PCR
Одноступенчатая против двухступенчатой RT-PCR 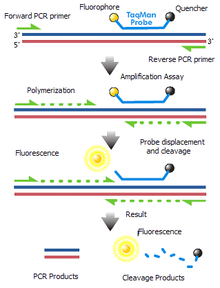 Пробы Такмана
Пробы ТакманаВ молекулярной биологии метод полимеразной цепной реакции с обратной транскрипцией (англ. reverse transcription polymerase chain reaction) принято обозначать как ОТ-ПЦР (англ. RT-PCR). ОТ-ПЦР представляет собой метод амплификации специфического фрагмента рибонуклеиновой кислоты (РНК).[1]
Одноцепочечную молекулу РНК превращают в реакции обратной транскрипции (ОТ, англ. RT, reverse transcription) в комплементарную ДНК (cDNA) и далее амплифицируют уже одноцепочечную молекулу ДНК, используя традиционную ПЦР. RT-PCR не следует путать с ПЦР в реальном времени (англ. Real-time PCR, Q-PCR), которую также иногда неверно сокращают как RT-PCR.[2]
Для превращения последовательности РНК в комплементарную ДНК используют обратную транскриптазу:
- 1. Реакция первой цепочки:
- Комплементарная ДНК (cDNA) образуется на матрице мРНК из dNTP ферментом обратной транскриптазой. Компоненты реакции смешиваются с ДНК-праймером и буфером с обратной транскриптазой на один час при 37 °C.
- 2. Реакция второй цепочки:
- После того как обратная транскрипция закончена и образована cDNA на матрице мРНК, следующие циклы производятся по стандартной методике ПЦР.
После 30 циклов амплификации образуются миллионы копий нужной последовательности.[2]
ОТ-ПЦР используется для обнаружения молекул РНК в образце с заранее известным участком последовательности, комплементарным праймеру. Экспоненциальная амплификация при помощи ОТ-ПЦР является чувствительной методикой, с помощью которой может быть обнаружено малое количество молекул РНК.
Примером являются РНК-вирусы, такие как вирус иммунодефицита человека (ВИЧ), который является ретровирусом и поэтому использует фермент обратную транскриптазу ВИЧ (англ. HIV-Reverse Transcriptase) для синтеза вирусной ДНК, которая затем встраивается в геном хозяина.
Также ОТ-ПЦР широко используется для диагностики генетических заболеваний и полуколичественного определения специфических молекул РНК в клетке или ткани как индикатор экспрессии соответствующих генов[3].
- Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. — Москва: Мир, 2002. — 589 с. — ISBN 5030033289.
сферы применения, подготовка к исследованию, анализы на инфекции
Полимеразно-цепная реакция (ПЦР) – это одно из самых ярких достижений в сфере молекулярной биологии. Метод получил широчайшее распространение в разных областях науки. Благодаря очень высокой специфичности и чувствительности, метод ПЦР применяется в медицине, биологии, ветеринарии, криминалистике, санитарной службе и других отраслях деятельности человека.
Для анализа методом ПЦР можно использовать любые биологические материалы, которые содержат нуклеиновые кислоты (молекулу ДНК или РНК).
Принцип ПЦР- исследования
У каждого живого существа, по крайней мере, на нашей планете, есть уникальный «отпечаток» — ДНК (дезоксирибонуклеиновая кислота), которая отвечает за передачу наследственных факторов от предков к потомкам. Структурно эта молекула представляет собой две нити из молекул-азотитых оснований, удерживаемые рядом друг с другом химическими связями и скрученные в спираль (считается, что для компактности). Из курса биологии вы можете помнить такие названия, как аденин (А), гуанин (Г), тимидин (Т) и цитозин (ц). Это 4 нуклеотида, которые и создают последовательность ДНК. Вирусы хранят свою генетическую информацию в другой нуклеиновой кислоте – РНК.
Информация об уже изученных ДНК и РНК хранится в научных базах лабораторий. После того, как был изобретен метод ПЦР, для многих возбудителей различных заболеваний (бактерии, грибки и вирусы) были созданы свои специфические генетические детекторы (праймеры) — уникальные последовательности нуклеотидов, характерных только для конкретного возбудителя. И если поместить их в пробирку с исследуемым материалом, при наличии в нем ДНК или РНК «живых» возбудителей, праймеры запускают реакцию репликации – создания огромного числа копий, которое можно идентифицировать визуально. Т.е. они начинают копировать свою ДНК/РНК десятки раз.
И при подсчете результатов сотрудники лаборатории могут понять, есть ли искомые бактерии и вирусы в исследуемом образце, или нет, именно поэтому результаты ПЦР чаще всего качественные, т.е. «обнаружено» или «не обнаружено».
Кому мы обязаны появлением метода ПЦР?
Со слов американского биохимика Керри Мюллиса (Kary Mullis), идея идентифицировать живые организмы по короткому участку их генетического кода (ДНК) пришла ему в голову в 1983 году, по пути с работы домой. А в основе этой идеи, лежала работа другого американского биохимика, Артура Корнберга (Arthur Kornberg), которая в свое время не нашла отклика у научного сообщества.
Керри допустил возможность того, чтобы взять молекулу ДНК какого-либо организма, с помощью высокой температуры «распустить» ее спираль на две нити, специфическими маркерами-праймеры пометить уникальные для этого микроорганизма участки ДНК и затем, применив фермент ДНК-полимеразу, создать из двух нитей две новые молекулы ДНК. Но уже содержащие в себе меченные праймеры. И потом останется просто искать эти участки в диагностическом материале.
В итоге, корпорация CETUS, в которой работал Мюлис, выделила ему команду ученых. И в 1985 году, в издании Американского общества генетики человека, появилась публикация с теоретическим обоснованием ПЦР, как метода идентификации генетического материала живых организмов.
Как это все происходит в лаборатории

Выделение ДНК
Сначала пробу биологического материала подготавливают: центрифугируют, осаждают и т.д. Затем лаборантам необходимо выделить ДНК из полученного биологического концентрата.
Амплификация (увеличение числа копий ДНК)
Важнейший этап исследования. Проводится в термоциклере и именно здесь проходят все процессы, подпадающие под определение полимеразно-цепная реакция: денатурация, отжиг, элонгация.
Денатурация
Самый первый этап – развернуть (денатурировать) нуклеиновые кислоты, чтоб сделать их доступными для дальнейшей работы. Осуществляется путем нагрева реакционной смеси до 80-90 °C.
Отжиг
Денатурированные (распущенные) ДНК/РНК обрабатывают праймерами — изготовленными в лабораторных условиях коротенькими цепочками нуклеиновых кислот. Благодаря запрограммированному участку, праймеры прикрепляются только к тем нуклеиновым кислотам, для которых были созданы. Например, праймер для вируса простого герпеса 1 типа, никогда не свяжется с ДНК другого вируса, микроорганизма или клетки.
Именно праймеры обусловливают крайне высокую специфичность ПЦР – способность реагировать только на нуклеиновые молекулы конкретных типов, видов классов и даже штаммов микроорганизмов. Или отдельные виды клеток живых организмов.
Элонгация
Или синтез. После завершения процесса отжига, в реакционной смеси создают условия для активности полимеразы. Фермент, ориентируясь на молекулы праймеров (а не исходных нуклеиновых кислот), начинает синтез новых ниток ДНК/РНК. Которые становятся копиями исходных, искомых молекул нуклеиновых кислот.
Такой температурный цикл проводится 30 и более раз. В результате, даже при изначально небольшом количестве искомого генетического материала, в реакционной смеси накапливается значительное число «помеченных» праймерами нуклеиновых кислот (растет экспоненциально, с удвоением при каждом цикле).Обнаружить большие количества ДНК/РНК намного проще, за счет чего реализуется еще одно преимущество ПЦР – высочайшая чувствительность.
Детекция
Оценка результатов ПЦР проводится несколькими путями:
- Электрофорез в вязкой среде. Суть в том, что ДНК/РНК заряжены электрически и движутся к одному из электродов. В среду (агар или полиакридный гель) добавляют краситель ДНК (например – бромистый этидий). В процессе сеанса электрофореза, молекулы нуклеиновых кислот движутся и формируют скопления, подкрашенные этидием. Под ультрафиолетом, это выглядит в виде полосок разной толщины и яркости.
- Метод гибридизации. Используются праймеры, заранее помеченные люминофором (флуорофором). После нужного числа температурных циклов, применяют специальный прибор – детектор флюоресценции. За счет того, что в образец можно добавлять флуорофоры для разных мишеней (они будут и светиться под ультрафиолетом разным цветом), метод гибридизации подходит для диагностики сразу нескольких мишеней в одном образце.
- ПЦР диагностика в реальном времени (real-time PCR). Отличается тем, что детекция проводится прямо в процессе амплификации. Для этого нужны зонды-люминофоры (из предыдущего пункта) и специальные приборы ДНК-амплификаторы. Эти устройства оценивают нарастание яркости люминофора после каждого температурного цикла и впоследствии, вычисляют исходное число искомых нуклеиновых кислот в образце.
Если мишеней для праймеров в образце не окажется, то температурные циклы пройдут в холостую и при детекции будет получен отрицательный результат.
Преимущества методики ПЦР
Всего разработано более 10 разных методик амплификации, применяемых лабораториями в зависимости от исходных условий и поставленных целей.
Общим для них есть высокая чувствительность (для положительного результата достаточно 40 (!) или менее искомых копий ДНК в 1 мл образца, то есть вероятность ложноотрицательного ответа ничтожно мала. И очень высокая специфичность: вероятность ложноположительного ответа составляет менее 1%.
Но точность результатов сильно зависит от качества сбора диагностического материала, тщательного соблюдения всех технических требований к каждому этапу и качеству оборудования, расходных материалов (буфера, праймеров, раствора для отмывки и т.д.).

Области применения в медицине
В дерматовенерологии ПЦР используют для выявления венерических заболеваний: микоплазменной, хламидийной инфекций, сифилиса, генитального герпеса и др.
Инфекционисты активно используют ПЦР для диагностики туберкулеза, ВИЧ, вирусных гепатитов, герпеса, мононуклеоза, вируса Эпштейн-Барр и др.). А с помощью ПЦР в реальном времени, оценивая вирусную нагрузку, врачи могут составить мнение о динамике заболевания, отклике на лечение, что особенно актуально для пациентов с ВИЧ, принимающих терапию.
Также благодаря ПЦР врачи могут в течение нескольких дней с уверенностью идентифицировать коклюш и паракоклюш, выявить возбудителей эпидемии ОРВИ. Уточняются типы вируса гриппа, циркулирующие на определенной территории, на основании чего появляется возможность разработать эффективную вакцину для каждого сезона гриппа.
В течение суток или быстрее можно установить вид возбудителя кишечной инфекции, а значит – назначить адекватное лечение и обнаружить вероятный источник заражения.
Летом, ПЦР актуальна для диагностики заболеваний, передаваемых иксодовыми клещами: боррелиоза (болезни Лайма), клещевых энцефалитов.
Метод позволяет работать с любым биологическим материалом. Гемотрансмиссивные инфекции (сифилис, ВИЧ, гепатиты, боррелиоз) исследуются по пробе венозной крови или спинномозговой жидкости. Кожные болезни (герпес, грибки) – по соскобу с пораженного участка. Венерические и урологические – по образцу мочи, спермы, влагалищного отделяемого.
Так что в медицине, ПЦР применяется везде, где нужна высокая точность и быстрота получения результатов.
Лабораторные исследования, выполняющиеся методом ПЦР:
пцр диагностика на Инфекции:
Результаты ПЦР: расшифровка и интерпретация.

Результаты ПЦР и особенности их расшифровки интересуют многих людей, чьим диагнозом является подозрение на ЗППП.
Как отмечают доктора, метод обладает высокой результативностью и минимальным процентом ошибок. Поэтому зачастую используется как контрольный в диагностике инфекционных процессов.
В чем состоит суть ПЦР методики, хотят знать больные люди, и благодаря чему обеспечивается высокая вероятность получения верных результатов. Как расшифровываются полученные итоги, и есть ли связь между этим методом и другими способами диагностики?
Содержание статьи
- Суть метода ПЦР
- Какие материалы можно использовать для ПЦР
- Что значит положительный результат ПЦР
- Что значит отрицательный результат ПЦР
- Кто из докторов выполняет расшифровку результатов ПЦР
- Когда показатели ПЦР становятся положительными после заражения
- Вид бланка анализов на ПЦР
- Вероятность ошибочных итогов при ПЦР
- Связь ПЦР с другими методиками
Суть метода ПЦР
ПЦР-методика – исследование, используемое довольно широко в современном мире. Диагностика позволяет поставить диагноз не только при инфекционных процессах, но и при генетических патологиях, некоторых онкологических недугах. Изначально ПЦР изобреталась не для применения в медицине.
В отрасль здравоохранения метод пришел из области молекулярной биологии, в которой активно использовался после своего открытия. Ученый, создавший ПЦР, получил нобелевскую премию.
Прежде чем разбираться, как расшифровывать результаты анализов ПЦР, необходимо понять, в чем основная суть методики.
На самом деле на словах все выглядит довольно просто. У пациента берется биологический материал. Затем он обрабатывается особым образом с помощью специальных химических реагентов.
Затем получившуюся смесь помещают в особую машину, которая проводит процесс амплификации. То есть многократного умножения определенных фрагментов ДНК или РНК, что удалось выявить с помощью добавления реагентов.
Когда процесс амплификации подойдет к концу, доктору остается только идентифицировать полученные результаты, чтобы поставить верный диагноз.
Главное – проявить внимательность на этапе идентификации. Но учитывая, что сегодня большую часть работы делает компьютер, все сильно упрощается.
ПЦР отличается высокой эффективностью. Ее широко применяют для того, чтобы определять наличие в организме скрытых инфекционных процессов, которые не дают положительных серологических реакций. Также скрытые инфекции обычно нельзя выявить с помощью посева или микроскопии. Поэтому зачастую ПЦР – единственный достоверный способ постановки диагноза в этом случае.
Какие материалы можно использовать для ПЦР
Часто удачность исследования зависит от того, как и какой материал брался для выполнения анализа. Однако в случае с полимеразной цепной реакцией расшифровка результатов ПЦР исследований мало зависит от биологического материала, который брался у пациента. Гораздо большее значение имеет подготовка к обследованию с помощью метода.
В качестве материала могут служить:
- кровь, сдаваемая в соответствии со стандартными рекомендациями из вены на локтевом сгибе
- мокрота, собираемая при откашливании
- налет с ротовой полости, собираемый доктором в утреннее время, пока пациент еще не завтракал и не чистил зубы
- мазок с половых органов, дающий хорошие результаты в том случае, если больной не мочился в течение нескольких часов, отказывался от сексуальных контактов несколько дней и соблюдал ряд других рекомендаций
- исследование мочи, при котором биоматериал также предпочтительно собирать с утра, не проводя накануне гигиену половых органов
- биоптаты органов или тканей, получаемые с помощью специальных инструментов и др.
Как отмечают врачи, материалом для ПЦР может быть совершенно любая жидкая среда организма человека.
При выборе главное помнить о том, что предпочтение отдают той среде, где с большей долей вероятности будет присутствовать возбудитель. Например, при половых инфекциях целесообразнее брать мазок с половых органов или кровь, чем мазок из ротовой полости.
Решать вопрос о том, какие материалы используются для получения результатов ПЦР в том или ином случае, лучше всего с лечащим врачом на приеме. Доктор сделает оптимальный выбор, исходя из предполагаемого у пациента заболевания.
Что значит положительный результат ПЦР
ПЦР – метод, который может похвастаться своей высокой специфичностью.
Предположим, доктор поставил себе цель обнаружить какой-то патогенный микроорганизм в теле пациента. И если тот на самом деле присутствует в теле, он будет обнаружен. При этом спутать его с каким-либо другим патогеном благодаря уникальному коду ДНК будет невозможно.
Если ПЦР положительный, значит, в организме с вероятностью почти в 100% находится возбудитель, поиск которого проводился врачом. Ведь методика рассчитана, в отличие от многих других диагностических методов, именно на поиск самих возбудителей, а не их следов.
Как отмечают доктора, при данном исследовании вероятность случайно принять один возбудитель за другой сводится к нулю. Зато существует вероятность получения положительных результатов после терапии.
Если в организме будут оставаться обломки нуклеиновых кислот. Однозначно положительной реакция чаще всего бывает, если пациент предъявляет жалобы на какие-то конкретные симптомы инфекционного процесса. Причем результат будет сохраняться даже в течение нескольких месяцев после того, как возбудитель будет полностью побежден и удален из организма.
Что значит отрицательный результат ПЦР
Если ПЦР результат отрицательный, значительное число пациентов автоматически считают, что они здоровы. Это практически правильное решение.
Это практически правильное решение.
Ведь если итоги оказались отрицательными, значит фрагменты патогенного микроорганизма не были определены тест-системой. Из этого следует логичный вывод, что микроорганизма в теле нет.
Однако стоит учитывать, что несмотря на всю свою высокую чувствительность и специфичность, методика имеет определенный порог чувствительности. Если концентрация возбудителя на момент обследования не переходит границу этого порога, результат будет расцениваться, как отрицательные. Хотя на самом деле окажется ложным до поры до времени.
Доктора акцентируют особое внимание на том, что отрицательный результат не всегда означает отсутствие патологии. Чтобы на 100% быть уверенным в своем здоровье, пройти исследование повторно рекомендуется через несколько недель, а порой и месяцев.
Кто из докторов выполняет расшифровку результатов ПЦР
Часто среди пациентов звучит вопрос о том, какой врач будет проводить расшифровку ПЦР исследования.
В первую очередь необходимо запомнить, что доверять результаты стоит тому же медицинскому работнику, что первоначально давал направление на исследование. Связана эта рекомендация с тем, что в этом случае доктор будет представлять себе, что он ожидает увидеть в анализах. Сможет грамотно интерпретировать итоги, соотнося их с клинической картиной.
Связана эта рекомендация с тем, что в этом случае доктор будет представлять себе, что он ожидает увидеть в анализах. Сможет грамотно интерпретировать итоги, соотнося их с клинической картиной.
Получить направление наиболее часто можно от уролога, гинеколога или венеролога. Соответственно, после получения итогов относить бланк с результатами стоит кому-то из них. Важно помнить, что ПЦР – довольно дорогой метод диагностики. Его не принято использовать просто так, без специальных показаний к обследованию.
Среди них:
- появление специфических для ЗППП симптомов
- обследование перед планированием беременности или процедурой искусственного оплодотворения
- поиск причин бесплодия и другие показания
Когда показатели ПЦР становятся положительными после заражения
Часто пациенты задают на приеме у медицинского работника вопрос о том, когда результаты ПЦР крови и мазков становятся положительными после заражения. Все зависит от того, насколько быстро конкретная инфекция сможет, размножаясь, пройти пороговую для теста концентрацию в материале.
Преимуществом ПЦР является то, что порог чувствительности у теста довольно низкий. Это значит, что выявить признаки заражения можно даже в том случае, если количество возбудителя в биологическом материале будет минимальным.
Подобная особенность дает возможность постановки диагноза даже в период инкубации, когда симптомы еще полностью отсутствуют.
Однако осечка возможна и при применении ПЦР методики. Это происходит, например, если пороговая концентрация все же не успела достичь определяемых тестом значений. В этом случае велика вероятность получения далеких от правды результатов.
Вид бланка анализов на ПЦР
Вопрос о том, как выглядит бланк результатов анализов ПЦР, весьма актуален.
Как отмечают доктора, ничего сложного во внешнем виде бумаги нет. Зачастую на документе можно обнаружить название искомого возбудителя. А напротив него пометку «обнаружен» или «не обнаружен».
В первом случае пациенту рекомендуется озаботиться собственным здоровьем. Так как анализ расценивается как положительный, а человек, как зараженный. Следовательно, ему требуется терапия.
Во втором случае чаще всего состояние пациента оценивают, как здоровое, хотя могут быть и исключения. Важно помнить, что количество возбудителей, указанных на бланке, зависит во многом от того, какое конкретно вид анализа применялся.
Если проводился поиск только одного патогенного микроорганизма, в результате будет фигурировать только его название с соответствующей пометкой. Если ПЦР проводилось сразу на несколько инфекций, что тоже возможно, в бланке будет список патологий с пометками.
Сегодня в лабораториях при комплексном анализе на группу инфекций не принято выдавать на каждый патогенный микроорганизм отдельный бланк. Их все указывают на одном листе.
Вероятность ошибочных итогов при ПЦР
Часто пациенты интересуются вопросом о том, возможно ли получение ложных результатов обследования при использовании методики. К сожалению, как отмечают врачи, ошибки хоть и редко, но случаются.
Существует, например, вероятность получить ложноположительные результаты ПЦР сразу после лечения. Объясняется это очень просто.
Терапия уже окончена, возбудитель удален из организма и не может заражать новые ткани. Однако остатки ДНК или РНК еще могут циркулировать в крови или ином диагностическом материале. В этом случае тест-система будет улавливать их и воспринимать за полноценную патологию, выдавая ложноположительный итог.
Именно поэтому рекомендуется после терапии сдавать исследование несколько раз с разными промежутками времени. Только в этом случае итоги будут достаточно объективными.
Ложноотрицательные результаты анализов ПЦР после приема антибиотиков также возможны. Происходит это в том случае, если пациент, неверно используя препараты антибактериального ряда, смазал симптомы болезни.
Не позволил микроорганизму активно размножаться в теле, но при этом и не довел его уничтожение до конца. В этом случае количество возбудителей может упасть ниже пороговой концентрации чувствительности. Это и даст неверные результаты тестирования.
Связь ПЦР с другими методиками
С помощью метода ПЦР доктора нередко подтверждают или, напротив, опровергают результаты других методов обследования, используемых для диагностики ИППП.
Например, с этой целью может использоваться ИФА.
Бывает так, что ПЦР отрицательный, а ИФА положительный. Тогда больной оказывается в замешательстве относительно своего состояния.
Доктора рекомендуют не теряться, а сначала провести оба теста повторно. Если ИФА останется положительным, а ПЦР отрицательным, с большой вероятностью заболевание в организме пациента отсутствует.
Ведь иммуноферментный анализ направлен на реакцию антиген-антитело. И порой может принимать сходные по структуре антигены других возбудителей за искомый, выдавая ложноположительные результаты.
Вероятность того, что ИФА дало верный результате на второй раз, а ПЦР, напротив, выдало ошибку, например, из-за низкого титра возбудителя, сведена к минимуму. Это скорее казуистика, чем реальная клиническая практика.
Результаты ПЦР диагностики обладают высокой ценностью в диагностике большого количества различных патологий. В первую очередь методика является незаменимой при подозрении на различные ЗППП.
Если вам нужно сдать получить комментарии по результатам ПЦР, обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
Виртуальная ПЦР — Википедия
Материал из Википедии — свободной энциклопедии
Виртуальная полимеразная цепная реакция (ПЦР in silico, цифровая ПЦР, электронная ПЦР, е-ПЦР) — математический метод компьютерного анализа теоретической полимеразной цепной реакции, использующий данные о нуклеотидных последовательностях праймеров (или ДНК-зондов) для предсказания потенциальной амплификации фрагментов исследуемого генома, хромосомы, или любого другого участка ДНК[1][2][3][4][5][2].
Этот инструмент используют для оптимизации подбора праймеров или ДНК-зондов к ДНК-мишени. Праймеры анализируются на наличие участков связывания и определяется степень их комплементарности к ДНК-мишени. Некомплементарные основания в участке связывания праймера с ДНК-мишенью снижают стабильность праймера, так как снижают температуру плавления, а также некомплементарные основания в 3′-конце праймера ингибируют инициацию синтеза ДНК в ПЦР с помощью ДНК-полимеразы Taq, которая не обладает корректирующей 3′,5′-экзонуклеазной активностью. Если же некомплементарные основания находятся только на 5′-конце праймера и праймер стабилен при конкретной температуре отжига, то в этом случае Taq-полимераза будет использовать данный праймер как затравку для начала синтеза ДНК, комплементарной ДНК-мишени.
Потенциально праймер с любой последовательностью нуклеотидных остатков найдёт комплементарные участки связывания на любой геномной ДНК про- или эукариот. Однако, полимеразная цепная реакция не будет проходить эффективно и синтез ПЦР-продукта будет проходить либо линейно (а не экспоненциально), либо не будет проходить вообще. Это связано, во-первых, с тем, что описано выше, для некомплементарных оснований на 3′-конце и стабильностью праймера; и во-вторых, для ПЦР необходимы два близко расположенных праймера, комплементарных обеим цепям и ориентированных 3′-концами друг к другу.
Результат ПЦР in silico с помощью программы jPCR [1][6]. Показаны места отжига праймеров и потенциальный ПЦР-продуктСуществует большое разнообразие программ для виртуальной ПЦР, различающихся по набору функций, простоте использования, эффективности и стоимости[7][8].
Вероятно, наиболее широко используемыми являются инструмент «Electronic PCR» (электронная ПЦР)[7], представленный в свободном доступе на сайте Национального центра биотехнологической информации (NCBI), а также бесплатная программа компании PrimerDigital[9].
С другой стороны, платная программа FastPCR [10] позволяет одновременно тестировать один праймер или набор праймеров (проб), предназначенных для амплификации множественных мишеней. Потенциальные ПЦР-продукты или сайты связывания праймеров могут быть предсказаны как для линейных, так и для кольцевых матриц, для стандартной, обратной или мультиплексной ПЦР. Программа вычислит температуру плавления для праймеров в участке связывания с ДНК-мишенью с некомплементарными основаниями и определит все потенциальные ПЦР-продукты. Можно также анализировать степень комплементарности и взаимодействие праймеров друг с другом.
- ↑ 1 2 Kalendar R., Lee D., Schulman A. H. Java web tools for PCR, in silico PCR, and oligonucleotide assembly and analysis (англ.) // Genomics : journal. — Academic Press, 2011. — Vol. 98, no. 2. — P. 137—144. — doi:10.1016/j.ygeno.2011.04.009. — PMID 21569836.
- ↑ 1 2 Yu B., Zhang C. In silico PCR analysis (неопр.) // Methods Mol Biol (англ.)русск.. — 2011. — Т. 790. — С. 91—107. — doi:10.1007/978-1-61779-176-5_6. — PMID 21779992.
- ↑ Schuler G. D. Sequence mapping by electronic PCR (англ.) // Genome Res (англ.)русск. : journal. — 1997. — Vol. 7. — P. 541—550. — doi:10.1101/gr.7.5.541. — PMID 9149949.
- ↑ Rotmistrovsky K., Jang W., Schuler G. D. A web server for performing electronic PCR (англ.) // Nucleic Acids Res (англ.)русск. : journal. — 2004. — Vol. ;32(Web Server issue). — P. W108—12. — doi:10.1093/nar/gkh550. — PMID 15215361.
- ↑ Bikandi J., San Millan R., Rementeria A., Garaizar J. In silico analysis of complete bacterial genomes: PCR, AFLP-PCR and endonuclease restriction (англ.) // Bioinformatics : journal. — 2004. — Vol. 20. — P. 798—790. — doi:10.1093/bioinformatics/btg491. — PMID 14752001.
- ↑ Kalendar R., Lee D., Schulman A. H. FastPCR software for PCR, in silico PCR, and oligonucleotide assembly and analysis. (англ.) // Methods in molecular biology (Clifton, N.J.). — 2014. — Vol. 1116. — P. 271—302. — doi:10.1007/978-1-62703-764-8_18. — PMID 24395370.
- ↑ 1 2 Electronic PCR (неопр.). NCBI — National Center for Biotechnology Information. Дата обращения 30 марта 2012.
- ↑ UCSC Genome Bioinformatics (неопр.). UCSC Genome Bioinformatics Group. Дата обращения 30 марта 2012. Архивировано 16 сентября 2012 года.
- ↑ jPCR (неопр.). PrimerDigital. Дата обращения 30 марта 2012. Архивировано 16 сентября 2012 года.
- ↑ FastPCR (неопр.). PrimerDigital Ltd. Дата обращения 30 марта 2012. Архивировано 16 сентября 2012 года.
пцр — с английского на русский
ПЦР — См. Реакция цепная полимеразная (Источник: «Словарь терминов микробиологии») … Словарь микробиологии
ПЦР — полимеразная цепная реакция … Словарь сокращений и аббревиатур
ПЦР — Запрос «ПЦР» перенаправляется сюда. Cм. также другие значения. Полимеразная цепная реакция (ПЦР) экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой… … Википедия
ПЦР — Полимеразная цепная реакция (ПЦР) метод лразмножения Источник: Медицинский словарь … Медицинские термины
ПЦР — polimerazinė grandininė reakcija statusas T sritis augalininkystė apibrėžtis DNR fragmentų dauginimas in vitro. atitikmenys: angl. PCR; polymerase chain reaction rus. полимеразная цепная реакция; ПЦР ryšiai: sinonimas – PGR … Žemės ūkio augalų selekcijos ir sėklininkystės terminų žodynas
ПЦР — 3.2.5. ПЦР полимеразная цепная реакция. Источник: МР 4.2.0019 11: Идентификация сырьевого состава мясной продукции … Словарь-справочник терминов нормативно-технической документации
ПЦР — полимеразная цепная реакция … Словарь сокращений русского языка
ПЦР правила — * ПЛР правілы * PCR rules правила, которым необходимо строго следовать при работе с использованием ПЦР метода. Эта необходимость продиктована высокой чувствительностью метода и требованием чистоты эксперимента, т. е. не допускать загрязнения… … Генетика. Энциклопедический словарь
ПЦР-гибридизация in situ — * ПЛР гібрыдызацыя in situ * PCR in situ hybridization or PCR PRINS вариант ПЦР, т. е. полимеразной цепной реакции (см.), когда ДНК амплифицируется и выявляется на морфологически интактных клетках или тканях. Для этого клетки или ткань… … Генетика. Энциклопедический словарь
ПЦР ISSR — * ПЛР ISSR * ISSR PCR or PCR of Inter Simple Sequence Repeats метод, суть которого заключается в том, что в качестве участков отжига праймеров используют микросателлитные локусы, а амплифицируют участки, находящиеся между их инвертированными… … Генетика. Энциклопедический словарь
ПЦР-кариотипирование — * ПЛР карыятыпаванне * PCR karyotyping метод идентификации отдельных хромосом с использованием ПЦР () со специфическими праймерами (см.), напр., с последовательностями Alu семейства альфоидной ДНК и др … Генетика. Энциклопедический словарь