Повышен общий иммуноглобулин Е в крови. Что делать?
Иммуноглобулин E (IgE) – это антитело, которое вырабатывается иммунной системой организма в ответ на предполагаемую угрозу. Это один из пяти классов иммуноглобулинов (A, G, M, D и E) и обычно присутствует в крови в очень небольших количествах. Он вырабатываются специфическими иммунными клетками, называемыми плазматическими клетками.
Физиологическая роль IgE недостаточно хорошо охарактеризована, хотя считается, что он участвует в защите от паразитов, особенно гельминтов.
При каких заболеваниях повышается общий иммуноглобулин Е?
Повышенные концентрации IgE обычно рассматриваются в контексте аллергического заболевания. Однако увеличение количества циркулирующего IgE также можно обнаружить при различных других заболеваниях, включая:
- первичные иммунодефициты,
- инфекции,
- воспалительные заболевания,
- злокачественные новообразования.
IgE может быть повышен при паразитарных инфекциях, поэтому общий тест на IgE иногда используется в качестве скринингового теста, если подозревается паразитарная инфекция.
Для пациентов с установленным диагнозом аллергического заболевания измерение общего IgE необходимо для выявления кандидатов на терапию омализумабом (анти-IgE) и для определения правильной дозировки.
При каких симптомах необходимо измерять общий иммуноглобулин в крови?
Общий тест на IgE может быть назначен, когда у человека наблюдаются периодические или постоянные симптомы, которые могут быть вызваны аллергической реакцией, особенно когда потенциальный аллерген неизвестен. Симптомы могут включать симптомы, предполагающие поражение кожи, органов дыхания и / или пищеварения, такие как:
- Периодический или постоянный зуд
- Крапивница
- Зуд глаз
- Экзема
- Тошнота, рвота, постоянный понос
- Чихание, заложенность носа и насморк
- Симптомы астмы: одышка, хрипы, кашель, стеснение в груди
Общий иммуноглобулин Е и аллергия
Иммуноглобулин Е связан с аллергическими реакциями, включая астму..gif) При аллергии человек реагирует на одно или несколько веществ в окружающей среде, называемых аллергенами, которые обычно не вызывают реакции у других людей. Аллергия может развиваться на пыльцу растений, арахис, яйца, клубника, пчелиный яд и сотни других потенциальных веществ.
При аллергии человек реагирует на одно или несколько веществ в окружающей среде, называемых аллергенами, которые обычно не вызывают реакции у других людей. Аллергия может развиваться на пыльцу растений, арахис, яйца, клубника, пчелиный яд и сотни других потенциальных веществ.
Каждый раз, когда человек с аллергией подвергается воздействию определенного аллергена (-ов) после первоначального воздействия, IgE быстро продуцируется, увеличиваясь до уровней, которые вызывают аллергическую реакцию. Степень тяжести реакции и симптомов, связанных с каждым эпизодом, может варьироваться от локального покраснения и зуда кожи, респираторного дистресса, рвоты и диареи, а в некоторых случаях до угрожающей жизни анафилаксии.
Измерения общего IgE имеют ограниченную полезность для диагностической оценки пациентов с подозрением на аллергическое заболевание, за исключением аллергического бронхолегочного аспергиллеза (AБЛA). AБЛА является реакцией гиперчувствительности к грибам Aspergillus, которая чаще всего встречается у пациентов с астмой или муковисцидозом.
Повышенный уровень общего IgE указывает на наличие аллергического процесса, но не указывает, на что у человека аллергия. В целом, чем в большей степени у человека проявляется аллергия, тем выше может быть общий уровень IgE.
Симптомы e человека во время аллергического эпизода не обязательно коррелируют с общим уровнем IgE этого человека. Повышенная концентрация общего иммуноглобулина E (IgE) не является диагностической для аллергического заболевания и должна интерпретироваться в клиническом контексте пациента, включая возраст, пол, историю путешествий, потенциальное воздействие аллергена и семейный анамнез.
Нормальная концентрация общего IgE не исключает возможности аллергического заболевания. У пациентов с высоким индексом подозрений на аллергическое заболевание может потребоваться тестирование на аллерген-специфические IgE.
Синдром гипериммуноглобилинемии Е
Нечасто может быть назначен тест на IgE, чтобы помочь диагностировать очень редкое наследственное заболевание, называемое синдромом гипериммуноглобулина Е (синдром Джоба).
Что можно сделать, чтобы снизить уровень IgE?
Ограничение контакта с аллергенами может помочь снизить уровень общего иммуноглобулина Е, а также лечение неаллергических состояний, которые могут вызвать его повышение, например, инфекции или глистная инвазия.
Кроме того, при высоких уровнях общего иммуноглобулина Е назначаются биологические препараты, такие как Омализумаб. Омализумаб является гуманизированным моноклональным антителом, полученным из рекомбинантной ДНК, которое селективно связывается с человеческим иммуноглобулином Е (IgЕ). Омализумаб связывается с IgE и предупреждает его связывание с FCεRI-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
Омализумаб связывается с IgE и предупреждает его связывание с FCεRI-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
Анализ на общий иммуноглобулин (IgE)
Общий иммуноглобулин Е (IgE)
Иммуноглобулины класса Е – это антитела, которые принимают участие в развитии аллергической реакции. Повышение уровня содержания иммуноглобулина наблюдается при астме, а также сенной лихорадке, других аллергических проявлениях. Часто причиной повышенного иммуноглобулина является воздействие паразитов (трематодозы, нематодозы, эхинококкоз и другие).
Хемилюминесцентный анализ позволяет установить общий уровень иммуноглобулина Е.
Материал необходимый для анализа: сыворотка крови
Подготовка
В течение 4 часов стоит воздержаться от приема пищи. Накануне, а также в день взятия пробы исключите физическую нагрузку. В этот же период времени нельзя употреблять алкоголь и курить. Можно пить воду без газа.
В этот же период времени нельзя употреблять алкоголь и курить. Можно пить воду без газа.
Показания к назначению
-
диагностика и определение эффективности терапии атопических болезней, гельминтозов;
-
диагностика синдрома гипер IgE;
-
оценка возможности развития атопического заболевания;
-
глубокие ожоги;
-
угнетение иммунной системы, в том числе при СПИДе;
-
злокачественные новообразования в дыхательной системе, желудочно-кишечном тракте/
Интерпретация результатов
Определяется общий уровень иммуноглобулина, что помогает уточнить диагноз и предпринять меры для исправления ситуации. Выявляется степень реактивности:
-
Класс 0 (0,1-0,34 kU/L) – очень низкая
-
Класс I (0,35-0,69 kU/L) – низкая
Класс II (0,7-3,49 kU/L) – умеренная
-
Класс III (3,5-17,49 kU/L) – высокая
-
Класс IV (17,5-52,49 kU/L) – очень высокая
-
Класс V (52,5- 99,99 kU/L) – сверхвысокая
-
Класс VI (более 100) – исключительно высокая
Повышенный уровень иммуноглобулина класса Е является показателем ряда заболеваний и нарушения жизнедеятельности, в том числе, при приеме лекарственных препаратов.
Уважаемые пациенты!
Обращаем Ваше внимание, что стоимость визита к врачу не всегда совпадает с указанной ценой приёма.
Окончательная стоимость приема может включать стоимость дополнительных услуг.
Необходимость оказания таких услуг определяется врачом в зависимости от медицинских показаний непосредственно во время приёма.
Как не допустить превращения аллергии в астму — эксперт
07:4523.09.2019
(обновлено: 10:46 23.09.2019)
326320
СИМФЕРОПОЛЬ, 23 сен — РИА Новости Крым. Неконтролируемый прием антибиотиков и пыльца растений может стать причиной возникновения и развития аллергии у человека. Об этом в эфире радио «Спутник в Крыму» рассказала врач аллерголог-иммунолог Людмила Соколова.
 Аллергическую реакцию может вызвать то, что мы едим, носим, чем дышим, различные факторы, которые не зависят от нас — изменения организма. Один из факторов риска развития аллергических реакций – неконтролируемый прием антибиотиков, которые уничтожают микрофлору, меняется иммунный ответ», — предупредила она.
Аллергическую реакцию может вызвать то, что мы едим, носим, чем дышим, различные факторы, которые не зависят от нас — изменения организма. Один из факторов риска развития аллергических реакций – неконтролируемый прием антибиотиков, которые уничтожают микрофлору, меняется иммунный ответ», — предупредила она. За нейтрализацию веществ, способных вызвать аллергическую реакцию, в организме человека отвечает иммуноглобулин Е, уточняет Соколова. Его повышенный уровень свидетельствует о предрасположенности человека к аллергическим реакциям. Провести такой анализ можно в любой лаборатории, для этого нужно лишь сдать кровь.
«Иммуноглобулин — то, как организм отвечает на разные чужеродные антигены. Иммуноглобулин Е — это неадекватный ответ на какой-то антиген. Он может быть либо нормальным, либо повышенным. Его числовое значение не имеет принципиальной роли. Если есть предрасположенность, то у таких людей шансы «приобрести» аллергию выше. Как правило, у таких людей аллергия поливалентная, то есть, смешанная, может быть и на лекарства, и сезонная, и так далее»,- пояснила эксперт.
Аллергии, по ее словам, в большей степени подвержены молодые люди. Если аллергию не лечить, она может прогрессировать и постепенно перерасти в бронхиальную астму.
«Если с аллергией ничего не делать, у людей с предрасположенностью спектр аллергенов, как правило, расширяется. Например, могла быть только пищевая, а потом присоединилась сезонная аллергия. Сезонная аллергия проявляется риноконъюктивитом и приступами удушья. Опасность в том, что это может перерасти в бронхиальную астму. По статистике, от 40 до 60% больных с аллергическим ринитом заканчивают бронхиальной астмой», — отмечает она.Полностью избавиться от аллергии нельзя, утверждает эксперт. Однако болезнь, по ее словам, можно контролировать: симптоматически лечить аллергические насморки, конъюнктивиты и астму антигистаминными препаратами. Или использовать «специфическую терапию».
Как спастись от сезонной аллергии: советы медика»Идея этой терапии в том, что мы сначала определяем, есть ли у человека высокий уровень иммуноглобулина Е, потом вне сезона, в отсутствии приема человеком противоаллергических препаратов, делаем ему кожные пробы с «актуальными» аллергенами. Определяем конкретный аллерген, и, начиная с низких доз и концентрации, его вводим. При таком введении вместо иммуноглобулина вырабатываются антитела, которые блокируют попадающий аллерген, не вызывая симптомов. Считается, что у 80- 85% пациентов такой метод дает длительную ремиссию — порядка пяти лет», — уточняет Соколова.
Определяем конкретный аллерген, и, начиная с низких доз и концентрации, его вводим. При таком введении вместо иммуноглобулина вырабатываются антитела, которые блокируют попадающий аллерген, не вызывая симптомов. Считается, что у 80- 85% пациентов такой метод дает длительную ремиссию — порядка пяти лет», — уточняет Соколова.Такой метод, по ее словам, разрешен детям с 6 лет, однако противопоказан больным, ранее пережившим анафилактический шок. В период сезонной аллергии эксперт советует соблюдать ряд правил, которые позволят минимизировать вредное воздействие.
«Нужно уменьшать контакт с аллергеном, по возможности, не выезжать в те места, где, например, много амброзии, особенно в ветреную погоду. Убрать из рациона подсолнечник – он может давать перекрестную аллергию с амброзией. Увлажнять нос физрастворами или суспензиями, чтобы уменьшить контакт с аллергеном. В плане лекарственных препаратов лучше обратиться к врачу», — заключила она.
Общий IgЕ (Общий иммуноглобулин E)
Синонимы: определение общего IgЕ, иммуноглобулин Е, иммуноглобулин Е общий, иммуноглобулин класса Е, IgЕ, IgG total, Immunoglobulin E.
Связанные тесты: аллергоскрининг: ингаляционная, пищевая, ингаляционно-пищевая, педиатрическая панели, общий анализ крови.
Исследование позволит вашему врачу:Определение общего IgЕ проводится для выявления аллергии. Также этот показатель используется как дополнительный метод для дифференцировки атопических заболеваний с аллергическим компонентом среди множества патологий, клинически проявляющихся как астма, частые заболевания дыхательных путей, хронический ринит, дерматит, хроническая диарея и другие.
- Дифференцировать аллергические заболевания среди множества патологий, клинически проявляющихся как астма, частые заболевания дыхательных путей, хронические риниты, дерматиты;
- Диагностировать аллергические заболевания;
- Оценить эффективность лечения аллергии;
- Оценить риск развития аллергический реакций у детей;
- Диагностировать иммунопатологические состояния.
- Пищевой аллергии;
- Лекарственной аллергии;
- Аллергии на пыльцу растений;
- Аскаридозе;
- Нематодозе кишечника;
- Эхинококкозе;
- Амебиозе;
- Анкилостомозе;
- Бронхиальной астме;
- Рините;
- Синусите;
- Дерматите;
- Крапивнице;
- Отеке Квинке;
- Высоком уровне эозинофилов;
- Аллергическом бронхолегочном аспергиллезе;
- IgE-миеломе;
- Синдроме Ди Джоржи;
- Узелковом периартрите;
- Синдроме Вискотта-Олдрича;
- Синдроме Джоба-Бакли;
- Синдроме Неймана.

Метод:
Иммуноферментный анализ (ИФА).
Чувствительность:
Не менее 2,5 МЕ/мл.
Материал для исследования:
Сыворотка крови.
Подготовка к исследованиюПоследний прием пищи за 3-4 часа перед сдачей анализа;
Исключить курение за 3 часа до сдачи анализа;
Исключить физическое и эмоциональное напряжение за 30 минут до сдачи анализа.
Особые условия:
Предварительная запись не требуется.
Формат выдачи результата:
Количество IgE общего в 1 мл сыворотки крови (МЕ/мл).
Норма общего IgE:
Дети до года: 3,5 – 4 МЕ/мл;
Дети 1 – 15 лет: не более 50 МЕ/мл;
Дети от 15 лет и взрослые: не более 100 МЕ/мл;
У курящих людей показатели завышены.
Интерпретация результатов:
Для взрослых:
IgE ≤ 25МЕ/мл – атопические заболевания маловероятны;
IgE = 25-100 МЕ/мл – атопические заболевания нельзя исключать;
IgE ˃ 100 МЕ/мл – атопические заболевания весьма вероятны.
Повышенный уровень IgE может свидетельствовать о:
- Аллергических заболеваниях;
- Бронхиальной астме;
- Бронхоспазме;
- Экземе;
- Крапивнице;
- Отеке Квинке;
- Воспалительных заболеваниях кожи;
- Гельминтозе;
- Кандидомикозе;
- Хронической диарее;
- Болезнях иммунной системы;
- Гипер-IgEобщий синдроме;
- Лимфосаркоме.
Пониженный уровень может свидетельствовать о:
- Прогрессирующих опухолях;
- Некоторых разновидностях агаммаглобулинемии.
Комментарий:
Диагноз ставит лечащий врач на основании клинических данных и результатов лабораторных исследований.
IgE общий (Иммуноглобулин Е общий)
Антитела, ответственные за развитие аллергических реакций.
Иммуноглобулины Е вырабатываются локально, преимущественно в подслизистом слое тканей, контактирующих с внешней средой: в коже, дыхательных путях, желудочно-кишечном тракте, миндалинах, аденоидах. Содержание IgE в крови ничтожно мало. Период полураспада этих иммуноглобулинов в сыворотке крови составляет 2 — 3 дня, а в коже — 9 — 14 дней. При попадании в организм аллергена происходит его взаимодействие с IgE. При контакте иммуноглобулинов E, адсорбированных на клетках, с аллергеном образуются комплексы «IgE — специфический антиген», что сопровождается поступлением ионов кальция в клетку-мишень, активацией в ней биохимических процессов и выбросом гистамина и других биологически активных веществ из тучных клеток, базофилов и эозинофилов, на мембране которых фиксированы IgE. Поступление гистамина и других цитотоксических веществ в межклеточное пространство приводит к развитию местной воспалительной реакции, проявляющейся в виде ринита, бронхита, астмы, сыпи или формирует системную реакцию в виде анафилактического шока. Синтез иммуноглобулина Е начинается уже у плода на 11 неделе внутриутробного развития. Через плаценту он не проникает. Высокий уровень IgE в пуповинной крови является индикатором высокого риска атопических заболеваний.
Содержание IgE в крови ничтожно мало. Период полураспада этих иммуноглобулинов в сыворотке крови составляет 2 — 3 дня, а в коже — 9 — 14 дней. При попадании в организм аллергена происходит его взаимодействие с IgE. При контакте иммуноглобулинов E, адсорбированных на клетках, с аллергеном образуются комплексы «IgE — специфический антиген», что сопровождается поступлением ионов кальция в клетку-мишень, активацией в ней биохимических процессов и выбросом гистамина и других биологически активных веществ из тучных клеток, базофилов и эозинофилов, на мембране которых фиксированы IgE. Поступление гистамина и других цитотоксических веществ в межклеточное пространство приводит к развитию местной воспалительной реакции, проявляющейся в виде ринита, бронхита, астмы, сыпи или формирует системную реакцию в виде анафилактического шока. Синтез иммуноглобулина Е начинается уже у плода на 11 неделе внутриутробного развития. Через плаценту он не проникает. Высокий уровень IgE в пуповинной крови является индикатором высокого риска атопических заболеваний.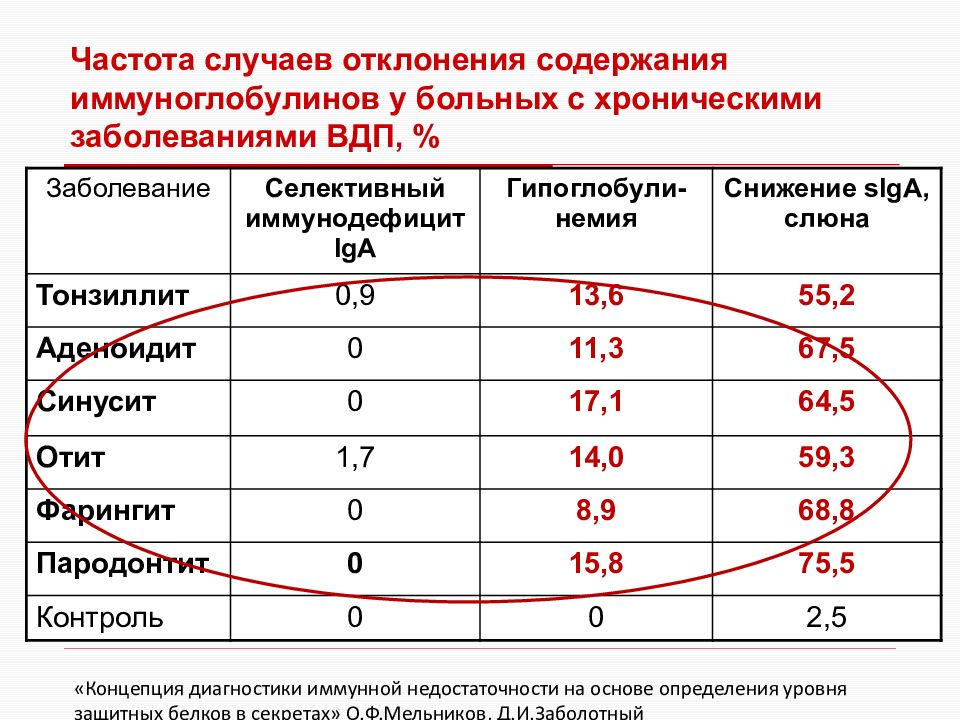
Повышенные уровни общего IgE связаны с гиперчувствительностью немедленного типа. У лиц, страдающих аллергией, IgE повышен, как во время атопических приступов, так и между ними. Концентрация IgE зависит от длительности заболевания и числа предшествующих контактов с аллергеном.
Пределы определения: 1,0 МЕ/мл-20000 МЕ/мл
Предпочтительно выдержать 4 часа после последнего приема пищи, обязательных требований нет. Исследование нежелательно проводить на фоне применения препаратов глюкокортикоидных гормонов (следует проконсультироваться с лечащим аллергологом относительно целесообразности отмены). Антигистаминные препараты не оказывают влияния на результат.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.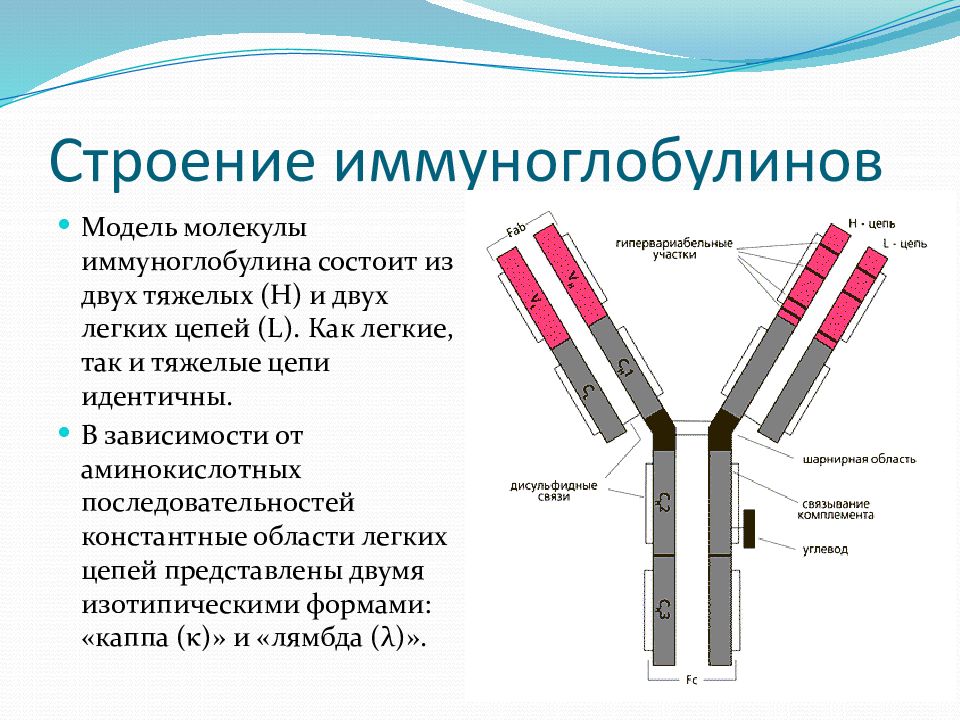 д.
д.
Единицы измерения в медицинском центре СТУДИЯ ДОКТОР: МЕ/мл.
Референсные значения
Возраст | Уровень IgE, МЕ/мл |
| 5 дней — 12 мес. | < 15 |
| 12 мес. — 6 лет | < 60 |
| 6 — 10 лет | < 90 |
| 10 — 16 лет | < 200 |
| дети старше 16 лет и взрослые | < 100 |
Повышение уровня:
аллергические заболевания:
- бронхиальная астма;
- астматический бронхит;
- поллинозы;
- крапивница;
- атопический дерматит;
- отёк Квинке;
- анафилактический шок;
- сывороточная болезнь;
- синдром Лайелла;
- синдром Стивенса — Джонсона;
- лекарственная аллергия;
- пищевая аллергия;
- синдром Вискотта — Олдрича;
- IgЕ- миелома;
- глистные инвазии;
- паразитарные инфекции;
- синдром гипериммуноглобулинемии Е.

Иммуноглобулин E (IgE) общий – что это за анализ и для чего он делается?
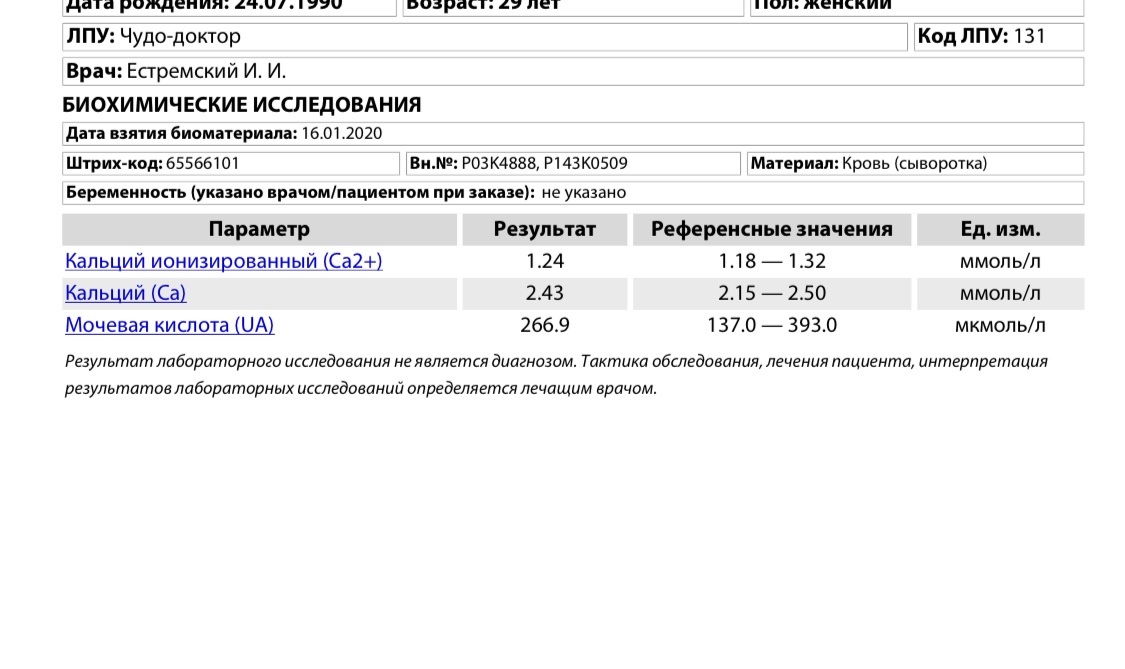
Иммуноглобулины, или специфические белковые антитела – это «стражи» нашей иммунной системы. Когда в организм проникает аллерген или другой чужеродный биоматериал, они реагируют первыми. Все иммуноглобулины делятся на 5 классов. Конкретно IgЕ отвечает за самую часто встречающуюся аллергическую реакцию – ту, которая проявляется немедленно. Кроме этого, он участвует в создании иммунитета против таких видов гельминтов, как: токсоплазмы, нематоды, аскариды, трихинеллы, описторхи.
Соответственно, повышение или понижение иммуноглобулина Е может говорить либо об аллергической реакции в организме, либо об инфицировании гельминтами. Назначают исследование тогда, когда есть необходимость в дифференцированной диагностике этих заболеваний. Направление может выписать терапевт (ребенку – педиатр), а также аллерголог, гастроэнтеролог, пульмонолог, гематолог или ревматолог. Чаще всего анализ на IgЕ назначают, если у пациента есть подозрение на:
- аллергическую бронхиальную астму;
- аллергический ринит;
- атопический дерматит;
- экзему;
- поллиноз;
- аллергию на пищу или лекарства;
- глистную инвазию.

Исследование позволяет точно определить причину заболевания и в дальнейшем бороться уже с его причиной.
Также анализ крови на IgЕ назначают детям, родители которых страдали какой-либо аллергией. По статистике, у ¾ таких детей показатели также будут повышены.
В ряде случаев у ребенка показатели иммуноглобулина Е повышены, но родители аллергиями не страдали. В этом случае ребенок попадает в группу риска. С высокой вероятностью в ближайшие два года у него разовьется аллергия.
Для исследования берут кровь из вены. Какой-либо специфической подготовки к этому исследованию не требуется, нужно лишь соблюдать общие правила подготовки к забору анализов.
Исследование позволяет установить аллергическую природу ряда заболеваний, однако конкретный аллерген выявить таким способом невозможно. Для этого необходимо проводить дополнительные тесты.
Кроме перечисленных выше заболеваний, причинами повышения IgE могут быть также: отек Квинке, анафилактический шок,
крапивница, астматический бронхит, паразитарные инфекции, синдром Стивенса — Джонсона, синдром Лайелла и некоторые другие заболевания.
В ряде случаев IgE может быть понижен. Возможные причины этого: гипогамма-глобулинемия, атаксия-телеангиэктазия,
иммунодефициты.
Резюме: IgE отвечает за развитие аллергической реакции. Анализ назначают при подозрении на аллергическую природу заболевания. Повышенные показатели иммуноглобулина Е чаще всего говорят о наличии аллергии.
По всем вопросам обращайтесь по телефону: +7 (4852) 20-65-50Со слезами на глазах: как победить аллергию
Врач-аллерголог Олимпа здоровья рассказала, что важно знать о самом распространенном недуге XXI века
Всемирная организация здравоохранения прогнозирует, что к 2025 году страдать от аллергии будут 50% населения мира. В России за последние десять лет заболеваемость аллергией возросла на 20% и сейчас, по данным Института иммунологии РФ, ее различные формы диагностированы у 17–30% населения.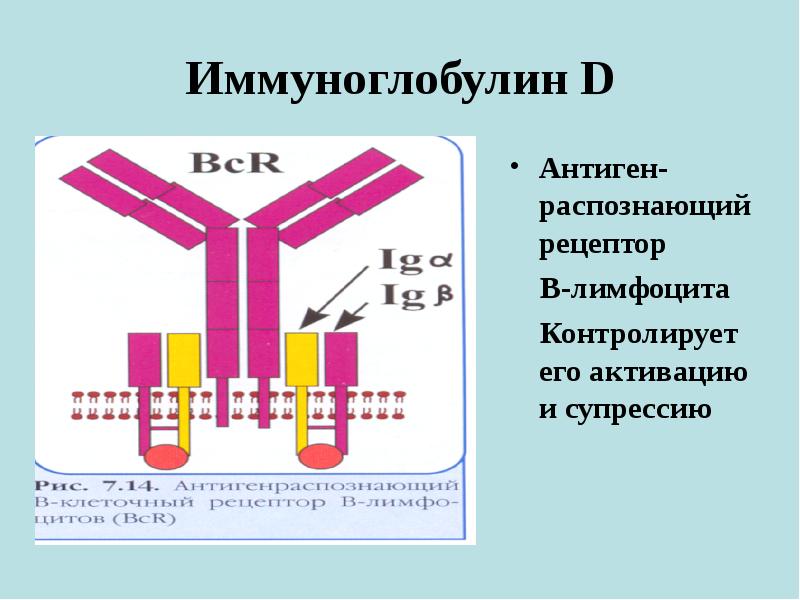 При этом за рамками статистики остаются те, кто предпочитает справляться с болезнью самостоятельно или не подозревает о ее наличии, принимая симптомы аллергии за другие расстройства. Врач — аллерголог-иммунолог Центра семейной медицины «Олимп здоровья» Татьяна Кононова рассказала о природе аллергии, ее проявлениях и заблуждениях, которые связаны с этим недугом.
При этом за рамками статистики остаются те, кто предпочитает справляться с болезнью самостоятельно или не подозревает о ее наличии, принимая симптомы аллергии за другие расстройства. Врач — аллерголог-иммунолог Центра семейной медицины «Олимп здоровья» Татьяна Кононова рассказала о природе аллергии, ее проявлениях и заблуждениях, которые связаны с этим недугом.
Природа возникновения аллергии до сих пор не ясна
По сути, аллергия является иммунным ответом на какой-то внешний раздражитель. Но отчего организм бросается в атаку на безвредные вроде бы вещества, не до конца понятно. Все гипотезы возникновения аллергии, так или иначе, связаны с образом жизни, работой, режимом питания и наследственностью.
– В последние десятилетия актуализировались исследования о связи питания и аллергии, – рассказывает Татьяна Кононова. – У нас в рационе появилось много нетипичных для нашей зоны проживания продуктов, и это повлияло на характер иммунного ответа к новым пищевым ингредиентам. В конце 90-х годов прошлого века появилась гигиеническая гипотеза, объясняющая рост распространенности аллергии снижением микробной нагрузки на организм, начиная с детского возраста в связи с уменьшением размера семьи и улучшением жизненных условий. Согласно этой концепции, перенесенные в первые два года жизни инфекционные болезни, могут оказывать протективное воздействие в отношении развития аллергии. И сейчас уже имеется достаточное число фактов в пользу того, что снижение микробной нагрузки приводит к развитию аллергии с большей вероятностью. Отдельные исследования доказывают, что частое использование антибиотиков блокирует формирование собственного противоинфекционного иммунитета, сдвигая его в сторону «аллергического». Есть научные работы о том, что раннее присутствие длинношерстных (пушистых) домашних животных в окружении младенца также способствует уменьшению вероятности развития аллергии. В отношении наследственного фактора сегодня можно говорить, что он влияет, но не предопределяет развитие аллергии.
В конце 90-х годов прошлого века появилась гигиеническая гипотеза, объясняющая рост распространенности аллергии снижением микробной нагрузки на организм, начиная с детского возраста в связи с уменьшением размера семьи и улучшением жизненных условий. Согласно этой концепции, перенесенные в первые два года жизни инфекционные болезни, могут оказывать протективное воздействие в отношении развития аллергии. И сейчас уже имеется достаточное число фактов в пользу того, что снижение микробной нагрузки приводит к развитию аллергии с большей вероятностью. Отдельные исследования доказывают, что частое использование антибиотиков блокирует формирование собственного противоинфекционного иммунитета, сдвигая его в сторону «аллергического». Есть научные работы о том, что раннее присутствие длинношерстных (пушистых) домашних животных в окружении младенца также способствует уменьшению вероятности развития аллергии. В отношении наследственного фактора сегодня можно говорить, что он влияет, но не предопределяет развитие аллергии.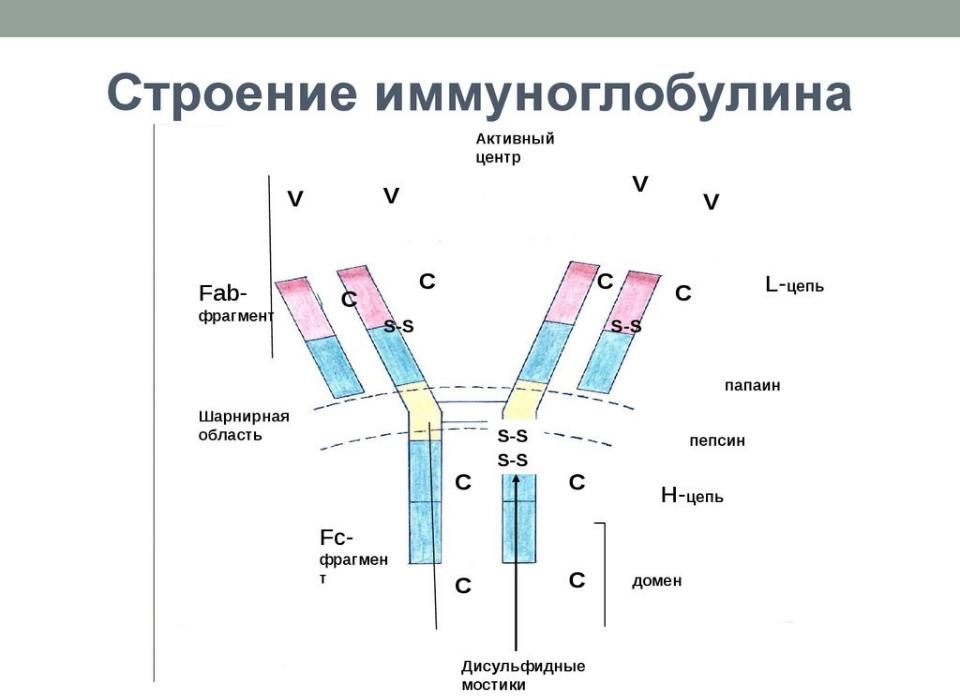 Например, если аллергия есть у матери, ребенок, скорее всего, родится с предрасположенностью к болезни, хотя и не факт, что ее реализует. В то же время даже ребенок из семьи, в которой никто не имел такого недуга, от него не застрахован.
Например, если аллергия есть у матери, ребенок, скорее всего, родится с предрасположенностью к болезни, хотя и не факт, что ее реализует. В то же время даже ребенок из семьи, в которой никто не имел такого недуга, от него не застрахован.
Точность диагностики аллергии возросла почти в два раза
Диагностический инструментарий для аллергии долгие годы остается неизменным – это кожно-скарификационные пробы и иммунологический анализ крови, который позволяет на ранних сроках выявить основные аллергены. В рамках исследования крови изучаются показания общего иммуноглобулина Е (IgE общий) и специфических иммуноглобулинов Е (IgE специфический) – антител, ответственных за развитие аллергических реакций. Выделяют несколько групп аллергенов: шерсть и эпителий животных, бытовые (домашняя пыль, микроклещи), грибковые, пыльцевые и пищевые аллергены, а также аллергены лекарств.
– Диагностика аллергии сегодня вышла на принципиально новый уровень, – поясняет Татьяна Кононова. – Исследование специфических иммуноглобулинов, выполняемое по технологии ImmunoCAP, позволяет измерить аллергию не просто к какому-то конкретному аллергену, но и оценить чувствительность к отдельным аллерго-компонентам.
– Исследование специфических иммуноглобулинов, выполняемое по технологии ImmunoCAP, позволяет измерить аллергию не просто к какому-то конкретному аллергену, но и оценить чувствительность к отдельным аллерго-компонентам.
Эта диагностика на молекулярном уровне сегодня считается золотым стандартом аллергологии. Раньше поиск источника аллергических симптомов затруднял эффект «перекрестной аллергии», возникающий из-за способности одного компонента аллергена присутствовать в разных веществах, из-за чего точность анализа составляла примерно 50%. Технология ImmunoCAP решает эту задачу, анализируя ответ организма на 112 компонентов из 51 источника аллергенов. Сегодня точность этого анализа составляет 90-95%, он не имеет возрастных или каких-либо других противопоказаний к проведению, в отличие, например, от кожных проб, которые проводятся только в период устойчивой ремиссии, вне лекарственной терапии.
– Но, прежде чем сдавать анализы на аллергию, пообщайтесь со своим доктором, – советует Татьяна Кононова.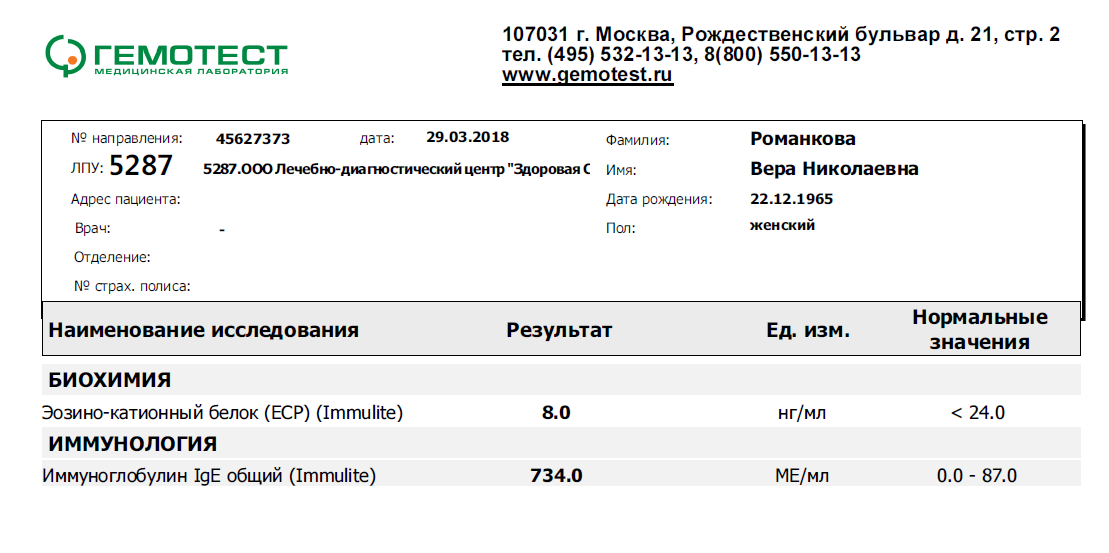 – Не нужно проверяться на все аллергены, и даже повышенный общий иммуноглобулин E – еще не повод для волнений. Он говорит лишь о наличии предрасположенности к аллергии, которая может никогда и не развиться. А хороший аллерголог лечит не анализы, а клиническое проявление болезни.
– Не нужно проверяться на все аллергены, и даже повышенный общий иммуноглобулин E – еще не повод для волнений. Он говорит лишь о наличии предрасположенности к аллергии, которая может никогда и не развиться. А хороший аллерголог лечит не анализы, а клиническое проявление болезни.
Частая заболеваемость может указывать на предрасположенность к аллергии
Обычно при контакте со «своим» аллергеном – погладили кошку, съели «запрещенный» продукт – организм реагирует достаточно бурно и не оставляет сомнения в причине такой реакции. Но до встречи со своим триггером аллергия может не давать о себе знать. В этом случае распознать ее можно по косвенным симптомам.
– Например, ваш организм легко подхватывает любые инфекции. Это само по себе повод для беспокойства и обращения к врачу. Но очень часто в таких случаях дело не в слабом иммунитете, как объясняют себе это многие пациенты, – предупреждает Татьяна Кононова. – Это может быть предвестником аллергии. Существует ряд исследований, показавших, что у большинства часто болеющих детей, как правило, выявлены и аллергические заболевания – ринит или астма, и после хорошей базисной антиаллергической терапии их самочувствие качественно улучшается. У взрослых затяжные симптомы – насморк, чихание, зуд в носовой полости, частые простуды, особенно в «непростудные», теплые месяцы – тоже могут говорить об аллергической предрасположенности.
У взрослых затяжные симптомы – насморк, чихание, зуд в носовой полости, частые простуды, особенно в «непростудные», теплые месяцы – тоже могут говорить об аллергической предрасположенности.
Чаще всего под видом таких вирусных заболеваний протекает поллиноз – аллергическая реакция на пыльцу растений и деревьев. Выделяют три периода поллинации – с конца марта до середины мая, когда цветут деревья, с мая по середину июля – злаковые и луговые травы, с середины июля по октябрь – время цветения сорной травы. Радиус действия растительных аллергенов – почти 1000 км, так что это время одинаково тяжело и городских аллергиков, и для тех, кто живет в сельской местности.
– Поллиноз стремительно «молодеет», – рассказывает Татьяна Кононова. – Если раньше он проявлялся главным образом у подростков и молодых людей в возрасте 20-30 лет, то сейчас мы ставим этот диагноз даже годовалым детям.
Симптоматика поллиноза действительно схожа с простудой – заложенность носа или, наоборот, ринорея, зуд и резь в глазах, иногда – кашель.
– Если врач при таких симптомах советует вам провериться на аллергию, не пренебрегайте этим. Многим пациентам кажется, что, будь у них аллергия, организм сразу дал об этом знать. Но это не всегда так. Аллергические реакции можно разделить на реакции немедленного типа, возникающие между аллергеном и тканями организма сразу же, и аллергические реакции замедленного типа, которые развиваются через несколько часов или даже суток, когда человек может уже не увидеть связи между причинно-значимым аллергеном и последовавшими симптомами. В этом случае прояснить ситуацию поможет анализ.
Связка аллергии с другими болезнями работает и в обратную сторону – то есть аллергические реакции, в свою очередь, могут быть предвестниками тяжелых заболеваний. Например, крапивница, острые симптомы которой перенесли хоть раз в жизни 5-6% населения земного шара, может быть проявлением глистной инвазии, аскаридоза или других не менее серьезных недугов.
Кое-что о псевдоаллергиях
Поскольку многие типичные симптомы аллергии не уникальны, многие пациенты при их появлении автоматически причисляют себя к отряду аллергиков. Например, нередко за аллергию принимают фотодерматоз, который проявляется в виде волдырей, покраснения, зуда и шелушения кожи, возникающих после контакта с солнцем. Его так и называют – аллергия на солнце, хотя в этом случае механизм развития заболевания – не иммунологический. Как такового, аллергического компонента в солнечных лучах нет. Токсическое действие солнца проявляется при взаимодействии солнечных (ультрафиолетовых) лучей с каким-либо веществом, находящимся на коже или в коже. Фотодерматиты могут развиться и на фоне приема некоторых лекарственных препаратов, провоцирующих повышенную чувствительность кожи к воздействию солнечных лучей. Как правило, высыпания возникают на лице, реже на теле, совсем редко – на руках и ногах.
Например, нередко за аллергию принимают фотодерматоз, который проявляется в виде волдырей, покраснения, зуда и шелушения кожи, возникающих после контакта с солнцем. Его так и называют – аллергия на солнце, хотя в этом случае механизм развития заболевания – не иммунологический. Как такового, аллергического компонента в солнечных лучах нет. Токсическое действие солнца проявляется при взаимодействии солнечных (ультрафиолетовых) лучей с каким-либо веществом, находящимся на коже или в коже. Фотодерматиты могут развиться и на фоне приема некоторых лекарственных препаратов, провоцирующих повышенную чувствительность кожи к воздействию солнечных лучей. Как правило, высыпания возникают на лице, реже на теле, совсем редко – на руках и ногах.
– Фотодерматит успешно излечивается, и даже при наличии такого диагноза можно принимать солнечные ванны, – поясняет врач-аллерголог. – Достаточно следовать некоторым правилам – свести к минимуму пользование парфюмерией и косметикой в период пребывания на солнце, избегать загорания с 10 до 16 часов, не делать перед загоранием никаких серьезных косметических процедур – шлифовок, пилингов, а также не принимать лекарственных препаратов, повышающих чувствительность кожи к УФ-лучам. Я советую также пользоваться солнцезащитными кремами, но помнить, что на другой чаше весов – недостаток витамина Д, получаемого с солнечными лучами.
Я советую также пользоваться солнцезащитными кремами, но помнить, что на другой чаше весов – недостаток витамина Д, получаемого с солнечными лучами.
Пищевая непереносимость некоторых продуктов – например, молочного сахара или глютена – еще одна реакция организма, которую часто путают с аллергенной. Но непереносимость – не то же самое, что аллергия. Хотя симптоматически организм реагирует почти одинаково, механизмы, запускающие эти реакции, различны. Например, пищевые аллергии чаще всего «перерастают» или на фоне лечения уходят в устойчивую ремиссию. Первоначально дифференцировать аллергию и непереносимость можно по признаку дозозависимости – аллергии достаточно минимальной дозы для ответа организма, в случае непереносимости доза должна быть более внушительной.
Аллергию можно «приручить»
– Но это небыстрый процесс, – предупреждает Татьяна Кононова. – Речь о лечении методом аллерген-специфической иммунотерапии. Его суть в том, что, вводя в организм микродозы аллергена, мы приучаем иммунную систему перестраиваться и реагировать на этот аллерген нормально.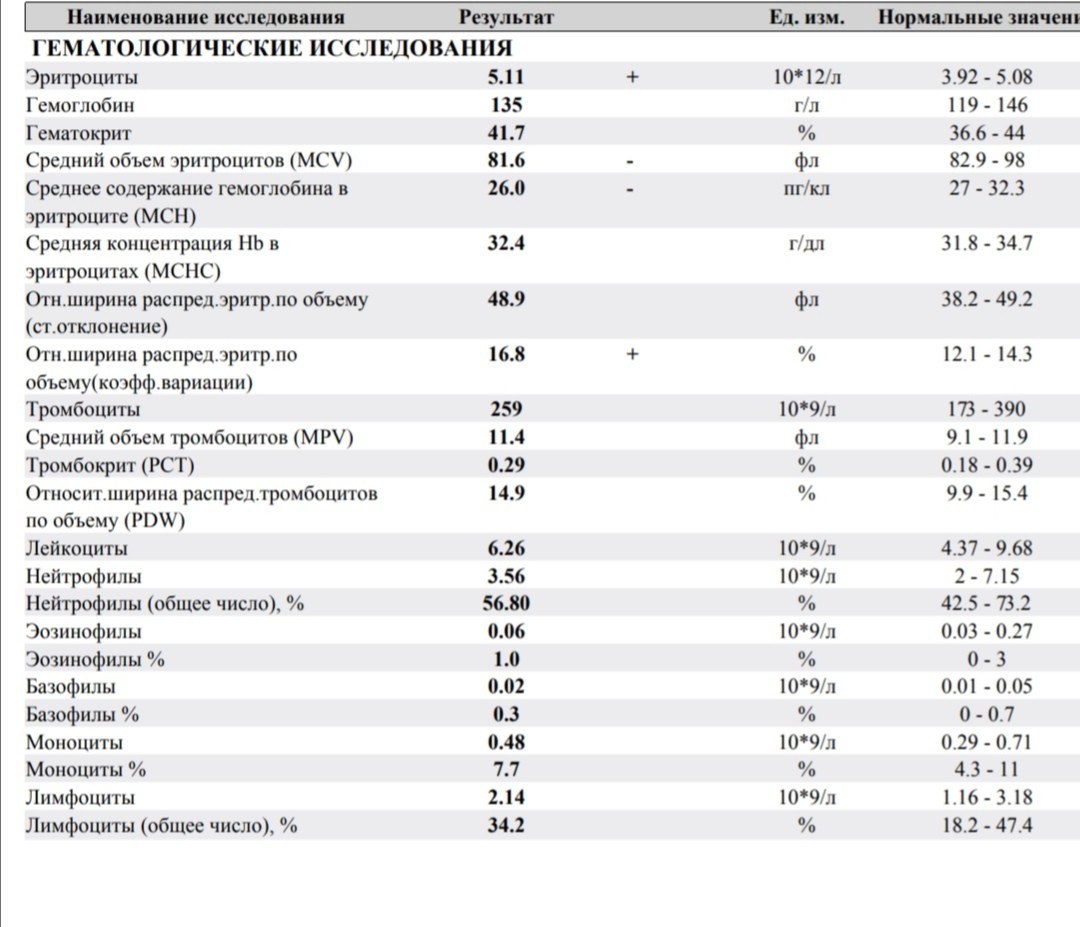 Чем раньше начать такое лечение, тем лучше организм на него откликается, и тем успешнее результат. Нижний возрастной порог, с которого можно проводить аллерген-специфическую иммунотерапию – пять лет, верхнего порога не существует. Этот метод не новый, в 2011 году он отметил свое столетие, но сегодня у него на вооружении – более современные препараты, более точные аллерго-компоненты, более широкий спектр форм – не только уколы, но и капли, таблетки, пластыри. Да, это не волшебная быстродействующая таблетка, о которой мечтают все аллергики – в зависимости от особенностей протекания болезни, лечение длится от трех до пяти лет и требует серьезной вовлеченности от пациента, соблюдения пищевого режима, правил ухода за кожей. А главное – следования этим правилам и ограничениям и после того, как острая стадия болезни уже позади. Но сегодня это – единственный метод, способный скорректировать патогенетический механизм, запускающий аллергию.
Чем раньше начать такое лечение, тем лучше организм на него откликается, и тем успешнее результат. Нижний возрастной порог, с которого можно проводить аллерген-специфическую иммунотерапию – пять лет, верхнего порога не существует. Этот метод не новый, в 2011 году он отметил свое столетие, но сегодня у него на вооружении – более современные препараты, более точные аллерго-компоненты, более широкий спектр форм – не только уколы, но и капли, таблетки, пластыри. Да, это не волшебная быстродействующая таблетка, о которой мечтают все аллергики – в зависимости от особенностей протекания болезни, лечение длится от трех до пяти лет и требует серьезной вовлеченности от пациента, соблюдения пищевого режима, правил ухода за кожей. А главное – следования этим правилам и ограничениям и после того, как острая стадия болезни уже позади. Но сегодня это – единственный метод, способный скорректировать патогенетический механизм, запускающий аллергию.
Аллергию может вызвать любой продукт или явление
ВОЗ выделяет несколько групп пищевых продуктов и ингредиентов, а также их производных, которые чаще всего вызывают гиперсенситивность и всегда должны указываться на маркировке. Это зерновые продукты, содержащие глютен (пшеница, рожь, ячмень, овес, пшеница-спельта или их гибридные разновидности и продукты из них), ракообразные и моллюски, яйца и яичные продукты, рыба, арахисы, соя, молоко и молочные продукты (включая лактозу), лесные орехи, сульфиды в концентрации 10 мг/кг или более.
Это зерновые продукты, содержащие глютен (пшеница, рожь, ячмень, овес, пшеница-спельта или их гибридные разновидности и продукты из них), ракообразные и моллюски, яйца и яичные продукты, рыба, арахисы, соя, молоко и молочные продукты (включая лактозу), лесные орехи, сульфиды в концентрации 10 мг/кг или более.
– При этом важно помнить – неаллергенных продуктов не бывает, – говорит Татьяна Кононова. – Например, организм может принимать без ограничений мед или яйца, но остро реагировать на гречку. На любой продукт может развиться аллергическая реакция – даже на препарат от аллергии!
«Стерильность» – не защита от аллергии
Сделать так, чтобы атмосфера в доме не провоцировала аллергических реакций, вполне можно. Но главное здесь – не переусердствовать, предупреждает врач-аллерголог. Минимальные контакты с потенциальными аллергенами иммунитету все же нужны, поэтому если в доме есть аллергики, не сажайте их под «стеклянный колпак».
– Если говорить о конкретных рекомендациях, то поддерживайте температуру в доме или квартире на уровне 23°– более теплый микроклимат создает благоприятную среду для развития клещей и домашней пыли, к тому же жаркий воздух пересушивает кожу и слизистые, снижая их защитные, а значит – и иммунные функции.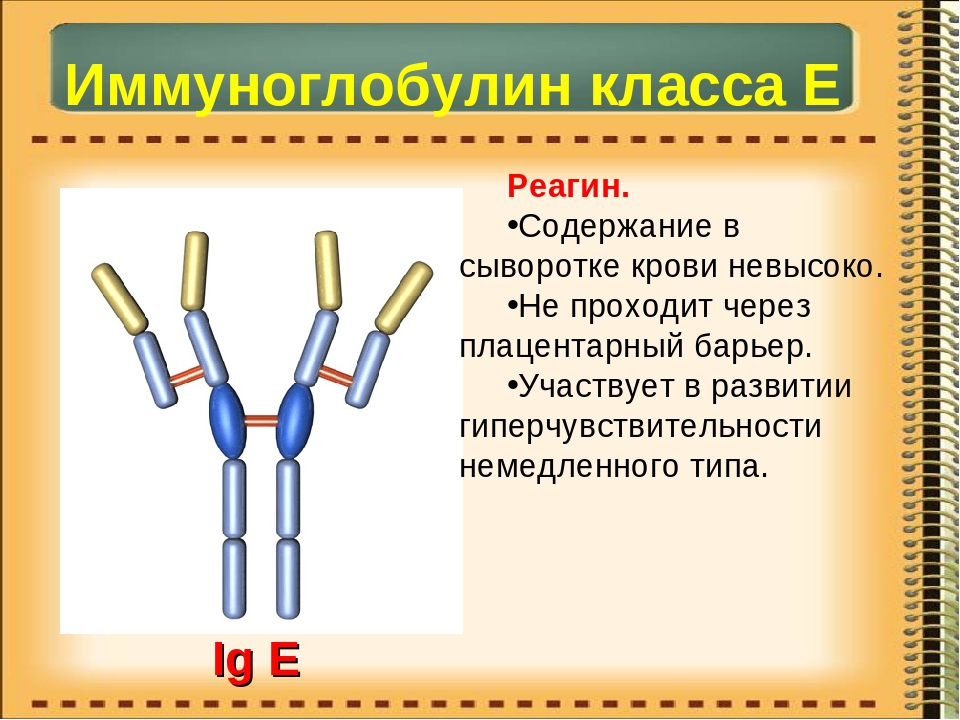 Откажитесь от большого количества комнатных растений в доме, а в спальне – уберите совсем. Ограничьте присутствие в спальне домашних животных, если они есть. Другое дело, если вы только подумываете завести питомца. Еще недавно рекомендации аллергологов были однозначны: если в квартире живут предрасположенные к аллергии люди – никаких домашних животных. Сегодня врачи менее категоричны и все больше склоняются к тому, что кратковременные контакты с животными аллергикам даже полезны. Если ребенок может непродолжительное время быть в цирке или зоопарке без реакции, то можно попробовать завести животное, ограничив зону обитания вашему питомцу. В случае тяжелой аллергии, конечно, от этой идеи нужно отказаться.
Откажитесь от большого количества комнатных растений в доме, а в спальне – уберите совсем. Ограничьте присутствие в спальне домашних животных, если они есть. Другое дело, если вы только подумываете завести питомца. Еще недавно рекомендации аллергологов были однозначны: если в квартире живут предрасположенные к аллергии люди – никаких домашних животных. Сегодня врачи менее категоричны и все больше склоняются к тому, что кратковременные контакты с животными аллергикам даже полезны. Если ребенок может непродолжительное время быть в цирке или зоопарке без реакции, то можно попробовать завести животное, ограничив зону обитания вашему питомцу. В случае тяжелой аллергии, конечно, от этой идеи нужно отказаться.
– Не стоит увлекаться уборкой с использованием антибактериальных средств, стиркой с кондиционерами – они все равно остаются на поверхности и могут быть если не аллергенами, то раздражителями и провокаторами нежелательных реакций организма. И наконец, я категорически не рекомендую курение в квартире и даже за ее пределами – в тамбуре или на балконе. Помимо вреда активного и пассивного курения, все чаще врачи говорят о феномене третичного курения. Речь идет о том, что химические остатки сигаретного дыма – следы никотина, табачных смол и канцерогенов, которые впитывают практически любые поверхности, даже со временем не ослабляют своего вредного воздействия на организм и могут провоцировать развитие различных заболеваний, вплоть до онкологических. И хотя эффект третичного курения на людях еще не изучен, исследования на животных показали, что у мышей, подвергавшихся воздействию остаточных компонентов табака, чаще развивается рак легких, астма, проблемы с печенью и инсулинорезистентность.
Помимо вреда активного и пассивного курения, все чаще врачи говорят о феномене третичного курения. Речь идет о том, что химические остатки сигаретного дыма – следы никотина, табачных смол и канцерогенов, которые впитывают практически любые поверхности, даже со временем не ослабляют своего вредного воздействия на организм и могут провоцировать развитие различных заболеваний, вплоть до онкологических. И хотя эффект третичного курения на людях еще не изучен, исследования на животных показали, что у мышей, подвергавшихся воздействию остаточных компонентов табака, чаще развивается рак легких, астма, проблемы с печенью и инсулинорезистентность.
Аллергию нужно контролировать!
Многие симптомы аллергии не несут прямой угрозы жизни, и в этом, как ни парадоксально, — их главная опасность.
— Аллергия — не просто временные «неудобства», влияющие на качество жизни. Аллергия — серьезный недуг. Это самое важное, что нужно помнить об этом заболевании, в какой бы форме оно не протекало, — предупреждает Татьяна Кононова.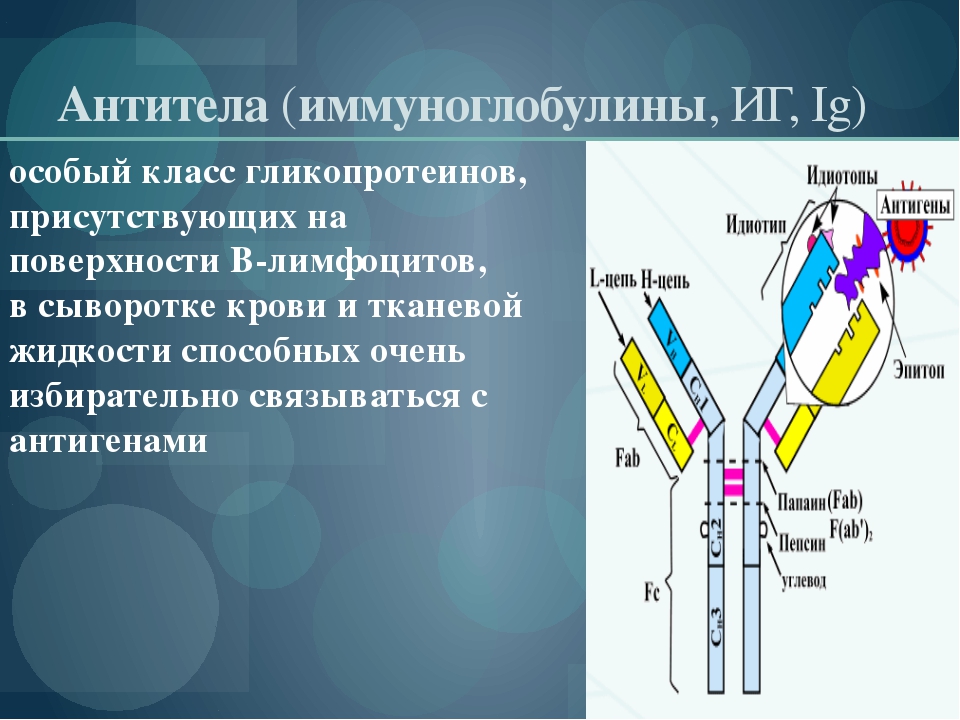 — Не успокаивайте себя тем, что его проявления незначительны, не ждите, что аллергия уйдет с возрастом, если речь идет о ребенке. Аллергия затрагивает важнейший фактор благополучия нашего организма — иммунитет, и это серьезный повод немедленно обратиться к врачу и контролировать вместе с ним весь ход болезни.
— Не успокаивайте себя тем, что его проявления незначительны, не ждите, что аллергия уйдет с возрастом, если речь идет о ребенке. Аллергия затрагивает важнейший фактор благополучия нашего организма — иммунитет, и это серьезный повод немедленно обратиться к врачу и контролировать вместе с ним весь ход болезни.
Имеются противопоказания. Необходима консультация специалиста.
Высокий, низкий и нормальный уровни (Ig) антител
Этот тест проверяет количество определенных антител, называемых иммуноглобулинами, в вашем организме.
Антитела — это белки, которые ваши иммунные клетки вырабатывают для борьбы с бактериями, вирусами и другими вредными захватчиками. Тест на иммуноглобулин может показать, есть ли проблемы с вашей иммунной системой.
Некоторые условия заставляют ваше тело вырабатывать слишком много или слишком мало иммуноглобулинов.
Недостаточное количество иммуноглобулинов в крови увеличивает вероятность заражения.Их слишком много может означать, что у вас аллергия или сверхактивная иммунная система.
Типы иммуноглобулинов
Ваше тело вырабатывает несколько различных типов иммуноглобулиновых антител, в том числе следующие:
Иммуноглобулин A: IgA-антитела обнаружены в слизистых оболочках легких, носовых пазух, желудка и кишечника. Они также находятся в жидкостях, производимых этими мембранами, таких как слюна и слезы, а также в крови.
Иммуноглобулин G: IgG — наиболее распространенный тип антител в крови и других жидкостях организма.Эти антитела защищают вас от инфекции, «запоминая», с какими микробами вы сталкивались раньше.
Продолжение
Если эти микробы вернутся, ваша иммунная система знает, как атаковать их. Ваш врач может проверить наличие IgG, чтобы выяснить, инфицированы ли вы определенными видами бактерий или вирусов.
Иммуноглобулин M: Ваше тело вырабатывает антитела IgM, когда вы впервые заражаетесь новыми бактериями или другими микробами.
Они — первая линия защиты вашего организма от инфекций.Когда ваше тело чувствует захватчика, ваш уровень IgM на короткое время повышается. Затем он начнет падать по мере того, как ваш уровень IgG начнет расти, чтобы защитить вас в долгосрочной перспективе.
Иммуноглобулин E: Ваш организм вырабатывает антитела IgE, когда он чрезмерно реагирует на вещества, которые не являются вредными, такие как пыльца или перхоть домашних животных. Ваш врач, скорее всего, измерит ваш уровень IgE, если у вас будет анализ крови для проверки на аллергию.
Зачем вам может понадобиться этот тест
Ваш врач может назначить тест на иммуноглобулин, если у вас много инфекций, особенно инфекций носовых пазух, легких, желудка или кишечника.
Они также могут заказать тест, если у вас есть:
Как проводится тест
Врачи часто измеряют IgA, IgG и IgM вместе, чтобы получить снимок вашей иммунной функции. Лаборант обычно берет образец крови, вводя иглу в вену на руке. Кровь собирается в пробирку или пузырек.
Другой способ сделать этот тест — взять образец так называемой спинномозговой жидкости (CSF).
ЦСЖ окружает головной и спинной мозг. Врач возьмет образец этой жидкости с помощью люмбальной пункции (часто называемой «спинномозговой пункцией»).
Для этого вы обращаетесь в поликлинику или больницу. Техник сделает вам укол в спину, чтобы обезболить.
Скорее всего, вы будете лежать на боку, подтянув колени к груди, или сидите на столе. Техник вводит полую иглу между двумя позвонками в нижней части позвоночника и удаляет небольшое количество жидкости, чтобы ее можно было проверить.
Что означают мои результаты?
Образец будет отправлен в лабораторию для тестирования. Это может занять несколько дней.
В зависимости от ваших результатов врачу может потребоваться провести другие тесты, например:
Если у вас высокий уровень иммуноглобулина, это может быть вызвано:
Низкий уровень иммуноглобулинов означает, что ваша иммунная система не работает должным образом. ну как надо. Это может быть вызвано следующими причинами:
Тот факт, что у вас высокий или низкий уровень иммуноглобулина, не означает, что у вас есть одно из этих состояний.
Тесты для каждого человека могут отличаться в зависимости от метода, который лаборатория использует для проверки результатов.Поговорите со своим врачом о результатах анализов и узнайте, что вам делать дальше.
Повышенные уровни иммуноглобулинов G, A и M связаны с повышенным риском общей смертности и смертности от конкретных причин: исследование опыта Вьетнама
Задний план: Иммуноглобулины (Ig) необходимы для борьбы с инфекционными заболеваниями. Однако высокие уровни связаны с рядом заболеваний и / или плохим здоровьем, такими как аутоиммунные заболевания, хроническая инфекция, ВИЧ и чрезмерное употребление алкоголя.В настоящем анализе мы расширяем эту работу, исследуя, связаны ли более высокие уровни сывороточных Ig G, A и M с повышенным риском смертности.
Методы: В нем приняли участие 4255 бывших военнослужащих вьетнамской эпохи (исследование Vietnam Experience Study). Из архивов военной службы, телефонных интервью в 1983 году и медицинского обследования в 1986 году были собраны социально-демографические данные и данные о состоянии здоровья.Были взяты современные образцы крови натощак утром, из которых были определены концентрации IgG, IgA и IgM. Наблюдение за смертностью в течение 15 лет привело к смерти от всех причин, смертности от сердечно-сосудистых заболеваний, совокупной смертности от всех видов рака, внешней причине и «другим» причинам (в основном включающим смерти от инфекционных заболеваний). Модели пропорциональных рисков Кокса использовались для расчета HR на SD увеличение Ig, которые сначала корректировались с учетом возраста, а затем дополнительно корректировались с учетом ряда кандидатов, влияющих на искажение.
Полученные результаты: Как правило, в анализах с множественной корректировкой, чем выше концентрация иммуноглобулина, тем выше риск смерти. Таким образом, IgA (HR = 2,0, 95% CI от 1,47 до 2,73), IgM (HR = 1,5, 95% CI от 1,11 до 1,91) и IgG (HR = 5,8, 95% CI от 3,38 до 9,95) были положительно связаны со смертностью от всех причин. Соответствующие результаты для «других» причин смертности составили 4,7 (от 2,64 до 8,19), 3,5 (2.29 до 5,45) и 33,4 (от 15,13 до 73,64).
Выводы: В настоящем исследовании высокие уровни Ig связаны с повышенным риском смерти от общих и «других» причин, в основном от инфекционных заболеваний. Высокий уровень Ig, особенно IgG, может сигнализировать о субклиническом заболевании.
Ключевые слова: ИНФЕКЦИОННОЕ ЗАБОЛЕВАНИЕ; Эпидемиология жизненного цикла; СМЕРТНОСТЬ.
Иммуноглобулины (IgA, IgG, IgM) — понимание теста и ваших результатов
Иммуноглобулины играют ключевую роль в иммунной системе организма. Это белки, вырабатываемые специфическими иммунными клетками, называемыми плазматическими клетками, в ответ на бактерии, вирусы и другие микроорганизмы, а также на воздействие других веществ, которые распознаются организмом как «чужие» вредные антигены. Этот тест измеряет количество иммуноглобулинов A, G и M (IgA, IgG, IgM) в крови и, при определенных обстоятельствах, в спинномозговой жидкости (CSF) или слюне.
Когда человек впервые инфицирован или иным образом подвергается воздействию чужеродного вещества (антигена), его иммунная система распознает микроорганизм или вещество как «чужое» и стимулирует плазматические клетки к выработке специфических иммуноглобулинов, также называемых антителами которые могут связываться с угрозой и нейтрализовать ее. При последующем воздействии иммунная система «запоминает» встреченный антиген, что позволяет быстро производить больше антител и, в случае микроорганизмов, помогает предотвратить повторное заражение.
Существует пять классов иммуноглобулинов и несколько подклассов. Каждый класс представляет группу антител и играет немного разную роль. Классы иммуноглобулинов включают:
- Иммуноглобулин M (IgM) — антитела IgM вырабатываются как первая реакция организма на новую инфекцию или на новый «чужой» антиген, обеспечивая краткосрочную защиту. Они увеличиваются в течение нескольких недель, а затем уменьшаются, когда начинается выработка IgG.
- Иммуноглобулин G (IgG) — около 70-80% иммуноглобулинов в крови составляют IgG.Специфические антитела IgG вырабатываются во время начальной инфекции или воздействия другого антигена, повышаясь через несколько недель после ее начала, а затем уменьшаясь и стабилизируясь. В организме сохраняется каталог антител IgG, которые могут быстро воспроизводиться при воздействии одного и того же антигена. Антитела IgG составляют основу долговременной защиты от микроорганизмов. У людей с нормальной иммунной системой вырабатывается достаточное количество IgG для предотвращения повторного инфицирования. Вакцинации используют этот процесс для предотвращения начальных инфекций и добавления в каталог антител IgG, подвергая человека воздействию ослабленного живого микроорганизма или антигена, который стимулирует распознавание микроорганизма.IgG — единственный иммуноглобулин, который может проходить через плаценту. Антитела IgG матери обеспечивают защиту плода во время беременности и ребенка в течение первых нескольких месяцев его жизни. Существует четыре подкласса IgG: IgG 1 , IgG 2 , IgG 3 и IgG 4 .
- Иммуноглобулин A (IgA) — IgA составляет около 15% от общего количества иммуноглобулинов в крови, но также обнаруживается в слюне, слезах, респираторном и желудочном секрете и грудном молоке.IgA обеспечивает защиту от инфекции в областях слизистой оболочки тела, таких как дыхательные пути (пазухи и легкие) и желудочно-кишечный тракт (желудок и кишечник). Когда он передается от матери к ребенку во время кормления грудью, он помогает защитить желудочно-кишечный тракт ребенка. Значительное количество IgA вырабатывается ребенком только после 6 месяцев, поэтому любой IgA, присутствующий в крови ребенка до этого момента, происходит из материнского молока. Существует два подкласса IgA: IgA 1 и IgA 2 .
- Иммуноглобулин D (IgD) — роль IgD до конца не изучена, и уровень IgD обычно не измеряется.
- Иммуноглобулин E (IgE) — IgE связан с аллергией, аллергическими заболеваниями и паразитарными инфекциями. Он почти всегда измеряется как часть анализа крови на аллергию, но обычно не включается как часть количественного теста на иммуноглобулины.
При тестировании иммуноглобулинов измеряется общее количество каждого основного класса иммуноглобулинов, IgA, IgM и IgG, без различия подклассов.Отдельное тестирование может быть выполнено для измерения подклассов иммуноглобулинов и / или для обнаружения и измерения специфических антител.
Различные состояния могут вызывать повышение (гипергаммаглобулинемия) или снижение (гипогаммаглобулинемия) выработки иммуноглобулинов. Некоторые вызывают избыток или недостаток всех классов иммуноглобулинов, в то время как другие влияют только на один класс. Некоторые из условий передаются от одного поколения к другому (наследуются), а другие приобретаются.
Иммуноглобулины (IgA, IgG, IgM) / Анализ крови / Exeter Clinical Laboratory International
Иммуноглобулины (IgA, IgG, IgM)
Образец
Сыворотка
Особые инструкции
Единицы г / л
Опорный диапазон
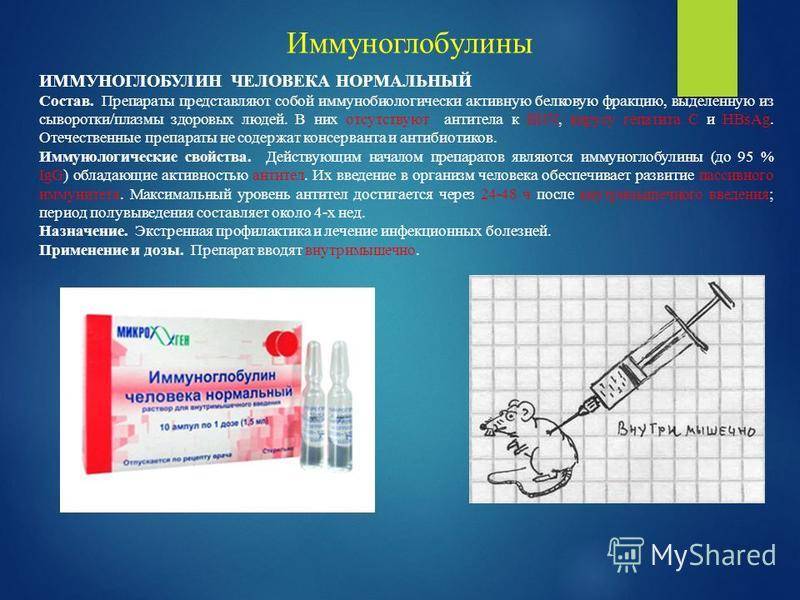
| Возраст | IgA | IgG | IgM |
| До 2 недель | 0.01 — 0,08 | 5,0 — 17,0 | 0,05 — 0,20 |
| 2-4 недели | 0,02 — 0,15 | 3,9 — 13,0 | 0,08 — 0,40 |
| 1-3 месяца | 0,05 — 0,40 | 2,1 — 7,7 | 0,15 — 0,70 |
| 3-6 месяцев | 0,10 — 0,50 | 2,4 — 8,8 | 0,20 — 1,00 |
| 6-9 месяцев | 0,15 — 0,70 | 3,0 — 9.0 | 0,40 — 1,60 |
| 9-12 месяцев | 0,20 — 0,70 | 3,0 — 10,9 | 0,60 — 2,10 |
| 1-2 года | 0,30 — 1,20 | 3,1 — 13,8 | 0,50 — 2,20 |
| 2-3 года | 0,30 — 1,30 | 3,7 — 15,8 | 0,50 — 2,20 |
| 3-6 лет | 0,40 — 2,00 | 4,9 — 16,1 | 0,50 — 2,00 |
| 6-9 лет | 0.50 — 2,40 | 5,4 — 16,1 | 0,50 — 1,80 |
| 9 — 12 лет | 0,70 — 2,50 | 5,4 — 16,1 | 0,50 — 1,80 |
| 12-15 лет | 0,80 — 2,80 | 5,4 — 16,1 | 0,50 — 1,90 |
| 16-45 лет | 0,80 — 2,80 | 6,0 — 16,0 | 0,50 — 1,90 |
| Более 45 лет | 0,80 — 4,00 | 6.0–16,0 | 0,50 — 2,00 |
Запросы на электрофорез иммуноглобулинов и белков
Все подразделения Доверительного фонда находятся в процессе обеспечения того, чтобы они предоставляли рентабельные услуги в рамках все более ограниченных ресурсов. Лаборатория наук о крови продолжает стремиться предоставлять рентабельные услуги, поэтому мы просим направлять конкретные запросы на электрофорез сыворотки и иммуноглобулины, как указано ниже.
Мы рекомендуем делать запросы на электрофорез сыворотки только в том случае, если идентификация или исключение парапротеина в сыворотке (т.е. миелома, MGUS и др.). Количественное определение сывороточного иммуноглобулина проводится только в том случае, если обнаружен парапротеин. Рекомендуется предоставить в лабораторию образец мочи вместе с образцом сыворотки, чтобы можно было идентифицировать свободную легкую цепь (белок Бенс-Джонса) в моче, если таковая имеется.
Запросы на иммуноглобулины следует делать только в контексте системных воспалительных заболеваний и иммунодефицита.
Если иммунодефицит вызывает беспокойство и вы хотите обсудить лучший подход к диагностике или мониторингу лечения этого состояния, пожалуйста, свяжитесь с доктором Клэр Бетьюн, консультантом-иммунологом по телефону 01752 431675 или по электронной почте [email protected]
Электрофорез сыворотки редко будет добавлен дежурным биохимиком на этапе проверки, если это будет сочтено целесообразным. Большинство запросов на электрофорез сыворотки от пациентов с воспалительными или инфекционными заболеваниями имеют низкую специфичность как для диагностики, так и для лечения.
Краткое руководство по устному переводу — ВЗРОСЛЫЕ
Высокий IgA (> 4 г / л)
Повышенные уровни IgA неспецифичны, но могут наблюдаться при воспалительных заболеваниях легких и желудочно-кишечного тракта, некоторых аутоиммунных состояниях, заболеваниях печени и плазматических клетках.
Низкий уровень IgA (<0,8 г / л)
Частичный или полный дефицит IgA поражает до 1% населения и обычно протекает бессимптомно. Пациенты могут иметь несколько более высокий риск желудочно-кишечных заболеваний (включая целиакию), аутоиммунных заболеваний или умеренное увеличение частоты поверхностных инфекций.
Высокий IgM (> 2 г / л)
Повышенный уровень IgM является неспецифическим маркером воспаления, но может быть связан с заболеванием печени
Низкий IgM (<0.5г / л)
Низкие уровни IgM обычно неспецифичны. Значимость этого результата зависит от клинической картины и других лабораторных параметров.
Высокий уровень IgG (> 16 г / л)
Повышенные уровни IgG могут наблюдаться при хронической активной инфекции или воспалении или в связи с нарушениями плазматических клеток.
НИЗКИЙ IgG
IgG 5-5,9 г / л
Легкая гипогаммаглобулинемия обычно неспецифична.Предлагаю повторить через 3 месяца. Предложите проконсультироваться с врачом-иммунологом, если есть рецидивирующие бактериальные инфекции.
IgG 3-4,9 г / л
Умеренная гипогаммаглобулинемия часто связана с рецидивирующими бактериальными инфекциями. Если постоянно низкий, рассмотрите возможность обсуждения с доктором Клэр Бетьюн, консультантом-иммунологом по телефону 01752 431675 или по электронной почте [email protected].
IgG 0-2,9 г / л
Значительная гипогаммаглобулинемия сопряжена с высоким риском серьезных бактериальных инфекций.Предложите сделать общий анализ крови и рассмотреть вторичные причины. Пожалуйста, свяжитесь с доктором Клэр Бетьюн, консультантом-иммунологом по телефону 01752 431675 для обсуждения или напишите по адресу [email protected]
Краткое руководство по интерпретации — ПЕДИАТРИЯ
Высокий уровень IgA (выше нормы)
Повышенные уровни IgA неспецифичны, но могут наблюдаться при воспалительных заболеваниях легких и желудочно-кишечного тракта, некоторых аутоиммунных состояниях, заболеваниях печени и плазматических клетках.
Низкий уровень IgA (ниже нормы)
Частичный или полный дефицит IgA поражает до 1% населения и обычно протекает бессимптомно. Пациенты могут иметь несколько более высокий риск желудочно-кишечных заболеваний (включая целиакию), аутоиммунных заболеваний или умеренное увеличение частоты поверхностных инфекций.
Высокий IgM (выше нормы)
Повышенный уровень IgM является неспецифическим маркером воспаления, но может быть связан с заболеванием печени
Низкий IgM (ниже нормы)
Низкие уровни IgM обычно неспецифичны.Значимость этого результата зависит от клинической картины и других лабораторных параметров.
Высокий уровень IgG (выше нормы)
Повышенные уровни IgG могут наблюдаться при хронической активной инфекции или воспалении или в связи с нарушениями плазматических клеток.
НИЗКИЙ IgG
IgG (<20% ниже нормы)
Легкая гипогаммаглобулинемия обычно неспецифична.Предлагаю повторить через 3 месяца. Если постоянно низкий, проверьте общий анализ крови. Предложите проконсультироваться с врачом-иммунологом, если есть рецидивирующие бактериальные инфекции.
IgG (> 20% ниже нормы)
Гипогаммаглобулинемия часто связана с рецидивирующими бактериальными инфекциями, которые могут быть серьезными. Предложите проверить сыворотку крови и рассмотреть вторичные причины. Обсудите возможность обсуждения со службой клинической иммунологии по телефону 01752 431675.
Срок выполнения
3 дня
Наличие
Локальный тест
Может быть добавлен к существующему запросу в течение 4 дней после получения образца
Минимальный интервал повторения
20 дней
Процедура маркировки образцов
RACGP — Количественные сывороточные иммуноглобулиновые тесты
Ричард К.С. Ло
Сандра Вейл
Эндрю Маклин-Тук
Эта статья является частью нашей серии «Тесты и результаты» за 2013 год, целью которой является предоставление информации об общих тестах, которые регулярно заказывают врачи общей практики.Он учитывает такие аспекты, как показания, что сказать пациенту, что тест может и не может сказать вам, а также интерпретацию результатов.
Что такое тест?
Иммуноглобулины — это белковые молекулы. Они обладают активностью антител и продуцируются терминальными клетками дифференцировки B-клеток, известными как «плазматические клетки». Существует пять классов иммуноглобулинов (Ig): IgG, IgM, IgA, IgD и IgE. В нормальной сыворотке около 80% составляет IgG, 15% — IgA, 5% — IgM, 0.2% — IgD, а след — IgE. 1
Количественные тесты сывороточного иммуноглобулина используются для выявления аномальных уровней трех основных классов (IgG, IgA и IgM). Тестирование используется для диагностики различных состояний и заболеваний, которые влияют на уровни одного или нескольких из этих классов иммуноглобулинов. Некоторые состояния вызывают повышенный уровень, некоторые — недостаток, а другие — сочетание повышенного и пониженного уровней. IgD и IgE в этой статье обсуждаться не будут.
Когда следует заказывать тест?
Сывороточные иммуноглобулиновые тесты используются для оценки антител (гуморальных) иммунодефицитов.Низкий уровень иммуноглобулина называется «гипогаммаглобулинемией». Анализы следует назначать, если у пациента есть симптомы, указывающие на дефицит иммуноглобулина, такие как семейный анамнез иммунодефицита, рецидивирующие, тяжелые или необычные бактериальные инфекции, отсутствие ответа на антибиотики, необычные или рецидивирующие вирусные инфекции и / или хроническая необъяснимая диарея. Пациенты с дефицитом антител особенно предрасположены к рецидивирующим синопульмональным инфекциям, особенно с инкапсулированными полисахаридами организмами, включая Streptococcus pneumoniae и Haemophilus influenzae .Существует множество типов дефицита антител, от изолированного дефицита IgA до серьезного дефицита всех иммуноглобулинов. 2 Они могут возникать как изолированный дефект или как часть более широкого комбинированного иммунодефицита, поражающего как Т-, так и В-клетки.
Сывороточные иммуноглобулиновые тесты могут использоваться для оценки состояний, связанных с хроническим воспалением (например, ревматоидный артрит, системная красная волчанка, аутоиммунное заболевание печени) или хронических инфекций (например, гепатит C, ВИЧ). 3 Анализы также следует заказывать вместе с другими тестами, включая электрофорез сыворотки и мочи, при подозрении на В-клеточную злокачественность, такую как миелома, лимфома или хронический лимфолейкоз (ХЛЛ).
Измерение IgM у новорожденного может помочь в диагностике врожденной или неонатальной инфекции.
В зависимости от состояния (например, миелома) также могут периодически назначаться тесты на сывороточный иммуноглобулин для отслеживания прогрессирования заболевания.
Когда не следует заказывать тест?
В остальном здоровые и благополучные дети, часто болеющие «простудными заболеваниями», не нуждаются в измерении уровня иммуноглобулинов.В Австралии у нормальных здоровых малышей может быть до 12 инфекций в год. Число инфекций увеличивается, если ребенок посещает детский сад, имеет старших братьев и сестер и / или курящих родителей.
Как работает тест?
Нефелометрия и турбидиметрия являются наиболее широко используемыми методами из-за их скорости, простоты использования и точности. И в нефелометрии, и в турбидиметрии источник света проецируется через жидкий образец в прозрачном контейнере. Турбидиметрия измеряет уменьшение интенсивности света, а нефелометрия измеряет рассеивание света при его прохождении через образец, которое пропорционально концентрации иммуноглобулина в растворе.Лабораторные уровни могут варьироваться в зависимости от лаборатории из-за различий в методах тестирования.
Что означают результаты?
Уровни IgG, IgA и IgM обычно оцениваются вместе. Ненормальные результаты тестов указывают на то, что что-то влияет на иммунную систему, и могут указывать на необходимость дальнейшего тестирования. Аномальные Ig не являются диагностическими, но могут, в сочетании с соответствующим клиническим анамнезом и результатами других тестов, быть надежным индикатором заболевания или состояния.
Существует ряд состояний, связанных со снижением и повышением уровня иммуноглобулинов.
Дефицит иммуноглобулина
Первичные (наследственные) — менее распространенные заболевания, при которых организм не может вырабатывать один или несколько классов иммуноглобулинов
Вторичный (приобретенный) — наиболее частые причины гипогаммаглобулинемии возникают в результате основного состояния, которое либо влияет на способность организма вырабатывать Ig, либо увеличивает потерю Ig из организма (, таблица 1, ).
| Состояния, вызывающие аномальную потерю или повышенный катаболизм иммуноглобулина |
|
| Условия / факторы, влияющие на выработку иммуноглобулинов |
|
Гипогаммаглобулинемия чаще возникает из-за вторичных, а не первичных причин. 4 Вторичные причины включают нефротический синдром, энтеропатии с потерей белка, сепсис и злокачественные новообразования ( Таблица 1 ). У пациентов, у которых наблюдается потеря иммуноглобулина в почечных путях или кишечнике, IgM имеет тенденцию оставаться нормальным, поскольку он сохраняется из-за своего большого размера.
Существует большое количество первичных гуморальных иммунодефицитов, при которых иммуноглобулины проявляют легкие или глубокие изменения (обычно уменьшаются, иногда повышаются). 5 Селективный дефицит IgA является одним из наиболее распространенных иммунодефицитов и встречается с частотой 1: 500. 5 Лабораторные исследования показывают неопределяемый IgA и нормальные IgG и IgM. Это открытие часто обнаруживается случайно, например, при тестировании на целиакию. У большинства пациентов симптомы отсутствуют, а у некоторых могут быть рецидивирующие синопульмональные инфекции в более позднем детстве. Поскольку сывороточные уровни IgA не достигают уровня взрослых до 8 лет, диагноз дефицита IgA не следует ставить у детей младше 4 лет.
УровеньIgG падает в течение первых 6 месяцев жизни, так как уровень антител, приобретенных матерью через плаценту, падает (нормальная физиологическая гипогаммаглобулинемия).У недоношенных детей меньше материнского IgG, и они могут достигать нижнего надира. В некоторых случаях нормальное постепенное повышение уровня IgG у младенца в первый год жизни задерживается (так называемая преходящая гипогаммаглобулинемия младенчества). 5 Уровни Ig обычно восстанавливаются к 2 годам, хотя это может быть отложено, пока ребенку не исполнится 8 лет. У этих пациентов IgM обычно в норме.
Пациенты с Х-связанной агаммаглобулинемией обычно имеют низкие или неопределяемые уровни всех основных иммуноглобулинов из-за аномалий развития В-клеток, что приводит к отсутствию или значительному снижению количества В-клеток. 5 Симптомы обычно впервые появляются в возрасте от 4 до 8 месяцев, когда уровень IgG, полученного трансплацентарно от матери, снижается.
Общий вариабельный иммунодефицит — наиболее часто встречающийся тяжелый дефицит антител, поражающий как детей, так и взрослых. 5 Он имеет различный возраст начала, обычно к третьему десятилетию, хотя часто существует значительная задержка между симптомами и диагнозом. У этих пациентов наблюдается гипогаммаглобулинемия (низкий уровень IgG с низким уровнем IgA и / или IgM), слабый специфический ответ антител на вакцинацию и повышенная частота аутоиммунных заболеваний, особенно аутоиммунных цитопений из-за нарушения регуляции иммунного ответа.
Избыток иммуноглобулина
Причины повышения уровня иммуноглобулинов:
- Повышенное содержание поликлональных иммуноглобулинов, возникающих из многих различных иммунных (плазматических) клеток
- увеличило количество моноклональных иммуноглобулинов в результате пролиферации одного клона плазматических клеток.
Эти причины дополнительно поясняются в таблице 2 .
| Результат иммуноглобулина | Сопутствующие состояния |
|---|---|
Поликлональное увеличение любого или всех трех классов (IgG, IgA и / или IgM) | Инфекции, острые и хронические (включая ВИЧ, вирус Эпштейна-Барра, цитомегаловирус) |
Моноклональное увеличение в одном классе с уменьшением в двух других классах или без него | Множественная миелома (IgG, IgA, редко IgM) |
Повышение уровня иммуноглобулинов (гипергаммаглобулинемия) обычно является поликлональным и связано с активацией иммунной системы, связанной с аутоиммунными заболеваниями или инфекциями.В этих случаях, как правило, страдают несколько классов Ig. Напротив, моноклональная продукция обычно связана с заметным увеличением только одного класса иммуноглобулинов (называемых парапротеином или моноклональным белком). Это может быть связано с уменьшением двух других классов (иммунопареза). Хотя у пациентов наблюдается повышение общего количества иммуноглобулинов, они часто имеют относительно ослабленный иммунитет, потому что большая часть продукции иммуноглобулинов является ненормальной и не способствует иммунному ответу.
Следующие шаги?
Наличие гипогаммаглобулинемии необходимо подтвердить повторным тестированием. Перед направлением к консультанту-иммунологу для исследования гипогаммаглобулинемии необходимо рассмотреть любые основные вторичные причины гипогаммаглобулинемии. Важно проанализировать мочу на предмет потери белка. История приема лекарств может выявить использование лекарств, связанных с низким уровнем иммуноглобулинов (, таблица 1, ).
У взрослых с аномальной или избыточной выработкой иммуноглобулинов следует проводить электрофорез сывороточного белка для обнаружения присутствия любой моноклональной полосы (также называемой «парапротеином» или «М-спайком») и электрофорез белков мочи на белок Бенс-Джонса.
Полный анализ крови (FBC) важен для выявления лимфопении, анемии и тромбоцитопении (все они могут возникать при гипогаммаглобулинемии) и для исключения нейтропении. Лимфоцитоз может наблюдаться при ХЛЛ или лимфоме. Лимфопения у младенцев с инфекциями, диареей и / или нарушением нормального развития является важным открытием, так как предполагает тяжелый комбинированный иммунодефицит. Тяжелый комбинированный иммунодефицит требует неотложной медицинской помощи, и пациентов следует срочно направлять в специализированные центры для продолжения диагностики и лечения при появлении подозрения на него (т. Е.если у пациентов низкое абсолютное количество лимфоцитов и низкие / отсутствующие иммуноглобулины). 6
Существуют разногласия по поводу измерения уровней подкласса IgG, поскольку изолированный дефицит подкласса IgG редко бывает значительным и, в отсутствие дефицита специфических антител, не имеет большого клинического значения. Подклассы IgG не следует заказывать в обычном порядке. 7
Тесты, которые следует заказывать только после обсуждения с клиническим иммунологом, включают: 8
- Идентификация Т- и В-лимфоцитов методом проточной цитометрии
- измерение IgA слюны.Этот тест полезен для младенцев, поскольку этот иммуноглобулин слизистой оболочки созревает раньше циркулирующего IgA. Если в этой возрастной группе обнаружен низкий уровень IgA в сыворотке крови, следует измерить уровень IgA в слюне до диагностики дефицита IgA Ответы специфических антител
- на вакцины, такие как столбняк и пневмококк, обеспечивают качественную оценку функции иммуноглобулинов и могут помочь в диагностике таких состояний, как дефицит специфических антител. У таких пациентов нормальный уровень иммуноглобулинов, но слабый специфический ответ на вакцины. 9
Подводные камни
Значения всех уровней иммуноглобулинов для педиатрических пациентов необходимо сравнивать с нормальными лабораторными значениями для возраста. Нормальный доношенный ребенок имеет неопределяемые уровни IgA и IgM при рождении, и эти уровни постепенно повышаются в первые 2–3 года жизни. Уровни IgA повышаются с возрастом и часто повышаются у пожилых людей.
У пациентов с дефицитом иммуноглобулинов могут быть ложноотрицательные результаты лабораторных тестов, измеряющих уровень антител в крови.Например, один тест на целиакию выявляет антитела против тканевой трансглутаминазы типа IgA (анти-tTG). Если у человека дефицит IgA, то результаты этого теста могут быть отрицательными, если у человека действительно глютеновая болезнь. Если есть подозрения, что это так, может быть проведен количественный анализ на IgA.
Нарушение ответа антител на патогены при гипогаммаглобулинемических состояниях может затруднить серологический диагноз некоторых инфекций, таких как ВИЧ и вирус Эпштейна-Барра.У этих пациентов должны быть выполнены методы обнаружения нуклеиновых кислот или посев.
Важно отметить, что количественная оценка иммуноглобулинов не позволяет оценить клональность. Кроме того, нормальный уровень иммуноглобулина не исключает наличия небольшого парапротеина, и при подозрении на это следует провести дополнительное тестирование. Парапротеины также могут мешать иммуноанализу, и их следует подозревать, если есть необычные или неожиданные результаты для клинической картины, особенно у пациентов с известным лимфопролиферативным заболеванием. 10 Если лечащий врач знает, что у пациента есть основной парапротеин, это следует указать в форме запроса.
Кого следует направить к клиническому иммунологу?
Наличие гипогаммаглобулинемии необходимо подтвердить повторным тестированием. Следует рассмотреть вторичные причины гипогаммаглобулинемии и, по возможности, исключить их до направления к консультанту-иммунологу. Направление по поводу гипергаммаглобулинемии будет зависеть от основной причины.Пациентов с моноклональным парапротеином следует направить к гематологу для дальнейшего обследования.
Пример использования
Питер, 2 года, посещал своего терапевта с историей двух инфекций нижних дыхательных путей, трех инфекций уха и одного эпизода гастроэнтерита за последнюю зиму. Он хорошо питается и имеет соответствующие вехи в развитии. Он начал посещать детский сад 6 месяцев назад, имеет двух старших братьев и сестер. Все инфекции дыхательных путей поддались лечению 5-дневными курсами пероральных антибиотиков.
Врач общей практики организовал уровни общего анализа крови и иммуноглобулинов. FBC был нормальным, но уровни иммуноглобулинов были низкими для IgG.
Есть ли у этого пациента иммунодефицит?
Вряд ли. Число инфекций все еще находится в пределах ожидаемого диапазона для здорового ребенка, посещающего детское учреждение, и у старших братьев и сестер, которые являются дополнительными источниками инфекционных агентов. 11 Ни одна из инфекций не была резистентной к антибиотикам, и о необычных или редких осложнениях не сообщалось.Ребенок не перестает развиваться. Общий анализ крови в норме (отсутствие лимфопении, которая может развиваться при более тяжелых формах иммунодефицита).
Следует ли пациенту немедленно повторить анализ IgG?
Нет. У пациента может быть преходящая гипогаммаглобулинемия, и ожидается, что в течение следующих 12 месяцев уровень IgG повысится. IgG можно повторить через 6 месяцев, если у пациента все еще есть проблемы с инфекциями. Если уровень IgG по-прежнему низкий или снижается и есть клинические опасения, следует рассмотреть вопрос о направлении к клиническому иммунологу для дальнейшего обследования.
Конкурирующие интересы: Нет.
Происхождение и экспертная оценка: Введен в эксплуатацию; внешняя экспертная оценка.
Список литературы
- Stoop JW, Zegers BJM, Sander PC, Ballieux RE. Уровни сывороточного иммуноглобулина у здоровых детей и взрослых. Clin Exp Immunol 1969; 4: 101–12.
- Чапел Х. Классификация болезней первичного иммунодефицита Комитетом экспертов по первичному иммунодефициту Международного союза иммунологических обществ (IUIS) 2011.Clin Exp Immunol 2012; 168: 58–9.
- Кацманн Дж. А., Кайл Р. А.. Иммунохимическая характеристика иммуноглобулинов в сыворотке, моче и спинномозговой жидкости. В: Руководство по молекулярной и клинической лабораторной иммунологии, 7-е изд., Детрик Б., редактор. Вашингтон, округ Колумбия: Пресса Американского общества микробиологии, 2006 г .; стр.88.
- Jaffe EF, Lejtnenvi MC, Nova, FJ Mazer BD. Вторичная гипогаммаглобулинемия. Immunol Allergy Clin North Am 2011; 21: 141–63.
- Mehr S, Isaacs D, Kemp A.Первичный иммунодефицит — рецидивирующие инфекции у детей. Австралийский доктор 2008; 28: 21–8.
- Yee A, De Ravin SS, Elliott E, Ziegler JB. Тяжелый комбинированный иммунодефицит: национальное эпиднадзорное исследование. Paediatr Allergy Immunol 2008; 19: 298–302.
- Ochs HD, Stiehm ER, Winkelstein JA и др. Недостаток антител. В кн .: Иммунологические расстройства у младенцев и детей, 5 изд. Ochs HD, Stiehm ER, Winkelstein JA, редакторы. Филадельфия: Эльзевир, 2004.
- De Vries E, для клинической рабочей группы Европейского общества иммунодефицитов (ESID).Скрининг первичного иммунодефицита, ориентированный на пациента: многоступенчатый диагностический протокол для неиммунологов. Clin Exp Immunol 2006; 145: 204–14.
- Boyle RJ, Le C, Balloch A, Tang ML. Клинический синдром дефицита специфических антител у детей. Clin Exp Immunol 2006; 146: 486–92.
- Smogorzewska A, Flood JG, Long WH, Dighe AS. Интерференция парапротеинов в автоматизированных химических анализаторах. Clin Chem 2004; 50: 1691.
- Schwartz B, Reichler MR, Jereb J, et al.Респираторные инфекции в детском саду. Педиатрия 1994; 94: 1018–20.
Переписка [email protected]
Открытие или сохранение файлов
Файлы на веб-сайте можно открывать или загружать и сохранять на свой компьютер или устройство.
Чтобы открыть, щелкните ссылку, ваш компьютер или устройство попытается открыть файл с помощью совместимого программного обеспечения.
Чтобы сохранить файл, щелкните ссылку правой кнопкой мыши или щелкните ссылку и выберите «Сохранить как»… «. Следуйте инструкциям по выбору местоположения.
Типы файлов
PDF Большинство документов на веб-сайте RACGP имеют формат Portable Document Format (PDF). Эти файлы будут иметь «PDF» в скобках вместе с размером файла для загрузки. Чтобы открыть файл PDF, вам потребуется совместимое программное обеспечение, такое как Adobe Reader. Если у вас его нет, вы можете бесплатно загрузить Adobe Reader.
DOC Некоторые документы на этом сайте представлены в формате Microsoft Word.Они будут иметь «DOC» в скобках вместе с размером файла для загрузки. Для просмотра этих документов вам понадобится программа, которая может читать формат Microsoft Word. Если у вас ничего нет, вы можете бесплатно скачать MS Word Viewer.
MP3 Большинство веб-браузеров воспроизводят аудио в формате MP3 в браузере
Тяжелая коронавирусная болезнь 2019 (COVID-19) связана с повышенным уровнем сывороточного иммуноглобулина (Ig) A и антифосфолипидными антителами IgA | Клинические инфекционные болезни
Аннотация
Общие сведения
Тяжелая форма коронавирусной болезни 2019 г. (COVID-19) часто влечет за собой осложнения, которые имеют сходство с аутоиммунными заболеваниями.На сегодняшний день имеется мало данных о возможных аутоиммунных ответах, опосредованных иммуноглобулином (Ig) A. Здесь мы стремимся определить, связан ли COVID-19 с сильным общим ответом IgA и связаны ли антитела IgA с осложнениями тяжелого заболевания. Поскольку тромботические явления часты при тяжелой форме COVID-19 и напоминают гиперкоагуляцию антифосфолипидного синдрома, наш подход был сосредоточен на антифосфолипидных антителах (aPL).
Методы
В этом ретроспективном когортном исследовании сравнивались клинические данные и APL от 64 пациентов с COVID-19 из 3 независимых больниц третичного уровня (1 в Лихтенштейне, 2 в Швейцарии).Образцы были собраны с 9 апреля по 1 мая 2020 года.
Результаты
Клинические записи 64 пациентов с COVID-19 были проанализированы и разделены на когорту с легким заболеванием (mCOVID; 41%), когорту с тяжелым заболеванием (sdCOVID) ; 22%) и когорта подтверждения с тяжелым заболеванием (scCOVID; 38%). Общий IgA, IgG и aPL измеряли с помощью наборов для клинической диагностики. Тяжелое заболевание было значительно связано с повышением общего IgA (sdCOVID, P = 0,01; scCOVID, P <.001), но не общий IgG. Среди aPL обе когорты с тяжелым заболеванием достоверно коррелировали с повышенным уровнем антикардиолипинового IgA (sdCOVID и scCOVID, P <,001), антикардиолипинового IgM (sdCOVID, P = 0,003; scCOVID P P P 001) и IgA против бета 2 гликопротеина-1 (sdCOVID и scCOVID, P < .001). Системная красная волчанка была исключена у всех пациентов в качестве потенциального фактора, мешающего оценке.
Выводы
Более высокий уровень общего IgA и IgA-aPL неизменно ассоциировался с тяжелым заболеванием.Эти новые данные убедительно свидетельствуют о том, что сильный противовирусный ответ IgA, возможно, запускаемый в слизистой оболочке бронхов, вызывает системный аутоиммунитет.
Новое коронавирусное заболевание 2019 года (COVID-19), вызванное тяжелым острым респираторным синдромом, коронавирусом 2 (SARS-CoV-2), стало глобальной пандемией с широкими последствиями для здоровья и социально-экономического развития. После SARS и ближневосточного респираторного синдрома он представляет собой третье известное распространение тяжелого заболевания, связанного с коронавирусом, от животных к человеку за последние 20 лет [1–3].SARS-CoV-2 проникает в клетки человека путем присоединения и последующей интернализации рецепторов ангиотензинпревращающего фермента 2, которые высоко экспрессируются пневмоцитами типа II в глубокой бронхиальной системе [4], где иммуноглобулин (Ig) A, продуцируемый в бронхах. ассоциированная лимфоидная ткань является главной линией гуморальной защиты [5]. Действительно, было показано, что специфическая продукция IgA против спайкового белка SARS-CoV-2 проявляется на ранней стадии у инфицированных пациентов [6]. Однако, несмотря на важную роль IgA в иммунитете слизистых оболочек, уровень общего IgA, генерируемого этим ответом, и его роль в тяжести COVID-19 остаются неизученными.
Вскрытие показало, что острый респираторный дистресс-синдром и сепсис являются наиболее частыми осложнениями у тяжелобольных пациентов с COVID-19 [7]. Большая серия случаев из Северной Италии, в которых оценивали гистологию легких умерших пациентов с COVID-19, показала стойкое диффузное альвеолярное повреждение и некроз пневмоцитов [8]. Отличительным фактором COVID-19 было выраженное наличие диффузного тромбоза периферических мелких сосудов. Это согласуется с сообщениями о частых тромбоэмболиях у пациентов с тяжелой формой COVID-19, которые возникают, несмотря на профилактическое внутрибольничное использование низкомолекулярных гепаринов [9, 10].Хотя причины остаются неясными, недавний отчет описывает серию случаев тяжелых пациентов с COVID-19 с инсультом и повышенным уровнем антифосфолипидных (aPL) антител, совместимых с антифосфолипидным синдромом (APS) [11]. APS — это приобретенное аутоиммунное заболевание, которое опосредуется аутоантителами, направленными против фосфолипид-связывающих белков, и приводит к гиперкоагуляции. Наиболее частым триггером APS является системная красная волчанка (СКВ), за которой следуют легочные инфекции, вызванные микобактериями или вирусами [12].Эти случаи предполагают, что COVID-19 приводит к вирусному развитию АФС у пациентов с тяжелой формой COVID-19. Насколько нам известно, полное профилирование APL в легких и тяжелых случаях COVID-19 никогда не проводилось. Целью этого исследования было выяснить, имеют ли пациенты с тяжелой формой COVID-19 повышенный уровень общего IgA в качестве немедленного иммунного ответа и имеют ли aPL, совместимые с APS.
МЕТОДЫ
Источники и этическое положение
Многоцентровое когортное исследование было проведено в Landesspital Liechtenstein (LLS) в Вадуце, Лихтенштейн; Кантонская больница Св.Галлен (KSSG) в Санкт-Галлене, Швейцария; и Университетская клиника Цюриха (USZ) в Цюрихе, Швейцария, в соответствии с директивами Хельсинкской декларации. Сбор данных о пациентах и образцов крови был одобрен соответствующими местными комитетами по этике участвующих исследовательских центров (идентификаторы проектов 2020-00676, 2020-00821 и 2020-00646). Все участники согласились с общей политикой согласия больниц, разрешающей дальнейшее использование клинических данных и биологического материала (LLS и KSSG), или подписали информированное согласие (USZ).В тех случаях, когда подписание информированного согласия было невозможно из-за тяжелого заболевания и для предотвращения поверхностного загрязнения, согласие запрашивалось устно или у ближайших родственников, которое было одобрено соответствующим местным комитетом по этике.
Данные пациента и сбор образцов
Сбор данных о пациентах и образцов (сыворотка или плазма) проводился с 9 апреля 2020 года по 1 мая 2020 года. Все образцы были получены в течение 2 недель с момента появления симптомов. У пациентов была инфекция SARS-CoV-2, подтвержденная либо с помощью обратной транскриптазно-полимеразной цепной реакции (ОТ-ПЦР) образцов носоглоточного мазка в реальном времени, либо с помощью серологии.Методы ОТ-ПЦР, используемые для обнаружения SARS-CoV-2, зависели от исследовательского центра и выполнялись, как описано ранее [13, 14]. Для серологического подтверждения антитела SARS-CoV-2 были проанализированы с помощью 2 независимых тестов на антитела: иммунохроматографического анализа с латеральным потоком (на основе наночастиц золота, SGIT flex Covid 19; Sugentech, Тэджон, Южная Корея) и электрохемилюминесцентного иммуноанализа (Elecsys Anti-SARS-CoV-2; Roche International Diagnostics AG, Роткройц, Швейцария). Серопозитивность определялась как положительный сигнал IgM в иммунохроматографическом анализе с боковым потоком в острой фазе, который был подтвержден с помощью IgG в электрохемилюминесцентном иммуноанализе через 3-4 недели.
Пациенты были разделены на 3 группы: (1) когорта пациентов с легкой формой заболевания без необходимости госпитализации (mCOVID), данные собирались в LLS и KSSG; (2) обнаруженная когорта пациентов с тяжелым заболеванием (sdCOVID) с данными, полученными в USZ; и (3) когорта независимых подтверждающих пациентов с тяжелым заболеванием (scCOVID) с данными из KSSG. Легкое заболевание было определено как неосложненная инфекция верхних дыхательных путей с неспецифическими симптомами или неосложненная пневмония, в то время как тяжелое заболевание для когорт sdCOVID и scCOVID потребовало госпитализации и включало тяжелую пневмонию, острый респираторный дистресс-синдром и септический шок [15].
Иммуноглобулины и тестирование на АФЛ
Антитела к aPL определяли иммуноферментным флуоресцентным анализом на анализаторе Phadia 250 (Thermo Fisher Diagnostics AG, Штайнхаузен, Швейцария) с использованием кардиолипина EliA и гликопротеина-1 EliA beta 2 на изотопы IgG, IgA и IgM (все Thermo Fisher Diagnostics AG , Штайнхаузен, Швейцария). Общий IgA и IgG определяли на анализаторе Cobas c 501 (Roche International Diagnostics AG, Rotkreuz, Швейцария) с помощью нефелометрического анализа (IgA-2, Tina-Quant IgA Gen.2; IgGu2, Tina-Quant IgG Gen.2; Roche International Diagnostics AG, Роткройц, Швейцария). IgG к антигенам, связанным с синдромом Сьегрена, A (SS-A) и B (SS-B), антидвухцепочечной ДНК (dsDNA), белкам Смита (Sm), хроматину и рибонуклеопротеидам (RNP) одновременно определялись с помощью бусин. принцип подвесной матрицы на системе Bioplex 2200 (Biorad Laboratories, Cressier, Швейцария). Коэффициенты вариации, определенные коммерчески доступными контрольными материалами, составляли 4,5% для общего IgA, <2.0% для общего IgG, 4,6% для антител к aPL и 3,7% для антител к волчанке. Измерения проводились в Labormizinisches Zentrum Dr. Risch, Вадуц, Лихтенштейн.
Статистические методы
Точечные оценки уровней аутоантител были описаны с использованием среднего значения и стандартной ошибки среднего. Различия в уровнях аутоантител между когортами оценивали с помощью непараметрического критерия Манна-Уитни. Все значения P были скорректированы для проверки множественных гипотез с использованием метода ложного обнаружения.Статистическая значимость была определена как уровень ложного обнаружения <0,05. Все анализы были выполнены с использованием программного обеспечения R, версия 3.5.0 (R Project for Statistical Computing, Вена, Австрия). Кроме того, мы создали иерархическую кластеризацию (расстояние кластеризации Спирмена и метод полной кластеризации) по среднецентровым значениям уровней антител. Недостающие значения были заменены соответствующими средними значениями для остальных пациентов.
РЕЗУЛЬТАТЫ
Характеристики пациента
Мы собрали в общей сложности 64 образца сыворотки или плазмы у пациентов с инфекцией SARS-CoV-2 (по 1 образцу на пациента).Средний возраст всех пациентов составлял 62 года (межквартильный размах [IQR], 46–74), и 32 года (60%) были мужчинами. В когорту mCOVID вошли 26 (41%) пациентов со средним возрастом 57 лет (IQR, 45–63), 9 (35%) были мужчинами. Критериям тяжелой формы COVID-19 соответствовали 38 (59%) пациентов. Средний возраст всех тяжелобольных пациентов составлял 70 лет (IQR, 58–76), и, в отличие от пациентов с mCOVID, тяжелобольные пациенты были преимущественно мужчинами (28; 74%). Из них когорта sdCOVID включала 14 (22%) пациентов со средним возрастом 64 года (IQR, 56–70), а когорта scCOVID включала 24 (38%) пациентов со средним возрастом 73 года (IQR , 64–80).Для диагностики SARS-CoV-2 57 (89%) из 64 пациентов прошли ОТ-ПЦР, а 7 (11%) пациентов — серологически. Из 26 пациентов в когорте mCOVID у 4 (15%) были сопутствующие заболевания, предрасполагающие их к тяжелой форме COVID-19, из которых наиболее частой была артериальная гипертензия (3/26; 12%). Напротив, 26 (93%) тяжелобольных пациентов имели по крайней мере 1 сопутствующую патологию, из которых наиболее распространенными были артериальная гипертензия (26; 68%), сердечно-сосудистые заболевания (25; 66%) и сахарный диабет (13/38; 34%). ). Следует отметить, что у 13 (34%) пациентов с тяжелой формой COVID-19 во время госпитализации развились тромбозы, которые не коррелировали с уровнями D-димера ( P =.48; Двусторонний т -тест). Характеристики пациентов и лабораторные показатели приведены в таблице 1.
Таблица 1.Обзор характеристик пациента
| Характеристики пациента . | Легкое заболевание, n = 26 . | Тяжелое заболевание, когорта обнаружения, n = 14 . | Тяжелое заболевание, когорта подтверждения, n = 24 . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Пол, n (%) | ||||||||||
| Мужской | 9 (35) | 8 (57) | 20 (83) | Женский 65) | 6 (43) | 4 (17) | ||||
| Возраст, лет, медиана (IQR) | 57 (45–63) | 64 (56–70) | 73 (64–80) | |||||||
| Сопутствующие заболевания, a n (%) | ||||||||||
| Нет | 22 (85) | 2 (14) | 0 (0) | (15) | 12 (86) | 24 (100) | ||||
| Гипертония | 3 (12) | 10 (71) | 16 (67) | |||||||
| Сердечно-сосудистые заболевания | 0 (0) | 6 (43) | 19 (79) | |||||||
| Цереброваскулярные заболевания ase | 0 (0) | 0 (0) | 6 (25) | |||||||
| Диабет | 1 (4) | 5 (36) | 8 (33) | |||||||
| Болезнь печени | Болезнь печени | 0 (0) | 0 (0) | 5 (21) | ||||||
| Рак | 0 (0) | 0 (0) | 9 (38) | |||||||
| Болезнь почек | 0 (0 ) | 5 (36) | 7 (29) | |||||||
| Тромбоэмболии, n (%) | ||||||||||
| Да | 0 (0) | 4 (294) 38) | ||||||||
| Нет | 26 (100) | 10 (71) | 15 (63) | |||||||
| Иммуносупрессия, b n (%) | 0 (0) | 5 (36) | 5 (21) | |||||||
| 26 (100) | 9 (64) | 19 (79) | ||||||||
| Лабораторные параметры, медиана (IQR) | ||||||||||
| C-реактивный белок, c / л | н / д | 228 (95–303) | 201 (161–262) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 14 (100) | 24 (100) | |||||||
| D-димеры, c мг / л | нет данных | 1.69 (1,01–2,41) | 1,94 (0,99–12,03) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 10 (71) | 21 (88) |
| Характеристики пациента . | Легкое заболевание, n = 26 . | Тяжелое заболевание, когорта обнаружения, n = 14 . | Тяжелое заболевание, когорта подтверждения, n = 24 . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Пол, n (%) | ||||||||||
| Мужской | 9 (35) | 8 (57) | 20 (83) | Женский 65) | 6 (43) | 4 (17) | ||||
| Возраст, лет, медиана (IQR) | 57 (45–63) | 64 (56–70) | 73 (64–80) | |||||||
| Сопутствующие заболевания, a n (%) | ||||||||||
| Нет | 22 (85) | 2 (14) | 0 (0) | (15) | 12 (86) | 24 (100) | ||||
| Гипертония | 3 (12) | 10 (71) | 16 (67) | |||||||
| Сердечно-сосудистые заболевания | 0 (0) | 6 (43) | 19 (79) | |||||||
| Цереброваскулярные заболевания ase | 0 (0) | 0 (0) | 6 (25) | |||||||
| Диабет | 1 (4) | 5 (36) | 8 (33) | |||||||
| Болезнь печени | Болезнь печени | 0 (0) | 0 (0) | 5 (21) | ||||||
| Рак | 0 (0) | 0 (0) | 9 (38) | |||||||
| Болезнь почек | 0 (0 ) | 5 (36) | 7 (29) | |||||||
| Тромбоэмболии, n (%) | ||||||||||
| Да | 0 (0) | 4 (294) 38) | ||||||||
| Нет | 26 (100) | 10 (71) | 15 (63) | |||||||
| Иммуносупрессия, b n (%) | 0 (0) | 5 (36) | 5 (21) | |||||||
| 26 (100) | 9 (64) | 19 (79) | ||||||||
| Лабораторные параметры, медиана (IQR) | ||||||||||
| C-реактивный белок, c / л | н / д | 228 (95–303) | 201 (161–262) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 14 (100) | 24 (100) | |||||||
| D-димеры, c мг / л | нет данных | 1.69 (1,01–2,41) | 1,94 (0,99–12,03) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 10 (71) | 21 (88) |
Обзор характеристик пациента
| Характеристики пациента . | Легкое заболевание, n = 26 . | Тяжелое заболевание, когорта обнаружения, n = 14 . | Тяжелое заболевание, когорта подтверждения, n = 24 . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Пол, n (%) | ||||||||||
| Мужской | 9 (35) | 8 (57) | 20 (83) | Женский 65) | 6 (43) | 4 (17) | ||||
| Возраст, лет, медиана (IQR) | 57 (45–63) | 64 (56–70) | 73 (64–80) | |||||||
| Сопутствующие заболевания, a n (%) | ||||||||||
| Нет | 22 (85) | 2 (14) | 0 (0) | (15) | 12 (86) | 24 (100) | ||||
| Гипертония | 3 (12) | 10 (71) | 16 (67) | |||||||
| Сердечно-сосудистые заболевания | 0 (0) | 6 (43) | 19 (79) | |||||||
| Цереброваскулярные заболевания ase | 0 (0) | 0 (0) | 6 (25) | |||||||
| Диабет | 1 (4) | 5 (36) | 8 (33) | |||||||
| Болезнь печени | Болезнь печени | 0 (0) | 0 (0) | 5 (21) | ||||||
| Рак | 0 (0) | 0 (0) | 9 (38) | |||||||
| Болезнь почек | 0 (0 ) | 5 (36) | 7 (29) | |||||||
| Тромбоэмболии, n (%) | ||||||||||
| Да | 0 (0) | 4 (294) 38) | ||||||||
| Нет | 26 (100) | 10 (71) | 15 (63) | |||||||
| Иммуносупрессия, b n (%) | 0 (0) | 5 (36) | 5 (21) | |||||||
| 26 (100) | 9 (64) | 19 (79) | ||||||||
| Лабораторные параметры, медиана (IQR) | ||||||||||
| C-реактивный белок, c / л | н / д | 228 (95–303) | 201 (161–262) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 14 (100) | 24 (100) | |||||||
| D-димеры, c мг / л | нет данных | 1.69 (1,01–2,41) | 1,94 (0,99–12,03) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 10 (71) | 21 (88) |
| Характеристики пациента . | Легкое заболевание, n = 26 . | Тяжелое заболевание, когорта обнаружения, n = 14 . | Тяжелое заболевание, когорта подтверждения, n = 24 . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Пол, n (%) | ||||||||||
| Мужской | 9 (35) | 8 (57) | 20 (83) | Женский 65) | 6 (43) | 4 (17) | ||||
| Возраст, лет, медиана (IQR) | 57 (45–63) | 64 (56–70) | 73 (64–80) | |||||||
| Сопутствующие заболевания, a n (%) | ||||||||||
| Нет | 22 (85) | 2 (14) | 0 (0) | (15) | 12 (86) | 24 (100) | ||||
| Гипертония | 3 (12) | 10 (71) | 16 (67) | |||||||
| Сердечно-сосудистые заболевания | 0 (0) | 6 (43) | 19 (79) | |||||||
| Цереброваскулярные заболевания ase | 0 (0) | 0 (0) | 6 (25) | |||||||
| Диабет | 1 (4) | 5 (36) | 8 (33) | |||||||
| Болезнь печени | Болезнь печени | 0 (0) | 0 (0) | 5 (21) | ||||||
| Рак | 0 (0) | 0 (0) | 9 (38) | |||||||
| Болезнь почек | 0 (0 ) | 5 (36) | 7 (29) | |||||||
| Тромбоэмболии, n (%) | ||||||||||
| Да | 0 (0) | 4 (294) 38) | ||||||||
| Нет | 26 (100) | 10 (71) | 15 (63) | |||||||
| Иммуносупрессия, b n (%) | 0 (0) | 5 (36) | 5 (21) | |||||||
| 26 (100) | 9 (64) | 19 (79) | ||||||||
| Лабораторные параметры, медиана (IQR) | ||||||||||
| C-реактивный белок, c / л | н / д | 228 (95–303) | 201 (161–262) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 14 (100) | 24 (100) | |||||||
| D-димеры, c мг / л | нет данных | 1.69 (1,01–2,41) | 1,94 (0,99–12,03) | |||||||
| Пациенты, участвовавшие в этом расчете, n (%) | 0 (0) | 10 (71) | 21 (88) |
Результаты антител
Тяжелобольные пациенты с COVID-19 имели значительно более высокие титры общего IgA по сравнению с пациентами с mCOVID (среднее значение sdCOVID, 2,94 г / л [стандартное отклонение {SD}, ± 0,46; P = 0,01]; среднее значение scCOVID, 3,04 г / л. [SD, ± 0,19; P <.001]), но не более высокий общий IgG (среднее значение sdCOVID, 7,69 г / л [SD, ± 0,55; P = 0,09]; scCOVID не измерялся). У них также был значительно более высокий уровень антикардиолипинового IgA (среднее значение sdCOVID, 6,38 Ед / мл [SD, ± 0,96; P < 0,001]; среднее значение scCOVID, 4,86 Ед / мл [SD, ± 0,84; P < .001]), анти-бета 2 гликопротеин-1 IgA (среднее значение sdCOVID, 8,50 Ед / мл [SD, ± 3,86; P < .001]; среднее значение scCOVID, 4,71 Ед / мл [SD, ± 2,17; П <.001) и антикардиолипиновый IgM (среднее значение sdCOVID, 4,01 Ед / мл [SD, ± 0,88; P = 0,003]; среднее значение scCOVID, 10,35 U / мл [SD, ± 5,48; P < 0,001] ), как показано на рисунке 1. Мы обнаружили значимые различия только в группе sdCOVID, но не в когорте scCOVID с двумя другими антителами против aPL: антикардиолипиновым IgG (среднее значение sdCOVID, 8,23 Ед / мл [SD, ± 4,02; P = 0,02] ; среднее значение scCOVID, 2,42 [SD, ± 0,54; P = 0,09]) и анти-бета 2 гликопротеин-1 IgG (среднее значение sdCOVID, 1,57 Ед / мл [SD, ± 0.23; P = 0,002]; scCOVID среднее, 1,58 Ед / мл [SD, ± 0,85; P = 0,15]). Не было обнаружено значительных различий между IgM к бета 2 гликопротеину-1 среди когорт (среднее значение sdCOVID, 1,07 Ед / мл [SD, ± 0,25; P = 0,16]; среднее значение scCOVID, 2,00 Ед / мл [SD, ± 0,72; P = 0,16]), как показано на рисунке 2. Иерархический кластерный анализ дополнительно демонстрирует общие повышения титров антител среди пациентов с легкой и тяжелой формой COVID-19 (см. Рисунок 3). Мы не смогли обнаружить корреляцию между полом и IgA-aPL (среднее значение антикардиолипинового IgA для мужчин, 4.46 Ед / мл [стандартное отклонение ± 3,70] и среднее значение для женщин 3,47 ед / мл [стандартное отклонение ± 3,31; P = 0,26]; IgA к бета 2 гликопротеину-1 у мужчин, 3,89 Ед / мл [SD, ± 8,65], и у женщин, в среднем 4,67 Ед / мл [SD, ± 10,9; P = 0,76]), как показано на дополнительном рисунке 1. Кроме того, не было корреляции между возрастом и IgA-aPL (анти-бета 2 гликопротеин-1 IgA R = 0,10 [ P = 0,45]; антикардиолипиновый IgA R = 0,19 [ P = 0,12]), представленный на дополнительном рисунке 2.
Рисунок 1.
Антитела, значимо связанные с тяжелой формой COVID-19 в обеих когортах. Названия графиков указывают на соответствующие белки-мишени и тип иммуноглобулина. По оси Y отображаются результаты измерений и единицы измерения. По оси X отображается количество пациентов. Сокращения: COVID-19, коронавирусная болезнь 2019; Ig, иммуноглобулин.
Рисунок 1.
Антитела, значимо связанные с тяжелой формой COVID-19 в обеих когортах. Названия графиков указывают на соответствующие белки-мишени и тип иммуноглобулина.По оси Y отображаются результаты измерений и единицы измерения. По оси X отображается количество пациентов. Сокращения: COVID-19, коронавирусная болезнь 2019; Ig, иммуноглобулин.
Рисунок 2.
Антитела с частичной или несущественной ассоциацией с тяжелой формой COVID-19. Названия графиков указывают на соответствующие белки-мишени и тип иммуноглобулина. По оси Y отображаются результаты измерений и единицы измерения. По оси X отображается количество пациентов. Сокращения: COVID-19, коронавирусная болезнь 2019; Ig, иммуноглобулин; п.с., не имеет значения.
Рисунок 2.
Антитела с частичной или несущественной ассоциацией с тяжелой формой COVID-19. Названия графиков указывают на соответствующие белки-мишени и тип иммуноглобулина. По оси Y отображаются результаты измерений и единицы измерения. По оси X отображается количество пациентов. Сокращения: COVID-19, коронавирусная болезнь 2019; Ig, иммуноглобулин; n.s., не имеет значения.
Рисунок 3.
Иерархическая кластеризация уровней антител по пациентам.На тепловой карте показаны общие изменения уровней антител среди пациентов с легкой формой заболевания и тяжелой формой COVID-19. В строках показаны антитела, а в столбцах — пациенты. Все уровни антител центрированы по медиане и отображаются в виде кратного относительного увеличения по сравнению с медианой, причем более высокие титры окрашены в красный цвет, а более низкие титры — в синий. Для отсутствующих результатов использовали среднее значение соответствующего антитела / иммуноглобулина. Масштабная линейка (внизу в центре) обозначает уровни в x-кратном масштабе. Сокращения: COVID-19, коронавирусная болезнь 2019; Ig, иммуноглобулин.
Рисунок 3.
Иерархическая кластеризация уровней антител по пациентам. На тепловой карте показаны общие изменения уровней антител среди пациентов с легкой формой заболевания и тяжелой формой COVID-19. В строках показаны антитела, а в столбцах — пациенты. Все уровни антител центрированы по медиане и отображаются в виде кратного относительного увеличения по сравнению с медианой, причем более высокие титры окрашены в красный цвет, а более низкие титры — в синий. Для отсутствующих результатов использовали среднее значение соответствующего антитела / иммуноглобулина. Масштабная линейка (внизу в центре) обозначает уровни в x-кратном масштабе.Сокращения: COVID-19, коронавирусная болезнь 2019; Ig, иммуноглобулин.
Поскольку APS обычно вызывается СКВ, серологический скрининг проводился для всех пациентов, как описано в разделе «Методы». В то время как у 1 пациента из когорты scCOVID был повышенный уровень анти-La IgG (7,4 Ед / мл; норма, < 1 Ед / мл), других специфичных для волчанки антител не было. Ни у одного из других пациентов не было обнаружено каких-либо антител, связанных с СКВ.
ОБСУЖДЕНИЕ
В этом исследовании мы измерили общий IgA и IgG, а также aPL у пациентов с COVID-19 аналогичного возраста и сравнили результаты для пациентов с легкими и тяжелыми заболеваниями из независимых медицинских центров третичного уровня.Для тяжелобольных пациентов мы создали когорты открытий и исследований. Наши новые открытия показывают заметное повышение общего уровня IgA, которое в значительной степени связано с тяжелой формой COVID-19, о которой, насколько нам известно, ранее не сообщалось. Нет значимой связи с общим IgG. Эти данные подтверждают нашу гипотезу о том, что сильный иммунный ответ, управляемый IgA, возможно, возникает из лимфоидной ткани, связанной с бронхами, когда SARS-CoV-2 влияет на более глубокие дыхательные пути [16]. Согласно литературным данным, примерно у трети тяжелобольных пациентов развились тромбозы [10], которые не коррелировали с уровнем D-димера [17, 18].Эти тромбозы можно объяснить повышением общего уровня антител IgA и aPL IgA, что, как мы обнаружили, в значительной степени связано с тяжелым заболеванием. Эту корреляцию нельзя было увидеть ни для общего IgG, ни для антител IgG к aPL. Хотя предполагалась связь повышенного уровня aPL и тяжелой формы COVID-19 [19], повышение общего IgA вместе с IgA-aPL при сравнении легкой и тяжелой формы COVID-19 является новым и указывает на недостающую связь между иммунным ответом и гиперкоагуляцией. поскольку это убедительно указывает на индукцию IgA-доминированного APS.APS чаще всего вызывается СКВ [12], которая была исключена у всех пациентов при серологическом скрининге [20]. Еще одним потенциальным триггером APS является инфекция, в том числе пневмония, которая приводит к аутоиммунитету через молекулярную мимикрию [21–23]. В случае COVID-19 такой механизм может быть опосредован легочным сурфактантом, поскольку он богат фосфолипидсвязывающими белками [24]. Поверхностно-активное вещество продуцируется пневмоцитами II типа, которые экспрессируют высокие уровни рецепторов ангиотензинпревращающего фермента 2 и являются основной мишенью SARS-CoV-2 [8, 25].Некроз пневмоцитов приводит к утечке сурфактанта, подвергая фосфолипидные белки воздействию иммунной системы. Возможно, что сходство пептидов между SARS-CoV-2 и белками сурфактантов индуцирует APS. Действительно, высокий охват таких общих пептидов был недавно продемонстрирован Kanduc и Shoenfeld [26], которые обнаружили, что почти половина иммунореактивных эпитопов на шиповом гликопротеине SARS-CoV-2 имеют общие пентапептиды на человеческих сурфактант-связанных белках. На практике предварительные результаты исследования рандомизированной оценки терапии COVID-19 (RECOVERY) демонстрируют значительную пользу терапии дексаметазоном для тяжелобольных [27], что также указывает на важную роль обострения иммунитета в смертях, связанных с COVID-19.Эффекты aPL могут быть дополнительно усилены толл-подобным рецептором-4, который активируется у пациентов с SARS [28] и, как было показано, усиливает гиперкоагуляцию [29]. Важно отметить, что эти данные подтверждают связь между IgA и мультисистемным воспалительным синдромом, подобным болезни Кавасаки, у детей (MIS-C). MIS-C — это новое заболевание, связанное с COVID-19, которое в значительной степени перекликается с классической болезнью Кавасаки (KD), но имеет более позднее начало и имеет тенденцию быть более тяжелым [30, 31]. Интересно, что классический KD чаще всего ассоциируется с респираторными вирусами [32], а редкие, тяжелые KD, как было показано, связаны с отложениями в органах плазматических клеток, продуцирующих IgA [33, 34].Это говорит о том, что повышенный уровень общего IgA может иметь причинную роль в MIS-C.
Ограничения исследования
Основными ограничениями исследования являются размер когорты и ретроспективный дизайн. Кроме того, исследование не включает продольные измерения антител. Из-за непоследовательной доступности данных о тромбозах в анамнезе, провоспалительных цитокинах и клинических исходах эти факторы не могли быть приняты во внимание. Более того, уровни С-реактивного белка и D-димера были доступны только для тяжелобольных.Тем не менее, включение когорт из независимых медицинских центров, а также выявление и подтверждение когорт пациентов с тяжелой формой COVID-19 из разных больниц для дополнительной проверки являются основными сильными сторонами исследования.
В заключение мы представляем новые значимые ассоциации между тяжелой формой COVID-19, повышенным общим IgA и IgA-aPL. Эти данные предполагают, что аутоантитела могут играть причинную роль в тяжелой форме COVID-19 и ее системных осложнениях. Данные убедительно свидетельствуют о том, что COVID-19 является мощным индуктором аутоиммунитета, и мы рекомендуем дальнейшие исследования с более крупными когортами, продольную выборку и изучение механизмов.
Банкноты
Благодарности. Авторы благодарят Доротею Хиллманн и Франческу Феррара (обе из Лабораторного центра доктора Риша) за их вклад в лабораторный анализ.
Финансовая поддержка. Эта работа была поддержана Швейцарским национальным научным фондом (номер гранта PP00P3_157448 для L. F., номер гранта P400PM_194473 для О. Х. А. и грант номер PZ00P3_179919 для П. К.), Исследовательский фонд Kantonsspital St.Галленом (грант № 20/20, Л. Ф.) и Фондом Промедика (грант № 1449 / М, С. Д. Б.).
Возможный конфликт интересов. JMP является основателем и акционером компании Apeiron (Вена, Австрия), которая разрабатывает растворимый ангиотензинпревращающий фермент 2 в качестве терапии коронавирусного заболевания 2019 (COVID-19), но не имеет прямого конфликта интересов, связанного с бумагой или данными. в газете. Все остальные авторы не сообщают о потенциальных конфликтах. Все авторы подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов.Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Представлено частично: части этого исследования ранее были опубликованы как препринт (medRxiv, 24 июля 2020 г., doi: 10.1101 / 2020.07.21.20159244).
Список литературы
1.Горбаленя
AE
,Baker
SC
,Baric
RS
и др.Виды коронавируса, связанного с тяжелым острым респираторным синдромом: классификация 2019-nCoV и присвоение ему названия SARS-CoV-2
.Nat Microbiol
2020
;5
:536
—44
.2.Drosten
C
,Günther
S
,Preiser
W
и др.Выявление нового коронавируса у пациентов с тяжелым острым респираторным синдромом
.N Engl J Med
2003
;348
:1967
—76
.3.Banerjee
A
,Baid
K
,Mossman
K
.Молекулярный патогенез коронавируса ближневосточного респираторного синдрома (MERS)
.Curr Clin Microbiol Rep
2019
;6
:139
—47
.4.Monteil
V
,Kwon
H
,Prado
P
и др.Ингибирование инфекций SARS-CoV-2 в искусственно созданных тканях человека с использованием растворимого человеческого ACE2 клинического уровня
.Ячейка
2020
;181
:905
—913.е7
.5.Brandtzaeg
P
,Jahnsen
FL
,Farstad
IN
.Иммунные функции и иммунопатология слизистой оболочки верхних дыхательных путей
.Acta Otolaryngol
1996
;116
:149
—59
.6.Yu
H-q
,Sun
B-q
,Fang
Z-f
и др.Отличительные особенности ответа IgA, специфичного для SARS-CoV-2, у пациентов с COVID-19
.Eur Respir J
2020
;56
:2001526
.7.Chen
T
,Wu
D
,Chen
H
и др.Клиническая характеристика 113 умерших пациентов с коронавирусной болезнью 2019: ретроспективное исследование
.BMJ
2020
;368
:м 1091
.8.Carsana
L
,Sonzogni
A
,Nasr
A
и др.Результаты патологоанатомического исследования легких в серии случаев COVID-19 из северной Италии: двухцентровое описательное исследование
.Lancet Infect Dis
2020
;20
:1135
—40
.9.Wise
J
.COVID-19 и тромбоз: что мы знаем о рисках и лечении?
BMJ
2020
;369
:м 2058
.10.Klok
FA
,Kruip
MJHA
,van der Meer
NJM
и др.Частота тромботических осложнений у тяжелобольных пациентов ОИТ с COVID-19
.Thromb Res
2020
;191
:145
—7
.11.Zhang
Y
,Xiao
M
,Zhang
S
и др.Коагулопатия и антифосфолипидные антитела у пациентов с COVID-19
.N Engl J Med
2020
;382
:e38
.12.Schreiber
K
,Sciascia
S
,de Groot
PG
, et al.Антифосфолипидный синдром
.Nat Rev Dis Primers
2018
;4
:17103
. 13.Corman
VM
,Landt
O
,Kaiser
M
и др.Обнаружение нового коронавируса 2019 г. (2019-nCoV) методом ОТ-ПЦР в реальном времени
.Euro Surveill
2020
;25
:2000045
.14.Pfefferle
S
,Reucher
S
,Norz
D
,Lutgehetmann
M
.Оценка количественного анализа RT-PCR для обнаружения появляющегося коронавируса SARS-CoV-2 с использованием высокопроизводительной системы
.Euro Surveill
2020
;25
:2000152
.16.Pilette
C
,Ouadrhiri
Y
,Godding
V
,Vaerman
JP
,Sibille
Y
.Иммунитет слизистой оболочки легких: повторный визит иммуноглобулина-А
.Eur Respir J
2001
;18
:571
—88
. 17.Yao
Y
,Cao
J
,Wang
Q
и др.D-димер как биомаркер тяжести заболевания и смертности пациентов с COVID-19: исследование случай-контроль
.J Интенсивная терапия
2020
;8
:49
. 18.Yu
B
,Li
X
,Chen
J
и др.Оценка различий в уровнях D-димера среди COVID-19 и бактериальной пневмонии: ретроспективный анализ
.J Тромб Тромболизис
2020
;50
:548
—57
.19.Zhang
Y
,Cao
W
,Jiang
W
и др.Профиль естественного антикоагулянта, фактора свертывания крови и антифосфолипидных антител у тяжелобольных пациентов с COVID-19
.J Тромб Тромболизис
2020
;50
:580
—6
.20.Aringer
M
,Costenbader
K
,Daikh
D
и др.Европейская лига против ревматизма / Американский колледж ревматологии Критерии классификации системной красной волчанки
.Ревматический артрит
2019
;71
:1400
—12
. 21.Shoenfeld
Y
,Пустой
M
,Cervera
R
,Шрифт
J
,Raschi
E
,PL
Инфекционное происхождение антифосфолипидного синдрома
.Ann Rheum Dis
2006
;65
:2
—6
.22.Cervera
R
,Asherson
RA
,Acevedo
ML
и др.Антифосфолипидный синдром, ассоциированный с инфекциями: клинико-микробиологическая характеристика 100 пациентов
.Ann Rheum Dis
2004
;63
:1312
—7
.23.Мендоса-Пинто
C
,Гарсия-Карраско
M
,Cervera
R
.Роль инфекционных заболеваний в антифосфолипидном синдроме (включая его катастрофический вариант)
.Curr Rheumatol Rep
2018
;20
:62
.24.Fessler
MB
,Лето
RS
.Липиды поверхностно-активного вещества на интерфейсе «хозяин-окружающая среда».Метаболические сенсоры, супрессоры и эффекторы воспалительного заболевания легких
.Am J Respir Cell Mol Biol
2016
;54
:624
—35
. 25.Nkadi
PO
,Merritt
TA
,Pillers
DA
.Обзор легочного сурфактанта у новорожденных: генетика, метаболизм и роль сурфактанта в здоровье и болезнях
.Мол Генет Метаб
2009
;97
:95
—101
.26.Kanduc
D
,Shoenfeld
Y
.О молекулярных детерминантах атаки SARS-CoV-2
.Клин Иммунол
2020
;215
:108426
,27.Horby
P
,Lim
WS
,Emberson
,JR
и др.Дексаметазон у госпитализированных пациентов с COVID-19 — предварительное сообщение
.N Engl J Med
2020
17 июля.По состоянию на 10 октября 2020 г. doi: 10.1056 / NEJMoa2021436.28.Imai
Y
,Kuba
K
,Neely
GG
и др.Идентификация окислительного стресса и передачи сигналов толл-подобного рецептора 4 как ключевого пути острого повреждения легких
.Cell
2008
;133
:235
—49
,29.Laplante
P
,Fuentes
R
,Salem
D
и др.Опосредованные антифосфолипидными антителами эффекты в артериальной модели тромбоза зависят от Toll-подобного рецептора 4
.Волчанка
2016
;25
:162
—76
. 30.Toubiana
J
,Poirault
C
,Corsia
A
и др.Мультисистемный воспалительный синдром, подобный Кавасаки, у детей во время пандемии COVID-19 в Париже, Франция: проспективное обсервационное исследование
.BMJ
2020
;369
:м 2094
. 31.Verdoni
L
,Mazza
A
,Gervasoni
A
и др.Вспышка тяжелой болезни Кавасаки в итальянском эпицентре эпидемии SARS-CoV-2: наблюдательное когортное исследование
.Ланцет
2020
;395
:1771
—8
.32.Dietz
SM
,van Stijn
D
,Burgner
D
и др.Рассекающая болезнь Кавасаки: современный обзор
.Eur J Pediatr
2017
;176
:995
—1009
. 33.Rowley
AH
,Eckerley
CA
,Jäck
HM
,Shulman
ST
,Baker
SC
.Плазматические клетки IgA в сосудистой ткани пациентов с синдромом Кавасаки
.J Immunol
1997
;159
:5946
—55
.34.Rowley
AH
,Shulman
ST
,Mask
CA
и др.Инфильтрация плазматическими клетками IgA проксимальных отделов дыхательных путей, поджелудочной железы, почек и коронарной артерии при острой болезни Кавасаки
.J Инфекция Dis
2000
;182
:1183
—91
.© Автор (ы) 2020. Опубликовано Oxford University Press для Общества инфекционных болезней Америки.Все права защищены. Для получения разрешения обращайтесь по электронной почте: [email protected].
синдромов гипер-IgM | Фонд иммунодефицита
Пациенты с синдромом гипер-IgM (HIGM) восприимчивы к рецидивирующим и тяжелым инфекциям, а также к некоторым типам оппортунистических инфекций с синдромом HIGM, а также к повышенному риску рака. Заболевание характеризуется пониженным уровнем иммуноглобулина G (IgG) в крови и нормальным или повышенным уровнем IgM.Синдром HIGM может быть вызван рядом различных генетических дефектов. Наиболее распространенная форма наследуется как сцепленная с Х-хромосомой. Большинство других форм наследуются как аутосомно-рецессивные признаки и поэтому могут поражать как мальчиков, так и девочек.
Определение синдромов гипер-IgM
Пациенты с синдромом HIGM не могут переключиться с выработки антител типа IgM на антитела типа IgG, IgA или IgE. В результате у пациентов с этим заболеванием снижены уровни IgG и IgA, но нормальные или повышенные уровни IgM в крови.Эти разные типы антител выполняют разные функции и все они важны в борьбе с инфекциями. Обычно B-лимфоциты могут вырабатывать антитела IgM сами по себе, но им требуется интерактивная помощь Т-лимфоцитов, чтобы переключиться с IgM на IgG, IgA или IgE. HIGM является результатом множества генетических дефектов, которые влияют на это взаимодействие между Т-лимфоцитами и В-лимфоцитами.
Наиболее распространенная форма синдрома HIGM возникает в результате дефекта или дефицита белка, который обнаруживается на поверхности активированных Т-лимфоцитов.Пораженный белок называется лигандом CD40, потому что он связывается или лигируется с белком В-лимфоцитов, называемым CD40. Лиганд CD40 производится геном на Х-хромосоме. Следовательно, это заболевание первичного иммунодефицита наследуется как Х-сцепленный рецессивный признак.
Вследствие дефицита лиганда CD40 Т-лимфоциты у пациентов с Х-сцепленным гипер-IgM (XHIGM) не могут дать команду В-лимфоцитам переключить выработку иммуноглобулинов с IgM на IgG, IgA и IgE.Лиганд CD40 также важен для других функций, выполняемых Т-лимфоцитами, поэтому пациенты с Х-сцепленным синдромом гипер-IgM (XHIM) имеют дефектный клеточный иммунитет, а также подвержены всем видам инфекций, особенно оппортунистическим инфекциям и некоторым типам рака. .
Другие формы HIGM-синдрома наследуются как аутосомно-рецессивные признаки и наблюдаются как у девочек, так и у мальчиков. (См. Главу «Наследование».) Одна из этих форм возникает в результате дефекта CD40 и клинически идентична XHIGM (заболевание с дефектом лиганда CD40).Другие аутосомно-рецессивные формы синдрома HIGM возникают в результате дефектов генов, участвующих в сигнальном пути CD40 (сокращенно AID и UNG). Функция этих генов ограничивается переключением антител, поэтому другие функции Т-лимфоцитов лиганда CD40 не затрагиваются, и у таких пациентов меньше вероятность развития оппортунистических инфекций или рака.
Наконец, дефект в другом X-сцепленном гене (NEMO), который необходим для активации сигнальной молекулы NF-κB, был идентифицирован в форме синдрома HIGM, который связан с состоянием кожи, называемым эктодермальной дисплазией.(См. Главу «Синдром дефицита NEMO».) У этих пациентов есть иммунодефицит с редкими волосами и коническими зубами среди других аномалий. NF-κB активируется CD40 и необходим для сигнального пути, который приводит к переключению антител. NF-κB также активируется другими сигнальными путями, которые важны для борьбы с инфекциями. Таким образом, эти больные мальчики подвержены множеству серьезных инфекций.
Клиническая картина синдрома гипер-IgM
У большинства пациентов с синдромом HIGM клинические симптомы появляются в течение первого или второго года жизни.Наиболее распространенной проблемой при всех формах синдрома HIGM является повышенная восприимчивость к инфекциям, включая рецидивирующие инфекции верхних и нижних дыхательных путей. Наиболее частыми серьезными инфекционными агентами являются бактерии, но вирусные заболевания также встречаются чаще и тяжелее.
У пациентов с XHIGM и аутосомно-рецессивным HIGM из-за дефекта CD40 ряд других микроорганизмов также может вызывать серьезные инфекции. Например, Pneumocystis jiroveci (carinii) пневмония, оппортунистическая инфекция, относительно часто встречается в течение первого года жизни, и ее наличие может быть первым признаком того, что у ребенка синдром HIGM.Вирусы, такие как цитомегаловирус, и грибы, такие как Cryptococcus, также могут вызывать инфекции легких.
Жалобы со стороны желудочно-кишечного тракта, чаще всего диарея и мальабсорбция, также часто возникают при дефиците XHIGM и CD40. Одним из основных микроорганизмов, вызывающих желудочно-кишечные симптомы XHIGM, является Cryptosporidium. Инфекция Cryptosporidium может вызвать склерозирующий холангит, тяжелое, часто смертельное заболевание печени.
Примерно у половины пациентов с дефицитом XHIGM или CD40 развивается нейтропения (низкое количество лейкоцитов в гранулоцитах), временно или постоянно.Причина нейтропении неизвестна, хотя большинство пациентов реагируют на лечение колониестимулирующим фактором, G-CSF. Тяжелая нейтропения часто связана с язвами в полости рта, проктитом (воспалением и изъязвлением прямой кишки) и кожными инфекциями.
Аутоиммунные нарушения также могут возникать у пациентов с синдромом XHIGM или дефектами CD40. Их проявления могут включать хронический артрит, низкое количество тромбоцитов (тромбоцитопения), гемолитическую анемию, гипотиреоз и заболевание почек.
Наконец, риск рака, особенно рака печени, повышается у пациентов с дефицитом XHIGM или CD40. У нескольких пациентов с синдромом HIGM развилась быстро прогрессирующая нейроэндокринная карцинома.
Увеличение лимфатических узлов и селезенки часто наблюдается у пациентов с аутосомно-рецессивным синдромом HIGM из-за дефектов AID или UNG. В результате у пациентов часто увеличиваются миндалины и аденоиды, которые могут вызывать храп и обструктивное апноэ во сне.
Диагностика синдрома гипер-IgM
XHIGM следует назначать любому мальчику с тяжелыми рецидивирующими респираторными инфекциями или оппортунистической инфекцией с низким или отсутствующим IgG и нормальным или повышенным уровнем IgM.
Неспособность экспрессировать лиганд CD40 на активированных Т-клетках является характерной находкой. Однако есть некоторые пациенты с другими формами иммунодефицита, у которых может быть заметно подавленная экспрессия лиганда CD40, в то время как их ген лиганда CD40 совершенно нормален; у этих пациентов нет HIGM.Точный диагноз синдрома XHIM зависит от идентификации мутации, затрагивающей ген лиганда CD40. Этот анализ ДНК можно сделать в специализированных лабораториях.
Аутосомно-рецессивные формы HIGM можно заподозрить, если пациент имеет характеристики XHIGM, но является либо женщиной, либо имеет нормальный ген лиганда CD40 с нормальной экспрессией на активированных Т-лимфоцитах. NEMO можно заподозрить у пациента, у которого есть признаки эктодермальной дисплазии (например, редкие волосы и конические зубы) и рецидивирующие инфекции, нормальный или повышенный уровень IgM и низкий уровень IgG, IgA и IgE, а также нормальная экспрессия лиганда CD40 на активированных Т-лимфоцитах.
Диагноз различных форм аутосомно-рецессивного HIGM также может быть подтвержден анализом мутаций генов, которые, как известно, вызывают эти нарушения.
Наследование синдромов гипер-IgM
Х-сцепленный гипер-IgM (XHIGM) и NEMO с иммунодефицитом наследуются как Х-сцепленные рецессивные заболевания, и поражаются только мальчики.
Поскольку аутосомно-рецессивные формы HIGM требуют, чтобы были затронуты гены обеих хромосом, они встречаются реже, чем состояния, связанные с Х-хромосомой.Вероятность наличия аутосомно-рецессивной формы HIGM увеличивается, если родители находятся в родстве до брака.
Если точная мутация в пораженном гене известна в данной семье, можно поставить пренатальный диагноз или проверить членов семьи, чтобы узнать, являются ли они носителями мутации. Ранняя диагностика любого из синдромов HIGM позволит начать лечение до развития отдаленных последствий серьезных инфекций.
Лечение синдромов гипер-IgM
Поскольку пациенты со всеми формами HIGM-синдрома имеют тяжелый дефицит IgG, им требуется заместительная иммуноглобулиновая терапия. (См. Главу «Иммуноглобулинотерапия и другие медицинские методы лечения дефицита антител».) Иммуноглобулин заменяет отсутствующий IgG и часто приводит к снижению или нормализации уровня сывороточного IgM.
Поскольку пациенты с дефицитом XHIGM или CD40 также имеют выраженную восприимчивость к пневмонии Pneumocystis jiroveci (carinii) (PCP), им следует начинать профилактическое лечение триметоприм-сульфаметоксазолом (Bactrim, Septra), как только будет поставлен диагноз XHIGM. сделал.Другие препараты для профилактики PCP доступны, если у пациента аллергия на сульфамидные препараты.
При наличии нейтропении также может улучшиться замещение IgG. Пациентам со стойкой нейтропенией может также потребоваться терапия гранулоцитарным колониестимулирующим фактором (G-CSF), особенно если у них есть инфекции, язвы во рту или другие осложнения, связанные с нейтропенией. Однако лечение G-CSF необходимо только у отдельных пациентов, и длительное лечение G-CSF обычно не рекомендуется.
Пациенты с дефектами XHIGM или CD40 не должны получать живые вирусные вакцины, поскольку существует отдаленная вероятность того, что вакцинный штамм вируса может вызвать заболевание. Во избежание контакта с Cryptosporidium следует использовать воду в бутылках.
Пациенты с дефицитом XHIGM или CD40 имеют дефекты функции Т-лимфоцитов в дополнение к дефициту антител, и лечение заместительной терапией иммуноглобулином может не полностью защитить этих пациентов от всех инфекций. Трансплантация гемопоэтических стволовых клеток (стволовые клетки костного мозга или пуповинной крови) успешно выполнялась у многих пациентов с XHIM. (См. Главу «Терапия стволовыми клетками и генная терапия».) Хотя после успешной трансплантации стволовых клеток ожидается окончательное излечение, долгосрочный прогноз для этих пациентов еще не известен.
Поскольку пациенты с аутосомно-рецессивным HIGM, вызванным мутациями в AID или UNG, имеют только дефекты продукции антител без дефекта функции Т-клеток, трансплантация стволовых клеток не рекомендуется.
Ожидания для пациентов с синдромом гипер-IgM
У пациентов с различными генетическими формами HIGM наблюдается широкий диапазон степени тяжести.Людей с дефектами, в основном связанными с переключением классов антител, можно эффективно лечить заменой иммуноглобулинов, и они могут прожить долгую и продуктивную жизнь. Пациенты с HIGM со связанными дефектами активации Т-клеток, как правило, имеют более значительный иммунный дефицит и могут столкнуться с дополнительными проблемами, включая восприимчивость к более опасным типам инфекций, а также развитие аутоиммунных расстройств и рака в качестве дополнительных проблем. Опыт трансплантации гемопоэтических стволовых клеток обнадеживает для людей с более тяжелым заболеванием, и в настоящее время проводятся дальнейшие исследования для оценки долгосрочных результатов.
Выдержка из Справочника IDF для пациентов и семей по первичным иммунодефицитным заболеваниям ПЯТОЕ ИЗДАНИЕ . Авторское право 2013 г. Фондом иммунодефицита, США. Эта страница содержит общую медицинскую информацию, которую нельзя безопасно применить к любому отдельному случаю. Медицинские знания и практика могут быстро меняться.