Хронический гнойный средний отит: лечение заболевания
Быстрый переходОстрый наружный отит — воспалительное заболевание наружного слухового прохода.Быстрый переход
Хронический гнойный средний отит (ХГСО) представляет собой рецидивирующую инфекцию среднего уха и/или сосцевидного отростка (мастоидит) и характеризуется наличием стойкой перфорации барабанной перепонки (БП).
Холестеатома — образование в полости среднего уха или сосцевидном отростке, представляющее собой ороговевший эпителий с включениями кератина. Холестеатома может возникать как первичное заболевание или быть вторичной по отношению к перфорации БП. Врожденной холестеатома бывает редко.
Патогенез
ХГСО чаще встречается в странах (регионах) с низким социально-экономическим развитием и, возможно, связан с неадекватным лечением острого среднего отита (ОСО), плохими гигиеническими условиями и питанием, высоким уровнем потребления табака населением.
У детей к хроническому заболеванию уха часто ведут повторяющиеся эпизоды острого перфоративного среднего отита (ОСО).
Переход ОСО в хроническую форму определяется сроками от двух недель до трех месяцев, точное время перехода остается предметом спора различных исследователей.
Воспалительный процесс при ОСО может переходить из серозного (экссудативный средний отит) в гнойный. При гнойном воспалении в среднем ухе нарастает положительное давление, слуховая труба не успевает его уравновешивать и, когда предел прочности БП превышается, происходит ее разрыв — гнойное отделяемое начинает поступать в полость наружного уха. Такое гноетечение из уха называется отореей. Если эпизоды среднего отита рецидивируют до заживления БП, перфорация становится хронической (стойкой). Края перфорации покрываются эпителием, что затем мешает ее закрытию.
Перфорация БП может располагаться в натянутой части БП (более благоприятный вариант ХГСО) или в ненатянутой (чаще ассоциируется с холестеатомой, имеет злокачественное течение).
Первичные приобретенные холестеатомы чаще всего возникают в результате продолжительной дисфункции евстахиевой трубы (из-за инфекции верхних дыхательных путей, сезонного аллергического ринита, новообразований носоглотки, у детей — гипертрофии аденоидов). Длительно существующее отрицательное давление в среднем ухе и втяжение на этом фоне барабанной перепонки ведет к возникновению кармана, который оказывается позади БП. Из-за воспалительного процесса в кармане накапливаются ороговевшие чешуйки эпителия, из которого и формируется холестеатома.
Вторичная приобретенная холестеатома развивается на фоне существующей перфорации БП. Эпителий мигрирует через дефект барабанной перепонки в пространство среднего уха, что приводит к образованию холестеатомы.
Холестеатомы увеличиваются в размере, разрушая окружающие структуры, приводят к эрозии косточек среднего уха и потере слуха. Бактериальный процесс в области холестеатомы также способствует разрушению кости.
Флора при ХГСО
Синегнойная палочка (Pseudomonas aeruginosa), золотистый стафилококк (Staphylococcus aureus) и его метициллин-резистентные штаммы (MRSA) являются наиболее часто выделяемыми аэробными бактериями при ХГСО. Реже при ХГСО выявляют кишечные грамотрицательные палочки, такие как клебсиелла, протей и кишечная палочка. Среди грибов выявляются Aspergillus spp и Candida spp, но встречаются они довольно редко.
Реже при ХГСО выявляют кишечные грамотрицательные палочки, такие как клебсиелла, протей и кишечная палочка. Среди грибов выявляются Aspergillus spp и Candida spp, но встречаются они довольно редко.
Симптомы
Наиболее распространенным симптомом ХГСО является наличие рецидивирующего или стойкого гнойного отделяемого из уха с неприятным запахом. Боль и лихорадка, как правило, отсутствуют.
Пациенты жалуются на снижение слуха, выраженность которого может варьировать в зависимости от расположения и размеров перфорации БП, целостности слуховых косточек, а также зависеть от длительности заболевания.
Клинические проявления холестеатомы могут различаться. У некоторых пациентов заболевание протекает бессимптомно, другие могут жаловаться на снижение слуха, головокружение, оторею.
Диагностика
Тщательного осмотра ушей (включая микроскопию или отоэндоскопию) в некоторых случаях может быть достаточно для постановки диагноза.
Для оценки степени потери слуха пациентам проводится исследование слуха (аудиометрия).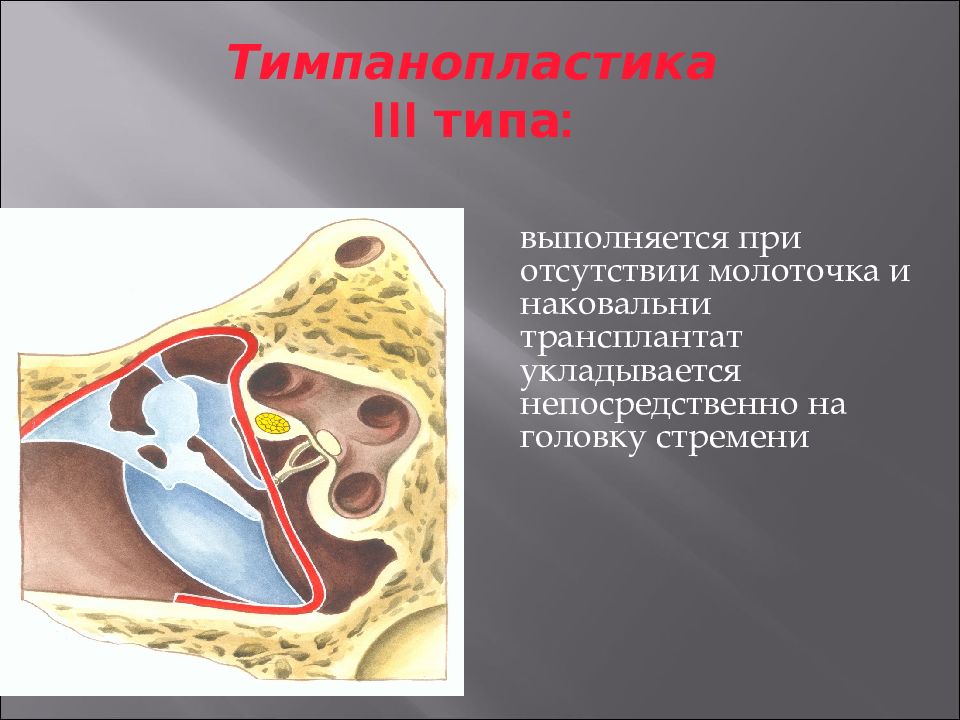
Для исключения обструкции слуховой трубы аденоидными вегетациями или новообразованием пациентам проводится эндоскопический осмотр носоглотки.
Для оценки распространенности процесса, а также при подозрении на экстракраниальные осложнения проводится визуализация с помощью компьютерной томографии (КТ), при подозрении на внутричерепные осложнения — магнитно-резонансной томографии (МРТ).
При ХГСО рекомендуется выполнение бактериологического исследования из уха с определением профиля устойчивости к антибактериальным препаратам.
Дифференциальный диагноз ХГСО включает острый наружный отит, гранулематозные заболевания (например, гранулематоз с полиангиитом, гистиоцитоз X), микобактериальную инфекцию (туберкулез) и злокачественные новообразования.
Основные осложнения ХГСО включают мастоидит (воспаление сосцевидного отростка), абсцесс височной доли головного мозга, тромбоз сигмовидного синуса, паралич лицевого нерва.
Лечение хронического гнойного среднего отита
Цель лечения ХГСО — устранение инфекционного процесса, предотвращение осложнений и рецидива заболевания.
При обострении ХГСО — на первом этапе лечения, для купирования отореи — пациентам рекомендуется местная антибактериальная терапия.
Проникновение системных антибиотиков через лишенную кровеносных сосудов слизистую оболочку среднего уха и сосцевидного отростка затруднено, поэтому местные препараты более эффективны (подтверждается исследованиями). Этот подход снижает и вероятность появления резистентных бактерий.
Несмотря на противоречивость рекомендаций по лечению, фторхинолоны остаются наиболее доказанной группой препаратов при ХГСО. Помимо эффективности, они имеют хороший профиль безопасности.
По данным исследований, местное применение фторхинолонов при ХГСО превосходит по эффективности системные формы.
Стандартная терапия фторхинолонами включает капли ципрофлоксацина или офлоксацина в течение двух недель, в некоторых случаях — до четырех недель.
Добавление глюкокортикоидов к местным антибактериальным препаратам пока не показало значимых преимуществ в лечении ХГСО. Но этот вопрос требует дополнительного изучения и проведения более крупных исследований, поэтому применение комбинированных капель (с антибиотиком и глюкокортикоидом в составе) является допустимым при ХГСО, но не обязательным.
Но этот вопрос требует дополнительного изучения и проведения более крупных исследований, поэтому применение комбинированных капель (с антибиотиком и глюкокортикоидом в составе) является допустимым при ХГСО, но не обязательным.
Системные антибиотики следует назначать пациентам с риском развития сложных и инвазивных инфекций среднего уха, а также пациентам с несколькими предшествующими курсами местного лечения, после которых повышается риск развития резистентных бактерий.
Неэффективность местного лечения всегда должна настораживать врача в отношении устойчивых бактерий.
Рандомизированных контролируемых испытаний, оценивающих пользу туалета уха, пока не проводилось, однако эта процедура может быть полезной при лечении ХГСО в качестве дополнения к антибиотикотерапии.
Хирургическое лечение
При ХГСО хирургическое лечение преследует несколько целей: снизить риск бактериальных осложнений, предупредить прогрессирование потери слуха, восстановить нормальное функционирование уха.
В ходе хирургического вмешательства удаляются инфицированные ткани, холестеатома, полипы из среднего уха и сосцевидного отростка; восстанавливаются анатомические контуры; при разрушенных слуховых косточках устанавливается протез для восстановления непрерывности слуховой цепи и возможности передачи звуковых сигналов во внутреннее ухо; восстанавливается целостность барабанной перепонки.
Как происходит лечение хронического гнойного среднего отита в клинике Рассвет?
Своевременное и адекватное лечение острых средних отитов является залогом снижения вероятности возникновения ХГСО. При диагностике обострения ХГСО мы всегда берем посев из уха — для исключения устойчивых форм бактерий. Эмпирическое лечение начинаем с местного применения фторхинолонов.
При лечении ХГСО мы всегда отдаем приоритет местному лечению и туалету уха под микроскопом. Системные антибиотики назначаем только при осложненном течении — в дополнение, а не вместо ушных капель.
После достижения ремиссии, через 3 месяца, пациент направляется для хирургического лечения к отохирургам, с которыми сотрудничает наша клиника. Данные операции относятся к высокотехнологичным вмешательствам, на которые предусмотрены квоты государства.
Данные операции относятся к высокотехнологичным вмешательствам, на которые предусмотрены квоты государства.
После операции пациент продолжает наблюдение у оториноларинголога для исключения рецидива заболевания.
Интраназальные глюкокортикоиды, сосудосуживающие и антигистаминные препараты не показаны при лечении ХГСО, поэтому оториноларингологами Рассвета не назначаются.
Автор:
Чекалдина Елена Владимировна
оториноларинголог, к.м.н.
Хронический гнойный средний отит
Хронический гнойный средний отит — это длительно протекающее гнойное воспаление среднего уха, характеризующееся наличием стойкой перфорации (дефекта, отверстия) барабанной перепонки, периодическими или постоянными выделениями из уха, как правило, слизисто-гнойного характера и постепенным прогрессирующим снижением слуха. Хронический средний отит является весьма распространенным заболеванием. В настоящее время им болеют около 1% населения и частота данного заболевания не имеет тенденции к снижению. Встречается как у взрослых, так и у детей; более половины отитов формируются в детском возрасте.
Встречается как у взрослых, так и у детей; более половины отитов формируются в детском возрасте.
В зависимости от выраженности воспалительных изменений выделяют 3 формы хронического среднего отита — мезотимпанит, эпитимпанит и эпимезотимпанит (смешанная форма).
При мезотимпаните в воспалительный процесс вовлекается только слизистая оболочка среднего уха — это наиболее благоприятная форма хронического среднего отита.
При эпи- и эпимезотимпаните в процесс вовлекаются костные структуры среднего уха. Развивается кариес костных стенок барабанной полости. Также возможно образование холестеатомы — клеточного образования, постепенно разрушающего структуры среднего уха. Опасность данных двух форм хронического среднего отита состоит в возможности развития осложнений, в том числе внутричерепных. Хотя при мезотимпаните небольшая вероятность осложнений также возможна.
Основная причина возникновения хронического воспаления среднего уха — перенесенные пациентом острые гнойные отиты, которые подвергались неправильному лечению, или не лечились вообще. Хочется особо подчеркнуть, что возникновению воспаления в среднем ухе и переходу его в хроническую форму часто способствуют проблемы в полости носа. При затрудненном носовом дыхании происходит нарушение функции слуховой трубы (канал, соединяющий среднее ухо с носом), и, соответственно, вентиляции среднего уха. При этом среднее ухо не может правильно функционировать, воспаление зачастую становится хроническим.
Хочется особо подчеркнуть, что возникновению воспаления в среднем ухе и переходу его в хроническую форму часто способствуют проблемы в полости носа. При затрудненном носовом дыхании происходит нарушение функции слуховой трубы (канал, соединяющий среднее ухо с носом), и, соответственно, вентиляции среднего уха. При этом среднее ухо не может правильно функционировать, воспаление зачастую становится хроническим.
Диагностика
Диагноз «хронический отит» устанавливает ЛОР-врач на основании осмотра уха. Дополнительно проводится исследование слуха, проверка функции слуховой трубы. Важным является осмотр полости носа, поскольку, важным фактором нормальной работы среднего уха является свободное носовое дыхание.
Лечение
Касательно лечения следует особо подчеркнуть, что хронический средний отит является хирургическим заболеванием. Проводится также медикаментозная терапия, но только для снятия обострения и как подготовка к операции. При отсутствии активного воспаления в среднем ухе пациенту с хроническим средним отитом абсолютно показана операция.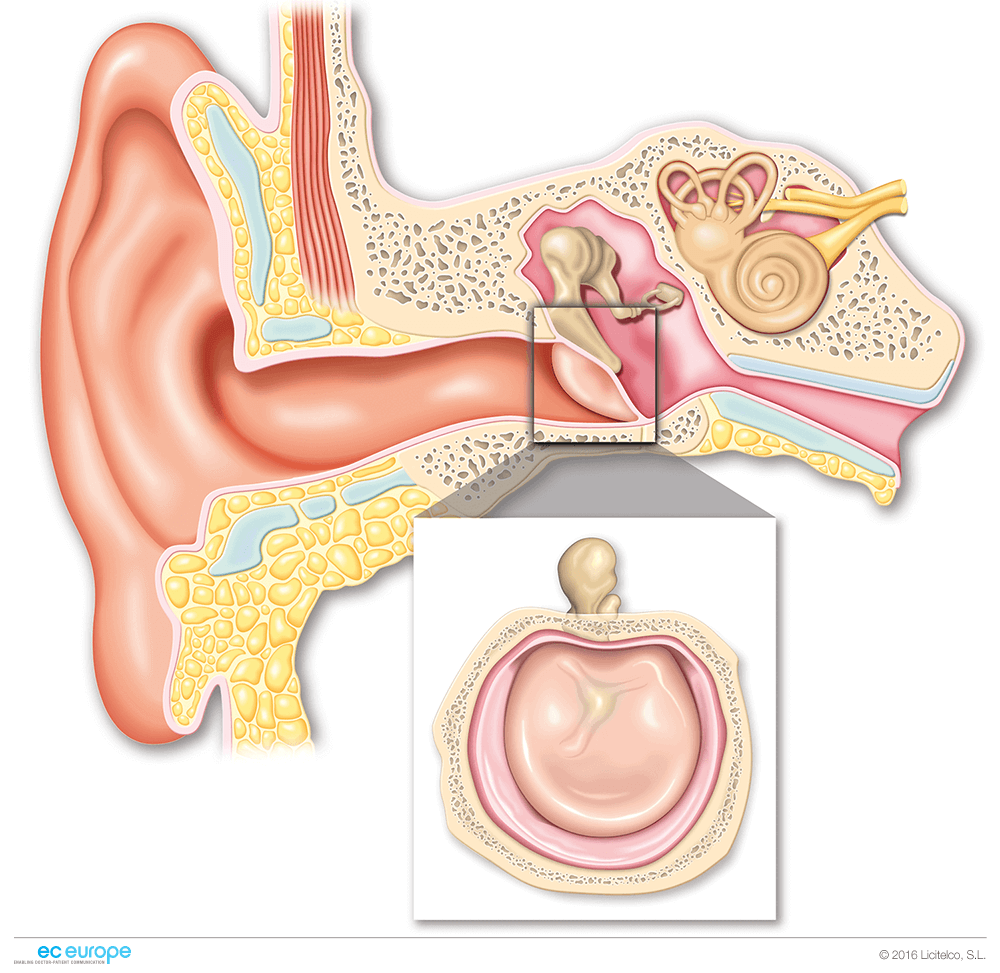 Как подготовку проводят коррекцию искривления носовой перегородки, выполняют курсы по лечению хронических очагов инфекции верхних дыхательных путей (тонзиллит, синусит).
Как подготовку проводят коррекцию искривления носовой перегородки, выполняют курсы по лечению хронических очагов инфекции верхних дыхательных путей (тонзиллит, синусит).
Хирургическое лечение при эпи- и эпимезотимпанитах (так называемые санирующие операции) направлено на санацию очага инфекции, предупреждение развития осложнений, а также сохранение и иногда улучшение имеющегося у больного слуха. При мезотимпаните вне обострения проводят хирургическое вмешательство, целью которого является закрытие перфорации барабанной перепонки, для чего используются ткани пациента (хрящи, фасции). Особенности выполнения операции в каждом конкретном случае уточняются ЛОР-хирургом после осмотра пациента.
Следует подчеркнуть, что данный вид хирургии весьма сложен, требует наличия специально микроскопической техники, микроинструментария и высокой квалификации ЛОР-хирурга.
Важно знать
при наличие перфорации в барабанной перепонке нужно защищать уши во время принятия ванны или душа, чтобы в них не попадали вода и мыло. Для этого можно поместить в наружный слуховой проход ватный тампон или беруши. В остальное время просвет наружного слухового прохода должен оставаться свободным.
Для этого можно поместить в наружный слуховой проход ватный тампон или беруши. В остальное время просвет наружного слухового прохода должен оставаться свободным.
Консультации
На консультацию к профессору А.С. Лопатину можно записаться по телефону: 8 499 241-13-63, поликлиника № 1 УД Президента РФ, г. Москва, пер. Сивцев Вражек, д. 26/28 (ближайшие станции метро: «Смоленская», «Арбатская», «Кропоткинская»).
Гнойный отит — цены на лечение гнойного отита в «СМ-Клиника»
Нужна дополнительная информация?
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Нужна дополнительная информация?
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалистыпроконсультируют Вас.
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Спасибо за обращение.
Ваша заявка принята.
Наш специалист свяжется с Вами в ближайшее время
О заболевании
Острый отит, сопровождающийся образованием гноя, составляет около трети случаев всех заболеваний уха. Патология чаще встречается у детей до 5 лет, пожилых людей, а также у подростков. Патологические изменения могут обретать хроническую форму. Почти половина случаев хронического гнойного отита развивается еще до 18 лет. Эта форма заболевания встречается у 1-2% взрослых. Более чем у половины из них она приводит к значительному ухудшению слуха.При гнойном отите наблюдается воспаление структур среднего уха (барабанной полости, сосцевидного отростка и слуховой трубы) с гипертрофией тканей и скоплением патологических выделений. При присоединении патогенной флоры или активизации условно-патогенных микроорганизмов начинает образовываться гной. Как правило, гнойный отит сопровождается повреждением барабанной перепонки.
В большинстве случаев провокатором гнойных изменений является стафилококковая или стрептококковая инфекция, протей или клебсиелла. У пациентов с хронической формой нередко обнаруживаются грибковые микроорганизмы. Гнойный отит опасен необратимым снижением слуха, внутричерепными гнойными осложнениями (менингитом, формированием абсцесса), которые при запоздалом лечении или без такового могут привести к летальному исходу.
У пациентов с хронической формой нередко обнаруживаются грибковые микроорганизмы. Гнойный отит опасен необратимым снижением слуха, внутричерепными гнойными осложнениями (менингитом, формированием абсцесса), которые при запоздалом лечении или без такового могут привести к летальному исходу.
Симптомы
Воспаление среднего уха проявляется резкой ушной болью, которая усиливается во время жевания или движений челюстью. На этом фоне могут появиться головные боли. Присоединение гнойного процесса сопровождается повышением температуры тела, общим недомоганием (слабость, вялость, сонливость, снижение трудоспособности).Нарушение функционирования слухового аппарата проявляется тугоухостью различной степени (от легкого ухудшения слухового восприятия до полной глухоты). Возможно возникновение ушных шумов (свиста, гула, бульканья, ощущения переливающейся жидкости).
Характерным признаком гнойного отита является образование гноя. Он может выделяться в незначительном количестве или обильно вытекать, загрязняя поверхность ушной раковины. При грануляционном или полипозном процессе в гное может обнаруживаться примесь крови. Гноетечение из уха дольше 4 недель свидетельствует о переходе заболевания в хроническую форму.
При грануляционном или полипозном процессе в гное может обнаруживаться примесь крови. Гноетечение из уха дольше 4 недель свидетельствует о переходе заболевания в хроническую форму.
Хронический гнойный отит развивается из-за неправильного или неполноценного лечения острого заболевания, при наличии очагов хронического воспаления в носоглотке. Спровоцировать очередное обострение может ангина, фарингит, ОРВИ, переохлаждение.
Причины
Главным провокатором гнойного отита считается инфекция. Микроорганизмы могут попадать в среднее ухо при травмах барабанной перепонки или через евстахиеву трубу. Последний вариант встречается при: хронических и острых инфекционно-воспалительных заболеваниях носоглотки, диагностических манипуляциях или инвазивных вмешательствах в области носоглотки.Немаловажную роль в развитии заболевания играет генетическая предрасположенность и состояние иммунитета. Иммунодефицитные состояния и лечение препаратами, подавляющими иммунитет, считаются предрасполагающим для отита фактором.
На устойчивости организма перед инфекциями неблагоприятно сказываются повышенные нагрузки, стрессовые ситуации, переохлаждение, пребывание в условиях сырости, некачественное питание, дефицит витаминов и минералов в рационе, нарушение правил личной гигиены. В таком случае даже нормальная микрофлора может стать причиной воспалительного гнойного процесса в среднем ухе.
Диагностика
С признаками гнойного отита необходимо обратиться к отоларингологу. Заподозрить заболевание можно по имеющимся жалобам. Чтобы подтвердить диагноз, потребуется обследование, которое включает:При поисках причины гнойного отита проводят обследование носоглотки, назначают бактериологический анализ отделяемого. В некоторых случаях проводят забор патологического секрета из уха, чтобы определить состав гноеродной флоры и правильно подобрать лечение. Хронический гнойный отит может быть одним из проявлений системных аллергических реакций, поэтому иногда требуется консультация аллерголога.
Лечение
Терапия, как правило, проводится в амбулаторных условиях. Медикаментозное лечение подразумевает применение антибиотиков, противовоспалительных, гормональных средств, регулярный туалет полости уха. При обильном образовании гноя возможно дренирование барабанной полости с помощью дренажа с последующим введением растворов антисептиков. Не менее важно провести санацию очагов хронического воспаления, качественное лечение тонзиллита или синусита, чтобы предотвратить переход отита в хроническую форму.
Медикаментозное лечение подразумевает применение антибиотиков, противовоспалительных, гормональных средств, регулярный туалет полости уха. При обильном образовании гноя возможно дренирование барабанной полости с помощью дренажа с последующим введением растворов антисептиков. Не менее важно провести санацию очагов хронического воспаления, качественное лечение тонзиллита или синусита, чтобы предотвратить переход отита в хроническую форму.В тяжелых случаях, при высоком риске развития осложнений или первых их признаках, показана срочная госпитализация. При разрушении костных структур среднего уха пациента готовят к операции. Санация полости и реконструктивные методики помогают сохранить слух.
Качественное лечение гнойного отита проводится в многопрофильном медицинском холдинге «СМ-клиника». У нас задействованы лучшие специалисты в области отоларингологии, современное диагностическое оборудование экспертного класса. Клиника располагает собственной лабораторией и стационарным отделением. Имеется возможность проведения физиопроцедур, которые в составе комплексной терапии позволяют добиваться полного восстановления органа.
Имеется возможность проведения физиопроцедур, которые в составе комплексной терапии позволяют добиваться полного восстановления органа.
Наши преимущества:
Более 20 ведущих отоларингологов
Все специалисты
в одной клинике
Передовое медицинское оборудование
Гарантия качества обслуживания
Хотите, мы Вам перезвоним?
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Хронический гнойный средний отит. Тимпанопластика
Воспалительные заболевания среднего уха широко распространены среди населения всех возрастных групп. По данным ВОЗ от 1 до 5% населения земли страдают воспалительными заболеваниями среднего уха с различной степенью выраженности тугоухости.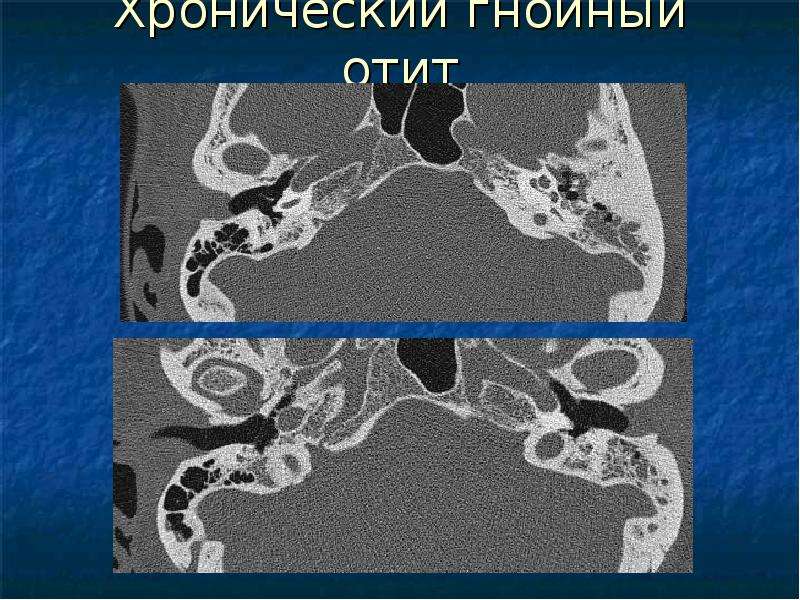
Несмотря на современные возможности диагностики и лечения острых воспалительных заболеваний среднего уха, доля хронических заболеваний, являющихся следствием острых, остается значительно высокой. В частности, в Российской федерации хронический гнойный средний отит встречается до 39,2 случаев на тысячу населения.
Хронический гнойный средний отит (ХГСО) — это заболевание среднего уха, характеризующееся тремя основными показателями: стойкой перфорацией барабанной перепонки, постоянным или периодическим гноетечением из уха и снижением слуха.
По клиническому течению и тяжести заболевания выделяют две формы хронического гнойного среднего отита: мезотимпанит (туботимпанальный гнойный средний отит) и эпитимпанит (хронический эпитимпано–антральный гнойный средний отит). Принципиальное отличие двух форм заболевания заключается в поражении костных структур среднего уха и преимущественной локализации патологического процесса в барабанном пространстве при эпитимпанальной форме. Мезотимпанит по течению является более благоприятной формой ХГСО.
Мезотимпанит по течению является более благоприятной формой ХГСО.
Причины возникновения хронического гнойного среднего отита (ХГСО)
Хронический гнойный средний отит является результатом запущенной формы острого среднего отита или его недостаточного лечения, при котором сформировавшиеся поствоспалительные изменения в слизистой оболочке и структурах среднего уха способствуют хронизации процесса. Стойкое нарушение целостности барабанной перепонки может быть обусловлено и рядом других внешних факторов, среди которых присутствует химическое воздействие или механическое повреждение вследствие травмы.
Развитие ХГСО обусловлено различными факторами, включая снижение общего иммунного статуса организма, наличие сопутствующих заболеваний организма, вирулентными штаммами возбудителей, устойчивыми к антибактериальным препаратам, нарушением репаративных процессов, дисфункцией слуховой трубы и др. Развитию и поддержанию ХГСО может так же способствовать искривление перегородки носа, наличие аденоидных вегетаций.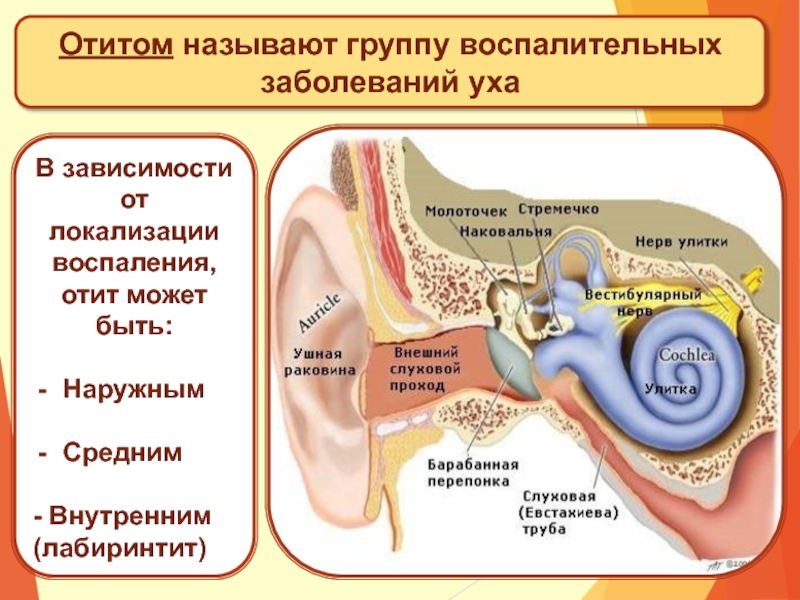
Признаки и симптомы хронического гнойного среднего отита
Обычно больные хроническим гнойным средним отитом или ХГСО предъявляют следующие жалобы:
- периодическое или постоянное гноетечение из уха,
- снижение слуха,
- периодически возникающие боли в ухе,
- на ощущение шума в ухе,
- головокружение.
Однако, в некоторых случаях, эти симптомы могут отсутствовать или быть маловыраженными. Причинами обострения процесса могут быть простуда, попадание воды в ухо, банальный насморк, заболевания носа и носоглотки. При обострении заболевания усиливается гноетечение, может повышаться температура тела, усиливается или появляется шум, нерезкая боль в ухе.
Лечение хронического гнойного среднего отита и последствия НЕ лечения
Консервативное лечение хронического гнойного среднего отита позволяет добиться лишь временного улучшения, а в некоторых случаях и вовсе является неэффективным. Основной причиной неэффективности консервативного лечения является наличие стойкой перфорации барабанной перепонки. Дефект барабанной перепонки является открытым путем распространения инфекции окружающей среды в область среднего уха, в норме имеющего строение замкнутой полости, единственное сообщение которой с внешней средой осуществляется через слуховую трубу. Наличие стойкой перфорации барабанной перепонки, постоянное или периодическое гноетечение поддерживает воспалительный процесс в среднем ухе, что нередко приводит к деструкции (разрушению) цепи слуховых косточек среднего уха. Длительное течение ХГСО приводит к более выраженному снижению слуха и большему распространению воспалительного процесса.
Основной причиной неэффективности консервативного лечения является наличие стойкой перфорации барабанной перепонки. Дефект барабанной перепонки является открытым путем распространения инфекции окружающей среды в область среднего уха, в норме имеющего строение замкнутой полости, единственное сообщение которой с внешней средой осуществляется через слуховую трубу. Наличие стойкой перфорации барабанной перепонки, постоянное или периодическое гноетечение поддерживает воспалительный процесс в среднем ухе, что нередко приводит к деструкции (разрушению) цепи слуховых косточек среднего уха. Длительное течение ХГСО приводит к более выраженному снижению слуха и большему распространению воспалительного процесса.
Своевременная диагностика и лечение ХГСО являются залогом предупреждения распространения патологического процесса в среднем ухе и прогрессирования тугоухости.
Хирургическое лечение хронического гнойного среднего отита
Тимпанопластика
На протяжении многих десятилетий в лечении пациентов с ХГСО с большим успехом используются хирургические методы лечения, являющиеся наиболее эффективными. Одним из таких методов является тимпанопластика. Тимпанопластика это метод хирургического восстановления звукопроводящего аппарата среднего уха–барабанной перепонки и цепи слуховых косточек, направленный на прекращение гноетечения и улучшение слуха. Тимпанопластика при сохранной, функционирующей цепи слуховых косточек может быть ограничена восстановлением только барабанной перепонки–мирингопластикой. Нередким следствием ХГСО является полное или частичное разрушение цепи слуховых косточек. При наличии дефекта или не функциональности отдельных элементов цепи слуховых косточек производится оссикулопластика–восстановление целостности и подвижности цепи слуховых косточек. Тимпанопластика может выполняться как самостоятельная операция, так и являться необходимым, заключительным этапом реконструктивных операций после ранее перенесенных санирующих (радикальных) операций на среднем ухе.
Одним из таких методов является тимпанопластика. Тимпанопластика это метод хирургического восстановления звукопроводящего аппарата среднего уха–барабанной перепонки и цепи слуховых косточек, направленный на прекращение гноетечения и улучшение слуха. Тимпанопластика при сохранной, функционирующей цепи слуховых косточек может быть ограничена восстановлением только барабанной перепонки–мирингопластикой. Нередким следствием ХГСО является полное или частичное разрушение цепи слуховых косточек. При наличии дефекта или не функциональности отдельных элементов цепи слуховых косточек производится оссикулопластика–восстановление целостности и подвижности цепи слуховых косточек. Тимпанопластика может выполняться как самостоятельная операция, так и являться необходимым, заключительным этапом реконструктивных операций после ранее перенесенных санирующих (радикальных) операций на среднем ухе.
На сегодняшний момент «золотым стандартом» в материалах использующихся при тимпанопластике во всем мире признаны аутоткани пациента (хрящ, надхрящница, фасция височной мышцы). Это обусловлено не только полной иммунологической совместимостью тканей, что исключает риск отторжения трансплантата, но и высокими показателями функциональных качеств этих материалов.
Это обусловлено не только полной иммунологической совместимостью тканей, что исключает риск отторжения трансплантата, но и высокими показателями функциональных качеств этих материалов.
Тимпанопластика на сегодняшний день это широко распространенный метод хирургического лечения ХГСО. Использование современного хирургического оборудования, инструментария совместно с накопленным опытом хирургического лечения позволяет эффективно лечить пациентов–достигать улучшения слуха и полного прекращения гноетечения.
В научно–клиническом отделе заболеваний уха ФГБУ НМИЦО применяются самые современные методики операции с использованием современного микроскопического оборудования, микрохирургической техники в исполнении высококвалифицированных отохирургов, проходивших обучение в лучших зарубежных клиниках Европы. Наши специалисты постоянно совершенствуют навыки, следуют самым современным тенденциям в мировой отохирургии.
Гнойный отит на протяжении пяти лет.
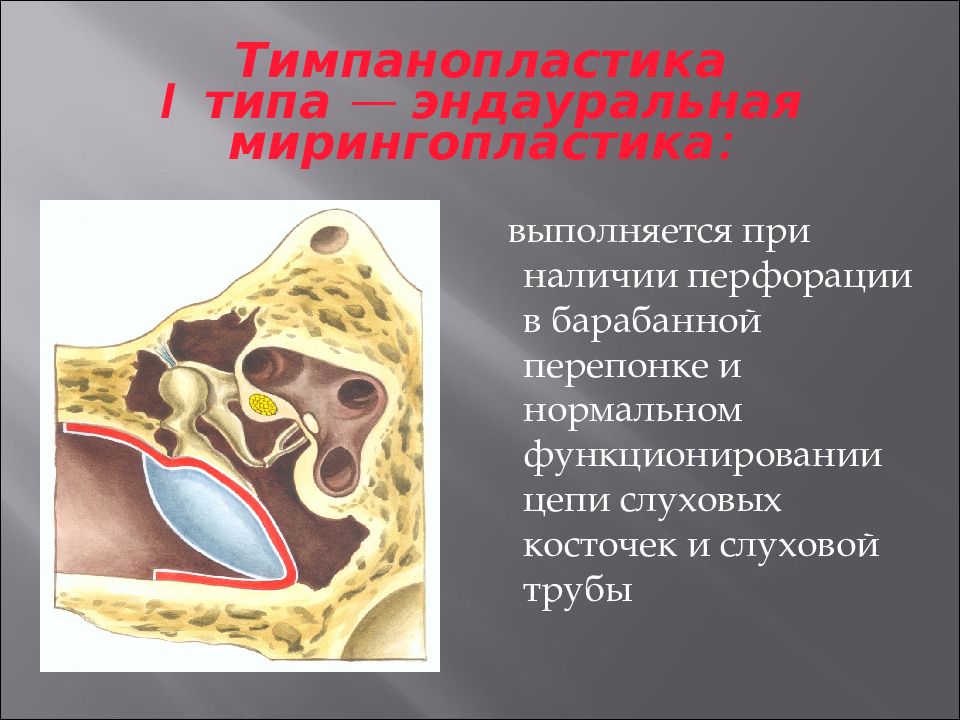 Возможна ли слухоулучшающая операция?
Возможна ли слухоулучшающая операция?проф. О.В.Стратиева
Обширная клиническая практика, солидный хирургический опыт и диссертационные исследования моих учеников и коллег, позволили нам разработать определенную эффективную тактику лечения пациентов с длительным воспалением среднего уха.
Вот, например, у человека в течение пяти лет, ежегодно, один, два раза в году, возникает гнойное воспаление среднего уха (гнойный средний отит). Он проводит лечение у отоларинголога – инъекции антибиотиков, промывание уха, всевозможные капли и др.
Несмотря на проводимое лечение в полости уха за пять лет, уже происходят необратимые изменения. Это стойкая перфорация барабанной перепонки (которая самопроизвольно не закроется), истончение и расплавление отдельных участков слуховых косточек (кариес и эрозия кости), кальцификация суставов и связок слуховых косточек, начинает развиваться холестеатома. Любой хронический гнойный отит – это прямая угроза развития внутричерепного осложнения.
Появление ушного шума, головокружения при закапывании капель и промывании уха, — неблагоприятные симптомы развития осложнений со стороны внутреннего уха. В итоге, все воспалительные изменения в полости уха, как правило, заканчиваются понижением слуха и кондуктивной или смешанной тугоухостью. И самое главное, ушные капли не способны остановить продолжающееся асептическое (не гнойное) воспаление кости или остеомиелит в барабанной полости, сосцевидном отростке и в глубине пирамиды височной кости.
Резюме. Человеку, у которого ежегодно, на протяжении пяти лет происходит обострение гнойного отита, мы непременно предлагаем хирургическое лечение с обязательной иммунной коррекцией после операции. Операцию на ухе мы проводим не в момент обострения отита, а в момент ремиссии, при отсутствии гнойного экссудата в ухе. Это позволяет провести две операции в один этап – санирующую слухосохраняющую и слухоулучшающую операцию – тимпанопластику, добиться хорошего заживления и лучшей функции.
Хронический гнойный средний отит. Нужна ли операция?
Хронический гнойный средний отит. Нужна ли операция?
Хронический гнойный средний отит – воспалительный процесс в среднем ухе, обусловленный стойкой перфорацией барабанной перепонки, постоянным, длительным или периодическим гноетечением из уха, нарушением слуха. Данное заболевание в основном бывает связано с перенесенным в детстве средним отитом, возможно и следствием травмы уха.
Различают две формы – туботимпанальная (мезотимпанит) и аттико-антральная (эпи- , эпимезотимпанит).
Мезотимпанит характеризируется гноетечением из уха, как правило, в большинстве случаев осложнений не дает.
Эпитимпанальная форма протекает более тяжело с деструкцией структур среднего уха, с возможным образованием холестеатомы – опухолевидного образования, состоящего из плотной массы эпидермиса.
Холестеатома в народе именуется как «костоеда». Действительно такая эпидермальная опухоль развивается и увеличивается, полностью разрушая костные структуры, как среднего, так и внутреннего уха с возможным развитием внутричерепных осложнений, пареза или паралича лицевого нерва, снижения слуха до глухоты.
Действительно такая эпидермальная опухоль развивается и увеличивается, полностью разрушая костные структуры, как среднего, так и внутреннего уха с возможным развитием внутричерепных осложнений, пареза или паралича лицевого нерва, снижения слуха до глухоты.
Таким образом, если пациент отмечает периодически гноетечение из уха, снижение слуха, а при отоскопии имеется перфорация барабанной перепонки необходимо проводить КТ (компьютерная томография) височных костей и исследование слуха – аудиометрия, после чего установить диагноз хронический гнойный средний отит и направить его в клинику для лечения.
На современном этапе единственным эффективным способом лечения пациентов с хроническим гнойным средним отитом является хирургическое лечение вне зависимости от формы заболевания. При мезотимпаните производится тимпанопластика, при необходимости – оссикулопластика с применением аутотканей пациента или оссикулярных протезов.
Наличие холестеатомы является абсолютным показанием к санирующей операции с реконструкцией структур среднего и наружного уха. Только полное удаление всей холестеатомы вместе с ее оболочкой может предотвратить ее рецидив. Своевременное лечение данной патологии предупреждает развитие отогенных осложнений.
Только полное удаление всей холестеатомы вместе с ее оболочкой может предотвратить ее рецидив. Своевременное лечение данной патологии предупреждает развитие отогенных осложнений.
В нашей клинике проводится весь спектр обследования и хирургического лечения при хроническом гнойном среднем отите, в том числе при наличии холестеатомы. Применяются авторские методики санирующих операций с восстановлением целостности среднего и наружного уха одномоментно.
Мухамедов Иса Туктарович – отоларинголог, Доктор медицинских наук, Заслуженный врач РФ, профессор.
Хронический гнойный средний отит: терминология, диагностика и лечебная тактика | Гаров Е.В.
Определение. Хронический гнойный средний отит (ХГСО) – заболевание среднего уха, характеризующееся наличием перфорации барабанной перепонки, периодическими выделениями из среднего уха, шумом в ухе и снижением слуха.
МКБ–10:
H66.1. Хронический туботимпальный гнойный средний отит (хр. туботимпанальная болезнь, мезотимпанит).
туботимпанальная болезнь, мезотимпанит).
H66.2. Хронический эпитимпано–антральный гнойный средний отит (хр. эпитимпано–антральная болезнь, эпитимпанит).
Эпидемиология
ХГСО – распространенная патология среднего уха поликлинического и стационарного уровня оториноларингологической помощи. В структуре заболеваний уха на долю ХГСО приходится 27,2%. Распространенность ХГСО в нашей стране составляет от 8,4 до 39,2 на 1000 населения. Среди пациентов с ЛОР–патологией, которым оказывается помощь в ЛОР–стационарах, 5,7–7% страдают ХГСО, а в сурдологических отделениях – около 40%. ХГСО с частыми обострениями является причиной отогенных осложнений, которые в настоящее время возникают у 3,2% больных: у 1,97% наблюдаются интракраниальные (менингит, абсцесс мозга и др.), у 1,35% – экстракраниальные (субпериостальный абсцесс, лабиринтит и др.) осложнения. Смертность от осложнений при ХГСО составляет 16,1%. Одной из причин развития деструкции в среднем ухе является холестеатома, которая выявляется у 24–63% больных ХГСО при любой локализации перфорации барабанной перепонки.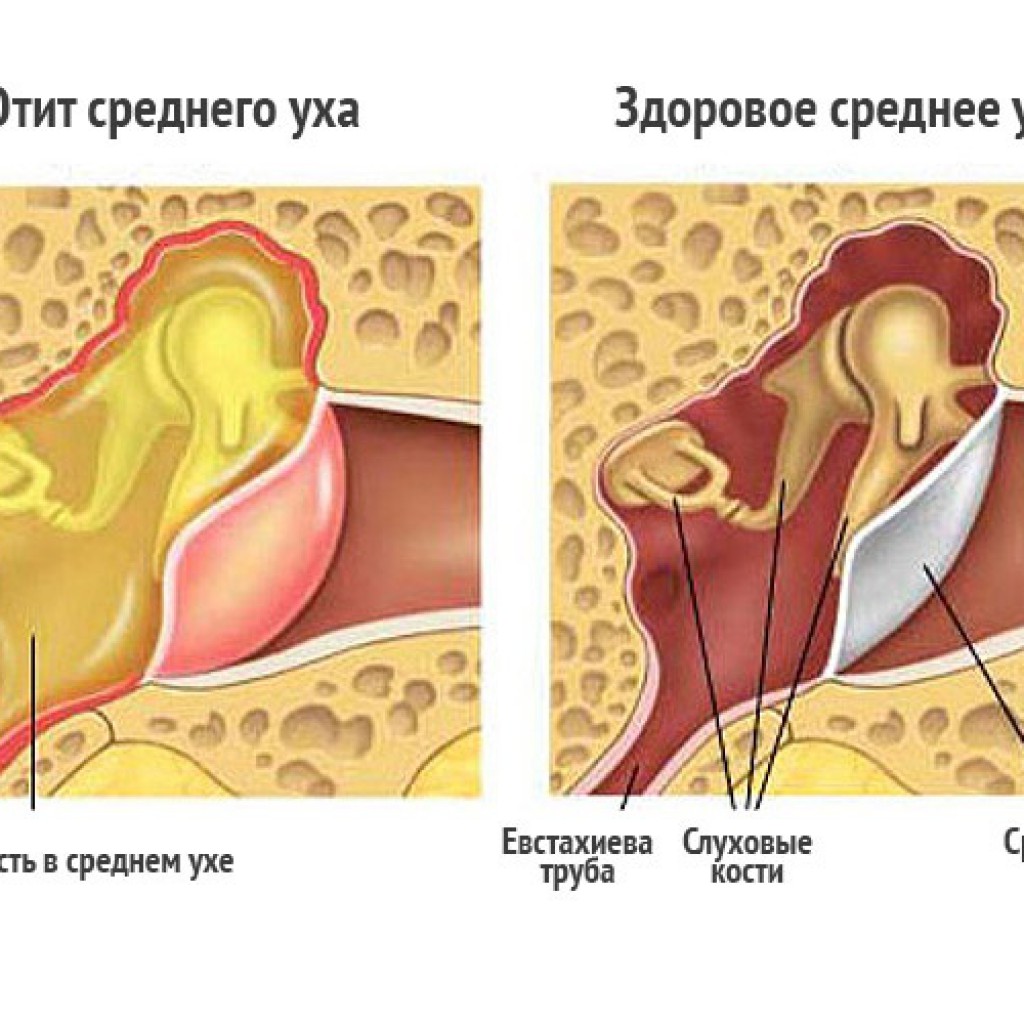 Костная резорбция при отите с холестеатомой, по данным ряда авторов, обнаруживается в 78,8% случаев.
Костная резорбция при отите с холестеатомой, по данным ряда авторов, обнаруживается в 78,8% случаев.
Заболевание чаще двустороннее и является результатом предшествующего острого гнойного среднего отита. Немаловажную роль в развитии ХГСО играют тубарная дисфункция, бессистемное назначение антибиотиков, увеличение общей сенсибилизации населения, а в последние годы – травматические повреждения среднего уха.
Профилактика. Профилактика ХГСО – это рациональное лечение больных экссудативным и острым средним отитом, а также устранение причин, вызывающих тубарную дисфункцию.
Скрининг. Профилактические осмотры оториноларингологом детского и взрослого населения позволяют выявлять бессимптомные формы данного заболевания. При выявлении тугоухости требуется консультация сурдолога.
Классификация
Согласно 10–й Международной классификации болезней различают хронический туботимпальный гнойный средний отит (мезотимпанит) и хронический эпитимпано–антральный гнойный средний отит (эпитимпанит). В нашей стране придерживаются классификации И.И. Потапова (1959), основанной на локализации, размере перфорации барабанной перепонки и вариантах течения заболевания, где выделяются мезотимпанит, эпитимпанит и эпимезотимпанит. Внедрение эндомикроскопии в практику и результаты патоморфологических исследований при ХГСО показали условность этой классификации вследствие различных морфологических вариантов воспаления и его последствий независимо от локализации дефекта перепонки. Сегодня при длительном течении ХГСО можно встретить сочетание катарального воспаления слизистой оболочки с участками фиброзирования, тимпаносклероза, кариеса и холестеатомы, что отражает динамику воспаления и его исходы. Такой полиморфизм проявлений затрудняет четкое разграничение клинических форм ХГСО (доброкачественный или нет) и объясняет активную хирургическую тактику в каждом случае заболевания.
В нашей стране придерживаются классификации И.И. Потапова (1959), основанной на локализации, размере перфорации барабанной перепонки и вариантах течения заболевания, где выделяются мезотимпанит, эпитимпанит и эпимезотимпанит. Внедрение эндомикроскопии в практику и результаты патоморфологических исследований при ХГСО показали условность этой классификации вследствие различных морфологических вариантов воспаления и его последствий независимо от локализации дефекта перепонки. Сегодня при длительном течении ХГСО можно встретить сочетание катарального воспаления слизистой оболочки с участками фиброзирования, тимпаносклероза, кариеса и холестеатомы, что отражает динамику воспаления и его исходы. Такой полиморфизм проявлений затрудняет четкое разграничение клинических форм ХГСО (доброкачественный или нет) и объясняет активную хирургическую тактику в каждом случае заболевания.
Диагностика
Жалобы и анамнез. Пациентов с ХГСО беспокоят выделения из больного уха слизистого или гнойного характера, снижение слуха и низкочастотный шум в ухе. Характерными для холестеатомы являются гнойные выделения с неприятным (ихорозным) запахом. При обострении заболевания наблюдаются оталгия, обильные гнойные выделения, головная боль и клинические проявления осложнений (системное головокружение и др.). Частота обострений зависит от локализации перфорации, провоцирующих факторов заболевания и иммунной защиты организма. Для эпитимпанита характерно бессимптомное течение в отличие от мезо– и эпимезотимпанита, для хронического катарального воспаления слизистой оболочки (так называемого мукозита) – постоянные скудные слизистые выделения из среднего уха.
Характерными для холестеатомы являются гнойные выделения с неприятным (ихорозным) запахом. При обострении заболевания наблюдаются оталгия, обильные гнойные выделения, головная боль и клинические проявления осложнений (системное головокружение и др.). Частота обострений зависит от локализации перфорации, провоцирующих факторов заболевания и иммунной защиты организма. Для эпитимпанита характерно бессимптомное течение в отличие от мезо– и эпимезотимпанита, для хронического катарального воспаления слизистой оболочки (так называемого мукозита) – постоянные скудные слизистые выделения из среднего уха.
Физикальное обследование. Диагностика ХГСО основывается на характерной отоскопической картине. При отоскопии (отомикроскопии) можно оценить количество и характер отделяемого в слуховом проходе и барабанной полости, дефект барабанной перепонки и ее ретракцию, изменение слизистой оболочки медиальной стенки (от гиперплазии до полипа), состояние окон лабиринта, кариозную деформацию латеральной стенки аттика, рукоятки молоточка и наковальни, выявить грануляции и холестеатому (рис. 1).
1).
При обострении верифицировать эти изменения затруднительно из–за воспалительных изменений кожи слухового прохода, барабанной перепонки и слизистой барабанной полости (рис. 2).
Для оценки состояния устья слуховой трубы, аттика и послеоперационной полости используется эндоскопия (жесткий эндоскоп диаметром 4 мм, угол осмотра 300, 700), как и для ведения фотодокументации (рис. 3). С помощью промывания или транстимпанального нагнетания антисептических растворов определяют проходимость адитуса, слуховой трубы и наличие холестеатомы в недоступных для осмотра отделах барабанной полости. Для определения степени проходимости слуховых труб используются пробы Тойнби, Вальсальвы, продувание слуховой трубы по Политцеру или с помощью катетера.
В оценке провоцирующих факторов важную роль играет эндоскопия полости носа и носоглотки.
Исследование слуховой функции с помощью разговорной речи, камертональных тестов (Ринне, Федеричи и Вебера) и тональной пороговой аудиометрии позволяет уточнить степень и характер слуховых нарушений. При ХГСО у больных наблюдается кондуктивная и смешанная тугоухость. На степень тугоухости влияет не только локализация дефекта барабанной перепонки, но и сохранность, подвижность цепи слуховых косточек, наличие адгезий и лабиринтных осложнений.
При ХГСО у больных наблюдается кондуктивная и смешанная тугоухость. На степень тугоухости влияет не только локализация дефекта барабанной перепонки, но и сохранность, подвижность цепи слуховых косточек, наличие адгезий и лабиринтных осложнений.
Комплексное отоневрологическое исследование проводится при системном головокружении у пациента с ХГСО для диагностики отогенных осложнений (фистула лабиринта, лабиринтит и др.).
Инструментальные и лабораторные исследования. Для определения распространения процесса и наличия костной деструкции при ХГСО используется рентгенография височных костей по Шюллеру и Маейру. Однако данные исследования представляют меньшую информацию в сравнении с компьютерной томографией (КТ) височных костей. Высокоразрешающая КТ шагом 1–2 мм в аксиальной и коронарной проекции, выполненная в стадии ремиссии, дает полную информацию о состоянии структур височной кости (рис. 4).
Больным ХГСО для назначения адекватной терапии проводится бактериологическое исследование отделяемого из уха на флору и ее чувствительность к антибиотикам. Часто выявляется полиморфная флора, но в то же время для мезотимпанитов характерна аэробная, а для эпитимпанитов – анаэробная флора.
Часто выявляется полиморфная флора, но в то же время для мезотимпанитов характерна аэробная, а для эпитимпанитов – анаэробная флора.
Клинические исследования крови и мочи, данные ЭКГ и рентгенографии легких назначаются для определения общего состояния больного и влияния хронического очага инфекции на организм в целом.
Дифференциальная диагностика
1) Мирингит (бактериальный, грибковый). Характеризуется скудными гнойными выделениями из уха и заложенностью уха. При отоскопии определяются утолщенность барабанной перепонки, грануляции на ее поверхности и грибковые мицелии без нарушения целостности барабанной перепонки (проба Вальсаль).
2) Холестеатома наружного слухового прохода. Проявляется скудными гнойными выделениями с неприятным запахом, грануляциями и деструкцией нижней стенки наружного слухового прохода. Предпосылками для образования служат узкий костный отдел и экзостозы наружного слухового прохода или его травма. Отсутствует снижение слуха. Помощь в диагностике оказывает КТ височных костей.
Помощь в диагностике оказывает КТ височных костей.
3) Врожденная холестеатома височной кости. Выявляется, как правило, при КТ височных костей, так как длительное время не проявляет себя клинической симптоматикой. Отсутствует в анамнезе острый средний отит, хорошо развита клеточная система сосцевидного отростка. Клинические проявления обусловлены ростом холестеатомы и деструкцией лабиринта.
4) Туберкулезный перфоративный средний отит. Характеризуется атипичностью течения заболевания, белым фибринозным налетом на медиальной стенке барабанной полости, ранним периферическим парезом лицевого нерва и отсутствием эффекта от общепринятой консервативной терапии. В диагностике важную роль играют патоморфологические исследования биоптатов, рентгеновское исследование грудной клетки и проба Манту.
5) Гломусная опухоль (хемодектома). Может проявляться полипом в слуховом проходе при экстратимпанальном росте и снижением слуха. Типичным симптомом является пульсирующий ушной шум. Отсутствуют сведения о заболевании среднего уха и выделения из него. Диагноз устанавливается по данным КТ височных костей в сосудистом режиме.
Отсутствуют сведения о заболевании среднего уха и выделения из него. Диагноз устанавливается по данным КТ височных костей в сосудистом режиме.
Показания к консультации других специалистов. При появлении отогенных осложнений (экстракраниальных или интракраниальных) показано проведение магнитно–резонансной томографии головного мозга, консультации невролога, окулиста и нейрохирурга для определения тактики лечения пациента.
Лечение
Цель лечения – ликвидация очага инфекции в среднем ухе для профилактики и коррекции тугоухости, предупреждения отогенных осложнений.
Показания к госпитализации:
• экстренные – при развитии отогенных осложнений на фоне обострения ХГСО госпитализация в ЛОР–отделение ургентной помощи для обследования и хирургического лечения в объеме санации;
• отсроченные – при обострении ХГСО госпитализация в оториноларингологическое отделение для обследования и проведения консервативной терапии;
• плановые – при ремиссии ХГСО госпитализация в сурдологическое отделение для санации и реконструкции структур среднего уха.
Медикаментозное лечение
При обострении ХГСО эффективна местная терапия с применением антибактериальных (ушные капли «Ципромед», «Отофа», «Нормакс», «Данцил» и др.) с учетом чувствительности идентифицированной микрофлоры, гормональных (эмульсия гидрокортизона, р–р дексаметазона) или комбинированных (ушные капли «Комбинил Дуо») препаратов транстимпанально 2 раза в сутки, после удаления отделяемого из уха в течение 7 дней. Наличие признаков интоксикации и осложнений определяет парентеральное назначение антибактериальной, дезинтоксикационной и симптоматической терапии.
При хронических заболеваниях в полости носа, искривлении перегородки носа и других процессах необходимо проводить консервативное их лечение или хирургическую коррекцию в плановом порядке, что в значительной степени повышает эффективность хирургии на среднем ухе.
Консервативная терапия при вялотекущем процессе у больных ХГСО оправдана в течение 10 дней в качестве подготовки пациента к хирургическому вмешательству. В этот период проводится и обследование пациента. Местное лечение в качестве транстимпанальных нагнетаний целесообразно осуществлять с применением антибактериальных (0,5–1% р–р диоксидина, 0,01% р–р мирамистина и др.), муколитических (ацетилцистеин) и гормональных или комбинированных препаратов 2 раза в сутки. Комбинации вышеперечисленных препаратов с местными физическими факторами воздействия (лазерным облучением, электростимуляцией мышц слуховой трубы и др.) уменьшают явления катарального воспаления слизистой оболочки барабанной полости (так называемого мукозита) и улучшают функции слуховой трубы. При диагностике холестеатомы в аттикальной зоне на дооперационном этапе рекомендуется максимально возможное удаление холестеатомных масс и использование препаратов на спиртовой основе (3% р–р борного или левомицетинового спирта) для уменьшения перифокального воспаления посредством дегидратации.
В этот период проводится и обследование пациента. Местное лечение в качестве транстимпанальных нагнетаний целесообразно осуществлять с применением антибактериальных (0,5–1% р–р диоксидина, 0,01% р–р мирамистина и др.), муколитических (ацетилцистеин) и гормональных или комбинированных препаратов 2 раза в сутки. Комбинации вышеперечисленных препаратов с местными физическими факторами воздействия (лазерным облучением, электростимуляцией мышц слуховой трубы и др.) уменьшают явления катарального воспаления слизистой оболочки барабанной полости (так называемого мукозита) и улучшают функции слуховой трубы. При диагностике холестеатомы в аттикальной зоне на дооперационном этапе рекомендуется максимально возможное удаление холестеатомных масс и использование препаратов на спиртовой основе (3% р–р борного или левомицетинового спирта) для уменьшения перифокального воспаления посредством дегидратации.
В качестве основного вида лечения консервативная терапия, носящая паллиативный характер, оправдана только у больных с тяжелыми сопутствующими заболеваниями при условии регулярного наблюдения.
Хирургическое лечение
Хирургическая санация при обострении ХГСО с отогенными осложнениями выполняется в экстренном или отсроченном порядке под общей анестезией в объеме аттикоантротомии с удалением задней стенки слухового прохода или в расширенном ее варианте в зависимости от осложнений.
В плановом порядке хирургическое вмешательство у больных ХГСО проводится через 6–12 месяцев после обострения в условиях специализированного отделения. Хирургия на «сухом» ухе всегда менее радикальна, позволяет дифференцировать и сохранить структуры среднего уха, избежать ятрогенных осложнений и добиться лучших результатов. Вместе с тем выбор методики операции индивидуален и определяется длительностью течения ХГСО, степенью распространения и выраженности патологического процесса, анатомическими особенностями сосцевидного отростка, уровнем слуховых нарушений, состоянием слуховой трубы, квалификацией хирурга и наличием современной аппаратуры. В связи с этим отохирурги используют интрамеатальный, эндауральный, заушный или комбинированный хирургические подходы.
При «сухих» центральных дефектах барабанной перепонки у пациентов с ХГСО интрамеатальным подходом после ревизии барабанной полости выполняется тимпанопластика I–III типа (по Х. Вульштейну) с применением в качестве пластических материалов аутотканей (аутохряща, аутофасции и меатального лоскута). При тотальных и субтотальных перфорациях тимпанальной мембраны эффективна только многослойная пластика, где в качестве опорного каркаса используется аутохрящевая пластина, которая при толщине 0,5 мм не влияет на звукопроведение.
У больных ХГСО и мукозитом после ревизии всех отделов барабанной полости и иссечения гиперплазированных участков слизистой оболочки вне зависимости от размера дефекта барабанной перепонки применяется многослойная пластика с (или без) дренирования барабанной полости, что в значительной степени повышает эффективность операции. Как показывают собственные наблюдения, проявления мукозита барабанной полости у больных ХГСО в силу незнания этой патологии часто принимают за обострение с элементами остеодеструкции, что является причиной необоснованного проведения больших по объему санирующих операций.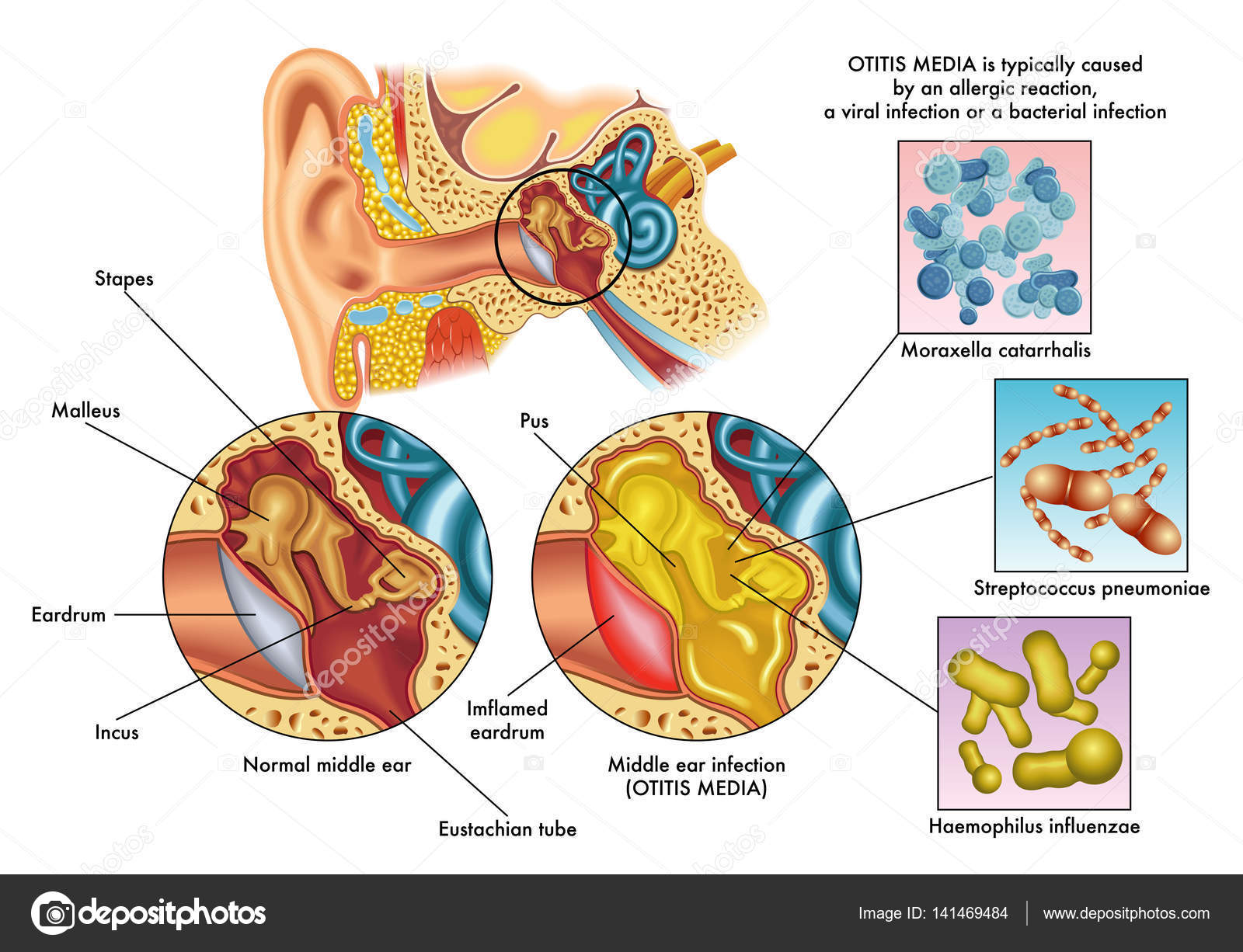
У пациентов с ХГСО и холестеатомой в зависимости от активности кариозного процесса, его распространенности и наличия осложнений используются щадящие закрытые и открытые методики санирующих хирургических вмешательств с одновременной реконструкцией звукопроводящей цепи аутотканями. При кистовидной невоспаленной холестеатоме в аттике и адитусе выполняется аттикоадитотомия интрамеатальным (эндауральным) подходом с удалением холестеатомы, реконструкцией аттика и тимпанопластикой I–III типа (закрытый вариант). При распространении невоспаленной холестеатомы в антрум предпочтительной является раздельная аттикоантротомия с тимпанопластикой комбинированным подходом, которая обеспечивает адекватную санацию и сохранение задней стенки слухового прохода. В зарубежной практике эта методика самая распространенная (69% всех операций при холестеатоме). Обязательным условием выполнения закрытых санирующих вариантов операций является ревизия зоны локализации холестеатомы через 1 год. В случаях воспаленной или стелющейся холестеатомы в зависимости от ее распространения и наличия лабиринтных осложнений проводятся полуоткрытые (аттикоадитотомия) или открытые варианты операции (аттикоантротомия с удалением задней стенки слухового прохода) с тимпанопластикой III–IV типа эндауральным или заушным подходом. При невозможности одновременной тимпанопластики она может быть выполнена вторым этапом через 8–12 месяцев. Результаты тимпанопластики одновременно с санирующей операцией или выполненной вторым этапом существенно не различаются. Формирование большой мастоидальной полости требует мастоидопластики или удаления верхушки сосцевидного отростка для уменьшения послеоперационной полости.
При невозможности одновременной тимпанопластики она может быть выполнена вторым этапом через 8–12 месяцев. Результаты тимпанопластики одновременно с санирующей операцией или выполненной вторым этапом существенно не различаются. Формирование большой мастоидальной полости требует мастоидопластики или удаления верхушки сосцевидного отростка для уменьшения послеоперационной полости.
За рубежом у 73% больных ХГСО с холестеатомой проводятся закрытые операции, у 27% – открытые, в том числе только у 1,3% больных выполняется радикальная санирующая операция на ухе. Многие авторы отмечают одинаковую частоту послеоперационных холестеатом, реперфораций и кохлеарных нарушений при открытых и закрытых методиках операций.
Представленная тактика лечения больных ХГСО позволяет у 92,4% добиться эффективности тимпанопластики, а при холестеатоме у 60% – выполнить операцию по закрытому варианту и у 93% больных провести тимпанопластику с хорошим функциональным результатом.
Прогноз заболевания благоприятный при постоянном наблюдении оториноларинголога, раннем выполнении санирующих, реконструктивных операций и качественном лечении обострений.
Литература
1. Крюков А. И. и соавт. Показатели заболеваемости и качество оказания амбулаторной лор–помощи больным с патологией уха и верхних дыхательных путей в городе Москве // Мат–лы VII науч.–практ. конференции «Фармакологические и физические методы лечения в оториноларингологии». – М., 2008. – с. 10–13.
2. Загайнова Н. С., Бродовская О. Б. О хирургическом лечении хронического гнойного среднего отита // Российская оториноларингология. – 2008. – Прил. 2. – с. 247–249.
3. Тарасов Д. И., Федорова О. К., Быкова В. П. Заболевания среднего уха. – М.: Медицина, 1988. – 185 с.
4. Тос М. Руководство по хирургии среднего уха. – Томск, 2005. – Т. 1, 2.
5. Ajalloueyan M. Experience with surgical management of cholesteatomas // Arch. Otolaryngol. Head Neck Surg., 2006; 132 (9): 931–933.
6. Gacek R. Ear surgery. – Springer – Verlag, Berlin, Heidelberg, 2008: 120 s.
7. Ikeda M. et al. Canal wall down tympanoplasty with canal reconstruction for middle–ear cholesteatoma: post–operative hearing, cholesteatoma recurrence, and status of re–aeration of reconstructed middle–ear cavity // J. Laryngology & Otology, 2003; 117 (4): 249–255.
Laryngology & Otology, 2003; 117 (4): 249–255.
8. Mishiro Y. et al.Tympanoplasty with and without mastoidectomy for non–cholesteatomatous chronic otitis media // Eur. Arch. Otorhinolaryngol., 2001; 258: 13–15.
9. Osma U., Cureoglu S., Hosoglu S. The complications of chronic otitis media: report of 93 cases // J. Laryngology & Otology. – 2000; 114 (2): 97–100.
10. Sasaki T. et al. Results of hearing tests after total middle ear reconstruction // Acta Otolaryngologica, 2007; 127 (5): 474–479.
11. Syms M., Luxford W. Management of Cholesteatoma: Status of the Canal Wall // Laryngoscope, 2003; 113 (3): 443–448.
12. Yung M. The use of middle ear endoscopy: has residual cholesteatoma been eliminated? // J. Laryngology & Otology, 2001; 115 (12): 958–961.
.
Порекомендуйте статью вашим коллегам
Хронический гнойный средний отит.
 Информация CSOM. Пациент
Информация CSOM. ПациентХронический гнойный средний отит (CSOM) — хроническое воспаление среднего уха и сосцевидного отростка. Это преимущественно болезнь развивающихся стран. Клинические признаки — рецидивирующая оторея через перфорацию барабанной перепонки с кондуктивной тугоухостью различной степени тяжести. Эксперты спорят о продолжительности отореи, необходимой для определения ее как хронической инфекции — определения Всемирной организации здравоохранения предполагают более двух недель [1] , в то время как другие утверждают, что более длительная (например, до шести недель) [2] .
Барабанная перепонка перфорирована в CSOM. Если это туботимпанальная перфорация (в центре барабанной перепонки), она обычно «безопасна», в то время как аттикоантральная перфорация (в верхней части барабанной перепонки) часто «небезопасна». Безопасный или небезопасный зависит от наличия холестеатомы:- Safe CSOM — это CSOM без холестеатомы.
 Он может быть разделен на активный или неактивный в зависимости от наличия инфекции.
Он может быть разделен на активный или неактивный в зависимости от наличия инфекции. - Небезопасный CSOM включает холестеатому. Холестеатома — доброкачественное, но деструктивное поражение основания черепа.
Основная патология CSOM — это продолжающийся цикл воспаления, изъязвления, инфекции и грануляции. Острая инфекция среднего уха вызывает раздражение и воспаление слизистой среднего уха с отеком. Воспаление вызывает изъязвление слизистой оболочки и разрушение эпителиальной выстилки. Образование гранулемы может перерасти в полипы в среднем ухе.Этот процесс может продолжаться, разрушая окружающие структуры и приводя к различным осложнениям CSOM.
Эпидемиология
[1]- В Великобритании 0,9% детей и 0,5% взрослых имеют CSOM, без различия между полами.
- Уровень заболеваемости CSOM составляет 4,76%, что соответствует 31 миллиону случаев, из которых 22,6% случаев ежегодно возникают у детей младше 5 лет.
 50% пациентов CSOM имеют нарушение слуха.
50% пациентов CSOM имеют нарушение слуха. - Во всем мире страдают от 65 до 330 миллионов человек, из которых у 60% развивается значительная потеря слуха.Это бремя непропорционально ложится на детей в развивающихся странах [3] .
- Существует связь между CSOM и низкой успеваемостью [4] .
Факторы риска
[2]- Множественные эпизоды острого среднего отита (ОСО).
- Жизнь в многолюдных условиях.
- Быть членом большой семьи.
- Посещение детского сада.
- Исследования родительского образования, пассивного курения, грудного вскармливания, социально-экономического статуса и ежегодного числа инфекций верхних дыхательных путей (ИВДП) показывают только неубедительные ассоциации.
- Черепно-лицевые аномалии повышают риск: расщелина губы или неба, синдром Дауна, синдром кридушата, атрезия хоан и микроцефалия — все это увеличивает риск CSOM.
Спектр среднего отита
[5] Средний отит (ОМ) — это общий термин для группы сложных инфекционных и воспалительных состояний, поражающих среднее ухо. Все ОМ связаны с патологией среднего уха и слизистой оболочки среднего уха. ОМ является ведущей причиной обращений за медицинской помощью во всем мире, а его осложнения — важные причины предотвратимой потери слуха, особенно в развивающихся странах [3] .
Все ОМ связаны с патологией среднего уха и слизистой оболочки среднего уха. ОМ является ведущей причиной обращений за медицинской помощью во всем мире, а его осложнения — важные причины предотвратимой потери слуха, особенно в развивающихся странах [3] .
Существуют различные подтипы ОМ. К ним относятся острый средний отит, средний отит с выпотом (OME), CSOM, мастоидит и холестеатома. Обычно их описывают как отдельные заболевания, но на самом деле между различными типами существует большая степень совпадения. ОМ можно рассматривать как континуум заболеваний:
- ОМ — это острое воспаление среднего уха, которое может быть вызвано бактериями или вирусами. Подтип АОМ — острый гнойный ОМ, характеризующийся наличием гноя в среднем ухе.Примерно в 5% случаев прободится барабанная перепонка.
- OME — это хроническое воспалительное состояние без острого воспаления, которое часто следует за медленно проходящим AOM. При отсутствии признаков и симптомов острого воспаления за интактной барабанной перепонкой происходит излияние клейкой жидкости.

- CSOM — это давнее гнойное воспаление среднего уха, обычно с постоянно перфорированной барабанной перепонкой.
- Мастоидит — это острое воспаление надкостницы сосцевидного отростка и воздушных клеток, возникающее, когда инфекция АОМ распространяется из среднего уха.
- Холестеатома возникает, когда ороговевший плоский эпителий (кожа) присутствует в среднем ухе в результате ретракции барабанной перепонки.
Презентация
Симптомы
- CSOM представляет собой хроническое дренирование уха (> 2 недель) с возможным повторным AOM в анамнезе, травматической перфорацией или вставкой втулок.
- Оторея должна протекать без оталгии и лихорадки.
- Лихорадка, головокружение и оталгия должны требовать срочного направления к врачу для исключения внутривременных или внутричерепных осложнений.
- Пораженное ухо часто теряет слух. Спросите, как это повлияет на развитие речи, учебу или работу. Смешанная потеря слуха (кондуктивная и нейросенсорная) предполагает обширное заболевание.
Признаки
- Внешний слуховой проход может быть отечным, но обычно не болезненным.
- Выделения варьируются от зловонных, гнойных и сырных до прозрачных и серозных.
- Грануляционная ткань часто видна в медиальном канале или в пространстве среднего уха.
- Слизистая оболочка среднего уха, видимая через перфорацию, может быть отечной или даже полиповидной, бледной или эритематозной.
Перфорация барабанной перепонки
Майкл Хок, доктор медицины (собственная работа), CC BY 4.0, через Wikimedia CommonsМайкл Хок, доктор медицины (победа в работе), CC BY 4.0, через Wikimedia Commons
Более серьезное состояние CSOM с хроническими слизистыми выделениями через большую центральную перфорацию можно найти в разделе «Дополнительная литература» и «Ссылки».
Дифференциальный диагноз
NB : хронический серозный средний отит не то же самое, что хронический гнойный средний отит.Первый может быть определен как выпот в среднем ухе без перфорации , сохраняющийся более 1-3 месяцев.
Исследования
[6]- Не используйте мазок из уха в первичной медико-санитарной помощи, поскольку клиническая польза от этого метода неясна.
- Аудиограмма обычно показывает кондуктивную тугоухость. Смешанная потеря слуха может указывать на более обширное заболевание и возможные осложнения.
- Визуализирующие исследования могут быть полезны:
- КТ-сканирование при неудачном лечении может показать скрытую холестеатому, инородное тело или злокачественные новообразования.Это может быть особенно полезно до операции [7] .
- КТ с точным разрезом может выявить эрозию кости в результате холестеатомы, эрозию слуховых косточек, поражение верхушки каменистой кости и поднадкостничный абсцесс.
- МРТ лучше при подозрении на внутривисочные или внутричерепные осложнения. Он лучше показывает мягкие ткани и может выявить воспаление твердой мозговой оболочки, тромбоз сигмовидного синуса, лабиринтит, экстрадуральные и внутричерепные абсцессы.
Ведение
[6]Первичная медицинская помощь
- При наличии припухлости или болезненности (что указывает на мастоидит), лицевого паралича, головокружения или признаков внутричерепной инфекции, срочно проведите обследование или госпитализируйте группу ЛОР.
- Направляйте случаи CSOM без этих функций для рутинной ЛОР-оценки. ЛОР-специалист сможет отсосать экссудат из слухового прохода и, следовательно, точно визуализировать барабанную перепонку.
- Текущее руководство Национального института здравоохранения и совершенствования медицинской помощи Сводки клинических знаний предполагают, что врачи общей практики не должны начинать лечение — это связано с тем, что у немногих неспециалистов есть оборудование или подготовка для проведения чистки слуха; Кроме того, местные антибиотики, используемые специалистами, либо используются не по лицензии (хинолоны), либо не рекомендуются при перфорации барабанной перепонки (аминогликозиды).
- Пациентам следует рекомендовать держать пораженное ухо сухим. Рекомендации по плаванию
Пациентам с CSOM обычно рекомендуется избегать плавания, но, если они плавают, им следует потом вытирать уши. Доказательства ограничены, и, следовательно, среди специалистов нет единого мнения. Некоторые советуют использовать беруши до тех пор, пока прокладки не будут выдавлены, а другие — нет. Точно так же нет соглашения о том, следует или не следует разрешать дайвинг, пока люверсы находятся на месте [8] .
Вторичная помощь
Консервативное лечение CSOM состоит из трех компонентов:
- Подходящий антибиотик, обычно назначаемый местно.
- Обычный интенсивный ушной туалет (микровсасывание) для удаления мусора.
- Контроль грануляционной ткани.
Лекарство
- Слуховой туалет и местные антибиотики оказались эффективными при лечении отореи. Долгосрочные результаты (например, заживление перфорации барабанной перепонки, предотвращение рецидивов и улучшение слуха) требуют дальнейшего изучения.
- Местное лечение более эффективно устраняет выделения из слуха, чем системная терапия [9] — вероятно, из-за более высоких местных концентраций антибиотика.
- Антибиотики должны обладать активностью в отношении грамотрицательных организмов, особенно псевдомонад и грамположительных организмов, особенно Staphylococcus aureus:
- И аминогликозиды, и фторхинолоны соответствуют этим критериям, но сохраняются проблемы безопасности в отношении обоих. Многие авторитетные источники советуют применять топические аминогликозиды , а не при перфорации барабанной перепонки из-за их ототоксичности.Однако многие специалисты продолжают использовать их с осторожностью, считая, что недолеченная ОМ связана с более высоким риском ухудшения слуха и осложнений [10] .
- Хинолоны для местного применения эффективны по сравнению с отсутствием медикаментозного лечения или только с применением только местных антисептиков; однако доказательства их превосходства над другими антибиотиками местного применения являются лишь косвенными [11] . Специалисты из Великобритании используют не лицензированные хинолоны или аминогликозиды (поскольку их эффективность перевешивает риски ототоксичности).Существуют определенные опасения по поводу использования фторхинолонов у детей, поскольку исследования на молодых животных указывают на риск травм суставов у детей. Кратковременное лечение оказалось безопасным [12] . Одно исследование обнаружило связь между ципрофлоксацином и артропатией у педиатрических пациентов, хотя эффект был обратимым. Связи между продолжительностью приема и частотой артропатии [12] обнаружено не было.
- Неудача антибиотика обычно происходит из-за неспособности проникнуть в дебрис, а не из-за устойчивости бактерий.
- Стероиды для местного применения используются для уменьшения образования гранулем, и обычно используются комбинированные препараты антибиотиков и стероидов.
- Системная терапия предназначена для неэффективности местного лечения. Если очаг инфекции в сосцевидном отростке не может быть достигнут с помощью капель для местного применения, то антибиотики, применяемые системно (обычно внутривенно), могут проникнуть внутрь в достаточных концентрациях для контроля или устранения инфекции. Одновременно продолжается местная терапия. Обычно это делается в больнице с сопутствующим режимом интенсивного слухового туалета.
- Лечение следует продолжать в течение трех-четырех недель после окончания отореи.
Хирургический
- Современные данные о хирургических процедурах для CSOM [13] ограничены.
- Однако небольшая серия случаев из Индии показала, что хирургическое вмешательство обычно может сделать ухо «сухим» и, следовательно, излечить от CSOM, когда другие методы лечения не помогли [14] .
- Тип операции будет зависеть от тяжести заболевания и может включать мирингопластику (восстановление только перфорации барабанной перепонки) или тимпанопластику (восстановление барабанной перепонки и хирургическое вмешательство с вовлечением костей внутреннего уха).
- Если отоскопия выявляет небезопасную грануляционную ткань, ушные полипы или инфекцию, сохраняющуюся, несмотря на соответствующее лечение, следует обратиться к холестеатоме. Целью последующего лечения является создание безопасного уха, хотя соответствующая хирургическая процедура часто вызывает споры.
- При наличии холестеатомы (небезопасная CSOM) может использоваться классическая радикальная мастоидэктомия, модифицированная радикальная мастоидэктомия или тимпанопластика с комбинированным доступом (передняя тимпанотомия плюс расширенная мастоидэктомия) в зависимости от степени холестеатомы и, что более важно, опыта хирург.Независимо от выбранной процедуры, цель операции — удалить все болезни и дать пациенту сухое и работающее ухо.
- Паралич лицевого нерва может возникать с холестеатомой или без нее. Оперативное обследование с мастоидэктомией должно быть выполнено незамедлительно.
- Лабиринтит возникает, когда инфекция распространилась на внутреннее ухо. Раннее хирургическое обследование для удаления инфекции уменьшает повреждение лабиринта. Агрессивная хирургическая обработка раны (включая лабиринтэктомию) проводится для предотвращения возможно смертельного менингита или энцефалита.
- Если кондуктивная потеря слуха возникла в результате CSOM (из-за перфорации барабанной перепонки и / или разрыва цепи слуховых косточек), хирургическое удаление инфекции и холестеатомы с последующей реконструкцией цепи слуховых косточек уменьшит потерю слуха.
- Кохлеарные имплантаты использовались в CSOM, но прежде всего необходимо искоренить все болезни [15] .
Осложнения
[16]Осложнения CSOM редки, но потенциально опасны для жизни.
Внутривисочные осложнения включают:
- Петрозит
- Паралич лицевого нерва [17]
- Лабиринтит
Внутричерепные осложнения включают:
- Боковой синусовый тромбофлебит
Изучить этиологию хронического гнойного среднего отита.
Опишите подходящую оценку хронического гнойного среднего отита.
Опишите возможные варианты лечения хронического гнойного среднего отита.
Обобщите стратегии межпрофессиональной группы по улучшению координации помощи и коммуникации для продвижения хронического гнойного среднего отита и улучшения результатов.
- 1.
- Хед К., Чонг Л.Й., Бхутта М.Ф., Моррис П.С., Виджаясекаран С., Бертон М.Дж., Шилдер А.Г., Бреннан-Джонс К.Г. Актуальные антисептики при хроническом гнойном среднем отите.Кокрановская база данных Syst Rev.2020 6 января; 1: CD013055. [Бесплатная статья PMC: PMC6956662] [PubMed: 310]
- 2.
- Эммет С.Д., Кокеш Дж., Кейли Д. Хроническая болезнь уха. Med Clin North Am. 2018 ноя; 102 (6): 1063-1079. [PubMed: 30342609]
- 3.
- Мастер А., Уилкинсон Э., Вагнер Р. Управление хроническим гнойным средним отитом и отосклерозом в развивающихся странах. Otolaryngol Clin North Am. 2018 июн; 51 (3): 593-605. [PubMed: 29525390]
- 4.
- Озджан Н., Саат Н., Йилдирим Байлан М., Акполат Н., Атмака С., Гюль К.Три случая хронического гнойного среднего отита (CSOM), вызванного Kerstersia gyiorum, и обзор литературы. Infez Med. 2018 декабря 01; 26 (4): 364-368. [PubMed: 30555142]
- 5.
- Удден Ф., Филипе М., Реймер Å, Пол М., Матушек Э., Тегерстрём Дж., Хаммершмидт С., Пелконен Т., Рисбек К. Аэробные бактерии, связанные с хроническим гнойным средним отитом в Анголе. Заразите бедность. 2018 Май 03; 7 (1): 42. [Бесплатная статья PMC: PMC5932871] [PubMed: 29720274]
- 6.
- Bozan N, Düzenli U, Yalinkilic A, Ayral A, Parlak M, Turan M, Kiroglu AF.Синдром Градениго, вызванный гнойным средним отитом. J Craniofac Surg. 2018 Октябрь; 29 (7): e645-e646. [PubMed: 29894453]
- 7.
- Дженсен Р.Г., Йохансен Х.К., Бьярнсхольт Т., Эйкхардт-Соренсен С.Р., Хомё П. Рецидивирующая оторея при хроническом гнойном среднем отите: биопленка — недостающее звено? Eur Arch Otorhinolaryngol. Июль 2017; 274 (7): 2741-2747. [PubMed: 28466356]
- 8.
- Рейсс М., Рейсс Г. [Гнойный хронический средний отит: этиология, диагностика и терапия]. Med Monatsschr Pharm.2010 январь; 33 (1): 11-6; викторина 17-8. [PubMed: 20131670]
- 9.
- Harris AS, Elhassan HA, Flook EP. Почему ототопические аминогликозиды по-прежнему являются терапией первой линии при хроническом гнойном среднем отите? Систематический обзор и обсуждение аминогликозидов по сравнению с хинолонами. J Laryngol Otol. 2016 Янв; 130 (1): 2-7. [PubMed: 26584651]
- 10.
- Роса-Оливарес Дж., Порро А., Родригес-Варела М., Рифкол Дж., Нируманд-Рад И. Медиа-отит: лечить, обращаться, ничего не делать: обзор для практикующего .Pediatr Rev.2015 ноябрь; 36 (11): 480-6; викторина 487-8. [PubMed: 26527627]
8 9000 9000 9000
8 Менинфлебит
8, включая Прогноз [2]
Прогноз хороший в развитых странах, где есть легкий доступ к антибиотикам и хирургическому лечению.Однако в неразвитых странах результат может быть различным. В 2002 году во всем мире отит умерло 3 599 человек, в большинстве случаев из-за распространения инфекции сосцевидного отита и внутричерепной инфекции.
Перфорация барабанной перепонки может зажить спонтанно, но иногда может сохраняться, приводя к легкому или умеренному нарушению слуха. Если это происходит в первые два года жизни, это связано с увеличением трудностей в обучении и снижением успеваемости.
Хронический гнойный средний отит: основы практики, анатомия, патофизиология
Автор
Денни Варугезе, MD Врач-резидент, Отделение отоларингологии — хирургии головы и шеи, Медицинская школа Рутгерса, Нью-Джерси
Раскрытие информации: Ничего не разглашать.
Соавтор (ы)
Yu-lan Mary Ying, MD Доцент кафедры отоларингологии, хирургии головы и шеи, Медицинская школа Рутгерса, Нью-Джерси; Лечащий отоларинголог, горная больница Hackensack UMC, больница Святого Варнавы и университетская больница
Ю-лан Мэри Ин, доктор медицинских наук, является членом следующих медицинских обществ: Американская академия отоларингологии — хирургия головы и шеи, Американское общество нейротологов, Североамериканский череп Базовое общество, Исследовательская группа отосклероза
Раскрытие: Ничего не нужно раскрывать.
Главный редактор
Арлен Д. Мейерс, доктор медицинских наук, магистр делового администрирования Профессор отоларингологии, стоматологии и инженерии, Медицинский факультет Университета Колорадо
Арлен Д. Мейерс, доктор медицины, магистр делового администрирования является членом следующих медицинских обществ: Американской академии пластической и реконструктивной лицевой хирургии Хирургия, Американская академия отоларингологии — хирургия головы и шеи, Американское общество головы и шеи
Раскрытие информации: Служить (d) в качестве директора, должностного лица, партнера, сотрудника, советника, консультанта или попечителя для: Cerescan; Cliexa, eMedevents, Neosoma, MI10
Получил доход в размере 250 долларов США от:, Cliexa ;; Neosoma
Получил акции от RxRevu; Получена доля владения от Cerescan за консультацию; для: Neosoma, eMedevents, MI10.
Дополнительные участники
Питер С. Роланд, доктор медицины Профессор кафедры неврологической хирургии, профессор и заведующий кафедрой отоларингологии — хирургия головы и шеи, директор Клинического центра заболеваний слухового, вестибулярного и лицевого нерва, заведующий педиатрической отологией Техасского университета Юго-Западный медицинский центр; Заведующий детской отологией Детского медицинского центра Далласа; Президент медицинского персонала Мемориальной больницы Паркленда; Адъюнкт-профессор коммуникативных расстройств, Школа поведенческих и мозговых наук, начальник медицинской службы, Центр коммуникативных расстройств Каллиер, Школа человеческого развития Техасского университета
Питер С. Роланд, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha , Американская академия отоларингической аллергии, Американская академия отоларингологии — хирургия головы и шеи, Американское слуховое общество, Американское общество невротологов, Американское отологическое общество, Североамериканское общество основания черепа, Общество университетских отоларингологов — хирургов головы и шеи, Триологическое общество
Раскрытие информации: получил гонорары от Alcon Labs за консультации; Получал гонорары от Advanced Bionics за членство в совете директоров; Получал гонорары от Cochlear Corp за членство в совете директоров; Получал гранты на поездки от Med El Corp за консультации.
Брэндон Исааксон, доктор медицины, FACS Доцент, кафедра отоларингологии, хирургия головы и шеи, Юго-западный медицинский центр Техасского университета
Брэндон Исааксон, доктор медицины, FACS является членом следующих медицинских обществ: Американская академия отоларингологии, руководитель и хирургия шеи, Американский колледж хирургов, Североамериканское общество основания черепа, Техасская медицинская ассоциация, Триологическое общество, Американское общество невротологов
Раскрытие информации: Получено вознаграждение за консультацию от института Medtronic Midas Rex Insitute; Получил медицинский консультативный совет от Advanced Bionics для членства в совете; Получил гонорар от Страйкера за выступление и преподавание.
Благодарности
Анураг Джайн, MBBS, FRCS (Ирландия), MS, FRCS (Oto), MS (Oto), DLO (RCSEngland) Специалист-регистратор, Отделение отоларингологии, Общая больница Пиндерфилдс, Уэйкфилд, Великобритания
Анураг Джайн, MBBS, FRCS (Ирландия), MS, FRCS (Oto), MS (Oto), DLO (RCSEngland) является членом следующих медицинских обществ: Ассоциация отоларингологов Индии, Британская ассоциация оториноларингологов, Head and Neck Хирурги, Британская медицинская ассоциация, Королевский колледж хирургов в Ирландии и Королевский колледж хирургов Англии
Раскрытие: Ничего не нужно раскрывать.
Джеффри Роберт Найт, MBChB, FRCS Хирург-консультант, отделение отоларингологии, Университетская больница Mayday, Лондон
Раскрытие: Ничего не нужно раскрывать.
Джон Си Ли, доктор медицины Частная практика в отологии и невротологии; Медицинский директор, Balance Center
Джон Си Ли, доктор медицины, является членом следующих медицинских обществ: Американской академии отоларингологии — хирургии головы и шеи, Американского колледжа хирургов, Американской медицинской ассоциации, Американского общества невротологов, Американской ассоциации тиннитуса, Флоридской медицинской ассоциации и Североамериканского черепа. Базовое общество
Раскрытие: Ничего не нужно раскрывать.
Дэвид Парри, MD Штатный врач отделения отоларингологии — хирургии головы и шеи, ЛОР-партнеры детской больницы, Бостон
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Reference Salary Employment
Питер А. Вайскопф, доктор медицины Нейротолог, Консультанты по отоларингологии Аризоны; Заведующий отделением невротологии, Неврологический институт Барроу
Питер А. Вайскопф, доктор медицины, является членом следующих медицинских обществ: Американской академии отоларингологии — хирургии головы и шеи и Американского колледжа хирургов
.Раскрытие: Ничего не нужно раскрывать.
| Каковы эффекты лечения хронического гнойного среднего отита у взрослых? | |||||||||||||||||||||||||||
| 2 (154) | Уменьшение отореи | Местные антибиотики плюс местные кортикостероиды v плацебо | 4 | –1 | 0 | –1 | 0 | Низкое | Вычитаются данные о качестве балла. Балл непосредственности, вычитаемый за неопределенность в отношении выгоды | ||||||||||||||||||
| 1 (64) | Снижение отореи | Местные антибиотики плюс местные кортикостероиды v Только местные кортикостероиды | 4 | –3 | 0 | 0 | +1 | Низкое качество | баллов вычтено, нет данных о назначениианализ лечения и неопределенность в отношении ослепления.Пункт размера эффекта добавлен для RR менее 0,5 | ||||||||||||||||||
| 2 (402) | Уменьшение отореи | Местные антибиотики плюс местные кортикостероиды v Только местные антибиотики | 4 | –1 | 0 | –1 | 0 | Низкая | в отчете о качестве результатов не полностью. За неуверенность в определении результата вычитается балл непосредственности | ||||||||||||||||||
| 5 (247) | Снижение отореи | Системные антибиотики v Местные антибиотики | 4 | 0 | 0 | –1 | 0 | Умеренное | Очки непосредственности вычитаются 9039 903 для широкого диапазона компараторов 9039 905 ) | Снижение отореи | Системные антибиотики v Местные антисептики | 4 | –1 | 0 | 0 | 0 | Умеренная | Балл качества вычитается из-за скудных данных | Снижение отореи | Системные антибиотики против друг друга | 4 | 0 | –1 | 0 | 0 | Умеренное | Точка согласованности вычтена для противоречивых результатов 1 |
| Уменьшение отореи | Системные антибиотики, добавленные к мастоидэктомии или тимпанопластике v без антибиотика | 4 | –1 | 0 | –1 | 0 | Низкое качество | вычтено для данных о низком качестве.Балл непосредственности, вычитаемый за исходные различия в тяжести заболевания||||||||||||||||||||
| 3 (150) | Снижение отореи | Местные плюс системные антибиотики v Только местные антибиотики | 4 | –1 | –1 | –1 | 0 | Очень низкий | Вычитаются балльные оценки качества. За противоречивые результаты вычитается балл согласованности. Балл прямолинейности вычитается для широкого диапазона компараторов | ||||||||||||||||||
| 2 (308) | Уменьшение отореи | Местные плюс системные антибиотики v только системные антибиотики | 4 | –1 | –1 | 0 | 0 | Низкая | Отчетность за неполное качество вычитается за неполные результаты.Точка согласованности, вычитаемая за противоречивые результаты | ||||||||||||||||||
| 1 (35) | Снижение отореи | Местные антибиотики против плацебо | 4 | –3 | 0 | 0 | 0 | Очень низкое | Очки качества вычитаются из-за недостаточности данных и методологических проблем и неопределенность в отношении рандомизации и ослепления) | ||||||||||||||||||
| 5 (570) | Уменьшение отореи | Местные антибиотики v друг друга | 4 | 0 | 0 | 0 | 0 | Высокий | |||||||||||||||||||
| 2 (89) | Уменьшение отореи | Антибиотики для местного применения v Антисептики для местного применения | 4 | –1 | –1 | 0 | 0 | Низкое | Пункты качества вычитаются из-за разреженных данных.Точка согласованности, вычитаемая за противоречивые результаты | ||||||||||||||||||
| 1 (101) | Уменьшение отореи | Актуальные антибиотики добавлены к тимпанопластике v без лечения | 4 | -1 | 0 | 0 | 0 | Умеренная | 9039 9039 9039 9039 9039 эффекты лечения хронического гнойного среднего отита у детей? | ||||||||||||||||||
| 1 (33) | Снижение отореи | Системные антибиотики v Плацебо или отсутствие лечения у детей, которым проводится очистка ушей и обработка раны | 4 | –1 | 0 | 0 | 0 | Среднее качество | , вычитаются данные по шкале | ||||||||||||||||||
| 2 (63) | Снижение отореи | Системные антибиотики против друг друга | 4 | –2 | 0 | 0 | 0 | Низкое | Пункты качества вычтены из-за разреженных данных и неполных данных 1 (96) | Уменьшение отореи | Местные антибиотики против друг друга | 4 | –3 | 0 | 0 | 0 | Очень низкое | Очки качества вычитаются за недостаточность данных и методологические проблемы короткое наблюдение) | |||||||||
| 2 (103) | Уменьшение отореи | Антисептики для местного применения v Плацебо или без лечения | 4 | –1 | 0 | 0 | 0 | Умеренный | Балл качества вычитается для разреженных данных ) | Уменьшение отореи | Местные антисептики v Местные антибиотики | 4 | –1 | 0 | 0 | 0 | Умеренная | Оценка качества, вычтенная за неопределенность метода 2 | Уменьшение отореи | Очищение ушей v без лечения | 4 | –2 | –1 | 0 | 0 | Очень низкий | Очки качества вычитаются за выявление и ослепляющие недостатки.Балл согласованности вычитается за противоречивые результаты |
Хронический гнойный отит — StatPearls
Непрерывное обучение
Хронический гнойный средний отит продолжает оставаться важным заболеванием в педиатрической популяции и серьезной причиной проблем со слухом, ведущих к нарушениям языкового развития и школе трудности у детей. В этой статье рассматриваются этиология, эпидемиология и патофизиология хронического гнойного среднего отита, а также лечение и долгосрочные осложнения, которые могут возникнуть у детей школьного возраста.Это важная область исследования, и наша роль состоит в том, чтобы выделить соответствующий уход за пациентами, страдающими этим заболеванием. В этой статье рассматривается и описывается оценка и лечение хронического гнойного среднего отита, а также объясняется роль медицинской бригады в оценке, лечении и улучшении ухода за пациентами с этим заболеванием.
Цели:
Введение
Средний отит — одна из наиболее частых причин лихорадки среди детей.Хронический гнойный средний отит, также известный как хронический средний отит, представляет собой стадию заболевания уха, при которой имеется постоянная хроническая инфекция среднего уха без неповрежденной барабанной перепонки. Это заболевание — хроническое воспаление среднего уха и сосцевидного отростка. Характерным проявлением является хроническая или стойкая оторея в течение 2–6 недель через перфорированную барабанную перепонку. [1] Евстахиева труба играет важную роль в этом заболевании, и дисфункция этой трубы обнаруживается у 70% пациентов, перенесших операцию на среднем ухе.Когда возникает дисфункция евстахиевой трубы, уравновешивание давления в среднем ухе нарушается и нарушается аэрация среднего уха, что приводит к классическим симптомам хронического гнойного среднего отита [2]. Приобретенная потеря слуха также характерна для пациентов с этим заболеванием и, если ее не лечить, может привести к дальнейшей заболеваемости и смертности [3].
Этиология
Хотя вирусы являются наиболее распространенной этиологией при среднем отите, бактерии часто поражают детей с хроническим гнойным средним отитом.Этиология обычно полимикробная. Наиболее часто встречающиеся при данной патологии микроорганизмы Staphylococcus aureus (MRSA). Другие, такие как Pseudomonas aeruginosa , Proteus spp, Klebsiella spp, Bacteroides spp. и Fusobacterium spp. могут вызывать заболевание. Реже встречаются Aspergillus spp и Candida spp. которые чаще встречаются у пациентов с ослабленным иммунитетом. [4] Туберкулез также может вызывать хронический гнойный средний отит; это более частая причина в регионах с высокой заболеваемостью туберкулезом.
Эпидемиология
Хронический гнойный средний отит обычно развивается в раннем детстве, чаще всего в возрасте около двух лет. Наибольшему риску подвергаются дети с низким доходом [5]. Это заболевание также наиболее часто встречается у детей с черепно-лицевыми аномалиями, такими как волчья пасть, и у детей, рожденных с синдромом Дауна. Хотя очень редко, средний отит присутствует при синдроме Градениго, который сопровождается орбито-лицевой болью и параличом шестого черепного нерва. Этот синдром может возникать как осложнение хронического гнойного среднего отита.[6] Общей чертой этих врожденных аномалий является недостаточность функционирования евстахиевой трубы, которая предрасполагает этих детей к заболеванию среднего уха. Основными факторами риска, связанными с хроническим гнойным средним отитом, являются а) частые эпизоды острого среднего отита, б) инфекции верхних дыхательных путей, в) любая травма барабанной перепонки и г) плохое питание и условия жизни. [5]
Патофизиология
При хроническом гнойном среднем отите бактериальные патогены проникают в слизистую среднего уха через наружный канал.[7] В среднем ухе возникает воспалительная реакция, сопровождающаяся отеком и фиброзом со спонтанной перфорацией барабанной перепонки и продолжающейся инфекцией.
Кроме того, хронический гнойный средний отит может возникать как осложнение после введения тимпаностомических трубок для лечения экссудативного среднего отита.
Гистопатология
Микроскопическое исследование обычно не проводится детям с хроническим гнойным средним отитом, и оно не обязательно для диагностики и лечения.Однако если провести микроскопию уха, она покажет перфорацию в барабанной перепонке. [7]
История и физика
Хронический гнойный средний отит в большинстве случаев проявляется отореей, хотя также может быть обнаружена сухость в ушах. Симптомы, которые могут быть обнаружены, но не являются обязательными для диагностики, включают нарушение слуха, шум в ушах и ощущение полноты в ушах. [8] Важно учитывать, что дети часто могут протекать бессимптомно или иметь очень тяжелое состояние с внутричерепными осложнениями.Очень важно выяснить, было ли у пациента головокружение и его связь с какими-либо жалобами на слух. Всем пациентам следует расспросить об их ушных инфекциях в анамнезе, недавнем лечении антибиотиками и хирургическом вмешательстве. Следует отметить любые другие медицинские проблемы, такие как аллергический ринит и гастроэзофагеальный рефлюкс, а также воздействие дыма. [2]
Оценка
Для оценки ушей можно использовать два типа насадок отоскопа: 1) хирургические или операционные и 2) диагностические или пневматические. Осматривая уши, можно оценить степень подвижности барабанной перепонки в ответ на отрицательное или положительное давление, чтобы определить наличие жидкости в среднем ухе, что является признаком среднего отита.Другими обнаруженными аномалиями барабанной перепонки являются эритема, выпуклость или полнота или крайнее втягивание. При лечении хронического гнойного среднего отита необходимо проводить микробиологическое исследование, нацеленное на выявление микроорганизмов в зависимости от результата.
Pseudomonas — один из организмов, который наиболее часто встречается и повсеместно встречается в нашей физической среде и имеет склонность к влажным местам. Считается, что в первую очередь он поражает ткани путем прикрепления к эпителиальным клеткам через пили или фимбрии.
Лечение / ведение
Хинолоны для местного применения являются препаратом выбора при хроническом гнойном среднем отите; они столь же или более эффективны, как аминогликозиды, и не имеют риска ототоксичности. Хинолоны эффективны при устранении отореи и уничтожении микроорганизмов. [9] Если нет ассоциированной холестеатомы, парентеральное противомикробное лечение в сочетании с тщательной очисткой слуха, вероятно, будет успешным в устранении инфекции, но в рефрактерных случаях может потребоваться тимпаномастоидэктомия.Бета-лактамные антипсевдомонадные препараты, такие как цефтазидим, используются в случаях, когда требуется родительский режим. Тикарциллин-клавуланат — альтернативный агент, эффективный против Pseudomonas sp. и S. aureus .
Образование биопленки связано с патогенезом инфекции и устойчивостью к лечению антибиотиками. [5] При хирургическом лечении это может иметь некоторые эффекты, предотвращающие осложнения, но у пациентов все еще могут быть выделения из уха после операции.
Если пациент не отвечает на начальную схему лечения и / или развивается холестеатома или любое другое новообразование, обязательно направить пациента в отоларингологию. При наличии холестеатомы требуется вмешательство бригады отоларингологов для мастоидэктомии с тимпанопластикой.
Также очень важно всегда оценивать функцию слуха и обеспечивать соответствующее последующее наблюдение за всеми пациентами с хроническим средним отитом.
Дифференциальный диагноз
Важно учитывать другие патологии, которые могут иметь клиническую картину, аналогичную хроническому гнойному среднему отиту.Поскольку оторея является одним из наиболее распространенных симптомов, встречающихся при этом заболевании, а наиболее частый возраст обращения обычно составляет менее 5 лет, необходимо исключить наличие инородного тела в слуховом проходе. Присутствие неприятного запаха, исходящего из уха, помогает отличить оторею, вызванную инородным телом или хроническим поддерживающим средним отитом. Другие состояния, которые могут быть ошибочно приняты за хронический средний отит, — это мирингит и наружный отит (оба имеют общие признаки отореи), но при физикальном осмотре диагноз может быть уточнен.Более серьезные состояния, которые также необходимо исключить, — это мастоидит, абсцесс и менингит. В этих случаях проявления более тяжелые и присутствуют системные симптомы.
Управление токсичностью и побочными эффектами
Аминогликозиды, хотя и не считаются препаратами первой линии для лечения хронического гнойного среднего отита, являются одним из возможных вариантов. Важно учитывать потенциальную ототоксичность аминогликозидов. [5]
Прогноз
В целом прогноз при хроническом гнойном среднем отите хороший, если проводится лечение и избегаются осложнения.Могут быть обнаружены некоторые рефрактерные случаи, которые требуют более тщательного обследования и лечения. Поскольку за хроническим гнойным средним отитом чаще всего следует острый средний отит, важно диагностировать и лечить бактериальную причину острого среднего отита, чтобы предотвратить хронический гнойный средний отит. Внедрение вакцины против пневмококка показало положительный эффект в плане снижения заболеваемости острым средним отитом, что привело к сокращению случаев хронического гнойного среднего отита.[5]
Осложнения
Хронический гнойный средний отит может вызвать множественные осложнения, такие как полипы, остит, склероз, тимпаносклероз, лабиринтит, а также внутричерепные гнойные осложнения, такие как эпидуральные, субдуральные или абсцессы головного мозга. Наиболее частым осложнением является потеря слуха, проводящая или нейросенсорная. Потеря слуха связана с задержкой речи и поведенческими проблемами. [10]
Сдерживание и обучение пациентов
Родители должны быть осведомлены и проконсультированы о важности регулярных посещений по уходу за детьми и незамедлительно обращаться за помощью, когда дети жалуются на боль в ушах или дискомфорт.Также важно учитывать жалобы учителей, особенно при подозрении на потерю слуха. Крайне важно лечить и следить за хроническим гнойным средним отитом, чтобы снизить вероятность дальнейших осложнений, которые могут повлиять на ребенка в долгосрочной перспективе.
Улучшение результатов команды здравоохранения
Хронический гнойный средний отит — это тип заболевания уха, при котором имеется постоянная хроническая инфекция среднего уха без неповрежденной барабанной перепонки; это обычно происходит в раннем детстве, обычно около 2 лет.Этому состоянию часто предшествует эпизод острого среднего отита, и при подозрении на него необходимо незамедлительно изолировать этиологический агент. Если не лечить хронический гнойный средний отит, он может привести к серьезным осложнениям, включая полипы, склероз, тимпаносклероз, лабиринтит, эпидуральный, субдуральный или мозговой абсцесс, а также кондуктивную или нейросенсорную тугоухость, влияющую на успеваемость ребенка в школе. Раннее выявление и начало лечения имеют решающее значение для достижения лучших результатов и предотвращения осложнений.
Выполнив указанные выше действия, педиатр сможет правильно диагностировать и лечить хронический гнойный средний отит. Стоит обратиться к отоларингологу, особенно в случаях, когда могут потребоваться дополнительные вмешательства, помимо антибиотиков.
Дополнительное образование / вопросы для повторения
Ссылки
Аэробные бактерии, ассоциированные с хроническим гнойным средним отитом в Анголе | Инфекционные болезни бедности
Хорошо известно, что инфекция среднего уха у CSOM обычно является полимикробной, и настоящее исследование дополнительно подтверждает это, поскольку отдельные изоляты были идентифицированы в очень небольшом количестве образцов выделений из уха [2]. Фактически был идентифицирован широкий спектр различных видов. Большое количество бактериальных штаммов и степень совместной колонизации как в выделениях из уха, так и в образцах из носоглотки, возможно, можно объяснить более высокой специфичностью MALDI-TOF MS по сравнению с традиционными методами микробиологической идентификации [15].Небольшая разница в количестве мужчин и женщин в текущем исследовании неясна, но может быть связана с различиями в поведении при обращении за медицинской помощью, поскольку было обнаружено, что CSOM в равной степени влияет на пол [2]. Однако преобладание мужчин было показано в более раннем отчете той же клиники [18].
Микробиом носоглотки был предложен в качестве резервуара для патогенов, вовлеченных в CSOM, и культура из этого локуса может предоставить важную клиническую информацию во время болезни [19]. Однако мы обнаружили низкую степень соответствия между микроорганизмами, присутствующими в носоглотке, и выделениями из среднего уха у одних и тех же пациентов.С другой стороны,> 25% изолятов из образцов ушей пациентов с двусторонним заболеванием соответствовали между ушами. Возможно, что это происходит из-за распространения через носоглотку, так как евстахиева труба дисфункциональна в CSOM, но также может быть связано с инвазией из наружного слухового прохода одним и тем же видом в оба уха [4]. Роль носоглоточной флоры в патогенезе и поддержании CSOM — это область, требующая дальнейшего изучения.
В соответствии с нашими результатами Taipale et al.[12] ранее обнаружили, что Proteus и P. aeruginosa являются наиболее распространенными бактериями у 18 пациентов с CSOM в Луанде. В кенийском исследовании энтерококки (28%) были зарегистрированы как общие патогены в CSOM вместе с Proteus , S. aureus и P. aeruginosa , что составляет 32%, 12% и 11% изолятов соответственно [ 20]. Orji et al. [21] и Афолаби и др. [22] оба обнаружили, что P. aeruginosa является доминирующим видом в Нигерии, за которым следует S.aureus и Klebsiella, соответственно. С другой стороны, Chirwa et al. [23] определили Proteus spp. как доминирующее, за которым следует P. aeruginosa в Малави. Таким образом, наши результаты по наиболее распространенным патогенам в CSOM согласуются с другими недавними исследованиями, проведенными в Африке к югу от Сахары, хотя, похоже, существуют географические различия в пропорциях между присутствующими видами.
Интересной находкой стали 19 изолятов Alcaligenes faecalis, , что может быть связано с периодической практикой заполнения наружного прохода уха птичьим пометом для предотвращения выделения, о которой мы ранее сообщали [24].Кроме того, было обнаружено 12 изолятов Kerstersia gyiorum . Этот грамотрицательный вид принадлежит к семейству Alcaligenaceae и ранее был обнаружен в CSOM с неэффективным лечением из-за устойчивости к противомикробным препаратам [25]. У нас не было возможности изучать анаэробы в настоящей работе из-за методов, используемых для отбора проб, транспортировки и микробиологической диагностики, хотя есть поддержка присутствия этих бактерий в большинстве инфекций CSOM [6].Высокая распространенность CoNS и Corynebacterium spp., Которые оба принадлежат к микробиому кожи внешнего слухового прохода, скорее всего, была загрязнением во время сбора [26]. Возможно, что другие изолированные виды также представляют собой заражение из соседних анатомических участков, и поэтому необходимы дополнительные исследования для выяснения богатого бактериального спектра, обнаруженного в CSOM, с применением методов, позволяющих идентифицировать конкретные виды.
Ушной туалет в сочетании с эмпирической антибактериальной терапией с местными хинолоновыми антибиотиками является рекомендуемым непосредственным лечением неосложненной CSOM, хотя также используются местные аминогликозиды, полимиксины или хлорамфеникол.Более того, антисептические средства для местного применения, такие как ацетат алюминия, уксусная кислота или борная кислота, могут быть эффективными и более осуществимыми в условиях ограниченных ресурсов из-за их более низкой стоимости и доступности [27,28,29]. Паттерны восприимчивости наиболее часто выделяемых видов в этом исследовании предполагают, что хинолоны или аминогликозиды могут быть более успешными в лечении инфекции, чем колистин или хлорамфеникол, последний в настоящее время является наиболее используемым местным антибиотиком для CSOM в Анголе. Ранее было показано, что хинолоны более эффективны, чем аминогликозиды, и также будут предпочтительным выбором из двух препаратов из-за потенциальной ототоксичности аминогликозидов [2].Однако уровень устойчивости к хинолонам превышал 10%, что подчеркивает необходимость постоянного определения характеристик чувствительности к антимикробным препаратам. Другими интересными находками, касающимися общей встречаемости устойчивости к противомикробным препаратам, являются высокие показатели MRSA, устойчивость к аминогликозидам среди грамотрицательных препаратов и невосприимчивые к пенициллину пневмококки. С другой стороны, только небольшое количество из Enterobacteriaceae были устойчивы к цефотаксиму, то есть к вероятному носителю бета-лактамаз расширенного спектра и карбапенемам, которые ранее сообщались как распространенные в Луанде [14].
Принимая во внимание риск устойчивости к противомикробным препаратам ко всем протестированным антибиотикам местного действия, а также тот факт, что эти антибиотики могут быть недоступны в условиях ограниченных ресурсов, следует изучить возможность использования антисептиков местного действия. Сообщается, что лечение с помощью одноразового применения порошка борной кислоты так же эффективно, как и ципрофлоксацин местного применения, в то время как лечение ацетатом алюминия показало аналогичные результаты по сравнению с местными аминогликозидами [2, 29]. В рандомизированном контролируемом исследовании в Танзании выбором лечения CSOM у детей были ежедневный ушной туалет и местная борная кислота в спиртовом растворе [30].Кроме того, Youn et al. [31] показали высокий бактерицидный эффект ацетата алюминия и уксусной кислоты против MRSA и хинолон-резистентного P. aeruginosa .
В рамках текущего проекта в HJM снят фильм, информирующий о состоянии улучшения ухода за CSOM. Здесь подробно описывается уход за ушами с помощью «сухой протирки» и защиты ушей от загрязнения. Он доступен в Интернете и планируется представить в социальных сетях и на телевидении Анголы [32].Такая информация и улучшенное лечение в медицинских центрах и больницах могут снизить бремя CSOM и его осложнений.
Поскольку CSOM обычно предшествует эпизод AOM, который преимущественно вызывается пневмококками, нетипируемыми Haemophilus influenzae или Moraxella catarrhalis [33] , , важным аспектом профилактики CSOM является снижение AOM. Фактически, уровень заболеваемости АОМ в западной части Африки к югу от Сахары оценивается более чем в 40%, причем большинство случаев приходится на детей в возрасте до 5 лет [3].Некоторые исследования предполагают, что использование PCV может иметь положительный эффект на частоту встречаемости АОМ по всем причинам, что может привести к последующему снижению заболеваемости CSOM [34, 35]. ЦВС-13 был введен в Анголу в 2013 году, и по оценкам ВОЗ, доля новорожденных, получивших три дозы вакцины, выросла с 9% в 2013 году до 58% в 2015 и 2016 годах [36]. Хотя было выделено небольшое количество пневмококков, наши результаты показывают, что серотипы вакцины присутствуют в Анголе, что указывает на то, что какой-либо очевидной замены серотипа, которая является хорошо задокументированным эффектом PCV во многих регионах мира, не произошло, по крайней мере, в изучалась смешанная возрастная группа [37, 38].Учитывая эти цифры и возможное воздействие на средний отит, в Анголе желательна более высокая степень охвата вакцинацией. Однако по этой теме требуются дальнейшие исследования.
Хронический гнойный средний отит — обзор
Хронический гнойный средний отит
Хронический гнойный средний отит (CSOM) описывает стойкое воспаление среднего уха и слизистой оболочки сосцевидного отита с продолжающимся гнойным дренажом через перфорацию в TM или тимпаностомической трубке. 7 Это заболевание чаще встречается у определенных групп населения, в том числе у коренных американцев и эскимосов, вызвано врожденной предрасположенностью к патологическому образованию евстахиевой трубы.Плотная евстахиева труба позволяет содержимому носоглотки забиваться в среднее ухо, и это явление усиливается отверстием в TM. Таким образом, CSOM может представлять собой порочный круг, в котором дальнейшее загрязнение среднего уха нестерильным содержимым наружного слухового прохода и носоглотки может способствовать сохранению хронической инфекции и дренажу. 1 Введение тимпаностомической трубки само по себе, даже при отсутствии активной инфекции, может вызвать оторею в 50% случаев 36 и приводит к стойкой CSOM в 3 случаях.6% пациентов. 37
Клинически CSOM может быть связан с видимым слуховым полипом и перфорацией TM любого размера. Боль и лихорадка не типичны и, если они присутствуют, должны побудить к исследованию другого внутривременного инфекционного процесса. 7 Холестеатома и инородные тела (включая тимпаностомические трубки) могут способствовать сохранению CSOM, а образование биопленки может играть роль в сохранении процесса. 38 Дренаж в CSOM часто бывает полимикробным, хотя чаще всего культивируются видов Pseudomonas . 39
Основой первичной диагностики и лечения в CSOM является микроскопическое исследование TM и среднего уха. Для адекватной визуализации может потребоваться удаление плоского мусора и жидкости из слухового прохода. Признаки холестеатомы (например, видимая белая масса, значительное втягивание барабанной перепонки) требуют тщательного обследования, включая компьютерную топографию (КТ). 1 Тщательное внимание к поддержанию чистоты и сухости канала является краеугольным камнем успешного лечения, хотя само по себе оно менее эффективно, чем в сочетании с ототопическими средствами. 40
Следует использовать культуральную терапию, но многие варианты нетотоксичных ушных капель эффективны и могут быть начаты до получения результатов лабораторных исследований (таблица 6-1). 41 Следует отметить, что старые средства для местного применения могут содержать ототоксичные противомикробные средства, включая аминогликозиды (например, неомицин, гентамицин) и полимиксины. Предпочтительны препараты фторхинолона, которые не вызывают повреждения внутреннего уха.
При последовательном удалении мусора из канала и применении местных препаратов у большинства пациентов в течение нескольких дней будет наблюдаться быстрое уменьшение дренажа.В противном случае следует рассмотреть возможность добавления системных антибиотиков. Несмотря на частое присутствие Pseudomonas , многие клиницисты успешно используют противомикробные препараты, активные против бактерий, обычно связанных с острым средним отитом (включая амоксициллин и амоксициллин-клавуланат), вероятно, потому, что эти организмы также вносят свой вклад в инфекцию. 1
Однако во многих случаях с положительным посевом требуется системный антипсевдомонадный препарат. Нет доступных пероральных средств для детей, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), которые были бы надежно активны против видов Pseudomonas , хотя было показано, что фторхинолоны безопасны и эффективны при этом показании. 42 Недавнее исследование 867 детей, получавших гатифлоксацин от упорного среднего отита, не выявило случаев стойкой артропатии; в это исследование вошли почти 200 пациентов моложе 2 лет. 43 В другом отчете подсчитано, что более 9000 детей лечились фторхинолонами за предыдущие 5 лет без значительных проблем с суставами, хотя в этот отчет были включены несколько пациентов моложе 12 месяцев, если таковые вообще были. 44
Местные препараты и пероральные антибиотики успешно избавят от инфекции примерно у 90% пациентов 45, 46 , но в остальных случаях следует рассмотреть возможность внутривенного введения антибиотиков.Как эмпирическая, так и культуральная терапия обычно диктует использование антипсевдомонадного пенициллина с расширенным охватом (например, пиперациллин, тикарциллин-тазобактам) или цефалоспоринов третьего поколения (например, цефтазидима). 41 Дренаж может быть устранен у большинства пациентов с этим режимом, но в одном долгосрочном исследовании с последующим наблюдением почти 25% пациентов в конечном итоге потребовалось хирургическое вмешательство на тимпаномастоиде для окончательного устранения CSOM. 47 В старых рекомендациях предлагалось внутривенное введение аминогликозидов (например,g., гентамицин, тобрамицин, амикацин) из-за их активности против Staphylococcus aureus и грамотрицательных организмов, но значительный риск нефротоксичности и ототоксичности, а также необходимость частого мониторинга сыворотки делают их менее привлекательными, особенно потому, что сейчас есть отличные альтернативы. имеется в наличии. 48
Отказ от максимальной медикаментозной терапии требует тимпаномастоидэктомии с тимпанопластикой, хотя медикаментозное лечение до, во время и после операции может улучшить конечный результат.Предоперационное планирование должно включать компьютерную томографию височных костей. 49, 50 Цели операции включают ликвидацию любого инфекционного очага (например, пораженных воздушных клеток и слизистой оболочки, скрытой холестеатомы, остеита, инфицированной грануляционной ткани), установление надежной связи между средним ухом и сосцевидным отростком и восстановление ТМ. Хотя это не всегда возможно, важной задачей является поддержание неповрежденного наружного слухового прохода. Сохраняя полость сосцевидного отростка изолированной от внешнего мира, можно свести к минимуму частоту стойкой инфекции и дренирования даже после операции.
Различные факторы влияют на долгосрочный успех, но наличие Pseudomonas и сохранение пораженных костей и мягких тканей часто упоминаются как важные причины хирургической неудачи. 1 Полный список факторов, которые могут увековечить CSOM и затруднить искоренение, представлен во вставке 6-2. Своевременное лечение рецидивирующего дренажа до возобновления хронической инфекции способствует долгосрочному успеху. 41 Тщательная очистка и разумное использование сильнодействующих местных агентов решает большинство случаев CSOM без хирургического вмешательства, 51 , но оперативное вмешательство имеет высокий уровень успеха, когда оно необходимо. 52, 53
Новая модель хронического гнойного среднего отита на мышах и ее использование в доклинической оценке антибиотиков
Резюме
Хронический гнойный средний отит (CSOM) — это забытое педиатрическое заболевание, поражающее 330 миллионов человек во всем мире, для которого нет новых препараты вводятся более десяти лет. Мы разработали модель мыши, которая может быть полезна для доклинической оценки лекарств и открытия антимикробных препаратов. В нашей модели использовались иммунокомпетентные мыши, перфорация барабанной перепонки и инокуляция люминесцентной синегнойной палочки, что позволило отслеживать численность бактерий в режиме реального времени в течение 100 дней.Возникшая в результате хроническая инфекция проявляла характерные черты клинической CSOM, включая ингибирование заживления барабанной перепонки и гнойные выделения из уха. Мы оценили стандартную терапию фторхинолоном офлоксацином и продемонстрировали, что эта терапия привела к временному снижению бактериальной нагрузки. Эти данные согласуются с клинической проблемой персистирующей инфекции в CSOM и необходимостью определения терапевтических результатов, которые оценивают конечную точку после лечения. Мы пришли к выводу, что эта новая мышиная модель CSOM имеет ценность для исследования новых потенциальных методов лечения.
ВВЕДЕНИЕ
Хронический гнойный средний отит (CSOM) поражает более 330 миллионов человек во всем мире и является наиболее частой причиной необратимой потери слуха среди детей в развивающихся странах ( 1 ). CSOM в настоящее время считается тропическим педиатрическим заболеванием, которому не уделяется должного внимания, и варианты лечения не улучшились за последние десять лет ( 2 , 3 ). Он характеризуется хроническим выделением и инфицированием среднего уха, при этом бактерии Pseudomonas aeruginosa (наиболее часто) и Staphylococcus aureus составляют примерно 80% случаев заболевания ( 4 — 6 ).Бактерии колонизируют среднее ухо через отверстие в барабанной перепонке и вскоре после этого образуют сообщество биопленок, тем самым затрудняя попытки лечения и полного искоренения инфекции ( 7 ). Клиницисты диагностируют CSOM после наблюдения за хроническим выделением среднего уха и сбора мазков из среднего уха для микробиологических тестов на культуру. Было показано, что они имеют высокий уровень ложноотрицательных результатов, часто считающихся отрицательными при посеве, несмотря на свидетельства инфекции при электронной микроскопии или полимеразной цепной реакции (ПЦР) ( 8 ).
Адаптивная резистентность P. aeruginosa , обусловленная состоянием роста биопленки и клетками-персистерами, субпопуляцией метаболически неактивных бактерий в биопленках P. aeruginosa , вносит существенный вклад в трудности, возникающие при лечении CSOM ( 9 , 10 ). Фторхинолоновые антибиотики, нынешний стандарт лечения в клинической CSOM, эффективны в уничтожении метаболически активных свободно плавающих бактерий, но менее эффективны против биопленок и могут усиливать образование биопленок и индуцировать клетки-персистеры ( 11 , 12 ).Даже после агрессивной терапии персистирующие и адаптивно резистентные клетки могут повторно заселять нишу биопленки после прекращения терапии фторхинолоном ( 13 , 14 ). Поскольку не существует эффективного лечения этих клеток-персистеров биопленки, конечным результатом является несколько раундов хирургического вмешательства по удалению биопленки и пожизненная борьба с этим заболеванием. Показатели успешности хирургического вмешательства составляют всего 60% ( 15 ).
Одним из факторов, ограничивающих разработку новых методов лечения CSOM, является отсутствие подходящих животных моделей для изучения этого заболевания.Большая часть того, что известно о CSOM, заимствовано из моделей и моделей острой инфекции, которые не связаны с бактериями, которые, как известно, вызывают CSOM ( 16 ). В моделях острого среднего отита на животных наблюдается дозозависимая крупная бактериальная инвазия и широко распространенное повреждение улитки или быстрое выведение патогена, не являющегося репрезентативным для человеческого заболевания ( 16 ). Это представляет собой ограничения изучения хронического состояния на моделях острой инфекции. Модель, воссозданная на мышах, идеальна с учетом их анатомического и физиологического сходства со средним ухом человека, естественного возникновения среднего отита, обширных фоновых исследований, определяющих их геном и иммунную систему, а также возможности создания больших и эффективных экранов пропускной способности in vivo для терапии последовательным, эффективным и воспроизводимым способом.До сих пор не существовало животной модели CSOM, которая воспроизводила бы человеческое заболевание с точки зрения хроничности инфекции, толерантности и использования человеческого патогена P. aeruginosa , поскольку предыдущие мышиные модели использовали естественные мышиные патогены и не использовали привести к нагноению хронической раны ( 17 ). Более крупных животных трудно изучать из-за извилистости их наружных слуховых проходов, что препятствует прямому доступу к среднему уху ( 18 ). Модель CSOM приматов, отличных от человека, была успешной только в 10%, а инфекция длилась не более 3 недель ( 18 ).
Чтобы преодолеть эти пробелы в строгости, мы предлагаем исследовать in vivo в рамках утвержденной модели хронической инфекции здесь. Мы разработали новую модель, которая имитирует человеческую инфекцию в сопоставимой микробиологии и гистопатологии, а также демонстрирует стойкость, то есть рецидив заболевания после прекращения приема антибиотиков. Модель показывает восстановление активной инфекции после прекращения местного лечения антибиотиками, что может быть использовано в качестве критерия первичного результата для тестирования новых противомикробных препаратов против CSOM.
РЕЗУЛЬТАТЫ
Генерация мыши
P. aeruginosa CSOM, модельМы впервые ввели P. aeruginosa в пространство среднего уха. Люминесцентные бактерии вводили непосредственно в среднее ухо через перфорированную барабанную перепонку с предварительной окклюзией евстахиевой трубы или без нее. График разработки модели показан на рис. 1А. Развитие модели и анатомия среднего уха показаны на рис. 1В. В этих исследованиях использовались мыши CBA / CaJ из-за их сохраненного слуха в течение как минимум 2 лет жизни, что делает его оптимальным для изучения потери слуха, и штамм C57Bl / 6J, обычно используемую линию мышей для иммунологических исследований ( 19 ).
Рис. 1. Создание модели мышей с хроническим гнойным средним отитом P. aeruginosa .Схема разработки модели. ( A ) График инокуляции бактерий и введения антибиотиков. За 1 день до инокуляции бактериями мышам выполняли процедуры окклюзии евстахиевой трубы и острой перфорации барабанной перепонки. Инфекцию контролировали после инокуляции живых анестезированных животных с помощью системы визуализации LagoX In Vivo (IVIS). Лечение антибиотиками (два раза в день) началось на 10-й день после заражения и продолжалось 14 дней.После лечения мышей наблюдали с помощью IVIS на предмет рецидива заболевания. ( B ) Осевой вид анатомии среднего уха, имеющий отношение к созданию модели хронического гнойного среднего отита на мышах (CSOM; иллюстратор: Крис Гралапп). Инфекция представлена в пространстве среднего уха и слуховом проходе. На снимке барабанная перепонка перфорирована; в нашей модели эту процедуру проводят перед посевом бактерий. Посев бактерий и введение антибиотиков могут проникать в пространство среднего уха через открытую барабанную перепонку через слуховой проход.В некоторых случаях блокирование евстахиевой трубы перед посевом бактерий использовалось для распространения инфекции. Окклюзия евстахиевой трубы была выполнена транстимпанической или трансцервикальной процедурой с введением точек гуттаперчи и описана далее в разделе «Материалы и методы».
Мы спросили, как бактериальный посевной материал повлиял на установление хронического заболевания в этой модели. Посев с увеличением дозы P. aeruginosa PAO1 в среднее ухо позволило определить дозу, необходимую для достижения хронической инфекции, и затем охарактеризовать степень заболевания, возникшего в результате инфекции.Исход хронической инфекции в ране барабанной перепонки определяли с использованием балльной шкалы, разработанной для оценки инфекций среднего уха. Классификация хронических инфекций среднего уха in vivo проводилась отологом на основе клинических признаков, используемых для классификации и классификации заболеваний у людей, включая факторы видимого воспаления, наличие перфорации барабанной перепонки, наличие экссудата или нагноения и воспалительные процессы. признаки на слизистой оболочке среднего уха (изображения критериев классификации; рис.S1).
Затем была определена корреляция между транстимпаническим и трансцервикальным методами в развитии хронической инфекции путем оценки восстановленных колониеобразующих единиц (КОЕ; рис. S2). Высокая степень корреляции ( r 2 = 0,875, P = 0,002) указала на то, что транстимпанический метод был подходящей заменой трансцервикального метода в модели CSOM, при этом первый допускал минимально инвазивную процедуру, которая могла должно быть выполнено менее чем за 2 минуты вместо инвазивной хирургии и длительного периода восстановления, необходимого для трансцервикальной модели.
При бактериальной инокуляции (1,64 × 10 7 КОЕ) PAO1, которая привела к воспроизводимым хроническим инфекциям с использованием транстимпанического метода окклюзии евстахиевой трубы, большинство мышей CBA / CaJ продемонстрировали заживление ран барабанной перепонки (66%, n = 23/35 для степени 0, I или II), и только 34% имеют отличительные признаки CSOM ( n = 12/35 для степени III или IV). Затем инокуляционная доза для мышей CBA / CaJ была дополнительно увеличена (до 2,4 × 10 7 КОЕ) для получения хорошо воспроизводимых открытых ран (100% группы, n = 10/10 при степени IV) (рис.2А, слева; таблица критериев оценки, рис. 2Б).
Рис. 2 Характеристика новой модели мыши из P. aeruginosa CSOM.( A ) Инфекции, классифицированные отологами. Число, соответствующее каждой степени, слева направо: PAO1 CBA / CaJ, PAO1 C57Bl / 6J и PA14 C57Bl / 6J. ( B ) Критерии клинической классификации CSOM мыши. ( C ) CSOM, отслеживаемая с помощью IVIS у мышей CBA / CaJ [репрезентативные изображения 14-го дня постинокуляции (dpi)]. Красный сигнал представлял собой люминесценцию ложного цвета в единицах яркости при 14 dpi, слева направо: PAO1 CBA / CaJ, PAO1 C57Bl / 6J и PA14 C57Bl / 6J.( D ) Долговременная стабильность CSOM. Зависимая от времени бактериальная биолюминесценция PAO1 CSOM мышей CBA / CaJ (слева) и C57BL / 6J (справа) в модели CSOM ( n = 4 на группу, отдельные мыши в каждом столбце). Зеленый цвет указывает на снижение, а красный — на более высокую бактериальную нагрузку. Хроническая инфекция все еще присутствовала у всех животных, показанных до 100 дня. ( E ) Флуоресцентные бактерии в выпоте среднего уха CSOM мыши CBA / CaJ после 14 dpi. Красная флуоресценция (PAO1.mCherry) и зеленая флуоресценция (pUCP.eGFP). ( F ) Бактериальное бремя болезни, измеренное с помощью IVIS и обычных КОЕ / мл при выздоровлении, сильно коррелирует, что позволяет предположить, что IVIS является полезным суррогатом для количественной оценки бактерий in vivo. Число бактерий in vivo измеряли с помощью люминесцентного сигнала PAO1.lux и сообщали как интенсивность люминесценции за вычетом фона (log 10 п / с).
Использование более низкой дозы (1,64 × 10 7 КОЕ) штамма PAO1 у мышей C57Bl / 6J с транстимпанальной окклюзией евстахиевой трубы привело к менее тяжелым инфекциям среднего уха по сравнению с мышами CBA / CaJ, большинство из которых были связаны с полное заживление ранее существовавшей перфорации барабанной перепонки, диагноз соответствует среднему отиту с выпотом (25/32 при степени I, представляющий скопление выпота в среднем ухе и наблюдаемое выпуклость за интактной барабанной перепонкой; рис.2А, посередине). У мышей C57BL / 6J, у которых хронические инфекции среднего уха развивались с 1,64 × 10 7 КОЕ штамма PAO1, перфорация барабанной перепонки зажила почти у всех (~ 97%) мышей (рис. 2A, в середине). Дальнейшее повышение дозы (до 2,4 × 10 7 КОЕ) привело к тому, что мыши не смогли развить CSOM ( n = 3). Инокуляция 1,64 × 10 7 КОЕ PA14, более вирулентного, но обычно используемого штамма P. aeruginosa , без предварительной окклюзии, привела к 82% CSOM (14/17 для степеней III и IV) и 18% (3 / 12) инфекции I степени (рис.2А, справа). Таким образом, оптимальными условиями для мышей C57Bl / 6J была инокуляция 1,64 × 10 7 КОЕ PA14, где CSOM (степени III и IV) однозначно воспроизводимо развивался без предварительной окклюзии евстахиевой трубы через перфорированную барабанную перепонку (рис. 2A, справа). . Рисунок S3 демонстрирует, что разные линии мышей показали дифференциальную чувствительность к штамму P. aeruginosa PA14. Инфекция 2,4 × 10 7 КОЕ PA14 в мышиной модели перфорации барабанной перепонки без окклюзии евстахиевой трубы переносилась у C57BL / 6J, но была быстро летальной у мышей CBA / CaJ, с уровнем смертности до 60% в первые дни после инокуляции. .При дозах более 1,64 × 10 7 КОЕ любого штамма люминесцентных бактерий все мыши заразились хроническими инфекциями, что подтверждено визуализацией IVIS (система визуализации in vivo) через 14 дней после инокуляции (рис. 2С).
Характеристика новой модели CSOM, имитирующей болезнь человека
Модель на мышах оценивалась в течение 3 месяцев, исследуя изменения интенсивности бактериальной люминесценции (бактериальная люминесценция зависит от метаболически активных и потребляющих кислород бактерий).Инфекция биопленки сохранялась в течение> 100 дней с минимальными изменениями нагрузки по данным IVIS. Мониторинг бактериальной инфекции в реальном времени путем оценки люминесценции с использованием изображений IVIS позволил оценить стабильность инфекции между начальным и конечным моментами времени (рис. 2D). Это указывает на стабильную инфекцию в модели CSOM с течением времени как для мышей CBA / CaJ, так и для мышей C57Bl / 6J.
Затем мы спросили, имеет ли мышиную инфекцию черты CSOM человека, включая хроническую инфекцию, которая часто дает отрицательные результаты посева, и наличие биопленки в слизистой оболочке среднего уха.Наша модель CSOM была охарактеризована с помощью флуоресценции и сканирующей электронной микроскопии (SEM), дополненных культуральными стандартами для оценки хронических инфекций биопленок. При использовании методов, аналогичных тем, которые используются для культивирования бактерий от инфекций CSOM человека, бактерии в выпоте из среднего уха CSOM мыши было трудно количественно определить ex vivo, и они неоднократно были ниже предела обнаружения для количественной культуры (т. 10). Однако с использованием флуоресцентно меченных штаммов Pseudomonas присутствие бактерий в выпоте среднего уха нашей модели было подтверждено ex vivo через 14 дней после инокуляции с помощью микроскопии (рис.2E). Количественная оценка была воспроизводимой при проведении в гомогенатах тканей всего очага инфекции, включая окружающую барабанную буллую кость и слизистую оболочку среднего уха. Количественные измерения бактерий (в КОЕ на миллилитр) из гомогената среднего уха ex vivo сильно коррелировали ( r 2 = 0,733, P <0,0001) с количественным считыванием бактерий IVIS по интенсивности люминесцентного света (фотон / с; рис. . 2F).
Уже через 1 день после инокуляции структуры биопленок были обнаружены в мышиной модели CSOM с помощью SEM (рис.3). Совместные эксперименты проводились, когда инфицированные и неопытные мыши (с перфорацией барабанной перепонки и транстимпанальной окклюзией евстахиевой трубы) находились в одной и той же клетке для обеспечения потенциальной передачи. Однако инфицированные мыши никогда не передавали инфекцию наивным животным даже после совместного проживания в течение ~ 1 месяца (неопределяемые КОЕ в среднем ухе у животных с окклюзией евстахиевой трубы и перфорацией барабанной перепонки, n = 5). Мы также искали бактериальную диссеминацию на мышиной модели CSOM и обнаружили, что инфекция была ограничена зараженным ухом (рис.S4). Только во время летальных инфекций ( n = 2) бактерии выделялись из других тканей (среднее КОЕ / мл на орган: среднее ухо, 3,2 × 10 6 ; трахея, 1,6 × 10 5 ; мозг, 1,3 × 10 3 ; печень 1,4 × 10 3 ; мазок из носа 1,4 × 10 2 ). Это контрастирует с мазками из носа из модели переносимой хронической CSOM, которые неоднократно были ниже предела обнаружения для КОЕ ( n = 6). Неблагоприятные события, включая вестибулярные симптомы, были редкостью, но в одном случае P.aeruginosa был обнаружен абсцесс у мышей CBA / CaJ с помощью IVIS (рис. S5). У этого животного излечилась инфекция среднего уха, но остался внебрюшинный абсцесс.
Рис. 3. Демонстрация биопленок слизистой оболочки P. aeruginosa на мышиной модели CSOM.Изображения с помощью сканирующей электронной микроскопии (СЭМ) ткани среднего уха ( A ) контрольной (неинфицированной) слизистой оболочки среднего уха и ( B ) P. aeruginosa — инфицированного среднего уха.Маленькие оранжевые стрелки указывают на P. aeruginosa , внедренные в биопленку слизистой оболочки среднего уха. Мышей C57BL / 6J инокулировали P. aeruginosa PAO1 через 1 день после окклюзии евстахиевой трубы и острой перфорации барабанной перепонки. Структуры биопленок были обнаружены in vivo на поверхности слизистой оболочки среднего уха в течение 24 часов после инокуляции. Биопленки не наблюдались ни в одном образце, взятом из неинфицированного контроля, для которого изображение SEM показало нормальную поверхность слизистой оболочки.Этот эксперимент был повторен дважды с очень похожими результатами.
Анализы, основанные на выздоровлении, демонстрируют клиническую неэффективность терапии фторхинолоном. т.е. после терапевтической конечной точки). Во-первых, PAO1 был использован в устройстве Calgary Biofilm Pin Lib Device для оценки чувствительности посредством уменьшения биопленки.Мы определили значения минимальной концентрации уничтожения биопленки (MBEC) и концентрации бактерицидной биопленки (BBC), соответственно (
20 ). Эти результаты сравнивали с анализом толерантности к антибиотикам in vitro, основанным на культурах, содержащих бактерии поздней стационарной фазы ( 21 ).Десятидневные биопленки P. aeruginosa PAO1 подвергали воздействию двукратных серийных разведений офлоксацина. После удаления антибиотика на 1-дневное восстановление роста было разрешено воздействие постантибиотика.Провокация фторхинолоном привела к дозозависимому снижению биопленок PAO1 с MBEC 1,5 мг / мл (> 1000 раз; минимальная ингибирующая концентрация офлоксацина для планктонных клеток), самая низкая концентрация, которая снижает рост биопленок ниже предела спектроскопическое обнаружение [OD 650 (оптическая плотность при 650 нм) менее 0,1; Рис. 4A]. Когда офлоксацин уменьшал бактериальную биопленку до уровня ниже предела обнаружения в анализе MBEC (концентрации офлоксацина 1,5 и 3 мг / мл), затем количественно определяли BBC.Рост бактериальных клеток (в среднем 2,7 × 10 4 КОЕ / мл) наблюдался после извлечения лунок, зараженных офлоксацином (1,5 мг / мл), обнаруживая значительное снижение ( P <0,0001), но все же определяемый уровень биопленки. клетки после обработки (рис. 4Б). Напротив, 3 мг / мл офлоксацина уничтожили клетки PAO1 из 10-дневной культуры биопленок (неопределяемые КОЕ, P <0,0001; фиг. 4B).
Рис. 4 Чувствительность P. aeruginosa в анализах на основе восстановления.P. aeruginosa был протестирован против офлоксацина в анализе биопленки Calgary Biofilm Device (CBD) на минимальную концентрацию уничтожения биопленки (MBEC) и бактерицидную концентрацию биопленки (BBC) в стационарном фазовом анализе на толерантность. ( A ) Оптическая плотность на этапе восстановления для MBEC в анализе биопленки CBD. Пунктирная линия указывает предел обнаружения спектрофотометрическим методом. ( B ) BBC офлоксацина против установленных 10-дневных биопленок P.aeruginosa PAO1 в анализе биопленки CBD. Результаты выражаются в виде количества жизнеспособных бактерий (в логарифме 10 КОЕ / мл) после 24-часового воздействия офлоксацина. ( C ) Бактерицидная активность офлоксацина в стационарном фазовом анализе толерантности. PAO1 обрабатывали офлоксацином (3 мг / мл) в течение 24 часов перед удалением антибиотика для изучения повторного роста после лечения. Восстановление биолюминесцентных бактерий было обнаружено через 24 часа и наблюдалось его увеличение через 48 часов. * P <0.05; *** P <0,001; **** P <0,0001
Затем мы провели анализ толерантности с культурами поздней стационарной фазы. Высокая доза офлоксацина не только не смогла уничтожить бактерии PAO1 в 24-часовой момент восстановления (в среднем 4,3 × 10 3 КОЕ / мл), но также, с 24 до 48 часов, наблюдалось постепенное увеличение КОЕ на миллилитр выживших бактерий на той же чашке (рис. 4С). PA14, обработанный офлоксацином (3 мг / мл), выделил 5,8 × 10 2 КОЕ / мл в анализе на переносимость.
Непокорность CSOM после терапии фторхинолоном
Учитывая, что за последнее десятилетие не было разработано ни новых, ни улучшенных препаратов для CSOM, мы задались вопросом, подходит ли эта модель на мышах для оценки терапевтической эффективности при резистентной инфекции биопленок. После согласованности хронической инфекции и барабанной перепонки статус перфорации был подтвержден для разработки модели хронической инфекции и CSOM; проверялось, подходит ли лечение с использованием текущего стандарта лечения офлоксациновым отическим раствором (офлоксацин 0.3% Floxin Otic, Daiichi Pharmaceutical Corp., Montvale, NJ, USA), приведет к искоренению патогена. После начального курса лечения офлоксацином два раза в день (BID) в течение 14 дней в моделях инфекции PAO1 окклюзии евстахиевой трубы и перфорации барабанной перепонки наблюдается значительное снижение количества бактерий после лечения (сигнал ниже предела обнаружения IVIS, P = 0,0003; рис.5, А и Б). В CBA / CaJ сигнал IVIS до лечения составлял в среднем 4,698 п / с. Бактерии не обнаруживаются с помощью IVIS после лечения, что указывает на то, что метаболически активные бактерии не могут быть обнаружены.
Рис. 5 Непокорность CSOM после терапии фторхинолоном.P. aeruginosa протестировали против лечения офлоксацином in vivo на CSOM мышей. ( A ) Мышей CBA / CaJ и C57Bl / 6J с окклюзией евстахиевой трубы и перфорацией барабанной полости инфицировали люминесцентным PAO1. Офлоксацин вводили через слуховой проход два раза в день в течение 2 недель. Репрезентативные изображения IVIS мышей в последний день лечения (день 14, вверху) и 3D-изображения после прекращения лечения (день 17, внизу) показаны для инфекции PAO1 у мышей CBA / CaJ и C57Bl / 6J ( n = 10 животных на группу). .Рецидив инфекции среднего уха наблюдался через 3 дня после прекращения местного лечения офлоксацином (3 мг / мл; показаны репрезентативные изображения). ( B ) Количественное определение данных IVIS до, во время и после лечения мышей CBA / CaJ, инфицированных PAO1. Измерения IVIS проводили через 2 дня после бактериальной инокуляции (-8 день), до начала лечения офлоксацином (день 0), в последний день лечения (день 14) и через 3 дня после прекращения лечения (день 17). ** P <0,01; *** P <0.001. не имеет значения. ( C ) Зависящая от времени бактериальная люминесценция PA14 во время курса лечения хронической инфекции среднего уха у мышей C57BL / 6J. Измерения люминесценции бактерий показаны для отдельных мышей (в каждом столбце) с течением времени ( n = 5). Слева ось y — день измерения; правая ось y — интенсивность люминесценции за вычетом фона (log 10 п / с) для отдельных мышей в зарегистрированный день; зеленый цвет указывает на снижение, а красный — на более высокую бактериальную нагрузку.Мышей C57Bl / 6J инфицировали PA14 за 10 дней до начала лечения. День 0 — это предварительное измерение, соответствующее первому дню лечения офлоксацином, доставляемым через слуховой проход два раза в день в течение 2 недель. Пунктирная линия указывает на окончание лечения (14 день). Через 14 дней лечения лечение было прекращено. На третий день после прекращения лечения (17 день) измерения IVIS были выполнены снова. Инфекционный ответ PA14 на офлоксацин заметно отличается от инфекционного ответа PAO1.
Через 3 дня после прекращения лечения бактериальная нагрузка восстанавливается, и ее снова можно измерить с помощью IVIS (в CBA / CaJ средний сигнал IVIS составляет 5.141 p / s после обработки) и аналогичен уровням до лечения (NS; рис. 5B). Уровни конечных точек после лечения были значительно увеличены по сравнению с последним днем терапии офлоксацином ( P = 0,0011). Офлоксацин, 10 мкл, вводимый дважды в день в течение 14 дней в соответствии с протоколом клинического испытания, в целом оказался безуспешным в искоренении патогена ни у одного из животных, испытанных с использованием моделей инфекции PAO1 у мышей CBA / CaJ и C57Bl / 6J ( n = 20). Бактерицидная эффективность офлоксацина против клеток биопленки переоценена стандартными анализами MBEC и BBC на основе биопленок.Чувствительность P. aeruginosa PAO1 к офлоксацину наиболее точно имитируется in vitro по сравнению с культурами в стационарной фазе в тесте на толерантность.
Реакция на лечение в моделях инфицирования CSOM PAO1 отличается от ответа на лечение CSOM PA14, который обнаруживался в течение всего курса лечения офлоксацином (рис. 5C). Средний уровень постобработки РА14 по IVIS у мышей C57Bl / 6J находился в пределах 5% от уровней до обработки. На рис. 5С прослеживается люминесценция с помощью IVIS для пяти мышей C57Bl / 6J, инфицированных PA14, в модели перфорации барабанной перепонки без окклюзии евстахиевой трубы с последующим отслеживанием во времени в ответ на терапию фторхинолоном.
ОБСУЖДЕНИЕ
Новая модель усилий по открытию лекарств в CSOM
Мы подтвердили, что наша модель воспроизводит состояние человека CSOM в бактериологии с использованием патогена, образующего биопленку человека P. aeruginosa , а также хронических и непокорных к фторхинолоновой терапии. Использование люминесцентных репортерных штаммов позволяет отслеживать инфекцию в режиме реального времени и в ответ на терапию. Наша модель показала, что IVIS имеет высокую корреляцию с количеством бактерий ex vivo, что позволяет предположить, что нашу модель можно использовать для документирования количества бактерий in vivo и, следовательно, отслеживания реакции in vivo на лечение.Как и в клинических условиях, наша модель CSOM часто показывала «стерильные» культуры выпота в среднем ухе, но бактерии по-прежнему наблюдаются под микроскопом и / или выращиваются в условиях аэрации. В настоящее время клиницисты используют отрицательный посев, чтобы указать на искоренение болезни, и мы показываем, почему это неточно и почему у пациентов наблюдается рецидив заболевания.
Антибиотики лечат обострения, но могут вызывать хроническое течение CSOM
Мы продемонстрировали способность офлоксацина успешно устранять метаболически активный P.aeruginosa в CSOM, но после прекращения терапии количество бактерий восстановилось до уровней до лечения. Возможно, что очень небольшая фракция метаболически активных бактерий (ниже предела обнаружения IVIS) повторно заселяет среднее ухо; однако при разработке нашей модели мы обнаружили, что более низкие дозы P. aeruginosa легко выводятся. Мы предполагаем, что более вероятно, что небольшое количество неметаболически активных клеток-персистеров и адаптивно резистентных клеток, не обнаруженных IVIS, повторно заселит среднее ухо после терапии.Это обеспечивает экспериментальную основу для наблюдаемой клинической неэффективности лечения офлоксацином у CSOM человека. При хронических бактериальных инфекциях клетки-персистеры и потенциальная индукция адаптивной резистентности являются важными препятствиями для терапевтического развития ( 22 ).
Теперь мы начинаем понимать, что антибиотики не только не способны убить клетки-персистеры, но также вызывают переход бактерий, которые не убиваются, в состояние клеток-персистеров ( 12 , 22 ).Повреждение сублетальной ДНК в клетках-персистерах было связано с устойчивостью как к исходному антибиотику, так и к неродственным антибиотикам, позволяя получать гены устойчивости из чужеродной ДНК, используя путь горизонтального переноса генов, опосредованный SOS-ответом ( 11 , 23 ). Когда эти клетки-персистеры повторно заселяются метаболически активными бактериями, они сохраняют тот же уровень чувствительности к провокации антибиотиками ( 11 , 23 ). К сожалению, это создает парадокс клинического лечения, когда единственное доступное лечение дает ложное ощущение излечения, но может способствовать хроническому заболеванию.Дальнейшее разочарование вызывает наш вывод о том, что лечение фторхинолоном может усугубить инфекцию у мышей CBA / CaJ, поскольку бремя имело тенденцию к снижению, если бы они вообще никогда не получали лечения.
Существующие стандарты терапевтической оценки хронической бактериальной болезни, вызванной биопленками, неадекватны
Многие инфекционные бактериальные заболевания являются инфекциями биопленок, но никаких антибиотикопленочных препаратов разработано не было ( 24 ). Ранние стадии образования биопленок, включая прикрепление и образование микроколоний, наблюдались в течение 1 дня после инокуляции.Это похоже на другие данные об образовании биопленки in vivo в течение 1 дня после инокуляции P. aeruginosa ( 25 , 26 ). Новые препараты, нацеленные на хронические бактериальные биопленки, включают тестирование на MBEC и BBC, но эти тесты на эрадикацию еще не коррелируют с клинической полезностью ( 20 ). Мы обнаружили, что чувствительность биопленок in vitro, основанная на этих анализах, не коррелировала с эффективностью in vivo и, таким образом, не должна служить единственной основой для прогнозирования преклинического успеха.Офлоксацин свободно диффундирует через матрицу биопленки, и нарушение диффузии не является причиной неспособности уничтожить биопленку ( 21 ). Использование толерантности in vitro для прогнозирования неэффективности лечения антибиотиками in vivo сомнительно, учитывая, что рецидив бактериальной инфекции связан с переносимостью лекарственного средства in vivo ( 23 ). Эти тесты на уничтожение биопленки полезны в качестве первого прохода, но не принимают во внимание другие факторы, включая адаптивную резистентность, стойкие бактериальные клетки и хроническое воспаление хозяина, которые ухудшают способность иммунной системы взаимодействовать с антибиотиками ( 24 ).
Мы показали, что отсутствие эффективности in vitro против бактерий в стационарной фазе, но не в экспоненциальной фазе, было лучшим предиктором неэффективности антибиотиков in vivo. Это может быть связано с тем, что механизмы, лежащие в основе отказа, могут различаться в этих двух ситуациях. Бактерии в стационарной фазе демонстрируют даже большую толерантность к многим антибиотикам, чем биопленка, что может отражать увеличение популяции персистеров ( 21 ). Толерантность к офлоксацину in vitro в стационарной фазе показала, что возобновление роста персистирующих клеток происходит в фазах после прекращения лечения офлоксацином, при этом количество клеток заметно увеличивается с 24 до 48 часов.Эти причины оправдывают исследование устойчивости in vitro для понимания неэффективности антибиотиков in vivo. Вместе наша модель in vivo и тестирование толерантности in vitro имеют отношение к доклинической разработке терапевтических средств для CSOM.
Модель CSOM, воспроизводящая болезнь человека
Наша модель изменила парадигму патогенеза CSOM, показав, что бактериальный штамм, состояние и доза являются ключевыми для развития хронического заболевания. Ранее считалось, что окклюзия евстахиевой трубы и ингибирование заживления ран барабанной перепонки являются необходимыми предшественниками CSOM ( 27 , 28 ).Дисфункция евстахиевой трубы, вероятно, создает нишу для развития хронической инфекции, но не является необходимой для развития CSOM. Ключом к хронизации CSOM была инокуляция среднего уха правильной дозой и штаммом бактерий. Слишком низкая инокуляция привела к отсутствию или непостоянству инфекций; слишком высокий уровень привел к ранней интоксикации внутреннего уха, неврологической заболеваемости и смертности. Кроме того, уникальные бактериальные штаммы были оптимальными в разных линиях мышей. Хотя мы знаем, что CSOM связан с сенсорной потерей слуха, мы еще не понимаем, как и почему ( 1 , 29 , 30 ).Мыши CBA / CaJ являются нынешним золотым стандартом для исследования механизмов сенсорной тугоухости ( 19 ). Создание этой модели в рамках этого штамма позволяет продолжить терапевтические разработки, направленные на предотвращение сенсорной потери слуха у CSOM.
Основа создана для тестирования доклинических кандидатов для CSOM
Ограничения этого исследования включают неопределенность относительно того, насколько верно оно отражает ситуацию с человеческими болезнями. Факторы болезни, специфичные для пациента, у инбредных мышей не учитываются.Дальнейшие исследования фенотипического изменения P. aeruginosa для смягчения проблемы антибиотиков необходимы для понимания основных механизмов ухудшения исходов у пациентов с хроническим и рецидивирующим заболеванием биопленок. Наша текущая работа по характеристике хронической инфекции по мере ее развития у отдельных животных может помочь выявить законсервированные механизмы, относящиеся к заболеванию человека.
Эта платформа in vivo хронической и резистентной инфекции позволит открыть новые терапевтические средства не только для CSOM, но и для других слизистых оболочек P.aeruginosa болезни биопленки, такие как хронический тонзиллит, хронический ларингит или инфекция носовых пазух, а также респираторная инфекция при муковисцидозе, диабетические раневые язвы и многие другие хронические инфекции биопленки ( 31 ). Эту модель CSOM на животных также можно использовать для скрининга потенциальных методов лечения барабанной регенерации ( 32 ). CSOM — серьезная проблема для здоровья во всем мире и основная причина необратимой потери слуха в развивающихся странах. Разработанные здесь модели животных CSOM дают возможность получить представление о лечении человека и позволяют тестировать перспективные терапевтические препараты in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Животные и одобрение этики
Все процедуры на животных были одобрены Институциональным комитетом по этике животных (IACUC) Стэнфордского университета. Руководства IACUC соблюдались со всеми животными. Мышей (6-8-недельные самцы CBA / CaJ и C57Bl / 6J) были приобретены или выведены из поголовья, приобретенного в лаборатории Джексона, и размещены в учреждении по уходу за животными Стэнфордского университета с неограниченным доступом к пище и воде. Эвтаназию проводили углекислым газом с последующим вторичным методом шейного вывиха.
Конструирование биолюминесцентных и флуоресцентных штаммов
PseudomonasБиолюминесцентные штаммы PAO1.lux и PA14.lux P. aeruginosa были сконструированы с использованием системы вставки mini-Tn7. Вкратце, плазмиду pUC18T-mini-Tn7T- lux -Gm (промотор P1 управляет конститутивной экспрессией генов luxCDABE ) соэлектропорировали с плазмидой-помощником pTNS2 (500 нг каждая) в PAO1 и PA14, соответственно, как описано ранее ( 33 — 35 ).Успешные трансформанты, определяемые по сильной люминесценции, отбирали на планшетах с гентамицином 2xYT (50 мкг / мл) и дополнительно проверяли на правильность хромосомной вставки с помощью ПЦР ( 36 , 37 ). Для экспериментов по флуоресценции использовали помеченный зеленым штамм PA14, несущий ген усиленного зеленого флуоресцентного белка (eGFP) на плазмиде pUCP23.eGFP ( 38 ). Флуоресценцию измеряли при возбуждении 478 нм и эмиссии 510 нм. Для хромосомы тега PAO1 с геномом флуоресценции, mCherry амплифицировали из плазмиды PMCH-23 ( 39 ) с помощью праймера mCherry Fwd-NsiI (ATCATGCATGGTGAGCAAGGGCGAGGA) и mCherry_rev_t0-KpnI (CATGGTACCGGGCCCTGGACTCACAAAGAAAAAACGCCCG GTGTGCAAGACCGAGCGTTCTGAACAACGCCAGGGTTTTCCCAGTCA), в результате чего обратного праймер имел t0 транскрипционные последовательность терминатора включена.Затем промотор P1 был вырезан из pUC18T-mini-Tn7T- lux -Gm через Bam HI и Pst I и клонирован на pUC18T-mini-Tn7T-Gm ( 37 ). Амплифицированный ген mCherry расщепляли Nsi I / Kpn I и клонировали в pUC18T-mini-Tn7T-Gm, расщепленную Pst I / Kpn I (Pst I и Nsi I имеют совместимые концы), с получением pUC18T-mini-Tn7T- mCherry -Gm. Конструкции проверяли по флуоресценции (возбуждение / испускание, 580/610 нм) с помощью планшет-ридера Synergy h2 (BioTek Instruments Inc., Winooski, VT, USA) и отправили на секвенирование. Хромосомную вставку mCherry в PAO1 выполняли, как описано выше.
Бактериальный препарат
Замороженные исходные глицериновые смеси наносили штрихами на агаре Лурия-Бертани (LB) и выращивали в течение ночи при 37 ° C. Затем все организмы культивировали в LB из отдельных колоний при 37 ° C, встряхивая при 200 об / мин. Культуры пересеивали на чашки LB. Выделенную колонию из второго субстрата отбирали и выращивали в течение ночи при 37 ° C в LB при встряхивании в аэробных условиях.
Рост контролировали с помощью спектрофотометра при оптической плотности 600 нм (OD 600 ). Для стационарных культур бактерии выращивали более 1 дня при 37 ° C и 200 об / мин. Экспоненциальные культуры выращивали до OD 600 0,5 из стационарной фазы, разведенной до OD 600 = 0,05, или непосредственно из изолированных колоний. Все культуры были разделены на аликвоты по 1 мл и центрифугированы при 8000 g в течение 7 мин. Супернатант сливали, бактерии промывали трижды в 0.9 мл стерильного физиологического раствора с фосфатным буфером (PBS) и ресуспендировали до конечной концентрации для инокуляции. Кривые роста бактерий OD 600 во времени (часы) использовали для расчета стандартной кривой для КОЕ на миллилитр из OD 600 . В различные моменты времени бактерии разводили и высевали из расчета КОЕ на миллилитр.
Тестирование лекарственной чувствительности in vitro
MBEC и BBC для P. aeruginosa определяли с использованием 96-луночных планшетов с крышками для посева биопленок (Nunc Immuno TSP Lids, Thermo Fisher Scientific).Планшеты инокулировали ночной культурой, разбавленной до OD 0,1, и выращивали без аэрации при 37 ° C. Рост бактерий в 96-луночных планшетах в бульоне подтвержден OD 650 . Колышки планшетов промывали в 150 мл стерильного Milli-Q H 2 O и затем заражали только бульоном Мюллера-Хинтона (MHB) или двукратными разведениями офлоксацина от 3 мг / мл. Аналитический стандарт офлоксацина (Sigma-Aldrich, Миссури, США) использовали для экспериментов in vitro и растворяли в LB или MHB. После контрольного заражения планшет дважды промывали, как указано выше, и обрабатывали ультразвуком в новом планшете со стерильным MHB в течение 15 мин при комнатной температуре для переноса биопленки с колышков в бульон для восстановления в лунках.Затем планшеты восстанавливали в течение 1 дня при 37 ° C. OD 650 подтвердил рост биопленки в среде для восстановления для лунок с положительным контролем, а MBEC был определен как самая низкая концентрация лекарственного средства ниже предела обнаружения для спектрофотометра (SpectraMax M2e, Molecular Devices, Сан-Хосе, Калифорния, США). BBC определяли как самую низкую концентрацию соединения, которая полностью предотвращала видимый рост клеток при посеве из расчета КОЕ на миллилитр. Для обработки культур в стационарной фазе в исследованиях толерантности бактерии в стационарной фазе (выращенные в течение> 1 дня) получали, как для инокуляции, описанной выше.Через 24 часа обработки лекарственным средством лекарственное средство удаляли пятикратной промывкой в PBS, как описано, и высевали для извлечения на агар LB.
Трансцервикальная окклюзия евстахиевой трубы
Операция была выполнена на мышах, как описано ранее ( 18 ). Вкратце, под общей анестезией был использован трансцервикальный доступ для идентификации костной евстахиевой трубы, идентифицированной медиальнее барабанной буллы. Его вскрыли прижиганием и использовали гуттаперчу (Meta-Biomed Co., Республика Корея) для окклюзии евстахиевой трубы.Мышей восстанавливали в течение 24 часов перед инокуляцией среднего уха.
Транстимпанальная окклюзия евстахиевой трубы
Транстимпаническая окклюзия евстахиевой трубы у мышей выполнялась под общей анестезией [внутрибрюшинное введение кетамина (65 мг / кг) и ксилазина (5 мг / кг)]. После создания субтотальной перфорации с помощью иглы Розена было идентифицировано отверстие среднего уха евстахиевой трубы. Гуттаперча (Meta-Biomed Co., Республика Корея) была вставлена для закупорки евстахиевой трубы.Мышей инокулировали одновременно, как показано ниже, или выздоравливали в течение 24 часов перед инокуляцией среднего уха.
Посев бактерий
Под анестезией 3% изофлураном бактерии были инокулированы (10 мкл) в булл среднего уха через открытые раны барабанной перепонки, и мыши отдыхали на вентральной стороне до выздоровления. Контрольные мыши получали равные объемы стерильного PBS. Для P. aeruginosa воспроизводимые хронические инфекции были получены с инокулятом 1,64 × 10 7 КОЕ.
Отслеживание инфекции в реальном времени
Прогрессирование заболевания отслеживалось путем получения изображений с открытым излучением с помощью LagoX IVIS (Spectral Instruments Imaging, AZ, США). Используя изофлуран, мышей помещали в правое боковое положение, чтобы обнажить левое ухо через несколько дней после инокуляции. Изначально изображения были получены при выдержке 60 с со средним биннингом. Если сигнал не был обнаружен, мышей повторно анализировали при 300-секундной экспозиции с высоким интервалом. Люминесценцию количественно оценивали с помощью программного обеспечения Aura (Spectral Instruments Imaging, AZ USA).Фоновый люминесцентный сигнал вычитался из сигнала, приходящего из области вокруг уха. Хроническая инфекция определялась как наличие инфекции через 14 дней после инокуляции. Прогрессирование контролировали с помощью IVIS, как описано, после инокуляции и ежедневно в течение 2 недель. В течение нескольких месяцев после инокуляции мониторинг IVIS был сокращен до еженедельного.
Обработка фторхинолоном
Floxin Otic (0,3% раствор офлоксацина, Daiichi Pharmaceutical Corporation, Нью-Джерси, США) или носитель (PBS) вводили непосредственно в среднее ухо после подтверждения открытой раны барабанной перепонки на 10-й день после бактериальной инокуляции.Для инфекции PAO1 в C57Bl / 6J барабанную перепонку реперфорировали перед лечением антибиотиками. Лечение антибиотиком или носителем проводилось два раза в день в течение 2 недель, позволяя мыши лежать на вентральной стороне в течение 5 минут после лечения, а затем выздоравливать после анестезии (от 2 до 3% изофлурана), имитируя дизайн клинических испытаний офлоксацино-отика ( 40 ).
Классификация инфекции in vivo
Характеристики ран и инфекции CSOM были охарактеризованы, как на рис. 2. Клинический отолог, не знающий инфекционного статуса животного, оценил мышей через 14 дней после инокуляции с помощью хирургического микроскопа (Leica Microsystems M320 , Германия).Исследователь был не осведомлен об инфекционном статусе животного, чтобы уменьшить систематическую ошибку обнаружения. Краткое описание экспериментального метода и временной шкалы для перфорации барабанной перепонки, окклюзии евстахиевой трубы, бактериальной инокуляции, лечения фторхинолоном и отслеживания во времени с помощью LagoX IVIS показано на рис. 1.
Оценка бактериальной нагрузки
Барабанная булла и другие органы собирали для определения количества бактерий. Для определения бактериальной нагрузки посредством серийных разведений ткани измельчали в 1 мл стерильного PBS, ткани оставляли встряхивать более 2 часов при 4 ° C и высевали на агар LB для расчета КОЕ на миллилитр.Предел обнаружения роста — 10 2 КОЕ / мл.
Микроскопия
Флуорофор, экспрессирующий P. aeruginosa , был идентифицирован в выпоте в среднем ухе мышей CBA / CaJ в модели транстимпанальной окклюзии евстахиевой трубы с перфорацией барабанной перепонки после 14 дней бактериальной инокуляции под микроскопом. Выпот мышей, инфицированных в среднем ухе PAO1.mCherry ( n = 3) и PAO1.eGFP ( n = 3), фиксировали 4% параформальдегидом и промывали PBS.Затем их поместили на предметное стекло и накрыли покровным стеклом. Изображения P. aeruginosa были получены на конфокальном микроскопе Zeiss LSM 700 (Carl Zeiss). Для PAO1.mCherry использовали возбуждение 590 нм и испускание 617 нм; возбуждение 499 нм и испускание 519 нм использовали для PAO1.pUCP.eGFP. Отрицательные контроли ( n = 3) не показали бактерий ни на одной флуоресцентной длине волны.
СЭМ и обработка образцов
Образцы среднего уха фиксировали в 2% глутаровом альдегиде / 4% формальдегиде в натрий-какодилатном буфере (pH 7.3) в течение 24 часов при комнатной температуре, а затем хранить при 4 ° C. Мы добавляли 1% OsO4 с последующей последовательной промывкой этанолом 50, 70, 95 и 100%. Для удаления этанола и сушки образца использовали гексаметилдисилазан, а затем давали ему высохнуть на воздухе. Сушилка для критических точек использовалась для удаления оставшегося этанола. Затем образец прикрепляли к 12-миллиметровому стержню с помощью двойной стержня из углеродной проводящей ленты и покрывали золотом / палладием (Au / Pd) в соотношении 60:40. С помощью двухлучевого СЭМ FEI Strata 235DB были получены изображения P.aeruginosa — инфицированная слизистая оболочка среднего уха. Бактериальные клетки отмечены оранжевыми стрелками для облегчения просмотра. Репрезентативные СЭМ-изображения поверхности слизистой оболочки показывают, что P. aeruginosa интегрируются с нативной тканью и воспалительным инфильтратом при электронном пучке 5 кВ.
Статистический анализ
Статистические данные выполняли с использованием GraphPad Prism 7.0 или 8.0 (GraphPad Software Inc., Ла-Хойя, Калифорния, США). Значения P были рассчитаны с использованием двустороннего теста t с поправкой Велча или двустороннего критерия Манна-Уитни с данными, считающимися значимыми, когда значения P были ниже 0.05 как указано. Pearson r использовался для определения корреляции.
Благодарности: Мы благодарим Т. Дойла из SCI3 Стэнфордского университета за поддержку анализа IVIS, Дж. Перрино из Центра клеточных исследований Стэнфордского университета за подготовку SEM, П. Секора из Университета Монтаны за помощь с протоколами бактерий и С. • Гралапп для научных иллюстраций. Финансирование: Мы хотели бы поблагодарить следующие источники финансирования: Стэнфордскую инициативу по лечению потери слуха щедрым подарком от Фонда Билла и Сьюзан Оберндорф, Отделение отоларингологии, хирургии головы и шеи, Стэнфордский университет, и Action on Hearing. Потеря гибкого гранта П.L.S.M .; NIH LRP от NCATS до K.M.K .; Стэнфордский научно-исследовательский институт здоровья матери и ребенка и Стэнфордская программа трансляционных исследований SPARK в P.L.S.M., K.M.K., L.A.B. и A.X .; Стэнфордские нано-общие объекты (SNSF), поддерживаемые NSF в рамках соглашения ECCS-1542152, выданного S.M.M .; и Фонд Майкла Смита для исследований в области здравоохранения, Канадские институты исследований в области здравоохранения грант FDN-154287, кафедра исследований в Канаде, а также звание профессора UBC Killam для R.E.H. Эта работа была частично поддержана отделом погашения ссуд NIH от NCATS до К.М.К. (присвоено в январе 2018 г.). Вклад авторов: K.M.K., P.L.B. и P.L.S.M. задумал исследование, а также разработал и интерпретировал эксперименты. K.M.K., L.A.B. и P.L.S.M. написал рукопись. K.M.K., A.K., A.X., L.A.B. и S.M.M. провели и проанализировали эксперименты. Д.П. создали важные инструменты для этого исследования. Д.П. и R.E.H. отредактировал рукопись.
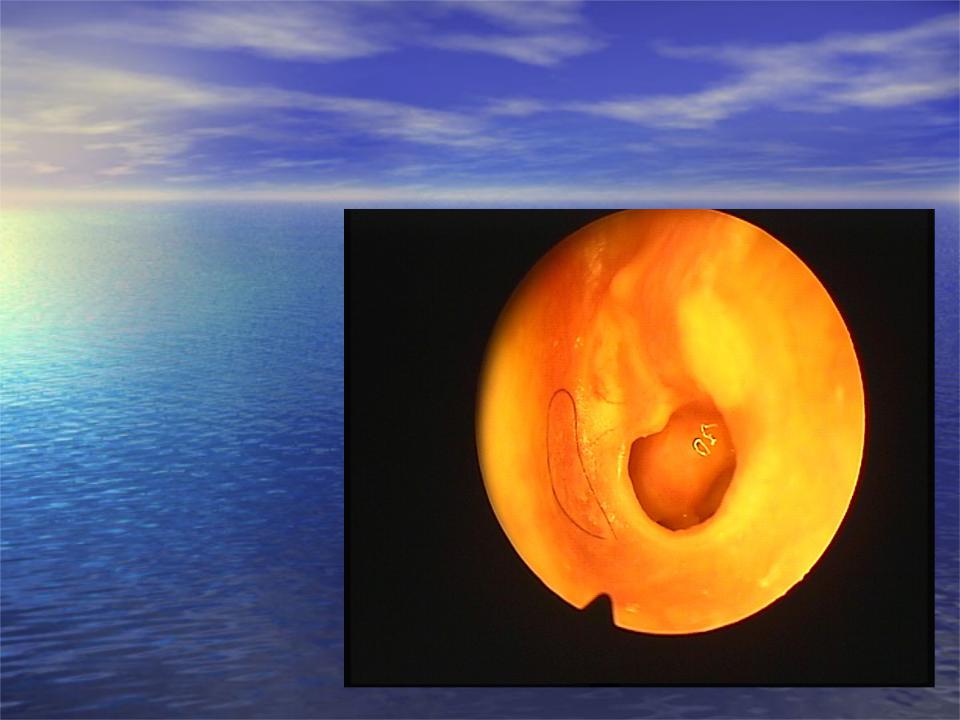 Он может быть разделен на активный или неактивный в зависимости от наличия инфекции.
Он может быть разделен на активный или неактивный в зависимости от наличия инфекции. 50% пациентов CSOM имеют нарушение слуха.
50% пациентов CSOM имеют нарушение слуха.