Гидроторакс | Клиника «Оберіг»
Гидроторакс – это скопление жидкости между плевральными листками – в плевральной полости. Плевральные листки покрывают легкие и выстилают внутреннюю поверхность грудной клетки. В норме между ними содержится всего несколько миллилитров жидкости, которая выполняет функцию смазки.
Если легкие воспаляются, между плевральными листками скапливается экссудат. Это жидкость, которая выделяется из мелких кровеносных сосудов. В плевральной полости может появиться также транссудат. Он накапливается вследствие нарушения крово- и лимфообращения.
В отличие от экссудата, образование транссудата не связано с воспалительными процессами. Экссудат характерен для другого заболевания – плеврита. В этой статье мы рассмотрим накопление транссудата.
Причины гидроторакса легких могут быть различными. Это сердечная недостаточность, заболевания почек, цирроз печени и портальная гипертензия, тромбоэмболия легочной артерии и др.
Гидроторакс также сопровождает онкологические заболевания.
СИМПТОМЫ И ПРИЗНАКИ ГИДРОТОРАКСА
Симптомы гидроторакса вызываются сдавливанием легких скопившейся жидкостью. Пациентов беспокоит чувство тяжести, давления в груди, сухой кашель, одышка. Если в плевральной полости накапливается большое количество транссудата, затрудняется отток крови из шейных вен. Тогда становится заметным их набухание.
Классификация гидроторакса основывается на объеме и расположении жидкости. Выделяют малый и большой, правосторонний и левосторонний, тотальный и осумкованный гидроторакс. В большинстве случаев гидроторакс охватывает обе плевральные полости, а при метастатическом его характере чаще наблюдается одностороннее поражение.
ДИАГНОСТИКА ГИДРОТОРАКСА
Проводится рентгенологическое обследование органов грудной клетки, которое позволяет выявить наличие жидкости в плевральной полости. При подозрении на опухолевый гидроторакс показана компьютерная томография для выявления метастазов в органах грудной клетки.
При подозрении на опухолевый гидроторакс показана компьютерная томография для выявления метастазов в органах грудной клетки.
Окончательный диагноз при гидротораксе можно поставить только после лабораторного исследования жидкости в плевральной полости. Для ее забора проводится плевральная пункция. Жидкость отсасывается через небольшой прокол в грудной клетке. Лабораторный анализ показывает, является он экссудатом или транссудатом.
Тем не менее, в ряде случаев путем лабораторного анализа жидкости не удается установить причину развития гидроторакса, и для окончательной установки диагноза может быть рекомендована видеоторакоскопия. Этот эндоскопический метод позволяет осмотреть плевральную полость и произвести биопсию подозрительного участка.
ЛЕЧЕНИЕ ГИДРОТОРАКСА
Небольшой гидроторакс не требует специального лечения. Жидкость рассасывается самостоятельно при успешной терапии основного заболевания.
При значительном накоплении транссудата плевральная пункция используется в качестве не только диагностического, но и лечебного метода.
Лечение гидроторакса легких с помощью плевроцентеза улучшает состояние пациента, уменьшает одышку и неприятные ощущения. Но поскольку гидроторакс – вторичное заболевание, последующее лечение должно быть направлено на причину его развития.
При персистирующем гидротораксе, в особенности – метастатического характера, может быть выполнен видеоторакоскопический плевродез. Хирург под контролем эндовидеокамеры вводит в плевральную полость различные агенты, чаще химические (тальковый плевродез). Процедура вызывает спаечный процесс между листками плевры, который препятствует дальнейшему накоплению жидкости.
В Торакопульмонологическом центре Универсальной клиники «Оберіг» имеется все необходимое для диагностики и лечения гидроторакса. Плевральная пункция, а также видеоторакоскопия, осуществляется с помощью современного высокотехнологичного оборудования.
В Универсальной клинике «Оберіг» работает собственный патогистологический центр, в котором проводится исследование плевральной жидкости. Точная диагностика причины гидроторакса – основа правильной стратегии лечения пациента.
Запишитесь на прием к специалистам Торакопульмонологического центра, позвонив по телефону:
(044) 521 30 03
Гидроторакс — это… Что такое Гидроторакс?
скопление жидкости невоспалительного происхождения (транссудата) в плевральных полостях. Может возникать при сердечной недостаточности, сопровождающейся застоем крови в малом круге кровообращения; заболеваниях почек, особенно с формированием нефротического синдрома; циррозах печени; асците различного генеза; синдроме нарушенного всасывания; алиментарной дистрофии; перитонеальном диализе; при опухолях средостения.
Основным механизмом накопления жидкости в плевральных полостях при сердечной недостаточности является повышение гидростатического давления в большом и малом кругах кровообращения.
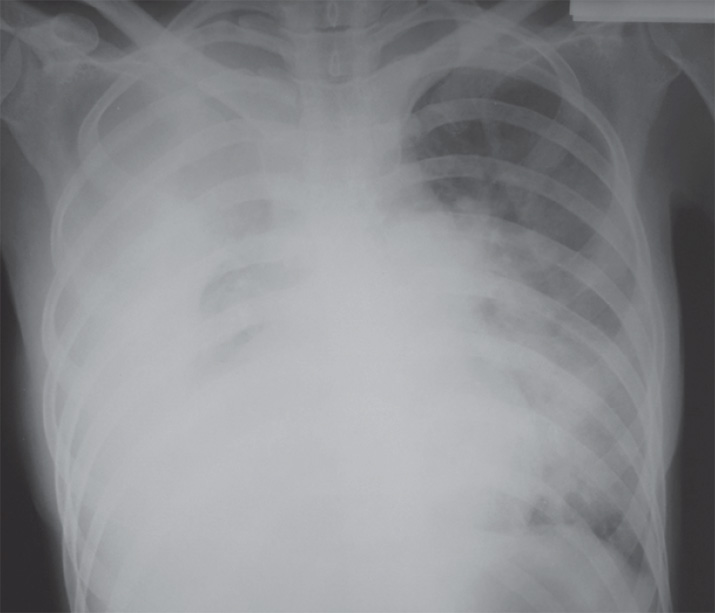
 Лихорадка, боли в грудной клетке не характерны. Г. нередко сочетается с периферическими отеками, анасаркой (распространенным отеком подкожной клетчатки), гидроперикардом. У больных обычно выявляются тяжелые болезни сердца, почек, печени и другие патологические состояния, послужившие причиной развития гидроторакса.
При физикальном исследовании над зоной накопления жидкости удается выявить ослабление или отсутствие голосового дрожания; приглушенный или тупой перкуторный звук с косой верхней границей; отсутствие дыхательных шумов. Важным диагностическим признаком плеврального выпота является смещение перкуторной границы тупости при изменении положения больного.
Рентгенологическое исследование позволяет обнаружить гомогенную тень жидкости с верхней границей, смещающейся при наклоне тела. Обязательным условием правильного распознавания плеврального выпота является рентгенологическое исследование в латеропозиции. С помощью ультразвукового метода можно выявить даже небольшое количество жидкости в плевральной полости и выбрать место для плевральной пункции.
Лихорадка, боли в грудной клетке не характерны. Г. нередко сочетается с периферическими отеками, анасаркой (распространенным отеком подкожной клетчатки), гидроперикардом. У больных обычно выявляются тяжелые болезни сердца, почек, печени и другие патологические состояния, послужившие причиной развития гидроторакса.
При физикальном исследовании над зоной накопления жидкости удается выявить ослабление или отсутствие голосового дрожания; приглушенный или тупой перкуторный звук с косой верхней границей; отсутствие дыхательных шумов. Важным диагностическим признаком плеврального выпота является смещение перкуторной границы тупости при изменении положения больного.
Рентгенологическое исследование позволяет обнаружить гомогенную тень жидкости с верхней границей, смещающейся при наклоне тела. Обязательным условием правильного распознавания плеврального выпота является рентгенологическое исследование в латеропозиции. С помощью ультразвукового метода можно выявить даже небольшое количество жидкости в плевральной полости и выбрать место для плевральной пункции.
Лечение направлено на устранение причины гидроторакса. При массивном Г., сопровождающемся дыхательной недостаточностью, показано медленное удаление содержимого плевральной полости во время плевральной пункции.
Библиогр.
Гидроторакс. Клиническая картина и диагностика гидроторакса!
1.Что такое гидроторакс
Так называемая «плевральная полость», расположенная между париетальными и висцеральными листками плевры лёгких, в норме содержит некоторый объём жидкости. Данная анатомическая особенность обеспечивает скольжение плевральных листков относительно друг друга в процессе дыхания. Объём этой жидкости не должен превышать 1-2 мл, однако в некоторых случаях происходит избыточное накопление транссудата в плевральной полости. Такое состояние называется «гидроторакс». Он может быть односторонним или симметричным.
В отличие от экссудата, содержащего в своём составе значительное количество белков (до 30%) и ферментов, транссудат является более водянистой жидкостью. Он чаще всего прозрачен, почти не содержит свойственных плазме ферментов, а белка в нём обнаруживается не более 3%.
Он чаще всего прозрачен, почти не содержит свойственных плазме ферментов, а белка в нём обнаруживается не более 3%.
Накопление жидкости в плевральной полости в подавляющем большинстве случаев развивается как осложнением других заболеваний. Гидроторакс неясной этиологии – редкое явление, относимое, скорее, к погрешностям диагностики.
Хотя гидроторакс локализуется в лёгких, он чаще всего имеет симптоматику сердечнососудистых нарушений. Проблемы с дыханием самим больным ощущаются реже. Накопление жидкости происходит постепенно. На протяжении значительного периода жидкость пропотевает через сосудистые стенки капиллярной сети и наполняет плевральную полость.
Обязательно для ознакомления!
Помощь в госпитализации и лечении!
2.
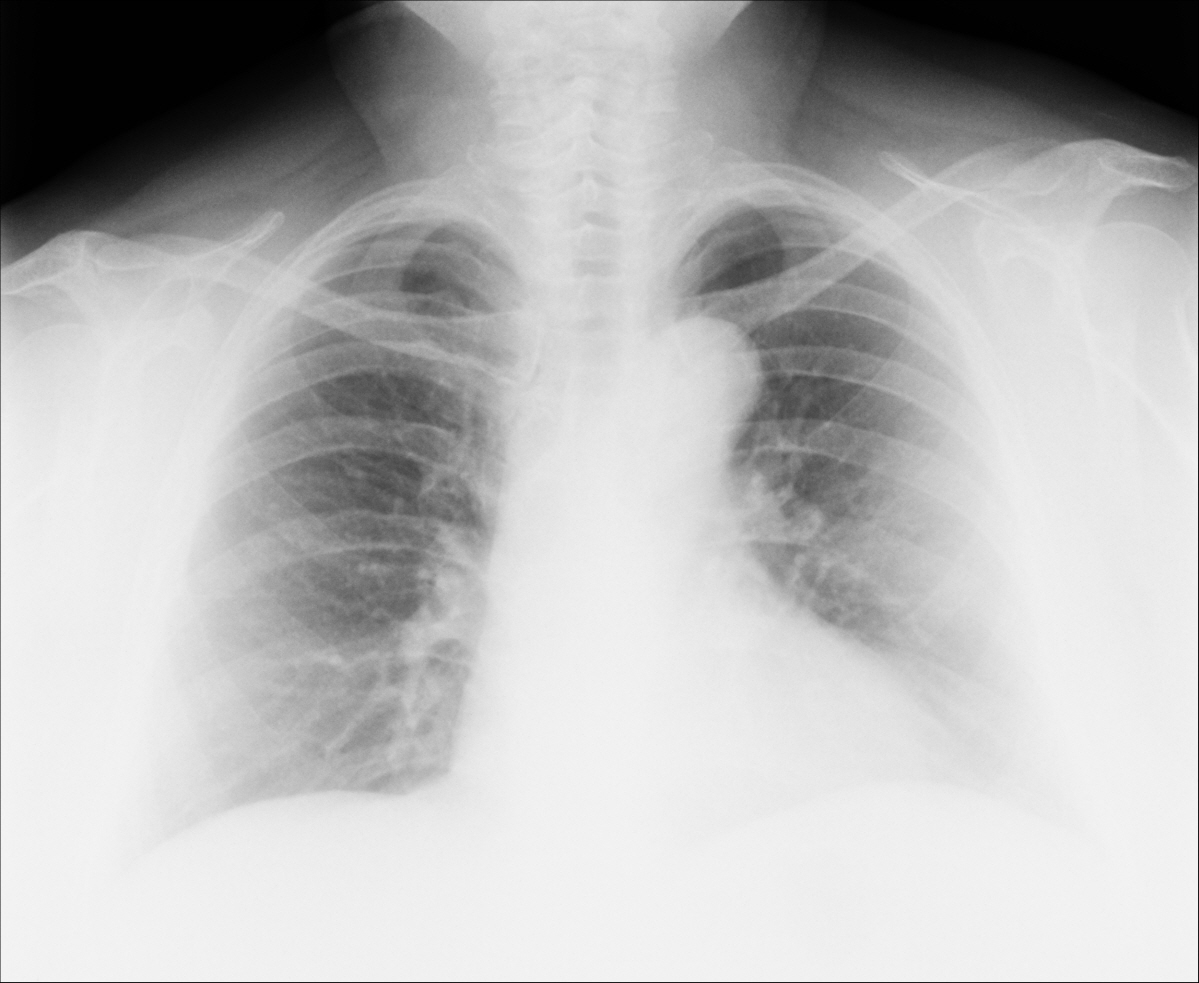
 Причины гидроторакса
Причины гидротораксаОдной из распространённых причин также являются заболевания почек. Нарушения в чашечно-лоханочном аппарате мочевыделительной системы приводят к гиперпротеинемии. Развивающаяся почечная недостаточность приводит к двустороннему гидротораксу при амилоидозе и на фоне нефротического синдрома.
Правосторонний гидроторакс характерен при циррозе печени. У 10 пациентов их ста, имеющих этот диагноз, жидкость из брюшины проникает в правую часть плевральной полости лёгких вследствие изменений, затрагивающих ткани диафрагмы в области печени.
Опухолевые заболевания органов средостения в ряде случаев также сопровождаются накоплением транссудата в лёгких.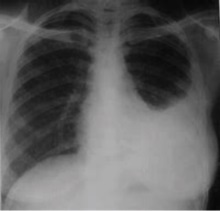
Запись на консультацию
Посетите нашу страницу
Пульмонология
3.Клиническая картина и диагностика гидроторакса
Гидроторакс часто сочетается с признаками накопления жидкости в подкожно-жировой клетчатке и других полостях тела (перикардиальной, брюшной).
Транссудат в объёме 100-150 мл при малом гидротораксе не имеет выраженной клинической картины. Компрессия органов грудной клетки начинает проявляться лишь при большом скоплении лимфы в плевральной полости. Дебют этого состояния обычно не острый – симптоматика усугубляется постепенно.
Прогрессирующее течение гидроторакса характеризуется следующими нарастающими симптомами:
- одышка;
- тяжесть в области диафрагмы;
- неудовлетворённость вдохом и другие проявления затруднённого дыхания.

В дифференциальной диагностике гидроторакса важно исключить пневмоторакс, признаками которого является выраженный болевой синдром и проявления воспалительного характера (повышение температуры, общее недомогание, слабость).
Визуальный осмотр может выявить акроцианоз кожных покровов (синюшность кожи) со стороны скопления транссудата. Больной, как правило, стремится принять вынужденную полусидячую позу. Осмотр проводится путём пальпации, перкуссии границ сердца и лёгочного звука. Также прибегают к их аускультации (анализу звуков сердечной деятельности и дыхания).
Для уточнения диагноза могут быть назначены следующие диагностические мероприятия:
- компьютерная томография;
- рентгеноскопия;
- ультразвуковая диагностика;
- плевральная пункция с целью последующего микробиологического и цитологического исследования.
Также показан общий и биохимический анализ крови и проведение пробы Ривальта, которая при наличии гидроторакса даёт отрицательный результат.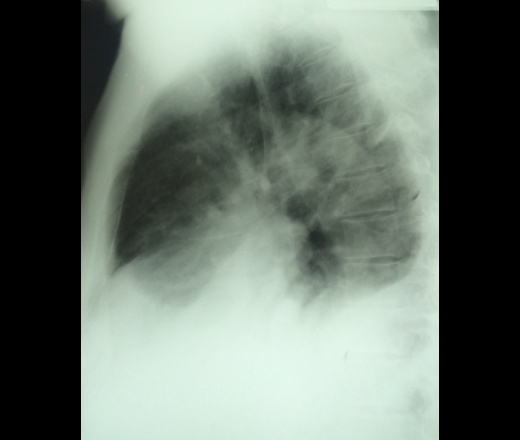
Запись на консультацию
О нашей клинике
м. Чистые пруды
Страница Мединтерком!
4.Лечение гидроторакса
Лечение гидроторакса, исходя из того, что данная патология не является самостоятельной нозологической единицей, заключается в устранении первопричин, спровоцировавших скопление жидкости.
Если этиопатогенетически гидроторакс связан с сердечнососудистой недостаточностью, комплексная терапия включает не только препараты, поддерживающие работу сердца, но и сочетается с мерами, направленными на коррекцию образа жизни больного. Рекомендуется внести изменения в режим труда и отдыха, сон, диету, физическую активность. Для вывода жидкости необходимо ограничить приём поваренной соли. Из лекарственных препаратов могут быть назначены:
- гликозиды;
- ингибиторы фосфодиэстеразы;
- диуретики;
- ингибиторы АПФ;
- периферические вазодилататоры.

При связи гидроторакса с почечной недостаточностью отёчно-нефрофитовый синдром требует постельного режима, полного исключения соли в питании, контроля диуреза. Лечебная тактика опирается на результаты диагностики – препараты назначаются в зависимости от первопричин и динамики заболевания почек.
Оперативная помощь может потребоваться при неэффективности консервативного лечения, а также в случаях развития острых дыхательных расстройств и сердечнососудистой недостаточности.
Запись на консультацию
Ответы
вероятность рака легких или как последствия рака молочной железы и терапии.Архивная запись
Добрый день! Хочу проконсультироваться насчет своей мамы. В 1998 году был определен рак молочной железы. Была проведена мастэктомия слева в этом же году. В 2002 году произошел рецидив заболевания, проводились курсы лучевой терапии. В 2011 году перенесла инфаркт миокарда, проводились стентирования в 2011 году и в 2013 году. Также у мамы имеется остеохондроз позвоночника и двухсторонний нефроптоз.
Также у мамы имеется остеохондроз позвоночника и двухсторонний нефроптоз.
Несколько месяцев (где-то в начале осени 2016 года) начала жаловаться на боли в грудной клетке, появился кашель (иногда затяжной, сухой). Начала сильно худеть, при любой физической активности появлялась сильная слабость. Врач-терапевт сделал заключение, что это простудное заболевание, потом подобие бронхита и прописывал различные лекарства (АЦЦ, пластинки от кашля, антибиотики). Состояние никак не улучшалось. В итоге провели рентгенографию органов грудной клетки:
— изменения в нижней зоне левого легкого с массивными плевральными наслоениями, которые не исключают неспецифический процесс. Необходимо КТ исследование грудной полости.
Соответственно провели мы компьютерную томографию органов грудной полости:
— КТ-картина консолидации легочной паренхимы с признаками ателектазирования на уровне верхней доли левого легкого S3 и S4, S6 левого легкого. КТ-признаки гидроторакса, плеврита слева с признаками осумкования. Выявленные изменения на уровне сегментов S3 правого легкого, учитывая анамнез, вероятно соответствуют последствиям лучевой терапии.
Выявленные изменения на уровне сегментов S3 правого легкого, учитывая анамнез, вероятно соответствуют последствиям лучевой терапии.
В конце 2016 года на скорой отвезли в больницу, так как состояние мамы стало очень тяжелым. Диагноз был поставлен следующий:
— левосторонний гидроторакс. Частичный ателектаз левого легкого. При проведении узи плевральной полости: на момент осмотра плевральных полостей в правой свободная жидкость не определяется, в левой визуализируется около 500 мл свободной жидкости. Прописали несколько лекарственных препаратов и выписали через 3 дня.
Улучшение ее состояния не наблюдалось, на протяжении всех новогодних праздников преследовали сильные боли в груди, кашель, даже ходить перестала, очень ослабла, похудела так, что остались кожа да кости.
После праздников обратились к пульмонологу и прошли обследование в пульмонологическом отделении. Провели узи и брали пункции. В итоге в правой и левой плевральной полости свободная жидкость убедительно не определяется.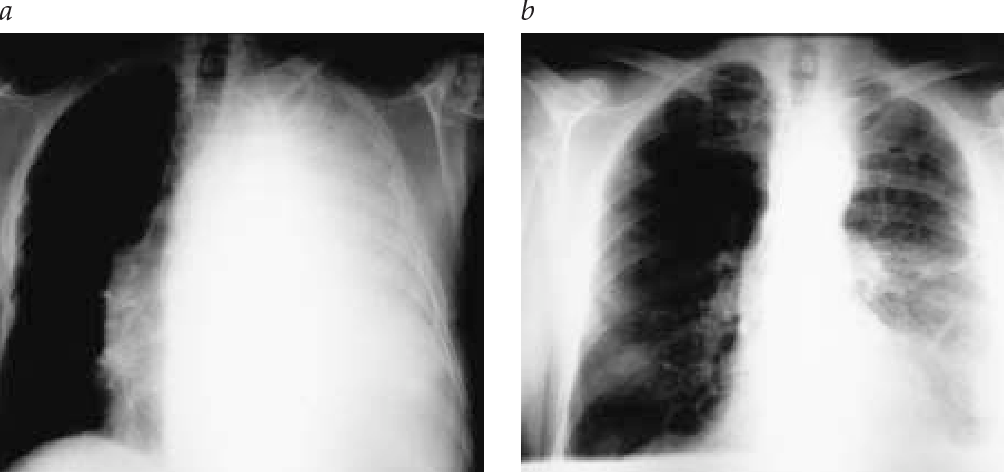 Врач рекомендовал обратить внимание, что есть вероятность рака легких или как последствия рака молочной железы и терапии.
Врач рекомендовал обратить внимание, что есть вероятность рака легких или как последствия рака молочной железы и терапии.
Записались к онкологу на прием (ждать около недели) в онкологическом диспансере, к которому прикреплена мама. Учитывая, что есть подозрения на такую страшную болезнь и тяжелое состояние мамы, хочу начать действовать заранее, потому прошу проконсультировать в этом вопросе и определить последовательность действий моих, чтобы не терять время. Плюс имеются следующие у меня вопросы:
1. Какие онкомаркеры для определения рака легких? (Так как можно сдать такие анализы быстро в любых платных клиниках).
2. Какие, помимо онкомаркеров, можно сделать анализы, обследования, которые могут помочь в определении рак легких ли у нее или же нет?
3. Посоветовать зарекомендованные учреждения по онкологии (платные в том числе), в которых имеется полный набор как диагностики, лечения рака легких.
Жалобы на данный момент
Боли в грудной клетке, слабость, сухой затяжной кашель, потеря веса.
Прошедшие обследования
Рентгенография органов грудной клетки:<br /> — изменения в нижней зоне левого легкого с массивными плевральными наслоениями, которые не исключают неспецифический процесс. Необходимо КТ исследование грудной полости.<br /> Компьютерная томография органов грудной полости:<br /> — КТ-картина консолидации легочной паренхимы с признаками ателектазирования на уровне верхней доли левого легкого S3 и S4, S6 левого легкого. КТ-признаки гидроторакса, плеврита слева с признаками осумкования. Выявленные изменения на уровне сегментов S3 правого легкого, учитывая анамнез, вероятно соответствуют последствиям лучевой терапии.
Данные биопсии и гистологии
Нет сведений.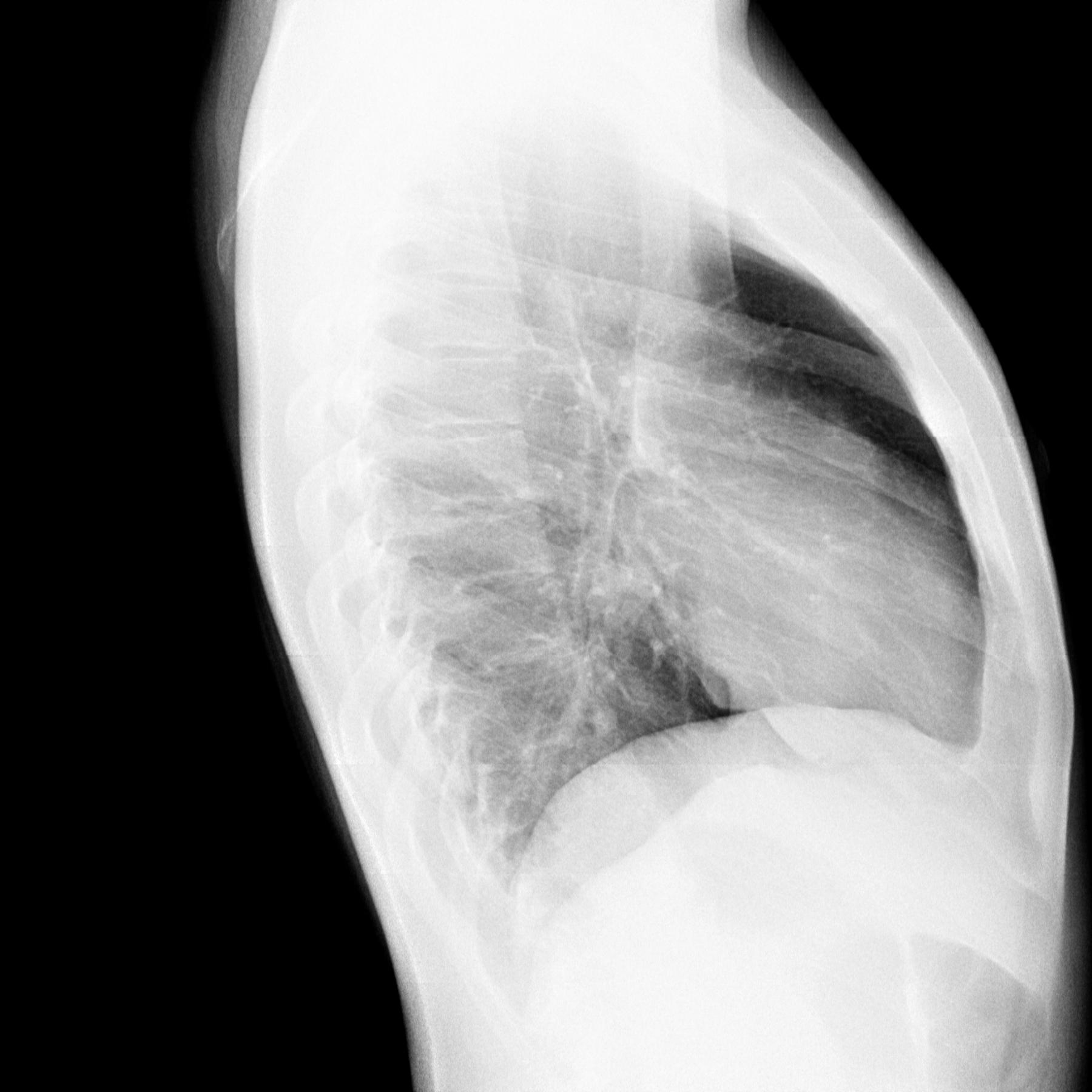
Предшествующее лечение
В 1998 году был определен рак молочной железы. Была проведена мастэктомия слева в этом же году. В 2002 году произошел рецидив заболевания, проводились курсы лучевой терапии.
Главная
4 июня 18:06
НПВП — давайте разбираться!Уважаемые коллеги, приглашаем 10 июня в 16:00 (мск) на вебинар постоянного автора журнала «Доктор.Ру» Каревой Елены Николаевны, д. м. н., профессора кафедры молекулярной фармакологии и радиобиологии им. акад. П.В. Сергеева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, профессора кафедры фармакологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
4 июня 18:05
Аллергические риниты, поллинозы у детей в летний периодЧлен редакционного совета журнала «Доктор. Ру» Ревякина Вера Афанасьевна, д. м. н., профессор, заведующая отделением аллергологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», 10 июня в 17:00 (мск) проведет вебинар,
посвященный аллергическим ринитам и поллинозам у детей
Ру» Ревякина Вера Афанасьевна, д. м. н., профессор, заведующая отделением аллергологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», 10 июня в 17:00 (мск) проведет вебинар,
посвященный аллергическим ринитам и поллинозам у детей
4 июня 18:02
Остеоартрит и коморбидность09 июня в 14:00 (мск) начнется онлайн-конференция «Остеоартрит и коморбидность», под руководством авторов журнала «Доктор.Ру» Лилы Александра Михайловича, д. м. н., профессора, директора ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», и Алексеевой Людмилы Ивановны, д. м. н., заведующей отделом метаболических заболеваний костей и суставов с центром профилактики остеопороза МЗ РФ ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», профессора кафедры ревматологии ФГБОУ ДПО РМАНПО Минздрава России
4 июня 18:00
Основные положения национальной программы по бронхиальной астме у детей
Главный редактор «Доктор.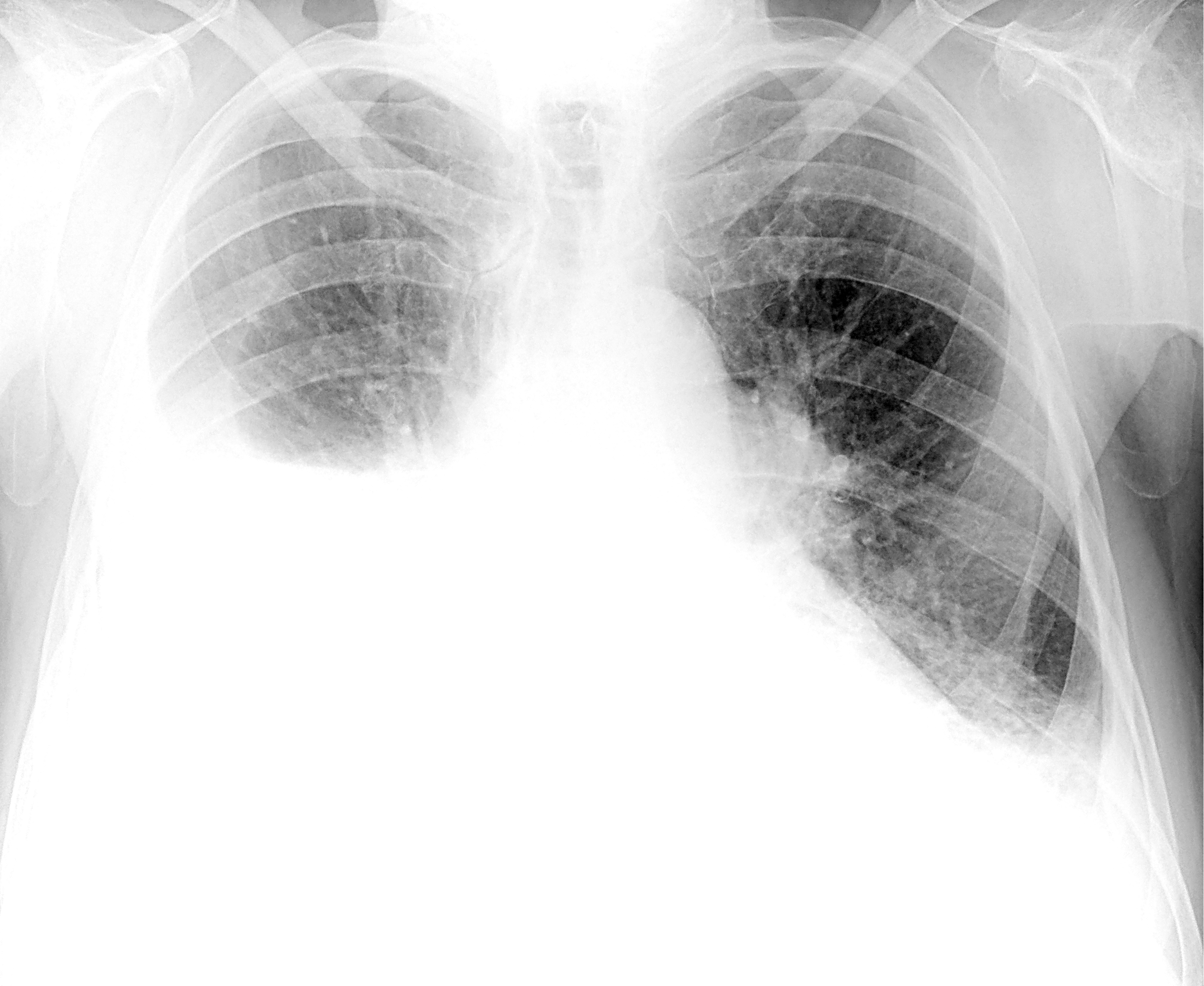 Ру» Педиатрия Геппе Наталья Анатольевна, д. м. н., профессор, заведующая кафедрой детских болезней Клинического института детского здоровья им. Н.Ф. Филатова Первого МГМУ им. И.М. Сеченова (Сеченовский Университет), и член редакционного совета журнала Ревякина Вера Афанасьевна, д. м. н., профессора, заведующей отделением аллергологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», проведут вебинар-диалог педиатра и аллерголога 08 июня в 16:30 (мск) Ревякиной Веры Афанасьевны, д. м. н., профессора, заведующей отделением аллергологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», председателя Союза детских аллергологов России.
Ру» Педиатрия Геппе Наталья Анатольевна, д. м. н., профессор, заведующая кафедрой детских болезней Клинического института детского здоровья им. Н.Ф. Филатова Первого МГМУ им. И.М. Сеченова (Сеченовский Университет), и член редакционного совета журнала Ревякина Вера Афанасьевна, д. м. н., профессора, заведующей отделением аллергологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», проведут вебинар-диалог педиатра и аллерголога 08 июня в 16:30 (мск) Ревякиной Веры Афанасьевны, д. м. н., профессора, заведующей отделением аллергологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», председателя Союза детских аллергологов России.
Посттравматическая диафрагмальная грыжа под маской посттравматической пневмонии и гидроторакса Текст научной статьи по специальности «Клиническая медицина»
СЛУЧАЙ ИЗ ПРАКТИКИ
В.Н. ШИЛЕНОК, Г.Н. ГЕЦАДЗЕ, А.В. ЕРЁМА
ПОСТТРАВМАТИЧЕСКАЯ ДИАФРАГМАЛЬНАЯ ГРЫЖА ПОД МАСКОЙ ПОСТТРАВМАТИЧЕСКОЙ ПНЕВМОНИИ И ГИДРОТОРАКСА
УО «Витебский государственный медицинский университет», Республика Беларусь
В статье приведено клиническое наблюдение больного, который находился на лечении в одной из клиник г. Витебска по поводу закрытой травмы грудной клетки, множественных переломов рёбер, травматической пневмонии, гидроторакса слева. После выписки больной повторно госпитализирован и прооперирован в БСМП г. Витебска по поводу посттравматической диафраг-мальной грыжи, гигантской язвы желудка с хорошим отдалённым результатом.
Ключевые слова: посттравматическая диафрагмалъной грыжа, посттравматическая пневмония, гидроторакс, оперативное лечение.
The article presents the clinical observation of the patient, who was treated in one of the clinics of Vitebsk with closed injury of the thoracic cage, multiple fractures of the ribs, traumatic pneumonia, and hydrothorax in the left side. After discharge the patient was hospitalized in Vitebsk emergency hospital with the posttraumatic diaphragmal hernia, giant gastric ulcer. The patient was operated on with the positive remote results.
Keywords: posttraumatic diaphragmal hernia, posttraumatic pneumonia, hydrothorax, surgical treatment.
Диафрагмальные грыжи составляют 2% от всех видов грыж, травматические диафрагмальные 0,2%. Редкость патологии обусловливает известные трудности при диагностике [1, 2, 3, 4].
Приводим клиническое наблюдение, когда правильный диагноз был поставлен только через 2 месяца после травмы.
Больной К., 1970 г.р., история болезни № 9139, поступил в 1-ехирургическое отделение БСМП 8-го декабря 2006 года. Жаловался на умеренные боли в эпигаст-рии, в левом подреберье, тошноту, многократную рвоту после еды, слабость, последнюю неделю эти признаки быстро прогрессировали.
В течение месяца в октябре — ноябре 2006 г. по поводу закрытой травмы грудной
клетки, множественных переломов рёбер слева, посттравматической пневмонии с гидротораксом находился в Витебской областной клинической больнице, где в процессе лечения выполнено дренирование плевральной полости слева.
Состояние при поступлении средней тяжести. Пониженного питания. Кожные покровы бледно-розовые, чистые. Дыхание везикулярное, несколько ослаблено слева в нижних отделах, ЧД — 18 в минуту. Слева в 6 межреберье по средне-подмышечной линии рубец 1,5 см без признаков воспаления. Тоны сердца ритмичные. АД 120/70 мм рт.ст. Пульс — 88 в минуту. Язык влажный. Живот не вздут, участвует в акте дыхания, при пальпации мягкий, умеренно болезненный в эпигастрии. Перитонеаль-
13 8
№3* 2008 ♦ том 16
ные симптомы не вызываются. Стула не было 7 дней. Газы отходят. Мочеиспускание не учащено, безболезненно. УЗИ органов брюшной полости 8.12.06. г. Без патологии. Свободной жидкости в брюшной и грудной полостях нет.
ФГДС 8.12.06.г.: пищевод эрозирован, с налетом фибрина. Кардия в норме. В желудке большое количество коричневого содержимого. Эвакуировано до 2-х литров буро-коричневого содержимого с остатками пищи. В средней трети тела на 55 см от резцов определяется резкая деформация в виде щели 0,8 х 2,5-3 см без изъявлений и инфильтраций. Пройти в антральный отдел не удалось.
Заключение: деформация средней трети желудка со стенозированием. Эрозивный эзофагит. Рак желудка?
Рентгенография грудной клетки. 8.12.06.г. Легкие: слева множественные сросшиеся переломы ребер, множественные плевродиафрагмальные спайки и шварты, плевральные паракостальные наложения. Уточнить расположение желудка (в грудной клетке либо брюшной полости затруднительно). Справа единичные сросшиеся переломы ребер. Средостение не смещено. Заключение: массивные спайки и шварты слева. Подозрение на повреждение диафрагмы, диафрагмальную грыжу слева.
Рентгеноскопия пищевода и желудка. 9.12.06. г. Глотка, пищевод свободно проходимы. Желудок грубо деформирован, в брюшной полости расположены свод, верхняя часть тела желудка. Нижняя треть тела, антральный отдел грубо деформированы, расположены в грудной клетке (рис. 1, 2, см. вкладыш). Луковица и петля 12-перстной кишки выпрямлены, расположены вертикально. Предполагаемая зона грыжевых ворот, дефекта диафрагмы — сухожильная часть, передний скат диафрагмы. Заключение: диафрагмальная грыжа, косвенные признаки повреждения диафрагмы,
предполагаемая зона дефекта диафрагмы -передний скат и центральная сухожильная часть, в грудной клетке расположена нижняя треть тела и антральный отдел, грудо-плевро-диафрагмальные спайки и шварты, множественные сросшиеся переломы ребер слева.
Общий анализ крови. 8.12.06.г. Гемоглобин — 82 г/л ; Эр — 2,7×1012/л; Л — 10,0х109/ л; П — 4% С — 53% Л — 40% М — 3%, ЦП -0,9; СОЭ — 68 мм/ч; Анизоцитоз «+»; Пой -килоцитоз»+».
Реакция Грегерсена в кале отрицательная.
Ирригоскопия. 15.12.06.г. Заключение: вся толстая кишка расположена в брюшной полсти! Грубой патологии не выявлено.
Диагноз: посттравматическая диафрагмальная грыжа. Хроническая анемия смешанного генеза средней степени.
19.12.06. г. Операция — трансплевральная резекция большой кривизны желудка и сальника. Пластика грыжевых ворот диафрагмы. Дренирование грудной клетки по Бюлау. Дренирование брюшной полости (проф. ШиленокВ.Н.).
Под общим эндотрахеальным наркозом выполнена срединная лапаротомия. При ревизии резко увеличенная печень. В левой части купола диафрагмы имеется дефект, в котором находится большая часть желудка, его большая кривизна вместе с большим сальником и поперечно-ободочной кишкой. Ниже диафрагмы имеется плотная неподвижная опухоль, при оттеснении которой от диафрагмы обнаружена гигантская язва большой кривизны, которая пенетрировала в диафрагму и поперечно-ободочную кишку. Ущемленный орган плотно фиксирован в грудной полости (рис. 3). Произведена торакотомия в 7 меж-реберье слева. Над диафрагмой имеется мощный воспалительный процесс, в который замурована большая кривизна желудка и часть некротизированного большого
© Новости хирургии
Рис. 3. Схема операции.
сальника. Постепенно желудок и сальник выделен из сращений до грыжевых ворот, отсечен под грыжевыми воротами. Большая кривизна желудка вместе с большим сальником удалены трансплеврально. Выполнена пластика грыжевых ворот диафрагмы П-образными и узловыми швами. Плевральная полость дренирована в 7 меж-реберье по Бюлау. Торакотомическая рана ушита. Через выполненный ранее абдоминальный разрез иссечена гигантская язва большой кривизны, пенетрирующая в поперечно-ободочную кишку и диафрагму. Ушита десерозированая часть поперечно-ободочной кишки. По передней и задней стенке в поперечном направлении желудок ушит швом Микулича и узловыми швами. Пилоропластика не производилась. Подди-афрагмальное пространство дренировано через отдельный прокол в левом подреберье. Лапаротомическая рана послойно ушита наглухо.
Макр опрепарат:
1. Резецированный желудок по большой кривизне с большим сальником.
2. Иссеченная язва большой кривизны желудка, пенетрирующая в поперечно-ободочную кишку и диафрагму.
Диагноз. Закрытая травма грудной клетки слева и брюшной полости с повреждением диафрагмы. Травматическая грыжа диафрагмы с ущемлением большой кривизны желудка и большого сальника. Гигантская язва желудка, с пенетрацией в поперечно-ободочную кишку и диафрагму.
В послеоперационном периоде умеренный левосторонний гидроторакс, который излечен консервативно. 30.12.06.г. в удовлетворительном состоянии выписан из стационара на амбулаторное лечение по настоянию. Через 1,5 года трудоспособность больного сохранена, жалоб не предъявляет.
Выводы
1. При закрытых травмах грудной клетки повреждение диафрагмы может протекать под маской пневмонии.
2. Сочетанный абдоминальный и трансплевральный доступ без рассечения рёберной дуги является оптимальным вариантом операции при лечении травматической грыжи диафрагмы.
ЛИТЕРАТУРА
1. Петровский, Б. В. Хирургия диафрагмы/ Б. В. Петровский, Н. Н. Каншин, Н. О. Николаев. — Москва, 1975.
2. Амосов, Н. М. Очерки торакальной хирургии / Н. М. Амосов. — Киев, 1973.
3. Атлас операций на диафрагме / Л. Г. Завгородний [и др.]. — Кишинёв, 1991.
4. Кузин, М. И. Хирургические болезни / М. И. Кузин. — Москва: «Медицина», 2006.
Поступила 20.03.2008 г.
Внебольничные пневмонии у детей в эпоху пандемии СОVID-19. Что изменилось?
Журнал «Медицинский совет» №1/2021
DOI: 10.21518/2079-701X-2021-1-214-219
О.В. Зайцева1,2, С.В. Зайцева1,3, Э.Э. Локшина1
Д.В. Хаспеков2, Н.В. Ткаченко2, Н.А. Шолохова1,2
Е.В. Куликова1, Х.Ю. Симановская1, А.Ю. Томилова3
А.Т. Баркинхоев2, Т.Ю. Беляева2
1 Московский государственный медико-стоматологический университет им. А.И. Евдокимова; 127473, Россия, Москва, ул. Делегатская, д. 20, стр. 1
2 Детская городская клиническая больница святого Владимира; 107014, Россия, Москва, ул. Рубцовско-Дворцовая, д. 1/3
3 Федеральный научно-клинический центр детей и подростков Федерального медико-биологического агентства; 115409, Россия, Москва, ул. Москворечье, д. 20
В период пандемии COVID-19 остро встал вопрос о диагностике и рациональной терапии внебольничной пневмонии у детей. Это обусловлено сложностями верификации диагноза внебольничной пневмонии в амбулаторном звене, особенностями интерпретации поражений органов дыхания. В статье представлены клинические случаи внебольничной пневмонии у детей, госпитализированных в пульмонологическое отделение педиатрического стационара.
Клинический случай 1. Ребенок 5 лет, анамнез болезни: заболела остро, 28.11.20 г. появилась боль в горле и лихорадка до 39,0 oС. Получала Кагоцел, Мирамистин, Нурофен. ПЦР на COVID-19 от 08.12.20 г. – положительный, от 18.12.2020 г., 22.12.2020 г., 20.01.2021 г. – отрицательный. Иммуноферментный анализ (ИФА) 23.12.20 г.: IgM – 4,47, IgG – 255,25.
УЗИ легких и плевральной полости: эхопризнаки резко выраженного интерстициального синдрома, массивного фибриноторакса с обеих сторон, косвенные признаки бронхоплевральных свищей; рентгенография легких: двусторонняя полисегментарная пневмония, двусторонний гидроторакс, двусторонний фибриноторакс, без выраженной динамики; КТ с в/в контрастированием: КТ-картина гидроторакса слева, гидропневмоторакса справа, плеврита с обеих сторон, компрессионный ателектаз сегментов нижних долей обоих легких. Без выраженной динамики. Лечение. Плевральные пункции, торакоцентез; антибактериальная терапия, антимикотики, инфузионная терапия, иммунотерапия, частичное парентеральное питание. На фоне проведенной терапии получена положительная динамика. Также приведены клинические примеры: ребенок 8 лет с подозрением на новую коронавирусную инфекцию и ребенок 5 лет с двусторонней полисегментарной пневмонией.
Для цитирования: Зайцева О.В., Зайцева С.В., Локшина Э.Э., Хаспеков Д.В., Ткаченко Н.В., Шолохова Н.А., Куликова Е.В., Симановская Х.Ю., Томилова А.Ю., Баркинхоев А.Т., Беляева Т.Ю. Внебольничные пневмонии у детей в эпоху пандемии СОVID-19. Что изменилось? Медицинский совет. 2021;(1):214–219. doi: 10.21518/2079-701X-2021-1-214-219.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Community-acquired pneumonia in children in the era of the COVID-19 pandemic. What has changed?
Olga V. Zaytseva1,2, Svetlana V. Zaytseva1,3, Evelina E. Lokshina1
Dmitriy V. Khaspekov2, Nadezhda V. Tkachenko2, Natalya A. Sholokhova1,2
Elena V. Kulikova1, Khilda Yu. Simonovskaya1, Anna Yu. Tomilova3
Adam T. Barkinkhoev2, Tatyana Yu. Belyaeva2
1 Yevdokimov Moscow State University of Medicine and Dentistry; 20, Bldg. 1, Delegatskaya St., Moscow, 127473, Russia
2 Children’s State Hospital of St. Vladimir; 1/3, Rubtsovsko-Dvortsovaya St., Moscow, 107014, Russia
3 Federal Scientific and Clinical Center for Children and Adolescents of the Federal Medical and Biological Agency; 20, Moskvorechye St., Moscow, 115409, Russia
During COVID-19 pandemic the issue of diagnosis and rational therapy of community-acquired pneumonia in children became acute. This is caused by difficulties in verification of the diagnosis of community-acquired pneumonia in the outpatient department, peculiarities of interpretation of the respiratory system lesions. The article presents clinical cases of communityacquired pneumonia in children admitted to the pulmonology department of a pediatric hospital.
Clinical case 1. 5-year-old child, medical history: acutely fell ill, on 28.11.20, had a sore throat and fever up to 39.0 oC. Received Kagocel, Miramistin, Nurofen. PCR for COVID-19 on 08.12.20 was positive, on 18.12.2020, 22.12.2020, 20.01.2021 negative. Immunoassay (ELISA) on 12.23.20: IgM 4.47, IgG 255.25.
Lung and pleural cavity ultrasound: echo signs of sharply pronounced interstitial syndrome, massive fibrinothorax on both sides, indirect signs of bronchopleural fistulas; lung radiography: bilateral polysegmental pneumonia, bilateral hydrothorax, bilateral fibrinothorax, with no marked progression; CT scan with IV contrast: CT picture of hydrothorax on the left, hydropneumothorax on the right, pleurisy on both sides, compression atelectasis of lower lobe segments of both lungs. With no marked progression. Treatment. Thoracentesis; antibiotic therapy, antimycotics, infusion therapy, immunotherapy, partial parenteral nutrition. Against the background of the therapy, positive dynamics was obtained. Clinical examples are also given: an 8-year-old child with suspected new coronavirus infection and a 5-year-old child with bilateral polysegmental pneumonia.
For citation: Zaytseva O.V., Zaytseva S.V., Lokshina E.E., Khaspekov D.V., Tkachenko N.V., Sholokhova N.A., Kulikova E.V., Simonovskaya Kh. Yu., Tomilova A.Yu., Barkinkhoev A.T., Belyaeva T.Yu. Community-acquired pneumonia in children in the era of the COVID-19 pandemic. What has changed? Meditsinskiy sovet = Medical Council. 2021;(1):214–219. doi: 10.21518/2079-701X-2021-1-214-219.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Внебольничные пневмонии (ВП) у детей по-прежнему остаются актуальной проблемой. В период пандемии бактериальные возбудители сохраняют свои лидирующие позиции в этиологии ВП у детей. В то же время особенно важно помнить о существовании вирусных поражений легких в период пандемии COVID-19. Многочисленные международные и отечественные публикации свидетельствуют о специфических изменениях в легких у пациентов при инфекции, вызванной SARS-CoV-2 [1, 2]. Пульмонологи отмечают, что термин «пневмония» совершенно не отражает клинико-рентгенологические и морфологические признаки патологического процесса, наблюдающегося при вирусном поражении легких вирусом SARS-CoV-2. Рекомендуется говорить о вирусном поражение легких – пневмоните или интерстициопатии, что существенно меняет терапевтические подходы ведения пациентов и ограничивает необходимость применения у них антибактериальных препаратов [3].
В педиатрической практике достоверно известно, что SARS-CoV-2 у детей младшего возраста протекает в виде легкого течения респираторного заболевания [4–6]. Только небольшая часть педиатрических пациентов с инфекцией SARS-CoV-2 требует интенсивной терапии, а смертность у детей значительно ниже, чем у взрослых [7, 8].
Принимая во внимание сложности диагностического поиска у пациентов с ВП, представляем вашему вниманию несколько клинических примеров диагностики и выбора этиотропной терапии у ребенка в период пандемии новой коронавирусной инфекции.
КЛИНИЧЕСКИЙ СЛУЧАЙ 1Эвелина К., 5 лет. Анамнез жизни: девочка от 4-й беременности, физиологических 3-х родов, к груди приложена сразу, раннее развитие без особенностей, вакцинирована по календарю. Хронических заболеваний нет. Семейный анамнез не отягощен. Болеет респираторными инфекциями 3–4 раза в год, посещает детсад с 3-летнего возраста.
Анамнез болезни: заболела остро, 28.11.20 г. появилась боль в горле и лихорадка до 39,0 oС. Получала Кагоцел, Мирамистин, Нурофен.
Лихорадка сохранялась 8 дней. 06.12.20 г. появилась одышка. Осмотрена педиатром. Госпитализирована 06.12.20 г. в районную больницу, переведена в ДГКБ г. Тулы 7.12.20 г., где находилась с диагнозом «Интерстициальная пневмония, двусторонний плеврит». Получала антибактериальную терапию, проведен двусторонний торакоцентез. ПЦР на COVID-19 от 08.12.20 г. – положительный, от 18.12.20 г., 22.12.20 г., 20.01.21 г. – отрицательный; ИФА 23.12.20 г. – IgM – 4,47, IgG – 255,25.
Переведена в ДГКБ св. Владимира г. Москвы 22.12.20 г. с диагнозом «Двусторонняя деструктивная пневмония, острая дыхательная недостаточность. Двусторонний пиопневмоторакс. Пиоторакс с фистулой. Состояние после торакоцентеза. Острая респираторная недостаточность».
При поступлении состояние тяжелое. Сознание ясное. Кожные покровы чистые, бледные. Дефицит массы более 20%. Дыхание самостоятельное, ЧДД 36/мин, аускультативно жесткое, ослабленное в нижнелатеральных отделах с обеих сторон, хрипов нет. FIO2 21%, SPO2 95%. Гемодинамика стабильная. PS 134/мин, АД 115/67. Живот мягкий, безболезненный. Мочеиспускание в норме.
УЗИ легких и плевральной полости 22.12.20 г.
Эхопризнаки резко выраженного интерстициального синдрома, массивного фибриноторакса с обеих сторон, косвенные признаки бронхоплевральных свищей.
Рентгенография легких
22–25–27.12.20 г. – двусторонняя полисегментарная пневмония. Двусторонний гидроторакс. Двусторонний фибриноторакс. Без выраженной динамики.
20.01.21 г. – двусторонняя полисегментарная пневмония. Положительная динамика.
КТ с в/в контрастированием
28.12.20 г. – КТ-картина гидроторакса слева, гидропневмоторакса справа, плеврита с обеих сторон. Компрессионный ателектаз сегментов нижних долей обоих легких. Без выраженной динамики (рис. 1а, б).
Рисунок 1. Клинический случай 1. Эвелина К., 5 лет
а) МСКТ с контрастным усилением от 28.12.20 г.; коронарный и аксиальный сканы. Визуализируется гидроторакс слева и гидропневмоторакс справа, плеврит, множественные участки интерстициальных изменений по типу «матового стекла» в обоих легких;
б) МСКТ через 16 дней; коронарный и аксиальный сканы.
Трахеобронхоскопия 28.12.20 г., 14.01.21 г. – двусторонний гнойный эндобронхит.
Лабораторные показатели: нейтрофильный лейкоцитоз со сдвигом влево, ускоренное СОЭ, значительно повышены провоспалительные цитокины, СРБ, прокальцитонин. Иммуноглобулины сыворотки крови соответствуют возрастной норме. Диаскин-тест отрицательный.
Лечение. Плевральные пункции, торакоцентез 27.12.20 г., 28.12.20 г.
Антибактериальная терапия: ванкомицин, цефоперазон + сульбактам, левофлоксацин в/в, цефепим. Антимикотики: микафунгин, флуконазол. Инфузионная терапия.
Иммунотерапия. Частичное парентеральное питание.
На фоне проведенной терапии получена положительная динамика.
Ребенок выписан домой в удовлетворительном состоянии под наблюдение педиатра по месту жительства.
Заключение. Данный клинический случай демонстрирует крайне неблагоприятное течение внебольничной пневмонии у соматически здорового ребенка, что, наиболее вероятно, связано с течением инфекции COVID-19, отсутствием своевременной противовирусной терапии (необходимо отметить, что Кагоцел, который лихорадящий ребенок получал 8 дней, не является противовирусным препаратом), поздней госпитализацией ребенка.
КЛИНИЧЕСКИЙ СЛУЧАЙ 2Константин М., 8 лет, мать ребенка обратилась к педиатру с жалобами на высокую лихорадку в течение 3 сут., кашель.
Из анамнеза жизни известно, что мальчик от молодых здоровых родителей. Наследственность не отягощена. Ребенок от первой физиологической беременности, срочных самостоятельных родов. Вес при рождении 3 540 г, рост 51 см. На грудном вскармливании находился до 1 года. Раннее развитие соответствовало возрасту. Привит по графику. Диаскин-тест отрицателен. Перенесенные заболевания – частые острые респираторные заболевания, ветряная оспа в возрасте 3 лет.
Эпидемиологический анамнез: мальчик организованный – посещает школу. Неделю назад вернулись из отпуска – отдыхал с родителями в Танзании, где перенес острый назофарингит. На период заболевания получал самостоятельно назначенный препарат цефуроксима аксетил в течение 4 сут. По возвращении проведено исследование ПЦР на SARS-CoV-2. Результат отрицателен.
Анамнез заболевания: настоящее заболевание в течение 3 сут. Ребенок заболел остро с повышением температуры тела до 38,5 oС, в первые сутки появился сухой кашель. В семье у родственников на момент осмотра симптомов заболевания не выявлено.
При осмотре – состояние средней тяжести. Температура 37,8 oС. Правильного телосложения, удовлетворительного питания. Вес 25 кг, рост 124 см. Кожные покровы бледные, чистые, влажные. Слизистые чистые, небные миндалины 2–3-й степени, чистые. Умеренная гиперемия дужек. Периферические лимфоузлы 2-й степени, единичные, безболезненные. ЧСС – 94 в минуту. Область сердца не изменена. Границы относительной сердечной тупости в пределах возрастной нормы. Перкуссия не проводилась. При аускультации жесткое дыхание проводится симметрично во все отделы легких, хрипов нет. ЧД – 24 в минуту. Сатурация кислорода 97%. Живот мягкий, доступен во всех отделах, безболезненный. Симптом поколачивания по поясничной области отрицателен с обеих сторон. Мочеиспускание свободное. Стул оформленный.
С учетом эпидемиологического анамнеза клинических симптомов и данных осмотра врач заподозрил у ребенка новую коронавирусную инфекцию. Рекомендовано повторить ПЦР на SARS-CoV-2, в терапии назначены жаропонижающие препараты (парацетамол), обильное питье.
На фоне терапии появилась слабость, потливость и на 5-е сут. от начала заболевания стойкая лихорадка до 39 oС, которая плохо снижалась на фоне жаропонижающей терапии.
При повторном осмотре изменений со стороны легких педиатр выявил снижение сатурации кислорода до 93% и локальные симптомы со стороны легких – ослабление перкуторного звука и мелкопузырчатые влажные хрипы в нижних отделах слева. С учетом длительности клинической картины (кашель, лихорадка 7 сут.), лабораторных данных (лейкоцитоз, гранулоцитоз, ускоренное СОЭ) снижение сатурации кислорода по данным пульсоксиметрии – SatО2 составило 93%.
При обследовании было выявлено – в клиническом анализе крови на 7-е сут. от начала заболевания: гемоглобин – 118 г/л, эритроциты 4,13–1012/л, лейкоциты 18,9–109/л, лимфоциты 24%, нейтрофилы 72%, моноциты 4%, СОЭ 44 мм/ч. ПЦР на SARS-CoV-2 отрицательный.
По данным рентгенограммы грудной клетки, выполненной на 8-е сут. от начала заболевания, выявлены инфильтративные изменения в области нижней доли слева (рис. 2). С учетом клинико-лабораторных и инструментальных данных ребенку был установлен диагноз внебольничной нижнедолевой левосторонней пневмонии, ДН 1-й степени.
Рисунок 2. Клинический случай 2. Константин М., 9 лет. Рентгенограмма органов грудной клетки пациента до терапии
В соответствии с установленным диагнозом была рекомендована антибактериальная терапия. С учетом установленных факторов риска наличия антибиотикорезистентных патогенов (частые острые респираторные заболевания в анамнезе, путешествие в другую климатическую зону, получал антибактериальную терапию в предшествующие 2 нед.) стартовым препаратом антибактериальной терапии решено выбрать ингибиторозащищенные аминопенициллины: амоксиклав в стандартной дозе (45–60 мг/кг/сут) – Амоксиклав® 400 мг + 31,25 мг/5 мл, суспензия 7,5 мл, 2 раза в сутки.
На фоне терапии на 3-и сут. у ребенка снизилась температура до субфебрильных цифр, улучшилось самочувствие. Антибактериальная терапия была продолжена до 7 сут. На фоне терапии получена положительная клинико-лабораторная и рентгенологическая динамика (рис. 3). Необходимо отметить, что изменения на рентгенограмме легких отстают от клинико-лабораторной динамики и не являются показанием для продолжения антибактериальной терапии. Ребенку рекомендован реабилитационный курс – массаж грудной клетки, дыхательная гимнастика.
Рисунок 3. Клинический случай 2. Константин М., 9 лет. Рентгенограмма органов грудной клетки пациента после антибактериальной терапии
Заключение. Данный клинический пример демонстрирует сложности диагностики внебольничной пневмонии в период пандемии новой коронавирусной инфекции. Первоначальный диагноз с подозрением на коронавирусную инфекцию не подтвердился. Своевременный диагноз внебольничной пневмонии бактериальной этиологии, назначение адекватного антибактериального препарата (амоксициллин + клавулановая кислота с учетом наличия резистентной флоры у ребенка, недавно вернувшегося из длительного путешествия) обеспечили неосложненное течение заболевания.
КЛИНИЧЕСКИЙ СЛУЧАЙ 3Василиса, 5 лет. Анамнез жизни: родилась в срок, здоровой. Раннее развитие без особенностей. Вакцинирована по календарю. Наблюдается эндокринологом с диагнозом «Экзогенно-конституциональное ожирение 1–2-й степени».
Болеет респираторными инфекциями редко, посещает детсад с 3 лет. Со слов мамы, антибиотики никогда не получала. В октябре 2020 г. – семейный контакт по COVID-19. По словам матери, клинических проявлений респираторного заболевания не было.
Обследование на коронавирус: ПЦР от 04.11.20 г. отрицательный. Анамнез болезни: 20.11.20 г. появились жалобы на кашель.
С 21.11.20 г. высоко лихорадит, температура 38,5–39 oС.
22.11.20 г. осмотрена педиатром, выставлен диагноз «ОРВИ, бронхит».
24.11.20 г. появилось нарастание симптомов одышки, кашля.
25.11.20 г. госпитализирована в ДГКБ св. Владимира.
Обследование на SARS-CoV-2: 25.11.20 г. ПЦР отрицательный, ИФА — IgM отрицательный, IgG – 187,56.
При поступлении состояние тяжелое, что обусловлено наличием дыхательной недостаточности 2-й степени, инфекционного токсикоза. Сознание ясное. Переведена на дотацию кислорода (лицевая маска, сатурация 99%, без дотации 92%).
Катаральных явлений нет, кожа, слизистые чистые. В легких аускультативно дыхание справа ослаблено, диффузные сухие и крепитирующие хрипы, ЧДД 30/мин, ЧСС 132/мин, АД 100/66. Гемодинамика стабильная. Живот мягкий, б/б. Физиологические отправления в норме.
Лабораторные показатели: нейтрофильный лейкоцитоз со сдвигом влево, СОЭ 35, СРБ 165, Д-димер 2465, фибриноген 7,76. Диаскин-тест отрицательный.
Рентгенография легких
25.11.20 г. Двусторонняя полисегментарная пневмония, деструктивная пневмония справа. Рентгенологическая картина может соответствовать объемному образованию правой половины грудной полости (средостения?).
27.11.20 г. Течение двусторонней полисегментарной пневмонии с некоторой положительной динамикой.
02.12.20 г. Течение двусторонней пневмонии с некоторой положительной динамикой.
КТ органов грудной полости
25.11.20 г. КТ-картина двусторонней полисегментарной пневмонии.
09.12.20 г. КТ-картина деструктивной пневмонии справа. Слева инфильтративные изменения не определяются (рис. 4а, б).
Рисунок 4. Клинический случай 3. Василиса, 5 лет
а) МСКТ 28.12.20 г.; коронарный и аксиальный сканы. Визуализируется тотальное снижение пневматизации верхней и средней долей правого легкого без уменьшения объема легкого; множественные участки интерстициальных изменений по типу «матового стекла» в обоих легких;
б) МСКТ через 14 дней; коронарный и аксиальный сканы.
Лечение. Антибактериальная терапия: ванкомицин, ампициллин-сульбактам, цефоперазон + сульбактам, имипенем + циластатин. Инфузионная терапия. Иммунотерапия. Физиотерапия.
На фоне терапии получена положительная клиниколабораторная динамика. Ребенок был выписан из стационара 11.12.20 г. в удовлетворительном состоянии под наблюдение участкового педиатра.
Заключение. Данный клинический пример демонстрирует тяжелое течение внебольничной пневмонии у ребенка, ранее перенесшего бессимптомную форму инфекции COVID-19. Можно предположить, что последствия коронавирусной инфекции оказали влияние на иммунную систему соматически здорового ребенка и явились предрасполагающим фактором для развития тяжелой внебольничной пневмонии. Впрочем, данное предположение необходимо подтвердить другими клиническими наблюдениями. В этом случае дети, перенесшие инфекцию COVID19, в т.ч. и бессимптомную, могут стать группой риска развития бактериальных осложнения при последующих ОРВИ.
ЗАКЛЮЧЕНИЕТаким образом, данные клинические случаи демонстрируют, что в эпоху пандемии взгляды на внебольничную пневмонию претерпели некоторые изменения: несмотря на то что представления об этиологических факторах остаются прежними, возрастает роль резистентных к антибактериальной терапии возбудителей [9]. В определенной мере этому послужило бесконтрольное назначение антибиотиков пациентам с COVID-19 [10]. Важно помнить, что наличие симптомов «матового стекла» при КТ-исследовании не служит показанием к назначению антибиотиков, в то время как клинико-лабораторные признаки бактериальной инфекции являются более значимыми критериями для решения вопроса о применении антимикробной терапии.
Пациенты, заболевшие инфекцией COVID-19, должны как можно раньше получить терапию противовирусными препаратами прямого действия, что может существенно улучшить прогноз заболевания.
Дети, перенесшие инфекцию COVID-19, в т.ч. и бессимптомно, в течение нескольких последующих месяцев могут иметь более высокий риск развития бактериальных осложнений при последующих ОРЗ, что необходимо учитывать в схемах терапии и реабилитации.
Список литературы / References
- Александрович А.С., Алексеева Е.И., Бакрадзе М.Д., Баранов А.А., Батышева Т.Т., Вашакмадзе Н.Д. и др. Особенности клинических проявлений и лечения заболевания, вызванного новой коронавирусной инфекцией (COVID-19) у детей. Версия 2 (03.07.2020). Режим доступа: https://static-0.minzdrav.gov.ru/. / Aleksandrovich A.S., Alekseeva E.I., Bakradze M.D., Baranov A.A., Batysheva T.T., Vashakmadze N.D. et al. Peculiarities of clinical manifestations and treatment of the disease caused by a new coronavirus infection (COVID-19) in children. Version 2 (03.07.2020). (In Russ.) Available at: https://static-0.minzdrav.gov.ru/.
- Синицын В.Е., Тюрин И.Е., Митьков В.В. Временные согласительные методические рекомендации Российского общества рентгенологов и радиологов (РОРР) и Российской ассоциации специалистов ультразвуковой диагностики в медицине (РАСУДМ) «Методы лучевой диагностики пневмонии при новой коронавирусной инфекции COVID-19» (версия 2). Вестник рентгенологии и радиологии. 2020;101(2):72–89. doi: 10.20862/0042-4676-2020-101-2-72-89. / Sinitsyn V.E., Tyurin I.E., Mitkov V.V. Consensus Guidelines of Russian Society of Radiology (RSR) and Russian Association of Specialists in Ultrasound Diagnostics in Medicine (RASUDM) “Role of Imaging (X-ray, CT and US) in Diagnosis of COVID-19 Pneumonia” (version 2). Vestnik rentgenologii i radiologii = Journal of Radiology and Nuclear Medicine. 2020;101(2):72–89. (In Russ.) doi: 10.20862/0042-4676-2020-101-2-72-89.
- Зайцев А.А. COVID-19: дискуссионные аспекты ведения пациентов. Терапия. 2020;(5):20–24. doi: 10.18565/therapy.2020.5.20-24. / Zaitzev A.A. COVID-19: controversial aspects of patients’ curation. Therapiya = Therapy. 2020;(5):20–24. doi: 10.18565/therapy.2020.5.20-24.
- Ludvigsson J.F. Systematic review of COVID-19 in children show milder cases and a better prognosis than adults. Acta Paediatr. 2020;109(6):1088–1095. doi: 10.1111/apa.15270.
- Lu X., Zhang L., Du H., Zhang J., Li Y.Y., Qu J. et al. SARS-CoV-2 infection in children. N Engl J Med. 2020;382:1663–1665. doi: 10.1056/NEJMc2005073.
- Parri N., Lenge M., Buonsenso D. Children with Covid-19 in pediatric emergency departments in Italy. N Engl J Med. 2020;383(2):187–190. doi: 10.1056/NEJMc2007617.
- Shekerdemian L.S., Mahmood N.R., Wolfe K.K., Riggs B.J., Ross C.E., McKiernan C.A. et al. Characteristics and outcomes of children with coronavirus disease 2019 (COVID-19) infection admitted to US and Canadian pediatric intensive care units. JAMA Pediatr. 2020;174(9):868–873. doi: 10.1001/jamapediatrics.2020.1948.
- Pathak E.B., Salemi J.L., Sobers N., Menard J., Hambleton I.R. COVID-19 in children in the United States: intensive care admissions, estimated total infected, and projected numbers of severe pediatric cases in 2020. J Public Health Manag Pract. 2020;26(4):325–333. doi: 10.1097/PHH.0000000000001190.
- Белевский А.С., Журавлева М.В., Каменева ТР., Безлепко Е.А., Родионов Б.А, Митрохин С.Д. и др. Алгоритм назначения антибактериальной терапии при SARS-CoV-2-ассоциированном повреждении легких у пациентов с COVID-19. М.; 2020. 13 с. / Belevskiy A.S., Zhuravleva M.V., Kameneva TR., Bezlepko E.A., Rodionov B.A, Mitrokhin S.D. et al. Algorithm for prescribing antibiotic therapy for SARS-CoV-2-induced lung injury in patients with COVID-19. Мoscow; 2020. 13 с. (In Russ.).
- Малеев В.В., Зайцев В.В., Яковлев С.В., Козлов Р.С., Сидоренко С.В., Белевский А.С. и др. О применении антибактериальной терапии у пациентов с новой коронавирусной инфекцией COVID-19. Совместное обращение к врачебному сообществу России. Режим доступа: https://omnidoctor.ru/. / Maleev V.V., Zaytsev V.V., Yakovlev S.V., Kozlov R.S., Sidorenko S.V., Belevskiy A.S. et al. On the use of antibiotic therapy in patients with the new COVID-19 coronavirus infection. Joint appeal to the Russian medical community. (In Russ.) Available at: https://omnidoctor.ru/.
Гидроторакс печени | Annals of Hepatology
ВведениеПеченочный гидроторакс (ГГ) определяется как плевральный выпот, обычно более 500 мл, у пациентов с циррозом печени без сопутствующего сердечного или легочного заболевания.1,2 Это нечастое осложнение портальной гипертензии с оценочная распространенность среди пациентов с циррозом составляет 5–10% [2–4]. Хотя плевральный выпот в связи с заболеванием печени был впервые описан в девятнадцатом веке Laënnec, HH впервые был определен Morrow et al.5 в 1958 году при описании быстрого накопления массивного правого плеврального выпота после диагноза цирроза печени. Наряду с гепатопульмональным синдромом и легочной гипертензией, в последние годы ГГ признан основным легочным проявлением хронического заболевания печени и цирроза.1,6 В большинстве случаев ГГ развивается с правой стороны (85%), в 13% случаев. встречается с левой стороны и в 2% случаев является двусторонним.2,3,7 Недавнее исследование показало, что частота HH была связана с функцией печени по оценке системы оценки Чайлд-Пью, но не с сывороточным альбумином.8 Хотя это часто наблюдается в сочетании с асцитом, ГГ может проявляться в отсутствие асцита у небольшой части пациентов. 9 В отличие от асцита, когда значительный объем (5-8 л) обычно хорошо переносится без значительных симптомов у пациента с ГГ разовьется одышка, одышка и / или гипоксия, когда в плевральной полости накапливается всего 1-2 л жидкости 7,10,11
В этом клиническом обзоре рассмотрены патофизиология, проявления, диагноз и Терапевтические варианты, доступные для лечения ГГ, будут обсуждены, чтобы позволить клиницисту лучше понять эти потенциально опасные для жизни осложнения.
ПатофизиологияХотя точные механизмы, участвующие в развитии гидроторакса печени, не были четко определены, несколько механизмов были постулированы, включая гипоальбуминемию и последующее снижение коллоидного осмотического давления, повышение давления в азиготной системе, ведущее к утечке плазмы в плевральную полость и трансдиафрагмальная миграция перитонеальной жидкости в плевральную полость через лимфатические каналы.12–14 Однако наиболее широко распространенной теорией является прямое прохождение асцитической жидкости из брюшины в плевральную полость через многочисленные диафрагмальные дефекты.15–17
Эти дефекты, которые называются плевроперитонеальными коммуникациями, обычно 15,17,18. Преобладание правой стороны может быть связано с эмбриологическим развитием диафрагмы, при которой левая сторона диафрагмы более мускулистая, а правая сторона более сухожильна из-за тесной анатомической связи с обнаженными участками печени.19 При микроскопическом исследовании эти дефекты были выявлены как разрывы в пучках коллагена, составляющих сухожильную часть диафрагмы.17 Макроскопически дефекты диафрагмы, связанные с развитием ГГ, были классифицированы по четырем морфологическим типам: Тип 1, без очевидного дефекта; тип 2 — пузырьки, лежащие в диафрагме; тип 3 — сломанные дефекты (оконные проемы) диафрагмы; и тип 4, множественные разрывы в диафрагме.18
Хотя диафрагмальные дефекты встречаются в нормальной популяции, и серии аутопсий сообщают о таких дефектах до 20% случаев, они, кажется, редко приводят к пневмотораксу после лапароскопических процедур.18,20 У пациентов с асцитом повышение давления в брюшной полости и истончение диафрагмы вследствие недостаточности питания у пациентов с циррозом увеличивают эти дефекты.1,13,21 Грыжи грыжи брюшины могут выступать через эти дефекты, и, если пузырек лопается, сообщение между брюшиной и плевральной полостью образуется 18,22,23. Движение жидкости из брюшной полости в плевральную полость является однонаправленным, что, вероятно, связано с постоянным градиентом давления в результате отрицательного внутригрудного давления во время дыхательного цикла и положительное внутрибрюшное давление.24 Если объем скопления асцита в плевральной полости превышает абсорбционную способность плевральных оболочек, наступает печеночный гидроторакс.
Этот механизм был подтвержден методами визуализации, демонстрирующими связь между брюшной полостью и плевральным пространством даже при отсутствии асцита.25–30 Несколько доступных методов оценки миграции плевры включают внутрибрюшинную инъекцию синего красителя или воздуха, 24 контрастного вещества. расширенное ультразвуковое исследование29–31 и сцинтиграфические исследования с использованием внутрибрюшинной инстилляции 99mT человеческого сывороточного альбумина или 99mTc-сульфора-коллоида.16,26,32,33 С другой стороны, другие теории о том, что лежащие в основе механизмы, приводящие к задержке жидкости у пациентов с ГГ, аналогичны механизмам, ведущим к другим формам накопления жидкости у пациентов с циррозом, не смогли объяснить правильное преобладание HH.10,12,13,34
Клинические проявленияПоскольку HH чаще всего возникает в контексте асцита и других признаков портальной гипертензии из-за декомпенсированного заболевания печени, основные клинические проявления неспецифичны и в большинстве случаев связаны с циррозом и асцитом. .7,9,35,36 Реже HH может быть показателем хронического заболевания печени.9 Респираторные симптомы у пациентов с HH варьировали, в основном в зависимости от объема выпота, скорости накопления выпота в плевральной полости и наличие сопутствующего сердечно-легочного заболевания.1,7,12 Пациенты могут протекать бессимптомно, у которых плевральный выпот является случайной находкой при визуализации грудной клетки, выполненной по другим причинам, или у них могут быть легочные симптомы одышки, кашля, гипоксемии или дыхательной недостаточности, связанные с большими плевральные выпоты.10,13,21,37 Недавняя серия случаев, включающая 77 пациентов с ГГ, показала, что большинство пациентов, как правило, предъявляли множественные жалобы, при этом наиболее частыми симптомами были одышка в покое (34%), кашель (22%), тошнота (11%). ) и плевритной боли в груди.7 В редких случаях у пациентов с ГГ может наблюдаться острый напряженный гидроторакс, проявляющийся в виде тяжелой одышки и гипотонии.7
ДиагнозДиагноз ГГ основывается на наличии цирроза печени с портальной гипертензией; исключение первичного сердечного, легочного или плеврального заболевания; и, в конечном итоге, подтверждение прохождения асцита в плевральную полость (рис. 1).2,33,38
Диагностический торакоцентезАнализ плевральной жидкости является обязательным для определения природы жидкости, исключения наличия инфекции, включая спонтанную бактериальную эмпиему (SBEM), и исключения альтернативного диагноза (воспаление или злокачественное новообразование) 39. ретроспективные серии40 показали, что 70% плевральных выпотов в группе из 60 пациентов с циррозом печени, поступивших с плевральными выпотами и перенесших диагностический плевроцентез, были вызваны неосложненным ГГ, 15% были связаны с инфицированным ГГ и 15% были вызваны причинами, не связанными с заболеванием печени, включая SBEM, туберкулез плевры, аденокарцинома, парапневмонические выпоты и невыявленные экссудаты.Кроме того, 80% правосторонних плевральных выпотов оказались неосложненными ГГ, в то время как только 35% левосторонних плевральных выпотов были неосложненными ГГ.
Анализ плевральной жидкости должен обычно включать уровни белка в сыворотке и жидкости, альбумина и лактатдегидрогеназы (ЛДГ), количество клеток, окраску по Граму и посев в бутылках для культивирования крови.2,37,41 Другие тесты, которые могут быть полезны в зависимости от клинического подозрения, включают триглицериды, pH, аденозиндезаминазу и полимеразную цепную реакцию (ПЦР) на микобактерии, амилазу и цитологию для исключения хилоторакса, эмпиемы, туберкулеза, панкреатита и злокачественных новообразований соответственно.4,10,36,37,42 Состав HH является транссудативным по своей природе и поэтому подобен аскетической жидкости.42–44 Однако общий белок и альбумин могут быть немного выше в HH по сравнению с уровнями в асцитической жидкости из-за большая эффективность поглощения воды плевральной поверхностью. 12,34,39,40,44,45
При неосложненной ГГ общий белок составляет 12,42. Кроме того, градиент альбумина от сыворотки к плевральной жидкости будет> 1,1, поскольку обнаруживается при асците, вторичном по отношению к портальной гипертензии, хотя этот вопрос широко не изучался (Таблица 1).12,42 Хотя широко сообщалось, что диурез увеличивает общий уровень протеина в плевральной полости, одно исследование показало, что только у одного пациента был выделен экссудат, несогласованный с белком, несмотря на то, что 34 пациента получали диуретики.39 Однако, когда ГГ является экссудатом, вероятно, из-за диуретиков, сыворотка Следует рассчитать соотношение альбумина плевральной жидкости и получить значение 43,44
Исключение других причин плеврального выпотаЧтобы исключить первичное сердечное, легочное или плевральное заболевание, в дополнение к соответствующим лабораторным исследованиям, например, необходимо выполнить рентгенографию грудной клетки. как мозговой натрийуретический пептид (BNP) в надлежащих клинических условиях.39,46,47 У пациентов с массивным плевральным выпотом рентгенограмму следует повторить, когда выпот значительно уменьшился (после диуреза или терапевтического торакоцентеза), чтобы оценить легочную или плевральную патологию, которая была замаскирована выпотом. 39 Компьютерная томография (КТ) сканирование грудной клетки поможет исключить поражения или злокачественные новообразования средостения, легких или плевры.7,42,48 Эхокардиография должна выполняться для оценки сердечной функции и устранения любых сердечных причин плеврального выпота.49,50 В исследовании с участием 41 пациента с ДГ диастолическая дисфункция была обнаружена у 11 из 21 пациента (52%). Контрастная эхокардиография с взбалтыванием физиологического раствора показала внутрилегочный шунт в 18 из 23 случаев (78%). 39 Однако в исследовании не упоминалось, как эти пациенты отличались от лево-сердечной недостаточности. Высокая распространенность диастолической дисфункции предполагает, что сердечная недостаточность могла способствовать развитию плеврального выпота.6,39,49,50 Повышенная нейрогормональная активность, связанная с циррозом печени, приводящая к гипертрофии сердца наряду с нарушением релаксации, рассматривалась как причина диастолической болезни. дисфункция у пациентов с циррозом печени.10,39 Традиционно, самая простая стратегия выявления истинной транссудативной природы выпотов, связанных с сердечной недостаточностью, обозначенных как экссудаты по критериям Лайта, заключается в вычислении градиента альбумина сыворотки к плевральной жидкости.44 Недавнее исследование продемонстрировало, что градиент между альбумином Уровни в сыворотке и плевральной жидкости> 1,2 г / дл работают значительно лучше, чем градиент белка> 3,1 г / дл, чтобы правильно классифицировать неправильно маркированные сердечные выпоты. С другой стороны, точность отношения плевральной жидкости к альбумину сыворотки 43,44
Диафрагмальная оценкаВ случаях, когда диагноз ГГ вызывает сомнения, в частности, когда плевральный выпот левосторонний и / или асцит отсутствует, диагноз: HH может быть подтвержден, когда установлено сообщение между брюшной и грудной полостями.10,13,34,38 Сцинтиграфические исследования с использованием внутрибрюшинной инстилляции 99mTc-сывороточного альбумина человека или 99mTc-сульфо-коллоида используются наиболее часто, потому что это просто и безопасно.24 Эти радиоактивно меченые частицы размером от 3 до 100 мкм не являются абсорбируются брюшиной, поэтому их внутриплевральный проход происходит только через анатомический дефект диафрагмы24,51. Было продемонстрировано, что радиоактивные индикаторы эффективны для демонстрации перитонеоплевральной коммуникации даже при отсутствии асцита.26,27,52 Этот метод имеет чувствительность и специфичность 71% и 100% соответственно.52 В случаях с минимальным асцитом рекомендуется внутрибрюшинное введение 300-500 мл физиологического раствора, чтобы способствовать прохождению радиоактивности через плевральную полость. помогает повысить эффективность перитонеальной сцинтиграфии в диагностике HH.24 Сцинтиграфические исследования также могут дать оценку размера диафрагмального дефекта (ов) по скорости, с которой радиоизотоп проходит из брюшины в плевральное пространство.33 Кроме того, внутрибрюшинная инъекция метиленового синего может использоваться во время операции для демонстрации и локализации дефектов, а ультразвуковое исследование с контрастным усилением используется для обнаружения потока через диафрагму в режиме реального времени.29–31 Хотя другие методы диагностики, включая магнитно-резонансную томографию и КТ также может использоваться для обнаружения основных дефектов диафрагмы, 15,48 прямая демонстрация дефектов с помощью этих методов может быть чрезвычайно сложной, поскольку сам дефект обычно довольно мал.39 Видео-торакоскопия, которая может обеспечить прямую визуализацию основных диафрагмальных дефектов, 18,20 является альтернативным вариантом диагностики. Тем не менее, этот метод является инвазивным и должен рассматриваться только в том случае, если диагноз неясен или есть план восстановления диафрагмальных дефектов.34
Спонтанная бактериальная эмпиемаСпонтанная бактериальная эмпиема (SBEM) — это инфекция уже существующего гидроторакса в отсутствие пневмонии.53,54 Сообщается, что она встречается у 2.От 0% до 2,4% пациентов с циррозом и от 13% до 16% пациентов с HH.55–57 Фактическая частота SBEM может быть выше, чем сообщалось, из-за недостаточной диагностики.58–60 Начало эмпирических антибиотиков у пациентов с циррозом и лихорадка или печеночная энцефалопатия из-за более высокого подозрения на спонтанный бактериальный перитонит маскирует диагноз SBEM. 58–60 SBEM следует отличать от вторичной эмпиемы пневмонии, потому что обычно нет признаков гноя или абсцесса в грудной полости при SBEM и отличаются по патогенезу, клиническому течению и стратегии лечения от эмпиемы, вторичной по отношению к пневмонии.61–63 Таким образом, некоторые авторы предложили назвать это спонтанным бактериальным плевритом.1,10,12,34
Хотя точный механизм SBEP остается неясным, считается, что патогенез подобен спонтанному бактериальному перитониту ( САД) в том смысле, что преходящая бактериемия приводит к инфицированию плевральной жидкости из-за нарушения ретикулоэндотелиальной фагоцитарной активности.3,53,54,56,61–64 В 40% случаев СБЭМ может возникать в отсутствие САД и даже при отсутствие асцита, что указывает на то, что САД не является предпосылкой для SBEM.3,53,55–57 Факторы риска, определенные для развития SBEM у пациентов с циррозом, включают: низкий уровень C3 в плевральной жидкости, низкий уровень общего белка в плевральной жидкости сывороточного альбумина, высокий балл по шкале Чайлд-Пью и сопутствующее SBP. , 65 Подобно SBEM, наиболее частыми бактериями, участвующими в SBEP, являются виды E. coli, Klebsiella, Streptococcus и Enterococcus.3,55–57, 66,67
Симптомы SBEM могут быть симптомами сопутствующего SBEP (т.е. боль в животе), может ограничиваться грудной полостью (т.д., одышка, боль в грудной клетке) или может иметь системный характер (например, лихорадка, шок, новая или обостряющаяся энцефалопатия) .54,68 Учитывая высокий уровень смертности, высокий индекс подозрения имеет важное значение для диагностики SBEM у пациентов. Пациенты с циррозом печени, у которых развивается лихорадка, плевритная боль, энцефалопатия или необъяснимое ухудшение функции почек. 250 клеток / мм3 с положительной культурой или количество клеток PMN> 500 клеток / мм3 в случаях с отрицательной культурой; отсутствие признаков пневмонии и / или сопутствующих инфекций; и градиент альбумина сыворотка / плевральная жидкость> 1.1 (Таблица 1) .56,65 Как и в случае с культурами асцитной жидкости, плевральная жидкость должна быть немедленно внесена в сосуды с кровяными культурами у постели больного, чтобы увеличить микробиологический выход.55,56 Прикроватная инокуляция приводила к положительным культурам в 75% случаев. Положительный результат составил только 33% при использовании обычных микробиологических методов.55,56 Обнаружение плевральной нейтрофилии обеспечивает раннюю диагностику SBEM при задержке результатов посева.54,66
Первоначальная адекватная антимикробная терапия является краеугольным камнем лечения.Учитывая связь с САД, начальная схема приема антибиотиков аналогична, а рекомендуемым лечением является внутривенное введение цефалоспорина третьего поколения в течение 7-10 дней12, 54,58,61. пациенты с SBEM, хотя использование альбумина специально не изучалось в SBEM.3,68 Установка плевральной дренажной трубки, как правило, не рекомендуется при SBEM даже в случаях с положительным посевом, поскольку это может привести к опасному для жизни истощению жидкости, белка потеря и нарушение баланса электролитов.21,69–71 Единственным показанием к дренированию через грудную трубку при SBEM является гной в плевральной полости. Из-за нарушения функции печени, часто связанной с почечной недостаточностью у большинства пациентов с циррозом и SBEM, лечение SBEM представляет собой клиническую проблему.54 Несмотря на агрессивную терапию, смертность у этих хрупких пациентов высока (до 20% ).54, 56 Независимыми факторами, связанными с неблагоприятным исходом, являются высокие модели терминальной стадии заболевания печени (MELD) -Na, первоначальная госпитализация в ОИТ и первоначальная неэффективность лечения антибиотиками.68
МенеджментМедицинское ведениеПоскольку подавляющим механизмом является трансдиафрагмальный асцит, основное лечение должно быть сосредоточено на устранении и предотвращении рецидива асцита. Диета с ограничением натрия и разумное использование диуретиков за счет индукции и поддержания чистого отрицательного баланса натрия могут обеспечить начальное снижение асцита и предотвратить развитие ГГ.72,73 Диета с низким содержанием натрия, 70-90 ммоль в день и потеря веса 0,5 кг в сутки у пациентов без отеков и 1.0 кг в день у людей с отеками является целью терапии.64 Одновременно с пациентами следует проводить диетологическое обучение. Однако для достижения этой цели диетической терапии обычно недостаточно. Поэтому диуретики необходимы в подавляющем большинстве случаев. Препарат дистального действия (обычно спиронолактон 100 мг / день) и петлевой диуретик (например, фуросемид 40 мг / день) следует назначать одновременно в качестве наилучшего начального режима для получения почечной экскреции натрия не менее 120 мэкв в день. 74 Дозы можно постепенно увеличивать каждые 3-5 дней, удваивая дозы фуросемида до 160 мг / день и спиронолактона до 400 мг / день.37,38 Уровень натрия в моче следует проверять до и во время терапии для корректировки дозировки диуретика в соответствии с клиническим ответом.2,13
Рефрактерный гидроторакс печениНесмотря на медикаментозную терапию диуретиками и ограничение натрия, многие пациенты все еще испытывают трудноизлечимую одышку и респираторные нарушения из-за стойкого гидроторакс. Более того, у многих пациентов дисбаланс электролитов, вызванный диуретиками, почечные аномалии или преципитация энцефалопатии могут помешать успешному симптоматическому контролю плеврального выпота.Считается, что у этих пациентов рефрактерный гидроторакс печени.2,12,34 Примерно от 21% до 26% пациентов, проходящих лечение, могут попасть в эту категорию.73,75 Единственным окончательным методом лечения рефрактерного ГГ является трансплантация печени14,72 ожидающих трансплантации печени и тех, кто не является кандидатом на трансплантацию, целями терапии рефрактерного ГГ является облегчение симптомов и предотвращение легочных осложнений (рис. 2) .1,10,34 Доступные терапевтические варианты включают терапевтический торакоцентез, установку плевральной дренажной трубки и постоянное пребывание. плевральный катетер, трансъюгулярный внутрипеченочный портосистемный шунт (TIPS) и хирургические вмешательства (таблица 2).72
Терапевтический торакоцентезТоракоцентез — это простая и эффективная процедура, показанная для облегчения симптомов одышки у пациентов с большими выпотами, а также у пациентов с рецидивирующим или рефрактерным гидротораксом, хотя преимущества процедуры часто кратковременны, и процедуру обычно необходимо повторять .10,76 В целом рекомендуется удалить не более 2 л, поскольку существует риск гипотензии или повторного развития отека легких. 40,77 Рентген грудной клетки и компьютерная томография грудной клетки перед терапевтическим торакоцентезом. определить размер излияния.После процедуры также рекомендуется сделать рентгенограмму грудной клетки, не только для выявления пневмоторакса, но и для оценки патологии легких или плевры, которая была замаскирована выпотом.40,77 Коагулопатия цирроза не считается противопоказанием к терапевтическому торацентезу, если она не диссеминирована. внутрисосудистая коагуляция.12,13,21,34,78 Торакоцентез при ГГ в клинической практике обычно безопасен. Риск пневмоторакса после серийного торакоцентеза увеличивается с 7,7% до 34,7%. Другие возможные осложнения включают боль в месте прокола, пневмоторакс, эмпиему или инфекцию мягких тканей, кровохарканье, воздушную эмболию, вазовагальные эпизоды, подкожную эмпизему, кровотечение (гематома, гемоторакс или гемоперитонеум), разрыв печени или селезенки.40,77
Установка плевральной трубки и постоянный туннельный плевральный катетерПлевральная трубка не должна устанавливаться в этой группе пациентов, так как это может привести к потере белка, вторичной инфекции, пневмотораксу, гемотораксу и гепаторенальному синдрому, а также к электролитным нарушениям.70,71,79 , 80 Также может быть трудно удалить плевральную дренажную трубку, потому что часто происходит быстрое повторное накопление жидкости после пережатия плевральной дренажной трубки 70,79
Постоянный туннельный плевральный катетер (ITPC, также известный как PleurX или катетер Denver) изначально был предназначен для паллиативной амбулаторной терапии рецидивирующих злокачественных плевральных и асцитических выпотов, и в настоящее время он стал обычным терапевтическим инструментом при лечении симптоматических злокачественных выпотов.81–83 Появляется все больше сообщений о его применении при доброкачественных состояниях плевры, в том числе HH. 82,84–88 Недавний метаанализ Патил и др. 89 относительно использования IPTC при доброкачественных плевральных выпотах продемонстрировал спонтанный уровень плевродеза 51%. В недавнем проспективном исследовании 81 25 ITPC были установлены 24 пациентам. Среднее количество процедур плеврального дренажа перед установкой ITPC составило 1,9, при этом никаких дополнительных плевральных дренирований не требовалось ни у одного пациента после установки ITPC. Спонтанный плевродез произошел у 33% пациентов, инфекция плевральной жидкости — у 16.7% пациентов. Несмотря на то, что эти результаты выглядят многообещающими, данные ограничены, и необходимы дальнейшие исследования для сравнения эффективности с другими методами лечения.72,90,91
Трансъюгулярный внутрипеченочный портосистемный шунтТрансъюгулярный внутрипеченочный портосистемный шунт (TIPS) — это нехирургический подход, который уменьшает компрессию портала. система, тем самым обращаясь к механизму сбора жидкости в брюшной полости и / или груди.75 В тщательно отобранной популяции TIPS может привести к значительному уменьшению осложнений, связанных с портальной гипертензией.75,92–96 В настоящее время это стандарт лечения пациентов с рефрактерным ГГ. Более того, TIPS превосходит другие методы лечения в предотвращении повторного кровотечения из варикозно расширенных вен и в борьбе с рефрактерным асцитом, что было хорошо изучено в контролируемых исследованиях.75
Эффективность и безопасность TIPS при ГГ были исследованы в нескольких неконтролируемых исследованиях. исследования и отчеты о случаях.75,92–98 Недавний метаанализ, включающий шесть исследований 198 пациентов, показал, что полный ответ на TIPS составил 55.8% (95% ДИ: 44,7–66,9%), частота частичного ответа составила 17,6% (95% ДИ: 10,9–24,2%) .99 Недавняя серия случаев показала, что TIPS был эффективным в 73,3% из 19 случаев100. Следует отметить, что стенты, использованные в большинстве этих исследований, были стентами из чистого металла, и, как и ожидалось, частота дисфункции шунта, приводящая к рецидиву гидроторакса, была высокой.99 При использовании стентов, покрытых ПТФЭ, в этих условиях проходимость шунта был значительно улучшен101–103, что расширит преимущества TIPS для HH. Частота энцефалопатии, связанной с TIPS, составила 11.7% (95% ДИ: 6,3–17,2%), большинство из которых можно контролировать с помощью медикаментозной терапии.104,105 Только в 5% случаев требуется окклюзия TIPS или уменьшение калибра TIPS для контроля энцефалопатии.
Однако TIPS не улучшает общий прогноз пациентов с терминальной стадией заболевания печени. Средняя 30-дневная смертность составляла 18%, а годовая выживаемость — 52% .92–94,106 Факторы риска смертности после размещения TIPS для HH включают балл Чайлд-Пью ≥ 10, балл MELD> 15 и повышенный креатинин. .92–94 Кроме того, отсутствие реакции гидроторакса после установки TIPS связано с повышенным уровнем смертности. 92–94 Поскольку TIPS отводит кровь от печени и снижает эффективную перфузию воротной вены в печень, это может вызвать печеночную недостаточность. у пациентов с уже значительным нарушением функции печени. В идеале пациенты с высокой вероятностью декомпенсации после TIPS должны также начать оценку трансплантации печени, при этом TIPS служит только мостом.93,94,99
Хирургические вмешательстваДля лечения HH использовались три хирургических подхода, включая химические плевродез (через трубчатую торакостомию или VATS), восстановление диафрагмальных дефектов или фенестраций с / без плевродеза, а также перитонеовенозное шунтирование или плевровенозное шунтирование.10
ПлевродезПлевродез — это метод, заключающийся в удалении пространства между париетальной и висцеральной плеврой склерозирующим агентом или раздражителем (например, тальком или тетрациклином), который вводится через трубчатую торакостомию (грудную трубку) или торакоскопию. (VATS) .107–111 Обычно его назначают пациентам без клинического асцита, у которых нет других вариантов.107,111–113 Причина этой рекомендации заключается в том, что для успешного плевродеза требуется висцеральное и париетальное плевральное сочленение, чего бывает трудно достичь при рефрактерном лечении. Пациенты с ДГ из-за быстрого накопления жидкости.14 Парацентез, выполняемый перед плевродезом, также может увеличить вероятность успеха за счет уменьшения асцита и потока жидкости из брюшины в плевральную полость, что дает больше времени для того, чтобы плевральные пространства располагались друг напротив друга.114 ITPC также может сочетаться с плевродезом для избежать и уменьшить госпитализацию115,116. Кроме того, в одном исследовании сообщалось, что постоянное положительное давление в дыхательных путях (СРАР) за счет увеличения положительного внутригрудного давления и изменения перитонеально-плеврального градиента давления в сочетании с плевродезом улучшало процент успеха.117
Метаанализ, проведенный Hou et al.118, включающий 180 пациентов с рефрактерной ГГ, подвергшихся плевродезу, в 13 исследованиях продемонстрировал начальную среднюю степень успеха 72% с последующим симптоматическим рецидивом в 25% случаев. Частота полного ответа на плевродез с помощью плевральной дренажной трубки составила 78% (95% ДИ 68-87%), тогда как при использовании видеоторакоскопического подхода (VATS) в сочетании с плевродезом с тальком частота полного ответа составила до 84% ( 95% ДИ 64-97%) .118 В соответствии с препаратами, используемыми для плевродеза, полный ответ на плевродез только тальком составил 71% (95% ДИ 63-79%), а полный ответ на лечение только OK-432 или в комбинация с миноциклином составила 93% (95% ДИ 78-100%).118
Различные осложнения, часто наблюдаемые после плевродеза, включают лихорадку и легкую боль в грудной клетке, хотя также сообщалось об эмпиеме, пневмотораксе, пневмонии, септическом шоке и печеночной энцефалопатии с печеночной недостаточностью.107,111–113,118 Постоянный асцитический дренаж большого объема из области грудной клетки, вызывающий азотемия и почечная недостаточность — еще одно опасное осложнение, когда плевральная дренажная трубка остается на длительное время. Механический плевродез сопряжен с высоким риском кровотечения, особенно у пациентов с запущенным заболеванием печени и коагулопатией.109
Хирургическое лечение дефектов диафрагмыИз-за предложенного механизма HH дефектов диафрагмы сообщалось о хирургических подходах, направленных на исправление дефектов с помощью фибринового клея или швов.119 Хотя закрытие трансдиафрагмальных дефектов может быть выполнено с помощью открытой торакотомии и с помощью VATS с сопутствующим тальком плевродез, открытая торакотомия у пациента с циррозом печени имеет значительную летальность.119
В небольшой серии из восьми пациентов, перенесших VATS по поводу рефрактерной ГГ, очевидные диафрагмальные дефекты были обнаружены у шести (75%) пациентов.Плевральный выпот не рецидивировал у шести пациентов с закрытыми дефектами, но у двух других пациентов был рецидив выпота, и они умерли через 1 и 2 месяца после процедуры, соответственно.120 В другой серии, описанной Milanez de Campos, et al.121 в котором 21 торакоскопия была выполнена 18 пациентам с ГГ, общий показатель успеха составил 48%. Из этих пяти пациентов, которым можно было наложить шов, у трех был хороший ответ (60%), один умер от послеоперационной пневмонии и печеночной недостаточности, а у другого была эмпиема и дренирование жидкости в течение 1 месяца.Десять из 21 (47,6%) процедуры дали хороший ответ. Однако высокая заболеваемость (57,1%) и смертность (38,9%) в этом исследовании в течение периода последующего наблюдения продолжительностью 3 месяца вызвали вопросы о полезности такого подхода.
Хотя VATS для наложения швов диафрагмальных дефектов эффективен для уменьшения плеврального выпота у пациентов с HH, остаточный или рецидивирующий плевральный выпот наблюдался клинически.122,123 Чтобы решить эту проблему, использование торакоскопической сетчатой накладки для предотвращения утечки асцита из зашитых отверстий в пациентам с рефрактерным ГГ.124 В недавней серии хирургических вмешательств Хуанг и др. 125 сообщили, что ГГ контролировали у всех 63 пациентов с рефрактерным ГГ, которым выполняли армирование торакоскопической сеткой для восстановления диафрагмальных дефектов (только сетчатое покрытие использовалось у 47 пациентов и использовалась сетка с наложением швов). у 16 пациентов). У четырех пациентов возник рецидив в среднем через 20,5 месяцев последующих обследований. Смертность в течение 1 месяца составила 9,5% (6 из 63 пациентов). Основное нарушение функции почек и показатели MELD были связаны с увеличением трехмесячной смертности у 16 пациентов.Основными причинами трехмесячной смертности были септический шок, острая почечная недостаточность, желудочно-кишечное кровотечение, печеночная энцефалопатия и ишемия кишечника. Хотя эти минимально инвазивные подходы кажутся обнадеживающими, требуется дальнейшая оценка в дополнительных опытных центрах для подтверждения этих результатов и подходов у этих хирургических пациентов из группы высокого риска.
Перитонеовенозное шунтирование или плевровенозное шунтированиеПеритонеовенозное шунтирование — это имплантируемое устройство, которое переносит асцит или гидроторакс в большой круг кровообращения через хирургически введенную подкожную пластиковую канюлю с односторонним клапаном давления.126 Сообщается, что это подходящее альтернативное лечение для лечения рефрактерного асцита. 126 Однако перитонеовенозный шунт для лечения ГГ использовался у ограниченного числа пациентов с противоречивыми результатами.127,128 Было отмечено, что более низкое давление в плевральная полость, чем в центральной вене в случае отсутствия асцита, обычно делает перитонеовенозный шунт неэффективным для лечения HH129. частая окклюзия привела других исследователей к выводу, что этот метод имеет ограниченную эффективность.128 Таким образом, от перитонеовенозного шунтирования для лечения ГГ отказались почти десять лет назад.
Альтернативный плевровенозный шунт Денвера включает однонаправленный насос, который вводился подкожно и дополнительно позволял внешнее ручное сжатие для перемещения жидкости.129,130 Таким образом, использование Денверского шунта показано в случаях, когда жидкость должна перемещаться против более высокого давления127,131. Его можно вводить чрескожно под местной анестезией, и при этом можно поддерживать проходимость шунта, можно управлять механической окклюзией и инфекцией с помощью ревизии шунта, а HH можно эффективно контролировать с помощью всего нескольких минут ежедневной прокачки.130,132,133 Однако полная аспирация плевральной жидкости может привести к плевритной боли в груди, и введение шунта необходимо выполнять с большой осторожностью, чтобы предотвратить воздушную эмболию.134 Сообщалось о нескольких случаях успешного длительного применения плевровенозного шунта Денвера при лечении ГГ. , в качестве «альтернативной» терапии для отдельных пациентов.131–133
Трансплантация печениТрансплантация печени является методом выбора при декомпенсированном циррозе и, таким образом, обеспечивает наилучшее лечение ГГ.1,135 Результат HH (рефрактерный или нет) после трансплантации печени очень благоприятный (таблица 3) .135 Xiol и др. 136 сообщили о 28 пациентах с HH по сравнению с контрольной группой из 56 пациентов с трансплантацией. Были рассмотрены пять пациентов с рефрактерным ГГ; ни один пациент не получал TIPS или дренирование плевральной трубки. ГГ сохранялся у 36% пациентов через месяц после трансплантации, но исчез у всех пациентов в течение 3 месяцев после трансплантации. Отдаленные результаты были сходными у пациентов с рефрактерным ГГ и у пациентов с неосложненным ГГ.Serste и др. 137 описали, что послеоперационные осложнения и выживаемость не различались в группе HH (n = 11) по сравнению с пациентами с напряженным асцитом и пациентами без HH (в обеих группах было n = 11), соответствующих по возрасту, полу, году жизни. трансплантат и тяжесть цирроза печени. Существенных различий в продолжительности ИВЛ, пребывания в отделении интенсивной терапии и стационара, частоты сепсиса и ранней послеоперационной смерти между тремя группами не наблюдалось. Годовая выживаемость также была аналогичной (64 ± 15% vs.91 ± 9% против 63 ± 15%). Endo и соавт. 138 сравнили результаты пациентов с (n = 36) и без (n = 201) неконтролируемым HH и массивным асцитом, требующим предоперационного дренирования, которым была проведена трансплантация печени. Они обнаружили, что частота послеоперационной бактериемии была выше (55,6 против 46,7%, P = 0,008), а показатели выживаемости через 1 и 3 года были ниже (1 год: 58,9 против 82,9%; 3 года: 58,9 против 77,7%). %; P = 0,003) у пациентов с неконтролируемым ГГ и массивным асцитом, чем у пациентов без него. Они предположили, что послеоперационный инфекционный контроль может быть важным средством улучшения результатов для пациентов с неконтролируемым ГГ и массивным асцитом, перенесших трансплантацию печени.Эти данные свидетельствуют о том, что трансплантация печени обеспечивает наилучшее окончательное лечение со значительной долгосрочной выживаемостью и ее следует рассматривать у всех пациентов.139
РезюмеHH является нечастым осложнением портальной гипертензии у пациентов с терминальной стадией заболевания печени. Хотя физиопатология ГГ до конца не выяснена, показано, что трансдиафрагмальное прохождение аскетической жидкости из брюшины в плевральную полость через многочисленные диафрагмальные дефекты является преобладающим механизмом в формировании ГГ.Хотя диагноз ГГ обычно может быть основан на клинических признаках у пациента с установленным циррозом и асцитом, который проявляется правосторонним плевральным выпотом, диагностический торацентез является обязательным для всех пациентов с плевральным выпотом, чтобы исключить наличие инфекции или альтернативного диагноз. В случаях, когда диагноз не определен, в частности, когда асцит не обнаружен или гидроторакс присутствует слева, могут быть полезны сцинтиграфические исследования сывороточного альбумина.Спонтанная бактериальная эмпиема, инфекция гидроторакса, может осложнить ГГ и увеличить заболеваемость и смертность. Лечение ГГ в первую очередь медикаментозное, с ограничением соли и диуретиками. Однако медикаментозное лечение этого состояния часто оказывается безуспешным, и трансплантация печени остается окончательной парадигмой лечения. Для пациентов, которые не являются кандидатами, и тех, кто ожидает трансплантации, терапевтический торакоцентез, ITPC, TIPS, плевродез и торакальная хирургия с помощью видео являются полезными инструментами для облегчения симптомов и предотвращения легочных осложнений у отдельных пациентов.
Конкурирующие интересыАвторы заявляют, что у них нет конкурирующих интересов.
Заболевание плевры: гидроторакс и гемоторакс печени
Болезнь плевры: гидроторакс и гемоторакс печени
1. Описание проблемы
Что нужно знать каждому врачу
Гидроторакс печени
Печеночный гидроторакс — это плевральный выпот, обычно более 500 мл, у пациента с циррозом без признаков первичного заболевания плевры, легких или сердца.Обычно эти излияния правосторонние, однако двусторонние или левосторонние излияния не редкость. У небольшого процента пациентов развивается гидроторакс при отсутствии асцита.
Гемоторакс
Гемоторакс определяется как кровь в плевральной полости.
Клинические особенности
Гидроторакс печени
Имеющиеся симптомы и признаки гидроторакса печени связаны с прямым сдавлением соседнего легкого. К ним относятся кашель, одышка, гипоксемия, боль в груди и утомляемость.Если она сопровождается лихорадкой и недомоганием, следует учитывать вторичную инфекцию плевральной жидкости, которая связана с повышенной смертностью.
Гемоторакс
Имеющиеся симптомы и признаки гемоторакса связаны с прямым сдавлением соседнего легкого. К ним относятся кашель, одышка, гипоксемия, боль в груди и утомляемость. Кроме того, если плевральное кровотечение быстрое, у пациента могут возникнуть симптомы и признаки острой кровопотери, включая шок. Если она сопровождается лихорадкой и недомоганием, следует учитывать вторичную инфекцию плевральной жидкости, которая связана с повышенной смертностью.
2. Управление в чрезвычайных ситуациях
Гидроторакс печени
Большой выпот может вызвать острые симптомы и признаки, требующие неотложной помощи. В некоторых случаях даже умеренный выпот может стать критическим из-за плохого сердечно-легочного резерва или из-за наличия другого острого процесса. В любом случае плевроцентез представляет собой необходимое первичное вмешательство.
Как правило, во время процедуры следует удалять не более 2 литров жидкости, чтобы избежать риска повторного расширения отека легких, потенциально опасного для жизни осложнения.В большинстве случаев удаление этого объема улучшит имеющиеся симптомы и признаки. Несмотря на то, что плевроцентез считается безопасным, возникают осложнения, включая гемоторакс, пневмоторакс, воздушную эмболию, эмпиему и кровохарканье.
ОИТ Гемоторакс
При подозрении на гемоторакс рекомендуется ранняя хирургическая консультация. Параметры свертывания следует немедленно измерить и скорректировать в случае отклонения от нормы. Важно убедиться, что у пациента есть упакованные эритроциты.Первоначальное лечение гемоторакса обычно включает введение плевральной трубки с целью эвакуации крови, повторного расширения легких и оценки дальнейшего кровотечения. Следует использовать плевральную дренажную трубку French 32-36 или больше, поскольку она обеспечивает лучший дренаж у взрослых; катетеры малого диаметра не рекомендуются.
После установки дренажной трубки необходимо получить повторную рентгенограмму грудной клетки, чтобы подтвердить положение трубки и оценить полноту эвакуации гемоторакса. Решение о хирургическом вмешательстве основывается как на скорости, так и на объеме кровотечения, измеряемом по выходу дренажной трубки и потребностям в переливании крови.Показания к последующему хирургическому вмешательству включают дренаж из плевральной дренажной трубки 1500 мл за 24 часа, накопление> 200 мл кровянистого дренажа в час в течение 2-4 часов и / или постоянные потребности в переливании крови для поддержания гемодинамической стабильности.
В зависимости от имеющегося опыта и ожидаемого источника кровотечения, проблему можно решить торакоскопически. Однако, как правило, торакотомия является распространенным подходом при наличии стойкого кровотечения, массивном гемотораксе или, конечно, если предполагается серьезное повреждение сосуда в качестве источника кровотечения.
3. Диагностика
Установление диагноза
Гидроторакс печени
У всех пациентов с плевральным выпотом следует исключить сердечную или легочную этиологию. Эхокардиография полезна для диагностики правожелудочковой недостаточности или перикардиального выпота. Всем пациентам с подозрением на гидроторакс печени следует проводить компьютерную томографию грудной клетки для выявления заболеваний легких, плевры или средостения, которые могут быть причиной скопления жидкости.
КТ также может выявить асцит, который, если он присутствует, может помочь в диагностике гидроторакса печени.Ультразвук печени полезен для выявления новообразований, а допплеровское исследование воротных и печеночных вен используется для оценки проходимости.
Торакоцентез — это диагностический тест выбора у пациентов с подозрением на гидроторакс печени. Анализ плевральной жидкости обычно выявляет транссудат. Хотя плевральная жидкость накапливается из перенесенного асцита, она может отличаться по концентрации общего белка и альбумина по сравнению с асцитом, вероятно, из-за различных абсорбционных свойств грудной плевры.
При подозрении на злокачественное новообразование следует провести цитологический анализ плевральной жидкости. У пациентов с лихорадкой, плевритной болью и / или энцефалопатией необходимо получить окраску жидкого грамма и посев, а также заподозрить парапневмонический выпот или инфекцию гидроторакса печени (спонтанная бактериальная эмпиема [SBEM]).
Критерии диагностики SBEM включают градиент сыворотки / плевральной жидкости> 1,1 г / дл, количество полиморфноядерных (PMN) лейкоцитов> 500 мм 3 или положительный посев жидкости при отсутствии пневмонии или сопутствующей инфекции.
Бактерии, обычно связанные со спонтанным бактериальным перитонитом (SBEM), аналогичны бактериям, обнаруживаемым при SBEM, и включают E. Coli, виды Streptococcus, Enterococcus, Klebsiella или Pseudomonas, и примерно 50% эпизодов SBEM связаны со спонтанным бактериальным перитонитом.
Внутрибрюшинная инъекция коллоида 99mTc-сульфер или 99mTc-сывороточного альбумина человека — это описанный метод, используемый для подтверждения диагноза гидроторакса печени. Пациентам проводят терапевтический торакоцентез с последующей внутрибрюшинной инъекцией радиоизотопа.Обнаружение маркера в плевральной полости подтверждает. Это редко бывает необходимо.
ОИТ Гемоторакс
Гемоторакс обычно диагностируется с использованием клинических и радиологических методов. Небольшой гемоторакс может быть трудно распознать клинически, а при аускультации грудной клетки можно не примечать. При большом или расширяющемся гемотораксе аускультация легких демонстрирует снижение звуков дыхания над пораженным полем легких с ассоциированной тупостью при перкуссии.
Сердечно-легочная нестабильность может развиваться частично из-за уменьшения объема циркулирующей крови и эффективного гематокрита.Сжатие легких и сердца может привести к увеличению объема крови в грудной клетке, что способствует сердечно-легочной нестабильности.
Рентген грудной клетки в вертикальном положении остается методом выбора при острой оценке гемоторакса. Для обнаружения гемоторакса на рентгенограмме грудной клетки в плевральной полости должно присутствовать 400-500 мл жидкости. Снимки на спине менее полезны для оценки количества жидкости в грудной клетке из-за наслоения жидкости. Практически всегда легче оценить накопление жидкости (или воздуха) на пленке в отделении интенсивной терапии, если рентгеновский снимок проводится в вертикальном, а не в положении лежа на спине пациента.
Боковые снимки на спине могут помочь отличить наслоенный выпот от ушибов легких или других внутрипаренхиматозных процессов. Врач должен иметь высокий индекс подозрения на гемоторакс, когда новый выпот виден на рентгенограмме грудной клетки после грудного вмешательства.
Ультразвук может быть полезен для определения наличия и количественного определения объема плевральной жидкости.
КТ грудной клетки — это высокоточное исследование для выявления и определения характеристик жидкости в плевральной полости.КТ позволяет различать паренхиматозный и плевральный отростки и может быть полезна для оценки стойких помутнений на рентгенограмме грудной клетки после торакостомии через зонд.
Нормальные лабораторные значения
Типичные результаты для плевральной жидкости при гидротораксе печени включают:
1. Количество клеток <1000 / см 3
2. Концентрация белка <2,5 г / дл
3. Количество полиморфноядерных лейкоцитов (PMN) <250 / мм 3
4. Соотношение общего белка в плевральной жидкости и сыворотке <0.5
5. Отношение лактатдегидрогеназы плевральной жидкости к сыворотке <0,6
6. Градиент плевральной жидкости / сывороточного альбумина> 1,1
7. pH> 7,4
8. Уровень глюкозы в плевральной жидкости аналогичен уровню сыворотки
Как мне узнать, что у пациента?
Гидроторакс печени следует подозревать у пациентов с портальной гипертензией и / или циррозом в анамнезе с плевральным выпотом. Асцит обычно присутствует наряду с другими признаками цирроза печени.
Дифференциальный диагноз
Необходимо рассмотреть альтернативные диагнозы при одностороннем или двустороннем плевральном выпоте.
Когда излияние одностороннее, Если у пациента наблюдается острая форма лихорадки и / или повышение уровня лейкоцитов, следует учитывать эмпиему или парапневмонический выпот, связанные с основной пневмонией. Если выпот находится слева, при лихорадке, особенно у алкоголиков, следует рассмотреть синдром Борхаве (разрыв пищевода).
После подтверждения наличия транссудата наиболее вероятной альтернативной этиологией является ЗСН или низкий уровень альбумина.Другие причины транссудативного выпота включают легочную эмболию, гипотиреоз и раннюю лимфатическую обструкцию. Дифференциация экссудативного выпота намного больше и включает воспалительные и злокачественные процессы.
4. Специальное лечение
Гидроторакс печени
Торакоцентез представляет собой первичное вмешательство, необходимое, когда симптомы или признаки срочно нуждаются в лечении. Если симптомы или признаки легкие и переносимые, то первым вмешательством должна быть медикаментозная терапия.Медикаментозное лечение гидроторакса печени должно в основном сосредоточиваться на борьбе с асцитом. Это достигается за счет постепенного уменьшения объема внеклеточной жидкости, но не за счет перфузии тканей.
Пациенты придерживаются диеты с ограничением натрия, пытаясь достичь отрицательного водного баланса с помощью диуретиков, включая спиронолактон и петлевой диуретик (фуросемид). Нестероидных противовоспалительных средств следует избегать из-за их активности по удержанию натрия и повышенного риска ОПН в этой популяции пациентов.Окончательное лечение гидроторакса печени требует лечения основной печеночной недостаточности, включая медикаментозное лечение трансплантации печени.
Когда медикаментозная терапия не контролирует выпот и он возвращается, показан торакоцентез. Если печеночный гидроторакс невосприимчив к медикаментозной терапии, обычно требуется повторное торакоцентез, однако продолжительность положительного эффекта может быть разной. Перед выполнением торакоцентеза полезно сделать рентген грудной клетки или компьютерную томографию, чтобы определить количество присутствующей жидкости.
Как правило, во время процедуры следует удалять не более 2 литров жидкости, чтобы избежать риска повторного расширения отека легких, потенциально опасного для жизни осложнения. Несмотря на то, что плевроцентез считается безопасным, возникают осложнения, включая гемоторакс, пневмоторакс, воздушную эмболию, эмпиему и кровохарканье.
Гемоторакс
См. Раздел «Экстренное лечение» для начального лечения гемоторакса.
Стойкая кровь, обнаруживаемая на рентгенограммах грудной клетки и компьютерной томографии после зонковой торакостомии, является независимым предиктором развития эмпиемы и требует лечения ранним ВАТС в течение 3-7 дней после госпитализации.
Кровь со временем имеет тенденцию к организации и образует толстую корку, которая может привести к «застреванию» нерасширяющегося легкого. На этом этапе требуется хирургическое вмешательство (видео-торакоскопия или торакотомия) для удаления кожуры для облегчения расширения легких. Ранняя торакоскопия (до 3-го дня) по поводу оставшегося гемоторакса была связана со снижением сложности операции, контаминации / инфицирования сгустка и продолжительности пребывания в больнице по сравнению с теми, которые выполнялись позже. Дополнительные преимущества включают меньшее количество легочных осложнений, более короткое время до выздоровления и меньшую длительную нетрудоспособность.
VATS может быть предпринята позже при ретенционном гемотораксе; тем не менее, процент перехода к открытой торакотомии увеличивается с более длительными задержками. Должен быть низкий порог для раннего направления к специалисту по очистке VATS, если у пациента сохраняется кровь, несмотря на адекватный дренаж через дренаж через дренажную дренажную трубку.
Сообщалось об использовании тромболитиков для лечения подострых (6-13-дневных) скоплений у пациентов с высоким риском торакотомии; однако хирургическое вмешательство является методом выбора, когда это возможно.
Огнеупорные футляры
Гидроторакс печени
У пациентов, которым требуется повторный плевроцентез, несмотря на максимальную медикаментозную терапию с частотой более чем каждые 2 недели, следует рассмотреть возможность проведения процедуры трансъюгулярного внутрипеченочного портосистемного шунта (TIPS). Процедура TIPS включает рентгеноскопическое размещение металлического стента в печени между воротной вене и печеночной венозной системой. Это приводит к снижению портального давления и последующему снижению образования асцита.
Симптоматическое улучшение отмечается у 70-80% пациентов с рефрактерным гидротораксом печени. Осложнения TIPS включают тромбоз шунта, печеночную энцефалопатию и обострение легочной гипертензии. Хотя TIPS может облегчить симптомы гидроторакса печени, его обычно считают «мостом» к трансплантации.
Следует ли ставить грудную трубку?
Нет, только не при неосложненном гидротораксе печени! Важно подчеркнуть, что, хотя дренаж плевральной дренажной трубки может обеспечить немедленное облегчение симптомов одышки у пациентов с печеночным гидротораксом, всегда следует избегать установки дренажной трубки.Это связано с последующим постоянным выводом через дренажную трубку большого объема, что приводит к значительному сдвигу жидкости, истощению белков и электролитов, риску инфицирования и кровотечения.
Является ли установка дренажной трубки после склероза вариантом лечения?
Нет! Установка грудной трубки с последующим введением склерозирующего агента (например, талька, тетрациклина) имеет ограниченный успех из-за быстрого накопления жидкости в плевральной полости, что препятствует висцерально-париетальной коаптации плевры и симфизу.Большой объем этих излишеств, обеспечивающий легкий путь выхода асцита, делает эти излияния невосприимчивыми к плевродезу. Поэтому ошибочно предполагать установку плевральной дренажной трубки с целью последующего выполнения плевродеза.
Если у пациента наблюдается одышка из-за выпота, временное облегчение может быть достигнуто с помощью плевроцентеза, так как начинается дальнейший контроль асцита, но установка дренажной трубки почти всегда является ошибкой.
Есть ли разумные варианты хирургического вмешательства?
Да.Сообщалось об успешных результатах использования талькового плевродеза с помощью видеоассистированной торакоскопии (VATS), хотя часто необходимы повторные процедуры. Сообщалось об успешном хирургическом лечении дефектов диафрагмы с хирургическим плевродезом или без него. Используя метод ВАТС, дефекты диафрагмы выявляются и закрываются наложением швов. Другие описанные методы включают восстановление ВАТС с использованием плеврального лоскута или армирования только сеткой.
Эти процедуры следует рассматривать как паллиативные и их можно попробовать как альтернативу частым торакоцентезам и TIPS.Плевродез и / или хирургическая пластика диафрагмы должны быть зарезервированы для пациентов, которым не удалось принять консервативные меры, и прежде чем рассматривать любой из этих подходов в качестве рационального варианта, необходимо учитывать повышенную заболеваемость и смертность при операциях у пациента с печеночной недостаточностью.
Сообщалось о случаях установки туннельного плеврокутанного катетера для лечения симптоматического гидроторакса печени. К преимуществам этого метода относятся простота введения и предотвращение повторного плевроцентеза и связанных с ним осложнений.Основной риск постоянного катетера связан с риском инфицирования, который может быть связан с повышенной смертностью в этой популяции пациентов.
Перитонеовенозный шунт (шунт Ле Вина) направляет асцит из брюшной полости в венозную систему и ранее использовался для лечения гидроторакса печени. Из-за их ограниченной эффективности и высокой частоты осложнений шунты Ле Вина больше не используются для лечения гидроторакса печени.
5. Мониторинг, наблюдение и лечение
Гидроторакс печени
После обследования гидроторакса печени за пациентом следует внимательно наблюдать в течение 24 часов на предмет повторения симптомов и признаков и осложнений, связанных с плевроцентезом.Что наиболее важно, рентгенография должна быть сделана вскоре после завершения процедуры, чтобы исключить пневмоторакс и оценить влияние удаления жидкости. HgB следует наблюдать в течение 6-24 часов, чтобы убедиться в отсутствии внутреннего кровотечения. Наконец, необходимо назначить медикаментозную терапию для контроля асцита, иначе излияние будет повторяться.
Гемоторакс
После установки плевральной дренажной трубки за пациентом следует внимательно наблюдать в течение 24 часов для оценки продолжающегося кровотечения и повторения сопутствующих симптомов и признаков.Вскоре после процедуры следует провести рентгенографию, чтобы оценить правильность размещения трубки и влияние удаления жидкости. Выход из грудной трубки следует определять каждые 1-2 часа, а уровень HgB следует проверять каждые 6-8 часов. Тщательное наблюдение должно продолжаться не менее 12-24 часов в зависимости от этиологии, объема и скорости кровотечения.
Последующие рентгеновские снимки грудной клетки и компьютерная томография должны быть выполнены для оценки очистки плевральной полости от крови, поскольку остаточная кровь, которая не может стекать после торакостомии через зонд, является независимым предиктором развития эмпиемы и требует лечения раннее ВАТС, в течение 3-7 дней после госпитализации.
Кровь со временем имеет тенденцию к организации и образует толстую корку, которая может привести к «застреванию» нерасширяющегося легкого. На этом этапе требуется хирургическое вмешательство (видео-торакоскопия или торакотомия) для удаления кожуры для облегчения расширения легких. Ранняя торакоскопия (до 3-го дня) по поводу оставшегося гемоторакса была связана со снижением сложности операции, контаминации / инфицирования сгустка и продолжительности пребывания в больнице по сравнению с теми, которые выполнялись позже. Дополнительные преимущества включают меньшее количество легочных осложнений, более короткое время до выздоровления и менее длительную нетрудоспособность.
VATS может быть предпринята позже при ретенционном гемотораксе; тем не менее, процент перехода к открытой торакотомии увеличивается с более длительными задержками. Должен быть низкий порог для раннего направления к специалисту по очистке VATS, когда у пациента сохраняется кровь, несмотря на адекватный дренаж через дренаж через дренажную дренажную трубку.
Сообщалось об использовании тромболитиков для лечения подострых (6-13-дневных) скоплений у пациентов с высоким риском торакотомии; однако хирургическое вмешательство является методом выбора, когда это возможно.
Патофизиология
Гидроторакс печени
Печеночный гидроторакс возникает в результате прямого прохождения асцита через небольшие дефекты диафрагмы, называемые фенестрациями. Эти фенестрации наблюдаются под микроскопом как разрывы пучков коллагена в сухожильной диафрагме. Асцит проталкивается через эти отверстия в плевральную полость вниз по градиенту давления от более высокого внутрибрюшного давления к более низкому внутриплевральному давлению.
Когда абсорбционная способность поверхности плевры нарушена, жидкость накапливается, что приводит к плевральному выпоту.Считается, что накоплению плевральной жидкости при гидротораксе печени способствуют дополнительные механизмы, включая гипоальбуминемию (снижение коллоидно-осмотического давления), перито-плевральный лимфатический дренаж и гипертонию из асиготных вен с утечкой плазмы, поскольку не у всех пациентов с этим заболеванием присутствует сопутствующий асцит.
Гемоторакс
Помимо травмы, большинство случаев гемоторакса в отделении интенсивной терапии связано с вмешательствами, включая торакоцентез, введение плевральной дренажной трубки, установку катетера по центральной линии или правому отделу сердца, а источник кровотечения обычно имеет венозное происхождение.Гемоторакс также возникает после торакальных и кардиохирургических вмешательств.
Торакоцентез часто выполняется у пациентов в отделении интенсивной терапии для оценки плевральной жидкости, а кровотечение, связанное с торакоцентезом, обычно незначительно и проходит без дополнительных вмешательств. Сильное кровотечение может возникнуть в результате разрыва межреберного сосуда.
Сообщалось о травмах селезенки и печени во время торакоцентеза; однако у этих пациентов чаще встречается внутрибрюшное кровотечение. Наличие в анамнезе нарушений свертываемости крови, приема антикоагулянтов и почечной недостаточности может увеличить риск кровотечения у пациентов, перенесших плевроцентез и другие инвазивные торакальные процедуры.
Гемоторакс после введения дренажной трубки — известное осложнение. Отток крови из плевральной дренажной трубки обычно является первым признаком осложнения вставочного кровотечения. Всегда следует получать рентгенограммы после установки дренажной трубки, чтобы подтвердить положение трубки и определить, были ли приняты во внимание показания к установке. Новое помутнение после установки трубки должно предупредить врача о повреждении паренхимы легких или о возможном развитии гемоторакса.
Чтобы избежать гемоторакса, связанного с грудной клеткой, антикоагулянтную терапию следует прекратить в подходящее время, а коагулопатию — по возможности, обратить вспять. Пневматическая трубка должна быть проложена прямо поверх желаемого ребра. Это снижает риск повреждения межреберной вены и артерии, лежащих в нижней части ребер. Может возникнуть мышечное кровотечение, которое обычно проходит самостоятельно; однако повреждение мышечных артериальных и венозных ветвей может привести к стойкому кровотечению, требующему хирургического вмешательства.
Установка центрального венозного катетера — это часто выполняемая процедура в интенсивной терапии. Подключичная вена расположена на вершине грудной клетки рядом с плеврой, и проникновение вены через свободную стенку может вызвать гемоторакс. Сообщалось о травмах яремной вены, подключичной артерии и правого предсердия, приводящих к гемотораксу. Венозное повреждение в месте соединения левой брахиоцефальной верхней полой вены иногда происходит при вставке левых внутренних яремных или подключичных линий.
Осложнения, связанные с введением катетера в легочную артерию, включают сердечную аритмию, пункцию сонной и подключичной артерий, катетер-ассоциированный сепсис и катетер-индуцированный разрыв легочной артерии (PA).Гемоторакс после разрыва ЛА, вызванного катетером, представляет собой опасное для жизни осложнение, связанное с высокой смертностью. Оптимальна экстренная торакотомия с восстановлением прямой травмы; однако для остановки кровотечения может потребоваться лобэктомия или пневмонэктомия.
Попытки избежать разрыва ЛА включают надувание баллона в крупные артерии перед продвижением катетера, минимизацию времени, проведенного в положении клина, и удаление воздуха из баллона до извлечения катетера.
Эпидемиология
NA
Прогноз
Гидроторакс печени
Прогноз пациентов с гидротораксом печени во многом зависит от основного заболевания печени.
Гемоторакс
Прогноз гемоторакса во многом зависит от причины. В случае травмы прогноз отличный. Если причиной гемоторакса является злокачественное новообразование, то прогноз мрачный и четко определяется злокачественным новообразованием.
Особые рекомендации для медсестер и смежных медицинских работников.
NA
Какие доказательства?
Гурунг, П., Голдблатт, М., Хаггинс, Дж. Т., Доелкен, П., Нитерт, П.Дж., Сан, С.А. «Анализ плевральной жидкости и рентгенографические, сонографические и эхокардиографические характеристики гидроторакса печени». Сундук. т. 140. 2011. С. 448-53. (В статье представлен подробный анализ жидкости пациентов, перенесших плевроцентез по поводу гидроторакса печени.)
Mercky, P, Sakr, L, Heyries, L. «Использование туннельного плеврального катетера для лечения рефрактерного гидроторакса печени: новый терапевтический вариант». Дыхание. т. 80. 2010. С. 348-352. (Авторы описывают успешное ведение пациента с гидротораксом печени с помощью туннельного катетера плеврекса)
Алонсо, JC.«Плевральный выпот при заболеваниях печени». Семинары по респираторной медицине и реанимации. т. 31. 2010. С. 698-705.
Гурунг, П., Голдблатт, М., Хаггинс, Дж. Т., Доелкен, П., Нитерт, П.Дж., Сан, С.А. «Анализ плевральной жидкости и рентгенографические, сонографические и эхокардиографические характеристики гидроторакса печени». Сундук. т. 140. 2011. С. 448-53.
Roussos, A, Philippou, N, Mantzaris, GJ, Gourgouliannis, KI. «Гидроторакс печени: патофизиологическая диагностика и лечение». Журнал гастроэнтерологии и гепатологии. т. 22. 2007. С. 1388–93. (Обзорная статья, посвященная патогенезу, клиническим проявлениям, диагностике и лечению гидроторакса печени).
Cerfolio, RJ, Bryant, AS. «Эффективность видеоассистированной торакоскопической хирургии с тальковым плевродезом при синдроме пористой диафрагмы у пациентов с рефрактерным гидротораксом печени». Анналы торакальной хирургии. т. 82. 2006. С. 457–9. (Авторы описывают хирургический подход с использованием видеоторакоскопии с тальковым плевродезом для лечения рефрактерного гидроторакса печени, который оказался успешным в борьбе с выпотами у 3/4 пациентов.)
ДюБозе, Дж., Инаба, К., Деметриадес, Д., Скалея, Т.М., О’Коннор, Дж., Менакер, Дж., Моралес, К., Константинидис, А., Шифлетт, А., Копвуд, Б. «Группа исследования сохраненного гемоторакса AAST. Ведение посттравматического ретенционного гемоторакса: проспективное обсервационное многоцентровое исследование AAST ». Журнал травматологической и неотложной хирургии. т. 72. 2012. С. 11–22. (В статье рассматриваются практические модели и факторы, влияющие на успешное ведение посттравматического ретинированного гемоторакса, и определяются предикторы необходимости торакотомии у этих пациентов).
Мауэри, Н.Т., Гюнтер, О.Л., Коллиер, Б.Р., Диас, Дж.Дж., Хаут, Э., Хилдрет, А., Холевар, М., Мэйберри, Дж., Стрейб, Э. «Практическое руководство по лечению гемоторакса и скрытого пневмоторакса». Журнал травм, травм, инфекций и интенсивной терапии. т. 70. 2011. С. 510-8.
Пневматикос, И., Бурос, Д. «Плевральные выпоты у тяжелобольных». Дыхание. т. 76. 2008. С. 241-8. (Авторы описывают оценку и лечение плеврального выпота у пациентов в критическом состоянии, уделяя особое внимание начальному и последующему лечению гемоторакса у этих пациентов).
Авторские права © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Гидроторакс — обзор | ScienceDirect Topics
Гидроторакс печени.
Гидроторакс печени определяется как рецидивирующий плевральный выпот у пациентов с терминальной стадией заболевания печени и портальной гипертензией при отсутствии сопутствующих заболеваний сердца или легких.Теории, предложенные для объяснения развития гидроторакса, включают трансдиафрагмальную утечку жидкости из лимфатических каналов и гипертонию непарных вен (Roussos etal, 2007). Однако с 1955 года было известно, что у тех, у кого гидроторакс, часто наблюдаются дефекты диафрагмы, которые позволяют асциту выходить в пространство отрицательного давления плевральной полости (Emerson & Davies, 1955). Было высказано предположение, что внутрибрюшное давление из-за асцита приводит к грыже брюшины через промежутки в диафрагмальной мышце, которые в конечном итоге прорываются в плевральную полость.Эта связь была дополнительно продемонстрирована путем отслеживания прохождения различных индикаторов от перитонеального к плевральным отделам и прямой тораскопической визуализации дефектов (Benet etal, 1992; Huang etal, 2005). Гидроторакс встречается редко; его зарегистрированная частота составляет от 5% до 12%, что очень похоже на частоту гидроторакса при непрерывном амбулаторном перитонеальном диализе (Lew, 2010). Выпоты в основном правосторонние, но могут быть левосторонними или двусторонними и могут быть обнаружены у пациентов с минимальным абдоминальным асцитом или без него.
Типичные респираторные симптомы, встречающиеся при гидротораксе, включают одышку, утомляемость и непродуктивный кашель. Связь между гипоксемией и гидротораксом более сложная. Гипоксемия требует несоответствия вентиляции и перфузии, и простое присутствие одного гидроторакса, даже одного достаточно большого, чтобы затемнить гемиторакс, не всегда приводит к гипоксемии в покое. При документальном подтверждении деоксигенации возможность основного острого или хронического паренхиматозного заболевания легких или гепатопульмонального синдрома следует рассматривать как причину гипоксемии, прежде чем связывать ее с гидротораксом.
Гидроторакс печени следует подозревать у любого пациента с циррозом и портальной гипертензией с плевральным выпотом. Диагностический торакоцентез следует выполнять в качестве отправной точки при обследовании. Печеночный гидроторакс является транссудативным по традиционным критериям. Отслеживание миграции альбумина, меченного технецием-99m, или коллоида серы было выполнено для установления диагноза гидроторакса, хотя на практике такие тесты используются редко. Скорее, диагноз целесообразен в условиях быстро рецидивирующего транссудативного выпота у пациента с портальной гипертензией, у которого были исключены другие заболевания, предрасполагающие к транссудативному выпоту.Если сомнения не исчезнут, измерение градиента венозного давления в печени может помочь подтвердить диагноз и исключить правостороннюю сердечную недостаточность.
Терапевтический торакоцентез безопасен и может обеспечить немедленное облегчение одышки. Для сравнения, торакостомии через зонд, также известной как установка плевральной дренажной трубки , следует избегать, если это вообще возможно. Основные осложнения, связанные с установкой дренажной трубки при гидротораксе, включают инфекцию и острую почечную недостаточность; последнее, вероятно, отражает потери в больших объемах.Размещение грудной трубки также связано с плохими результатами в небольших ретроспективных исследованиях (Orman & Lok, 2009).
Принципы лечения гидроторакса аналогичны принципам лечения асцита. Даже если эти методы лечения умеренно успешны, они могут оказаться недостаточными для облегчения симптомов, учитывая небольшую емкость плеврального пространства. В таких ситуациях СОВЕТЫ следует рассмотреть заранее. Хотя данные, подтверждающие роль TIPS при гидротораксе печени, не столь однозначны, как данные для рефрактерного асцита, сообщалось о благоприятных исходах (Badillo & Rockey, 2014; Dhanasekaran et al, 2010).Трансплантация печени также является эффективным средством лечения гидроторакса.
Хирургическое лечение дефектов диафрагмы было описано у небольшой группы пациентов (Mouroux etal, 1996; Yutaka etal, 2013), хотя оно может быть ограничено операционной заболеваемостью и смертностью у пациентов с терминальной стадией заболевания печени. Лечение гидроторакса особенно сложно у людей, которым TIPS противопоказан, и у тех, чей гидроторакс невосприимчив к TIPS. Одним из методов лечения рефрактерного гидроторакса являются туннельные плевральные катетеры (Harris & Chalhoub, 2012), которые используются для лечения рефрактерных злокачественных выпотов.Теоретически риск заражения снижается, поскольку катетеры имеют туннелирование и представляет собой закрытую систему. Кроме того, поскольку они предназначены для периодического использования, скорость потери жидкости можно контролировать.
|
Плевральный выпот: симптомы, причины, лечение
Обзор
Что такое плевральный выпот?
Плевральный выпот, иногда называемый «водой в легких», представляет собой скопление избыточной жидкости между слоями плевры вне легких.Плевра — это тонкие мембраны, выстилающие легкие и внутреннюю часть грудной полости, смазывая и облегчая дыхание. Обычно в плевре присутствует небольшое количество жидкости.
Серьезен ли плевральный выпот?
Серьезность состояния зависит от основной причины плеврального выпота, нарушения дыхания и возможности эффективного лечения. Причины плеврального выпота, которые можно эффективно лечить или контролировать, включают инфекцию, вызванную вирусом, пневмонию или сердечную недостаточность.Следует учитывать два фактора: лечение сопутствующих механических проблем, а также лечение основной причины плеврального выпота.
Симптомы и причины
Каковы симптомы плеврального выпота?
У некоторых пациентов с плевральным выпотом симптомы отсутствуют; это заболевание обнаруживается на рентгеновском снимке грудной клетки, выполненном по другой причине.У пациента могут быть несвязанные симптомы из-за заболевания или состояния, вызвавшего выпот. Симптомы плеврального выпота включают:
- Боль в груди
- Сухой непродуктивный кашель
- Одышка (одышка или затрудненное, затрудненное дыхание)
- Ортопноэ (невозможность легко дышать, если человек не сидит прямо или не стоит прямо)
Что вызывает плевральный выпот?
По данным Национального института рака, плевральные выпоты очень распространены: ежегодно в США диагностируется около 100 000 случаев.
В зависимости от причины избыток жидкости может быть бедным белком (транссудативный) или богатым белком (экссудативный). Эти две категории помогают врачам определить причину плеврального выпота.
Наиболее частые причины транссудативных (водянистых) плевральных выпотов включают:
Экссудативный (богатая белком жидкость) плевральный выпот чаще всего вызывается следующими причинами:
К другим менее частым причинам плеврального выпота относятся:
- Туберкулез
- Аутоиммунное заболевание
- Кровотечение (из-за травмы грудной клетки)
- Хилоторакс (вследствие травмы)
- Редкие инфекции грудной клетки и брюшной полости
- Асбестовый плевральный выпот (вследствие воздействия асбеста)
- Синдром Мейга (из-за доброкачественной опухоли яичника)
- Синдром гиперстимуляции яичников
Некоторые лекарства, абдоминальная хирургия и лучевая терапия также могут вызывать плевральный выпот.Плевральный выпот может возникать при нескольких типах рака, включая рак легких, рак груди и лимфому. В некоторых случаях сама жидкость может быть злокачественной (раковой) или может быть прямым результатом химиотерапии.
Диагностика и тесты
Как диагностируется плевральный выпот?
Тесты, наиболее часто используемые для диагностики и оценки плеврального выпота, включают:
Если плевральный выпот не диагностирован, несмотря на предыдущие, менее инвазивные тесты, можно провести торакоскопию.Торакоскопия — это минимально инвазивный метод, также известный как торакоскопическая хирургия с использованием видео, или VATS, выполняемый под общим наркозом, который позволяет визуально оценить плевру). Часто в этих случаях лечение выпота сочетается с диагностикой.
Ведение и лечение
Как лечится плевральный выпот?
- Лечение плеврального выпота зависит от основного состояния и от того, вызывает ли выпот серьезные респираторные симптомы, такие как одышка или затрудненное дыхание.
- Диуретики и другие лекарства от сердечной недостаточности используются для лечения плеврального выпота, вызванного застойной сердечной недостаточностью или другими медицинскими причинами. Злокачественный выпот также может потребовать лечения химиотерапией, лучевой терапией или инфузией лекарств в грудную клетку.
- Плевральный выпот, вызывающий респираторные симптомы, можно дренировать с помощью терапевтического торакоцентеза или через дренажную трубку (так называемая трубочная торакостомия).
- Пациентам с неконтролируемым плевральным выпотом или его рецидивом из-за злокачественного новообразования, несмотря на дренаж, склерозирующий агент (тип препарата, который намеренно вызывает рубцевание) может иногда закапываться в плевральную полость через трубчатую торакостомию для создания фиброза (чрезмерного фиброзного образования). ткань) плевры (склероз плевры).
- Склероз плевры, выполняемый с помощью склерозирующих агентов (таких как тальк, доксициклин и тетрациклин), на 50 процентов помогает предотвратить рецидив плеврального выпота.
Хирургия
Плевральный выпот, который невозможно вылечить с помощью дренажа или склероз плевры, может потребовать хирургического лечения.
К двум типам хирургии относятся:
Видеоассистированная торакоскопическая хирургия (VATS)
Минимально инвазивный подход, который выполняется через 1-3 небольших (приблизительно ½ дюйма) разрезов на груди.Эта процедура, также известная как торакоскопическая хирургия, эффективна при лечении плевральных выпотов, которые трудно дренировать или которые повторяются из-за злокачественной опухоли. Во время операции можно ввести стерильный тальк или антибиотик, чтобы предотвратить повторное накопление жидкости.
Торакотомия (также называется традиционной «открытой» торакальной хирургией)
Торакотомия выполняется через 6–8-дюймовый разрез на груди и рекомендуется при плевральных выпотах при наличии инфекции.Торакотомия выполняется для удаления всей фиброзной ткани и помогает вывести инфекцию из плевральной полости. Пациентам потребуется плевральная дренажная трубка в течение от 2 дней до 2 недель после операции, чтобы продолжить отток жидкости.
Ваш хирург внимательно оценит вас, чтобы определить наиболее безопасный вариант лечения, и обсудит возможные риски и преимущества каждого варианта лечения.
Ресурсы
Если вам нужна дополнительная информация или вы хотите записаться на прием к специалисту, свяжитесь с нами, поговорите в чате с медсестрой или позвоните медсестре по вопросам сердечно-сосудистой и торакальной медицины Miller Family по телефону 216.445.9288 или по бесплатному телефону 866.289.6911. Будем рады вам помочь.
Исследование одностороннего плеврального выпота у взрослых: Руководство Британского торакального общества по заболеваниям плевры, 2010 г.
Введение
Плевральный выпот — распространенная медицинская проблема с более чем 50 признанными причинами, включая заболевание, локальное для плевры или нижележащего легкого, системные состояния, дисфункцию органов и лекарственные препараты.1
Плевральный выпот возникает в результате повышенного образования жидкости и / или снижения резорбции жидкости.Точная патофизиология накопления жидкости зависит от основной этиологии. Поскольку дифференциальный диагноз одностороннего плеврального выпота обширен, необходим систематический подход к исследованию. Цель состоит в том, чтобы быстро установить диагноз, сведя к минимуму ненужные инвазивные исследования и облегчая лечение, избегая необходимости повторных терапевтических попыток, когда это возможно.
Со времени выпуска руководства 2003 г. было опубликовано несколько клинически значимых исследований, в которых были опубликованы новые рекомендации по визуализации плевральных процедур с очевидными преимуществами для комфорта и безопасности пациента, оптимальным отбором и обработкой плевральной жидкости и особой ценностью торакоскопической биопсии плевры.Это руководство также включает обзор последних данных об использовании новых биомаркеров, включая N-концевой натрийуретический пептид мозга (NT-proBNP), мезотелин и суррогатные маркеры туберкулезного плеврита.
Клиническая оценка и история болезни
Аспирацию не следует выполнять при двустороннем выпоте в клинических условиях, явно указывающих на наличие транссудата, за исключением случаев, когда имеются атипичные признаки или они не реагируют на терапию. (✓)
Во время клинической оценки необходимо собрать точный анамнез препарата.(✓)
Анамнез и физикальное обследование пациента с плевральным выпотом могут помочь клиницисту определить, является ли выпот транссудатом или экссудатом. Это важное различие сужает дифференциальный диагноз и требует дальнейшего исследования.
Одно только клиническое обследование часто позволяет выявить транссудативный выпот. Следовательно, в соответствующих клинических условиях, таких как левожелудочковая недостаточность с подтверждающим рентгеновским снимком грудной клетки, такие выпоты не нужно отбирать, если нет атипичных признаков или они не поддаются лечению.
Примерно 75% пациентов с тромбоэмболией легочной артерии и плевральным выпотом в анамнезе страдали плевритной болью. Эти выпоты, как правило, занимают менее одной трети гемиторакса, а одышка часто непропорциональна размеру выпота.2 3 Поскольку тесты плевральной жидкости не помогают при диагностике тромбоэмболии легочной артерии, требуется высокий индекс подозрения. чтобы не пропустить диагноз.
История лекарств пациента также важна. Некоторые лекарства, хотя и редко, могут вызывать экссудативный плевральный выпот (вставка 1).Полезные ресурсы для получения более подробной информации включают Британский национальный формуляр и веб-сайт http://www.pneumotox.com/.
Вставка 1 Обычно назначаемые препараты, которые, как известно, вызывают плевральный выпот (более 100 случаев зарегистрировано во всем мире)
Метотрексат
Амиодарон
Фенитоин
9
блокаторы 9 9 Источник: http: //www.pneumotox.com (2009) Должен быть задокументирован профессиональный анамнез, включая подробности известного или предполагаемого воздействия асбеста и потенциального вторичного воздействия через родителей или супругов. Алгоритм исследования одностороннего плеврального выпота показан на рисунке 1.
Рисунок 1Диагностический алгоритм исследования одностороннего плеврального выпота.
Первичная диагностическая визуализация
Обычная рентгенография
Обычно характерны простые рентгенографические признаки плеврального выпота.Задне-передний (PA) рентген грудной клетки не соответствует норме при наличии около 200 мл плевральной жидкости. Однако только 50 мл плевральной жидкости может вызвать заметное притупление заднего реберно-диафрагмального угла на латеральном рентгеновском снимке грудной клетки.4
В условиях интенсивной терапии большинство рентгеновских снимков грудной клетки выполняется как переднеприводное исследование в положении лежа на спине, в результате чего остается свободная плевральная жидкость. кзади в зависимой части грудной клетки. Следовательно, выпоты видны как увеличение непрозрачности гемиторакса с сохранением сосудистых теней на рентгеновском снимке в положении лежа на спине.Другие признаки включают потерю резкого силуэта ипсилатеральной гемидиафрагмы и просачивание жидкости в косые или горизонтальные трещины, что приводит к явному утолщению трещин. Объем плевральной жидкости обычно недооценивается на рентгенограмме грудной клетки в положении лежа на спине, и «нормальный» внешний вид не исключает наличия выпота.5
Подлегочный выпот возникает, когда плевральная жидкость накапливается между диафрагмальной поверхностью легкого и диафрагмой. Они часто являются транссудатами, их трудно диагностировать на пленке PA и может потребоваться ультразвуковое сканирование.Пленка PA часто показывает латеральный выступ явно поднятой гемидиафрагмы, которая имеет крутой боковой наклон с постепенным медиальным наклоном (см. Рисунок 2). Боковой рентгеновский снимок может иметь плоский вид задней части гемидиафрагмы с крутым наклоном вниз у большой трещины.6
Рисунок 2Рентгеновский снимок грудной клетки показывает умеренный плевральный выпот слева и субпульмонический выпот справа (a ). Обратите внимание на боковой выступ правого полушария. Воспроизведено с разрешения профессора Дэвида Милна из Оклендского университета.
Ультразвук
Прикроватный ультразвуковой контроль значительно увеличивает вероятность успешной аспирации плевральной жидкости и снижает риск прокола органа. (B)
Ультразвук обнаруживает перегородки плевральной жидкости с большей чувствительностью, чем КТ. (C)
Ультразвуковой контроль повышает скорость успешной аспирации плевры. Несколько исследований показали, что жидкость может быть успешно получена с помощью ультразвука у 88% пациентов после неудачной клинической и простой попытки рентгенологического исследования грудной клетки.7–9
Ультразвуковой контроль снижает частоту ятрогенного пневмоторакса после плевроцентеза, и несколько исследований показали, что этот эффект не зависит от размера выпота.10 11 Это преимущество, по-видимому, теряется, когда используется метод «X отмечает точку». Предположительно, из-за различий в расположении пациентов при УЗИ и процедуре.12
Клиническая оценка с обзором рентгеновского снимка грудной клетки сравнивалась с УЗИ при планировании места диагностической аспирации в проспективном исследовании, включающем 255 клинических оценок 67 пациентов. .4 Чувствительность и специфичность клинической оценки по сравнению с золотым стандартом ультразвука составила 76,6% и 60,3% соответственно. Ультразвук увеличил количество точных участков на 26%; 15% клинически определенных участков могли привести к пункции печени, селезенки или легкого, и, хотя возрастал риск при небольших или локализованных излияниях, 60% возможных проколов органов происходили в радиологически больших или умеренных излияниях.
Ультразвук превосходит простую рентгенографию в диагностике и количественной оценке плеврального выпота и отличает плевральную жидкость от утолщения с высокой специфичностью, особенно при использовании цветного допплера.13–16 Это особенно полезно при диагностике небольших выпотов или у лежачих пациентов (например, находящихся на ИВЛ и находящихся в критическом состоянии) из-за низкой чувствительности простой рентгенографии в этих ситуациях.
Диагностическая роль ультразвукового исследования грудной клетки в раннем исследовании плеврального выпота выходит за рамки идентификации и безопасной аспирации жидкости.
Ультразвук обнаруживает перегородки в плевральной жидкости с большей чувствительностью, чем компьютерная томография.17 Внешний вид перегородок может наблюдаться при злокачественных выпотах или плевральной инфекции и встречается с одинаковой частотой при обоих диагнозах.18
Ультразвук положительно идентифицирует экссудативный выпот, когда плевральная жидкость сложная, разделенная или эхогенная, хотя простые (анэхогенные) выпоты могут быть экссудатами или транссудатами. 19
Ультразвуковые признаки могут отличить злокачественные от доброкачественных выпотов. Qureshi и др. продемонстрировали 95% специфичность для злокачественного диагноза, 95% для париетального утолщения плевры> 1 см, 100% для висцерального утолщения плевры, 95% для утолщения диафрагмы> 7 мм и 100% для диафрагмальных узелков, как визуализировано при ультразвуковом исследовании. .20 Общая чувствительность ультразвука в дифференциации злокачественных опухолей от доброкачественных выпотов составила 79% (95% ДИ 61–91%), а специфичность 100% (95% ДИ 82–100%), при этом специфичность по сравнению с КТ-сканированием ( 89%).
Плевральная аспирация
Диагностический образец плевральной жидкости следует аспирировать с помощью иглы с тонким отверстием (21G) и шприца на 50 мл. (✓)
Прикроватный ультразвуковой контроль повышает вероятность успеха и снижает количество осложнений (включая пневмоторакс) и поэтому рекомендуется для диагностических целей.(B)
Плевральную жидкость всегда следует отправлять на протеин, лактатдегидрогеназу, окраску по Граму, цитологию и микробиологический посев. (C)
Это основное средство оценки плевральной жидкости, результаты которого используются для дальнейшего исследования.
УЗИ плевры следует использовать у постели больного, чтобы безопасно выбрать место аспирации плевры. Ультразвук увеличивает шансы на успешную аспирацию и сводит к минимуму необходимость в повторных попытках.21 Прямая аспирация под контролем ультразвука или ультразвуковое исследование у постели больного непосредственно перед процедурой предпочтительнее, чем метод «X отмечает точку». Боковой участок является предпочтительным при условии, что здесь показано адекватное количество жидкости на УЗИ, так как риск травмы межреберных сосудов увеличивается при большем количестве задних или медиальных проколов (см. Рисунок 3).
Рисунок 3Компьютерная томография (A) до и (B) через 2 дня после аспирации плевры с несоответствующим медиальным доступом и пункцией межреберной артерии с последующим гемотораксом, требующим хирургического вмешательства.Обратите внимание на активное кровотечение, указанное стрелкой.
Согласие пациента и другие технические детали плевральной аспирации описаны в руководстве по плевральным процедурам. В таблице 1 приведены инструкции по сбору образцов для конкретных тестов плевральной жидкости.
Зеленая игла (21G) и шприц на 50 мл подходят для диагностической аспирации плевры. Если есть диагностическое подозрение на плевральную инфекцию и необходимо измерить pH плевральной жидкости, аспирированную жидкость следует немедленно набрать в шприц с гепаринизированным газом крови, который затем следует закрыть колпачком в ожидании анализа, чтобы избежать попадания жидкости в воздух.Оставшуюся пробу следует разделить между емкостями для проб для микробиологического (5 мл), биохимического (2–5 мл) и цитологического (оставшаяся проба, которая должна быть 20–40 мл) анализа. Для всех проб плевральной жидкости необходимо провести микроскопическое исследование осадка плевральной жидкости, окрашенного по Граму. Если есть подозрение на инфекцию, часть плевральной жидкости следует отправить во флаконы для посева крови, что повысит диагностическую точность, особенно для анаэробных организмов.22
Существуют противоречивые данные относительно оптимального объема плевральной жидкости для диагностики злокачественных новообразований; Чувствительность зависит от клеточности образца и технологии обработки, а также от представленного объема.23 24 Разумно послать как можно больший объем пробы объемом 50–60 мл, полученной после диагностической аспирации, поскольку для других тестов требуются только небольшие объемы. При комнатной температуре образец для цитологического исследования следует отправить в лабораторию как можно быстрее, но, если ожидается задержка, образец можно хранить в холодильнике при 4 ° C на срок до 14 дней без ухудшения диагностической ценности злокачественных новообразований (таблица 1) .25
Таблица 1Анализы плевральной жидкости и руководство по сбору проб
Внешний вид
В таблице 2 обобщены данные о плевральных выпотах, вызванных определенными причинами.Жидкость может выглядеть серозной, с оттенком крови, откровенно кровянистой или гнойной. Центрифугирование мутной или молочной плевральной жидкости позволит различить эмпиему и липидный выпот. Если супернатант прозрачный, то мутная жидкость возникла из-за клеточного мусора и вероятна эмпиема, а если она все еще мутная, вероятен хилоторакс или псевдохилоторакс26. .
Таблица 2Диагностически полезные характеристики плевральной жидкости
Грубая кровянистая плевральная жидкость обычно возникает из-за злокачественной опухоли, эмболии легочной артерии с инфарктом, травмы, доброкачественных асбестовых плевральных выпотов или синдрома пост-сердечной травмы.27 28
Гемоторакс можно отличить от других кровянистых выпотов, выполнив гематокрит плевральной жидкости. Гематокрит плевральной жидкости> 50% гематокрита периферической крови пациента является диагностическим признаком гемоторакса.29
Дифференциация экссудата плевральной жидкости и транссудата
Критерии Лайта должны использоваться для различения экссудата плевральной жидкости и транссудата ( вставка 2). (B)
Чтобы применить критерии Лайта, необходимо измерить общий белок и лактатдегидрогеназу (ЛДГ) как в крови, так и в плевральной жидкости.(B)
Вставка 2 Критерии Лайта
Плевральная жидкость является экссудатом, если выполняется один или несколько из следующих критериев:
Белок плевральной жидкости, деленный на белок сыворотки, составляет> 0,5
Лактатдегидрогеназа (ЛДГ) плевральной жидкости, деленная на ЛДГ сыворотки, составляет> 0,6
ЛДГ плевральной жидкости> 2/3 верхних пределов лабораторных нормальных значений ЛДГ в сыворотке.
Отнесение плевральных выпотов к транссудатам и экссудатам — важный ранний шаг в сужении дифференциальной диагностики и направлении последующих исследований и лечения (см. Вставки 3 и 4).
Вставка 3 Причины плеврального транссудата
Очень частые причины
Левожелудочковая недостаточность
Цирроз печени
Реже причины
Гипотиреоз
Нефротический синдром
Митральный стеноз
Редкие причины
Вставка 4 Причины плевральных экссудатов
Box 4 Причины плеврального экссудата
Туберкулез
3 9902 9
Менее распространенные причины
Легочная эмболия
Ревматоидный артрит и другой аутоиммунный плеврит
9090 Доброкачественный асбест 0002 Панкреатит
Пост-инфаркт миокарда
Посткоронарное шунтирование
Редкие причины
Классически белок плевральной жидкости> 30 г / л показал экссудат 30 г / л транссудат.Эта классификация не точна, если уровень сывороточного белка не соответствует норме или когда белок плевральной жидкости близок к 30 г / л, и, поскольку это очень распространено, всегда рекомендуется применение критериев Лайта.30
Значительное количество других биохимических маркеров сравнивались с критериями Лайта, но последний, с диагностической точностью 93–96%, остается надежным методом.31 32 Эта дискриминационная точность вряд ли будет превзойдена в качестве «золотого стандарта» для сравнения в клинической диагностике, которая сама по себе несет частота ошибок.
При застойной сердечной недостаточности диуретическая терапия увеличивает концентрацию белка, лактатдегидрогеназы (ЛДГ) и липидов в плевральной жидкости, и в этом контексте признано, что критерии Лайта ошибочно классифицируют значительную часть выпотов как экссудаты.33 34
Хотя было предложено использование непрерывных отношений правдоподобия, а не дихотомического разделения транссудатов и экссудатов, в частности, для преодоления потери точности критериев Лайта, когда уровни плеврального белка и ЛДГ близки к пороговым значениям, вероятно, в этом громоздком виде мало пользы. статистический метод, выходящий за рамки тщательной интерпретации результатов испытаний в свете клинической оценки.35
N-концевой натрийуретический пептид мозга (NT-proBNP)
NT-proBNP является чувствительным маркером как систолической, так и диастолической сердечной недостаточности. Уровни в крови и плевральной жидкости тесно коррелируют, и в нескольких сериях было показано, что их измерение эффективно в различении транссудатов, связанных с застойной сердечной недостаточностью, от других транссудативных или экссудативных причин.36–39 Однако пороговое значение этих исследований: варьировала в широких пределах от 600 до 4000 пг / мл (наиболее часто использовалось 1500 пг / мл), и из большинства исследований исключались пациенты с более чем одной возможной этиологией выпота.Было показано, что NT-proBNP правильно диагностирует застойную сердечную недостаточность как причину большинства излишеств, которые были ошибочно классифицированы как экссудаты по критериям Лайта. Таким образом, использование этого теста позволяет избежать повторных инвазивных исследований у пациентов с сильным клиническим подозрением на сердечную недостаточность.40–42 Поскольку результаты с плевральной жидкостью и кровью сопоставимы, достаточно применить тест только к крови (см. Доступную таблицу доказательств A. на сайте BTS www.brit-thoracic.org.uk).
Доказательства использования измерения BNP (также известного как C-концевой BNP, активный пептид, от которого отщепляется NT-proBNP) на сегодняшний день относительно немногочисленны.
Дифференциальное количество клеток плевральной жидкости
Пропорции клеток плевральной жидкости помогают сузить дифференциальный диагноз, но ни один из них не является специфическим для заболевания. (C)
Любой длительный плевральный выпот имеет тенденцию заселяться лимфоцитами. Злокачественные новообразования плевры, сердечная недостаточность и туберкулез являются частыми специфическими причинами излияния с преобладанием лимфоцитов. (C)
Если дифференциальное количество клеток в плевральной жидкости показывает преобладающий лимфоцитоз (> 50% клеток составляют лимфоциты), наиболее вероятными диагнозами во всем мире являются злокачественные новообразования и туберкулез (ТБ).43 Сердечная недостаточность также является частой причиной лимфоцитарного выпота. Очень высокая пропорция лимфоцитов (> 80%) чаще всего встречается при туберкулезе, лимфоме, хроническом ревматоидном плеврите, саркоидозе и поздних выпотах после коронарного шунтирования (АКШ) (см. Вставку 5) .44
Вставка 5 Причины лимфоцитарных плевральных выпотов (т.е. лимфоциты составляют> 50% ядерных клеток)
Плевральные выпоты с преобладанием нейтрофилов связаны с острыми процессами. Они возникают при парапневмонических выпотах, тромбоэмболии легочной артерии, остром туберкулезе и доброкачественных асбестовых плевральных выпотах.28 45
Плевральные выпоты, в которых ≥10% клеток являются эозинофилами, определяются как эозинофильные.46 Наиболее частой причиной эозинофилии плевральной жидкости является воздух или кровь в плевральном пространстве.47 Плевральная эозинофилия является относительно неспецифической находкой, поскольку она может возникать при парапневмонических выпотах, медикаментозном плеврите, доброкачественных асбестовых плевральных выпотах, синдроме Чарджа-Стросса, лимфоме, инфаркте легкого и паразитарных заболеваниях.48 49 Злокачественные новообразования также являются частой причиной; злокачественный диагноз был поставлен в 37% из 60 эозинофильных выпотов в одной серии.46
pH
При негнойных выпотах при подозрении на плевральную инфекцию следует измерять pH плевральной жидкости при условии соблюдения соответствующей техники сбора и наличия анализатора газов крови. (B)
Включение воздуха или местного анестетика в образцы может значительно изменить результаты pH, и этого следует избегать. (B)
При парапневмоническом выпоте pH <7,2 указывает на необходимость дренажа через трубку.(B)
Ацидоз плевральной жидкости (pH <7,30) возникает при злокачественных выпотах, осложненной плевральной инфекции, заболеваниях соединительной ткани (особенно ревматоидном артрите), туберкулезных плевральных выпотах и разрыве пищевода и, по отдельности, не делает различий между эти причины.50
Ацидоз плевральной жидкости отражает увеличение выработки молочной кислоты и углекислого газа из-за локального повышения метаболической активности, а также снижение потока ионов водорода через аномальные плевральные мембраны.Повышенное потребление глюкозы без замены в тех же условиях означает, что плевральная жидкость часто имеет как низкий pH, так и низкую концентрацию глюкозы.51
При злокачественных плевральных выпотах низкий pH был связан с более короткой выживаемостью, более обширным заболеванием и меньшими шансами на успех. плевродез.52 Метаанализ с участием 417 пациентов со злокачественными плевральными выпотами показал, что рН плевры <7,28 был связан со средней выживаемостью 2,5 месяца и 3-месячной выживаемостью 38.9% (95% ДИ от 31,1% до 46,8%) по сравнению со средней выживаемостью 4,3 месяца и 3-месячной выживаемостью 61,6% (95% ДИ от 55,7% до 67,4%), если pH был> 7,28,53
В клинических условиях На практике наиболее важным показателем pH плевральной жидкости является принятие решения о лечении плевральной инфекции с помощью дренажа через трубку. Мета-анализ исследований, изучающих pH плевры и необходимость дренирования плевральной трубки или хирургического вмешательства у пациентов с парапневмоническим выпотом, показал, что pH <7,2 был наиболее специфическим дискриминатором осложненной плевральной инфекции.54 Это подробно описано в руководстве по инфекциям плевры.
Было показано, что при локализованных парапневмонических выпотах pH жидкости значительно различается между локулами, так что pH> 7,2 у пациента с другими клиническими показателями осложненной плевральной инфекции следует рассматривать с осторожностью.55
Техника сбора и анализа может иметь клинически значимое влияние на результаты pH плевральной жидкости. Проспективное исследование показало, что контакт жидкости с воздухом в шприце увеличивает измеренный pH плевральной жидкости на ≥0.05 в 71% проб и включение 0,2 мл местного анестетика привело к снижению pH в среднем на 0,15 (95% ДИ от 0,13 до 0,18) .56 Плевральную жидкость следует собирать и транспортировать без воздействия атмосферного воздуха, а местный анестетик следует избегать для диагностики стремления, когда pH будет использоваться для руководства. PH плевры существенно не меняется, если обработка откладывается до часа при комнатной температуре. Следует использовать газоанализатор артериальной крови.57 В повседневной клинической практике часто бывает трудно соблюдать эти требования к сбору, и, если они не могут быть выполнены, общая клиническая оценка может быть предпочтительнее, чем полагаться на субоптимальный результат pH плевральной жидкости.
Глюкоза
При отсутствии патологии плевры глюкоза свободно диффундирует через плевральную мембрану, и концентрация глюкозы в плевральной жидкости эквивалентна концентрации глюкозы в крови.1
Низкий уровень глюкозы в плевральной жидкости (<3,4 ммоль / л) может быть обнаружен в осложненный парапневмонический выпот, эмпиема, ревматоидный плеврит и плевральный выпот, связанный с туберкулезом, злокачественными новообразованиями и разрывом пищевода.1 Наиболее частыми причинами очень низкого уровня глюкозы в плевральной жидкости (<1,6 ммоль / л) являются ревматоидный артрит и эмпиема.58 59
Хотя уровень глюкозы обычно низкий при плевральной инфекции и коррелирует со значениями pH плевральной жидкости, для дренажа плевральной жидкости это значительно менее точный индикатор, чем pH. 54
При измерении глюкозы в плевральной жидкости образец следует отправить в лабораторию. трубка с фторидоксалатом.
Амилаза
Регулярные измерения амилазы плевральной жидкости или ее изоферментов не требуются. Однако он может быть полезен при подозрении на разрыв пищевода или излияния, связанные с заболеваниями поджелудочной железы.(C)
Уровни амилазы в плевральной жидкости повышаются, если они превышают верхний предел нормы для сыворотки или соотношение плевральная жидкость / сыворотка> 1,0.60 Это указывает на острый панкреатит, псевдокиста поджелудочной железы, разрыв пищевода. , прерванная внематочная беременность или злокачественное новообразование плевры (особенно аденокарцинома) .61 62 Приблизительно в 10% злокачественных выпотов повышен уровень амилазы плевральной жидкости 63, хотя оценка амилазы плевры, вероятно, не играет никакой роли в рутинном исследовании злокачественных выпотов.64
Анализ изоферментов может быть полезен, но не во многих лабораториях. Повышение уровня амилазы в слюне предполагает разрыв пищевода или злокачественное новообразование.61 62 Плевральный выпот, связанный с заболеванием поджелудочной железы, обычно содержит панкреатическую амилазу.61 Частота плеврального выпота при остром панкреатите превышает 50%. Пациенты с острым панкреатитом и плевральным выпотом, как правило, имеют более тяжелое заболевание и более высокую вероятность последующего развития псевдокисты, чем пациенты без выпота.65 Если разрыв пищевода рассматривается как дифференциальный диагноз, показано срочное более конкретное исследование с помощью контрастной рентгенографии или эндоскопии.
Имеется немного данных относительно измерения липазы плевральной жидкости, хотя в отчетах о случаях плеврального выпота, вторичного по отношению к панкреатиту, описано ее повышение наряду с амилазой.66
Цитология
Злокачественные выпоты могут быть диагностированы с помощью цитологического исследования плевральной жидкости примерно 60% случаев. (B)
Выход более двух образцов (взятых в разных случаях) очень низок, и этого следует избегать.(B)
Иммуноцитохимия должна использоваться для дифференциации типов злокачественных клеток и может иметь очень важное значение при проведении онкологической терапии. (C)
При подозрении на злокачественное новообразование цитологическое исследование плевральной жидкости является быстрым и малоинвазивным способом постановки диагноза. В сериях, посвященных диагностике злокачественных новообразований плевральной цитологии, сообщается о средней чувствительности около 60% (диапазон 40–87%) 67–70 Выход более двух образцов плевральной жидкости, взятых в разных случаях, является низким.Одно исследование показало, что выход составляет 65% от первого образца, еще 27% от второго и только 5% от третьего70. Диагностическая ценность злокачественных новообразований зависит от подготовки образца, опыта цитолога и типа опухоли. Уровень диагностики аденокарциномы выше, чем для мезотелиомы, плоскоклеточного рака, лимфомы и саркомы.
Swiderek et al обнаружили, что отправка образца плевральной жидкости объемом 60 мл дает значительно лучшую чувствительность для диагностики злокачественных новообразований, чем 10 мл, но предыдущие исследования показали, что отправка объемов> 50 мл не улучшила диагностический результат.23 24 Доказательства отправки больших объемов плевральной жидкости недостаточно убедительны, чтобы оправдать повышенный риск осложнений, связанных с использованием венфлона и трехходового крана для начальной диагностической аспирации. На цитологию следует отправить как можно больше жидкости из доступного диагностического образца (вероятно, 20-40 мл), и, если первоначальный результат отрицательный, но есть подозрение на злокачественное новообразование, следует отправить образец большего объема после второй аспирации. считается. Если первоначальная аспирация является одновременно лечебной и диагностической, необходимо отправить ≥60 мл на цитологическое исследование.
Плевральную жидкость следует отправлять в простом контейнере, который позволяет клеточной части отделяться, образуя фибринозный «сгусток», который может окутывать злокачественные клетки. Затем они могут быть подвергнуты гистологическому исследованию и сообщены с помощью цитологического исследования жидкости. Некоторые департаменты, однако, предпочитают использовать флаконы, содержащие цитрат натрия, чтобы клетки оставались в свободной суспензии. Не следует использовать никакие другие антикоагулянты или консерванты, так как они могут нарушить клеточную адгезию к предметным стеклам и иммуноцитохимический анализ.
Выявление злокачественных новообразований увеличивается, если из образцов плевральной жидкости готовят как клеточные блоки (которые формируются путем центрифугирования образца и извлечения твердой клеточной части), так и мазки.71
В таблице 3 представлена интерпретация обычных отчетов цитологического исследования плевральной жидкости. в клинической практике.
После морфологического подтверждения злокачественности следует использовать иммуноцитохимию для дифференциации различных типов злокачественных клеток. Это может быть выполнено на цитологическом образце, клеточном блоке или сгустке.72 Существует особенно обширное морфологическое совпадение между злокачественной мезотелиомой и метастатическими клетками аденокарциномы, и иммуноцитохимия может помочь в их дифференцировке. Однако, по возможности, следует получить плевральную ткань для подтверждения диагноза злокачественной мезотелиомы.
Если при морфологическом исследовании подозревается лимфома, в идеале образец следует отправить на проточную цитометрию для дальнейшего типирования, но можно использовать иммуноцитохимический анализ, если он недоступен (таблица 3).73
Таблица 3Отчетность результатов цитологии плевральной жидкости
Онкомаркеры
На уровне отсечения, который обеспечивает 100% специфичность для диагностики злокачественных новообразований, панель маркеров опухолей плевральной жидкости, включая CEA, CA-125, CA 15 -3 и CYFRA достигают комбинированной чувствительности только 54%, так что отрицательный результат не может использоваться для поддержки консервативного подхода к мониторингу и исследованию.74
Мезотелин, однако, показал более многообещающие диагностические возможности. характеристики (см. таблицу доказательств B, доступную на веб-сайте BTS по адресу www.brit-thoracic.org.uk).
Мезотелин
Мезотелин — гликопротеиновый онкомаркер, который присутствует в более высоких средних концентрациях в крови и плевральной жидкости пациентов со злокачественной мезотелиомой, чем у пациентов с другими причинами плеврального выпота.75 76 Исследования, изучающие уровни мезотелина в сыворотке и / или плевральная жидкость продемонстрировала чувствительность 48–84% и специфичность 70–100% для диагностики мезотелиомы.75–80 Прогностическая ценность отрицательного теста ограничена ложноотрицательными результатами при саркоматоидной мезотелиоме.79 Положительные результаты были также получены при бронхогенной аденокарциноме, метастатической карциноме поджелудочной железы, лимфоме и карциноме яичников.76 78 81
Положительный уровень мезотелина в сыворотке или плевральной жидкости с большой вероятностью указывает на злокачественность плевры и может быть использован для ускорения тканевой диагностики, но отрицательный результат нельзя считать обнадеживающим. Было показано, что мезотелин плевральной жидкости имеет дополнительную ценность помимо цитологии плевральной жидкости в диагностике мезотелиомы и может использоваться из-за его положительной прогностической ценности для уточнения неопределенных результатов цитологии.80 Хотя мезотелин имеет более высокую диагностическую точность, чем другие опухолевые маркеры, его реальная клиническая полезность при исследовании недиагностированного плеврального выпота, особенно в сочетании с рутинной клинической и радиологической оценкой, требует дальнейшего изучения, прежде чем его использование может быть рекомендовано на регулярной основе.
Дальнейшая диагностическая визуализация
Компьютерная томография (КТ)
КТ-сканирование плеврального выпота должно выполняться с контрастированием плевры и до полного дренирования плевральной жидкости.(C)
Компьютерная томография должна выполняться при исследовании всех недиагностированных экссудативных плевральных выпотов и может быть полезна для отличия злокачественного от доброкачественного утолщения плевры. (C)
Компьютерная томография должна быть запрошена при осложненной плевральной инфекции, когда первоначальный дренаж через трубку оказался неудачным и следует рассмотреть возможность хирургического вмешательства. (C)
При исследовании плеврального выпота перед полным дренированием жидкости необходимо выполнить КТ грудной клетки с контрастным усилением, так как аномалии плевры будут лучше визуализированы.82 Свободно текущая плевральная жидкость представляет собой серповидное помутнение в наиболее зависимой части грудной клетки. Подвешенные пузырьки воздуха в жидкости предполагают наличие перегородок (рисунок 4), но КТ не различает внутренние характеристики плевральной жидкости с той же чувствительностью, что и ультразвук.17
Рисунок 4КТ-сканирование левой эмпиемы с усилением плевры (а) и взвешенным воздухом пузыри (б).
КТ особенно полезна при диагностике эмпиемы, когда плевра интенсивно увеличивается вокруг жидкости, которая обычно образует линзовидное помутнение (рис. 4).83 84 КТ также отличает эмпиемы от абсцессов легких.
Существуют функции КТ грудной клетки с контрастным усилением, которые могут помочь отличить доброкачественные заболевания от злокачественных (рис. 5). В исследовании 74 пациентов, 39 из которых имели злокачественное заболевание, Leung et al показали, что злокачественному заболеванию способствует узловое утолщение плевры, утолщение плевры средостения, пристеночное утолщение плевры> 1 см и периферическое утолщение плевры. Эти особенности имели специфичность 94%, 94%, 88% и 100% соответственно и чувствительность 51%, 36%, 56% и 41%.85 Точность критериев Leung et al для выявления злокачественного новообразования плевры была подтверждена в нескольких проспективных исследованиях. 82 86 Дифференцировать мезотелиому плевры от метастатической злокачественной опухоли плевры очень сложно, поскольку эти состояния имеют много общих черт КТ.
Рисунок 5Злокачественный плевральный выпот справа с увеличивающимся узловым утолщением плевры (a), распространяющимся на средостение (b).
Магнитно-резонансная томография (МРТ)
МРТ точно различает доброкачественные и злокачественные плевральные выпоты по разнице в интенсивности сигнала на Т2-взвешенных изображениях.87 В некоторых исследованиях было показано, что различие морфологических признаков злокачественного новообразования плевры с помощью МРТ приравнивается к КТ, а оценка поражения диафрагмы и грудной стенки лучше. в это время, но может использоваться для точной оценки заболевания плевры у пациентов, которым противопоказан контраст. МРТ с динамическим контрастированием показала многообещающие результаты в мониторинге реакции мезотелиомы плевры на химиотерапию.89
ПЭТ-КТ
Хотя было показано, что поглощение 18-фтордезоксиглюкозы (ФДГ) больше при злокачественных плевральных выпотах, ценность ПЭТ-КТ-изображений в различении доброкачественных и злокачественных заболеваний ограничивается ложноположительными результатами у пациентов с воспалением плевры, включая плевральную инфекцию и последующий плевродез талька.90–92 ПЭТ-КТ в настоящее время не играет роли в рутинном исследовании плевральных выпотов, но, как и в случае с динамической МРТ с контрастным усилением, появляются новые данные, указывающие на потенциальную роль в мониторинге реакции на лечение мезотелиомы плевры.93–95
Инвазивные исследования
Чрескожная биопсия плевры
При исследовании недиагностированного выпота, при котором подозревается злокачественное новообразование и на КТ с контрастным усилением показаны узловые участки плевры, для чрескожной биопсии плевры используется режущая игла под визуальным контролем. метод выбора. (A)
Пункционная биопсия по Абрамсу полезна только с диагностической точки зрения в областях с высокой заболеваемостью туберкулезом, хотя было показано, что режущие иглы для торакоскопии и визуализации имеют более высокую диагностическую ценность.(C)
Обзор результатов биопсии плевры по Абрамсу на основании 2893 обследований показал, что частота диагностики злокачественных новообразований составляет только 57 %.96 Выход по сравнению с одной только цитологией плевральной жидкости увеличивается только на 7–27% для злокачественных новообразований.68 69 Осложнения биопсии плевры по Abrams включают боль в месте (1–15%), пневмоторакс (3–15%), вазовагальную реакцию (1–5%), гемоторакс (<2%), гематому в месте расположения (<1%), преходящую лихорадку ( <1%) и, очень редко, смерть в результате кровотечения.
КТ грудной клетки с контрастным усилением пациента с плевральным выпотом часто выявляет очаговую область аномальной плевры.Биопсия с помощью режущей иглы под контролем изображения позволяет провести биопсию этой очаговой области аномалии. Он имеет более высокую эффективность, чем слепая биопсия плевры при диагностике злокачественных новообразований. Этот метод особенно полезен для пациентов, которые не подходят для торакоскопии.
Злокачественные отложения плевры, как правило, преобладают вблизи средней линии и диафрагмы, которые лучше всего избегать при выполнении биопсии Абрамса. Тем не менее, эти анатомические области можно безопасно биопсировать под рентгенологическим исследованием.В недавнем проспективном исследовании 33 пациентам с плевральным выпотом и утолщением плевры, продемонстрированным на КТ с контрастным усилением, была проведена чрескожная биопсия плевры под визуальным контролем. Правильный гистологический диагноз был поставлен у 21 из 24 (чувствительность 88%, специфичность 100%), в том числе у 13 из 14 пациентов с мезотелиомой (чувствительность 93%) .97 В более крупном ретроспективном обзоре биопсии плевры под визуальным контролем в одном отделении, выполненной одним рентгенологом , 18 из 21 случая мезотелиомы были правильно идентифицированы (чувствительность 86%, специфичность 100%).98
Было показано, что биопсия с режущей иглой под визуальным контролем превосходит биопсию с иглой Абрамса по диагностической ценности злокачественных заболеваний. В рандомизированном контролируемом исследовании 50 последовательных пациентов с подозрением на злокачественный плевральный выпот с отрицательным цитологическим исследованием, биопсия Абрамса правильно диагностировала злокачественные новообразования у 8/17 (чувствительность 47%, специфичность 100%, отрицательная прогностическая ценность 44%, положительная прогностическая ценность 100%) и КТ. — биопсия под контролем правильно диагностировала злокачественное новообразование у 13/15 (чувствительность 87%, специфичность 100%, отрицательная прогностическая ценность 80%, положительная прогностическая ценность 100%).99
В проспективном исследовании, сравнивающем торакоскопию под местной анестезией с биопсией Абрамса в области с высокой распространенностью ТБ, было обнаружено, что торакоскопия 100 имеет комбинированную чувствительность посева / гистологии 100% по сравнению с 79% для биопсии плевры Абрамса. Таким образом, торакоскопия с местной анестезией является методом с наивысшим уровнем диагностики туберкулезного плеврита на основании опубликованных данных. Однако, поскольку слепая биопсия плевры имеет достаточно высокую чувствительность и, вероятно, будет более рентабельной в качестве первоначальной диагностической процедуры, она часто будет процедурой первого выбора в районах с ограниченными ресурсами с высокой заболеваемостью туберкулезом.Слепая биопсия плевры не может быть оправдана для диагностики ТБ, когда заболеваемость недостаточно высока для поддержания опыта оператора (см. Таблицу доказательств C, доступную на веб-сайте BTS по адресу www.brit-thoracic.org.uk).
Торакоскопия
У пациентов с симптоматическим экссудативным плевральным выпотом, когда диагностическая аспирация плевры отрицательна или неубедительна, торакоскопия предлагается в качестве следующего исследования выбора, поскольку процедура будет относительно несложной и будет показан плевродез.
Торакоскопия с местной анестезией
Торакоскопия с местной анестезией может выполняться врачами или хирургами и является безопасной и хорошо переносимой процедурой. Серьезные осложнения (например, эмпиема, кровотечение и пневмония) встречаются только у 2,3% (95% ДИ от 1,9% до 2,8%), а смерть встречается редко — 0,40% (95% ДИ от 0,2% до 0,7%). Он имеет диагностическую чувствительность при злокачественном заболевании плевры 92,6% (95% ДИ от 91,0% до 93,9%) 101–121. Он также имеет более высокую диагностическую ценность, чем слепая биопсия плевры при туберкулезном плеврите.В конце процедуры можно ввести тальк, который обеспечивает успешный плевродез в 80–90% случаев (более подробную информацию см. В руководстве BTS по торакоскопии.
Торакоскопическая хирургия с видеосъемкой (VATS)
Выполняется торакальными хирургами и требует общей анестезии. Следовательно, она не подходит для слабых людей и людей с другими тяжелыми сопутствующими заболеваниями. Эта процедура сообщает о столь же высоких показателях диагностической чувствительности около 95% для злокачественных новообразований, а также является относительно безопасной с низким уровнем осложнений.В одной серии из 566 обследований наиболее частым побочным эффектом была подкожная эмфизема с сердечной аритмией и воздушной эмболией, которые наблюдались у <1% и не приводили к летальному исходу.122
Одним из преимуществ VATS перед торакоскопией с местной анестезией является то, что хирург может продолжить лечение. к другим торакальным хирургическим вариантам, если это необходимо, во время процедуры. В частности, можно судить о том, заблокировано ли легкое или свободно расширяется. При синдроме защемленного легкого плевродез, вероятно, будет менее эффективным, поэтому во время VATS можно установить постоянный плевральный катетер (см. Руководство BTS по торакоскопии.
Бронхоскопия
Обычная диагностическая бронхоскопия не должна выполняться при недиагностированном плевральном выпоте. (C)
Бронхоскопию следует рассмотреть, если есть кровохарканье или клинические или рентгенологические признаки, указывающие на обструкцию бронхов. (C)
Бронхоскопия играет ограниченную роль в обследовании пациентов с недиагностированным плевральным выпотом, поскольку ее диагностическая ценность очень низкая.123–126 Его следует зарезервировать для пациентов, радиология которых предполагает наличие массы или потери объема, или когда в анамнезе есть кровохарканье, возможная аспирация инородного тела или застрявшее легкое с подозрением на проксимальное образование легкого.
Если бронхоскопия считается необходимой, ее следует выполнить после дренирования плевры, чтобы провести адекватное обследование без сдавления внешних дыхательных путей плевральной жидкостью.
Особые условия и тесты
Туберкулезный плеврит
После взятия биопсии плевры ее следует отправить как на гистологическое исследование, так и на посев для повышения диагностической чувствительности на ТБ.(B)
Торакоскопическая биопсия плевры — это тест, который с наибольшей вероятностью даст положительные результаты посева микобактерий (и, следовательно, чувствительность к лекарствам). (B)
Суррогатные маркеры плеврального туберкулеза полезны в странах с низкой заболеваемостью. Аденозиндезаминаза на сегодняшний день наиболее тщательно проверена. (B)
Туберкулезный плеврит — это реакция гиперчувствительности IV типа на микобактериальный белок, и микобактериальная нагрузка в плевральной жидкости обычно невысока.Таким образом, микроскопия плевральной жидкости на кислотоустойчивые бациллы имеет чувствительность <5%, а посев плевральной жидкости - 10–20% .127 Было показано, что торакоскопическая биопсия плевры имеет чувствительность> 70% для посева плевральной ткани и общей диагностической чувствительности приближается к 100%, когда доказательства казеозных гранулем на гистологическом исследовании плевральной биопсии сочетаются с посевом.100
Суррогатные маркеры плеврального туберкулеза
Туберкулезный плеврит является излечимой причиной лимфоцитарного плеврального выпота.Желательно исключить диагноз у пациентов с лимфоцитарным выпотом, избегая несоответствующей и склонной к побочным эффектам эмпирической противотуберкулезной терапии. У пациентов, которые не подходят для инвазивных исследований, могут быть полезны биомаркеры инфекции в плевральной жидкости или крови. Аденозиндезаминаза (ADA) — это фермент, присутствующий в лимфоцитах, и его уровень в плевральной жидкости значительно повышается при большинстве туберкулезных плевральных выпотов. Метаанализ 63 исследований по диагностическому использованию ADA подтвердил чувствительность 92%, специфичность 90% и соотношение правдоподобия положительного и отрицательного 9.0 и 0,10 соответственно.128 Повышенные уровни ADA также можно увидеть при эмпиеме, ревматоидном плеврите и, иногда, при злокачественных новообразованиях. Ограничение использования ADA лимфоцитарными излияниями или измерение изофермента ADA-2 может значительно снизить количество ложноположительных результатов.129 ADA очень дешевый и быстрый в исполнении и остается стабильным при хранении при 4 ° C до 28 дней130. у пациентов с ВИЧ или пациентов с ослабленным иммунитетом (например, при трансплантации почки). В странах с низкой распространенностью туберкулеза ADA является полезным тестом для исключения.
Было также показано, что нестимулированные уровни интерферона γ в плевральной жидкости имеют такую же диагностическую точность, что и ADA, в метаанализе.131 Первое, однако, более дорогое. Были изучены анализы высвобождения интерферона γ (IGRA). При применении к крови в регионах с низкой заболеваемостью туберкулезом сообщалось о чувствительности до 90%, но специфичность ограничена неспособностью тестов отличить латентный туберкулез от активного.132 В небольших исследованиях IGRA применяли к плевральной жидкости с демонстрацией превосходная чувствительность (96.4%), хотя коммерческие тесты еще не прошли валидацию для жидкостей, кроме крови.133 Хотя ожидаются дальнейшие исследования, общие диагностические характеристики, простота использования и стоимость вряд ли будут конкурировать с ADA.134
В хорошо обеспеченных ресурсами здравоохранении В таких условиях наибольшие шансы на получение культуры микобактерий и чувствительность следует оценивать с помощью торакоскопической биопсии плевры. Однако обширный обзор 7549 случаев туберкулезного плеврита, проведенный Центром по контролю за заболеваниями, показал, что характеристики лекарственной устойчивости плеврального туберкулеза в США в целом отражают характеристики легочного туберкулеза в том же регионе.135 Если микобактериальная культура и чувствительность не достигнуты, режим лечения должен отражать местные образцы резистентности.
Заболевания соединительной ткани
Ревматоидный артрит и системная красная волчанка (СКВ) являются наиболее частыми заболеваниями соединительной ткани, поражающими плевру. Плевральный выпот возникает при заболевании соединительной ткани из-за первичного аутоиммунного плеврита или вторичного почечной, сердечной, тромбоэмболической болезни или лекарственной терапии.
Плевральный выпот, связанный с ревматоидным артритом
Поражение плевры встречается у 5% пациентов с ревматоидным артритом.136 Плевральные выпоты, связанные с ревматоидным артритом, чаще возникают у мужчин, хотя само заболевание чаще встречается у женщин.137 Хронические ревматоидные выпоты являются наиболее частой причиной псевдохилезных (холестериновых) выпотов в странах с низкой заболеваемостью туберкулезом, но они могут также иметь серозный или геморрагический вид.138. 139 Измерение триглицеридов и холестерина в молочных выпотах подтвердит диагноз псевдохилезной картины, а при ревматоидном артрите другие причины выпота маловероятны.Ревматоидный артрит вряд ли станет причиной хронического выпота, если уровень глюкозы в жидкости> 1,6 ммоль / л, что служит полезным скрининговым тестом58. 80% ревматоидных плевральных выпотов имеют соотношение глюкозы в плевральной жидкости к сыворотке < 0,5 и pH <7,30. 140 Однако при остром ревматоидном плеврите глюкоза и pH могут быть нормальными.141 Дополнительную помощь может оказать измерение C4-комплемента в плевральной жидкости с уровнями <0,04 г / л во всех случаях ревматоидного плеврального болезни и только у 2 из 118 контрольных групп, о которых сообщалось в одном исследовании.141 Ревматоидный фактор может быть измерен в плевральной жидкости и часто имеет титр> 1: 320. 142 Однако он может присутствовать в выпотах другой этиологии и часто отражает сывороточные значения, что незначительно диагностически. 141
Системная красная волчанка (СКВ) )
Плеврит является первым проявлением СКВ у 5–10% пациентов, но является ранним признаком у 25–30% и обычно сопровождается мультисистемным поражением. Плевральный выпот часто бывает небольшим и у 50% пациентов двусторонний.143
Ни один тест не позволяет однозначно отличить плеврит СКВ от других причин экссудативных выпотов. Биохимические особенности не являются отличительными или непротиворечивыми.144 145 Повышенное содержание антинуклеарных антител (ANA) в плевральной жидкости и повышенное соотношение ANA плевральной жидкости к сыворотке крови наводят на мысль о плеврите с СКВ, но повышение также иногда наблюдается при злокачественных выпотах.146 Измерено Porcel et al Титры АНА плевральной жидкости у 266 пациентов с плевральным выпотом установленной причины, в том числе у 15 пациентов с СКВ.Они продемонстрировали чувствительность 100% (95% ДИ от 97% до 100%) и специфичность 94% (95% ДИ от 91% до 97%) для теста плевральной жидкости, но, в соответствии с предыдущими отчетами, результаты были идентичными, когда Тестирование сыворотки.147 Нет никакой дополнительной ценности в измерении ANA плевральной жидкости по сравнению с тестом сыворотки.
Плевральный выпот вследствие тромбоэмболии легочной артерии
Плевральный выпот, обнаруживаемый на рентгенограмме грудной клетки, встречается у 23–48% пациентов с тромбоэмболией легочной артерии.148 Выпоты небольшие (менее одной трети гемиторакса) почти в 90% случаев. случаев, хотя также распознаются умеренные и массивные излияния.3 Они могут быть ипсилатеральными, контралатеральными или двусторонними относительно эмбола, обнаруженного рентгенологически.2 3
Недавние серии исследований с применением критериев Лайта показали, что плевральные выпоты, связанные с тромбоэмболией легочной артерии, всегда являются экссудатами.3 149 Характеристики жидкости, однако, неспецифичны. и бесполезен при постановке диагноза, который следует проводить радиологически, учитывая высокий индекс клинического подозрения или в контексте излияния, которое остается недиагностированным после стандартных базовых исследований.
Хилоторакс и псевдохилоторакс
Если плевральная жидкость имеет молочный цвет, следует рассмотреть возможность хилоторакса и псевдохилоторакса. Иногда эмпиема бывает настолько мутной, что ее можно спутать с хилусом. Их можно отличить лабораторным центрифугированием, при котором в эмпиеме остается прозрачный супернатант, в то время как хилезный выпот остается молочного цвета. Следует отметить, что у голодных пациентов хилус может не выглядеть молочным.
Истинный хилезный выпот (хилоторакс) возникает в результате разрушения грудного протока или его притоков, так что хилез присутствует в плевральной полости.
Травмы, особенно после торакальной хирургии, вероятно, вызывают около 50% медицинских причин, включая злокачественные новообразования (особенно лимфому), туберкулез и лимфатические мальформации, составляющие большую часть оставшейся половины (вставка 6) .150
Вставка 6 Общие причины хилоторакса и псевдохилоторакс
Хилоторакс
Травма: торакальная хирургия (особенно при поражении заднего средостения, например, эзофагэктомия), травмы грудной клетки
Новообразование: лимфома
0003 лимфатическая опухоль, метастатическая опухоль- , цирроз, обструкция центральных вен, хилоацит
Идиопатический (около 10%)
Псевдохилоторакс
Туберкулез
Ревматоидный артрит подчиненный Причину этого обычно нельзя установить с помощью торакоскопии или биопсии плевры.В нехирургических случаях обязательно проведение компьютерной томографии грудной клетки для исключения патологии средостения (особенно лимфомы). Место утечки может быть продемонстрировано лимфангиографией.
Хилоторакс следует отличать от псевдохилоторакса или «холестеринового плеврита», который возникает в результате накопления кристаллов холестерина. Ревматоидный плеврит и туберкулезный плеврит являются наиболее частыми причинами псевдохилезного выпота.138. 151 Псевдохилоторакс обычно возникает из-за хронического (часто многолетнего) плеврального выпота, и плевра обычно заметно утолщена.152 Существуют исключения, и клиницистам рекомендуется не отказываться от диагноза при отсутствии хронического заболевания и утолщенной плевры.153
Хилоторакс и псевдохилоторакс можно отличить с помощью липидного анализа жидкости. Демонстрация хиломикронов подтверждает хилоторакс, тогда как наличие кристаллов холестерина диагностирует псевдохилоторакс. Настоящий хилоторакс обычно имеет высокий уровень триглицеридов, обычно> 1,24 ммоль / л (110 мг / дл), и его обычно можно исключить, если уровень триглицеридов <0.56 ммоль / л (50 мг / дл). При псевдохилотораксе уровень холестерина> 5,18 ммоль / л (200 мг / дл) или наличие кристаллов холестерина является диагностическим независимо от уровня триглицеридов (см. Таблицу 4) .152–154
Таблица 4Значения липидов плевральной жидкости при псевдохилотораксе и цилотораксе
Хилоторакс может быть результатом трансдиафрагмальной миграции хилезного асцита, который может быть вторичным по отношению к циррозу печени. В этих случаях плевральный выпот часто бывает транссудатом.
Доброкачественный асбестовый плевральный выпот
Доброкачественный асбестовый плевральный выпот обычно диагностируется в первые два десятилетия после воздействия асбеста.Распространенность зависит от дозы и имеет более короткий латентный период, чем другие заболевания, связанные с асбестом.155 Выпот обычно небольшой и бессимптомный, часто с геморрагической плевральной жидкостью156, 157 Существует склонность к исчезновению выпота в течение 6 месяцев. оставляя после себя остаточное диффузное утолщение плевры.156, 157 Поскольку окончательных тестов нет, диагноз может быть установлен с уверенностью только после длительного периода наблюдения, и следует рассмотреть возможность ранней торакоскопии с биопсией плевры у любого пациента с плевральным выпотом. и история воздействия асбеста, особенно при наличии боли в груди.В таблице 5 приведены клинические характеристики и характеристики плевральной жидкости других важных причин односторонних плевральных выпотов.
Таблица 5Другие важные причины плеврального выпота
Плевральный выпот: причины, диагностика и лечение
Плевральный выпот — это скопление жидкости в пространстве между легкими и грудной полостью. Это может быть вызвано пневмонией и многими другими заболеваниями. Это также может быть опасно для жизни.
Плевральный выпот или «вода в легких» может напоминать респираторную инфекцию.Иногда причина может быть респираторной, но есть и другие возможные причины. Медицинскому работнику необходимо будет диагностировать основную причину, чтобы назначить соответствующее лечение.
Симптомы плеврального выпота могут включать кашель, боль в груди и затрудненное дыхание.
В этой статье будет рассмотрено, что происходит при плевральном выпоте, почему он возникает, и некоторые варианты решения этой проблемы.
Плевральный выпот у человека означает скопление жидкости в пространстве между легкими и грудной полостью или плевральной полостью.И легкие, и грудная полость имеют слизистую оболочку, состоящую из плевры, которая представляет собой тонкую мембрану.
В здоровых легких эти мембраны обеспечивают наличие небольшого количества жидкости между легкими и грудной клеткой. Это предотвращает трение, поскольку легкие расширяются и сжимаются во время дыхания.
Однако у человека с плевральным выпотом в плевральной полости слишком много жидкости.
Любому, у кого может быть плевральный выпот, требуется немедленная медицинская помощь, поскольку без лечения он может быть опасен для жизни.
Плевральный выпот всегда является результатом другого заболевания. Это может быть вызвано многими условиями. Вот некоторые из наиболее частых причин:
Некоторые медицинские процедуры также могут вызвать плевральный выпот. Примеры:
- операция на открытом сердце или другая операция на грудной клетке
- определенные лекарства, включая метотрексат, амиодарон и фенитоин
- лучевая терапия
- гиперстимуляция яичников
Некоторые люди не испытывают никаких симптомов плеврального выпота .Если симптомы действительно возникают, они обычно начинают появляться по мере того, как жидкость заполняет грудную полость.
Некоторые возможные симптомы включают:
- сухой или непродуктивный кашель
- затрудненное дыхание, особенно в положении лежа
- лихорадка и симптомы гриппа
- боль в груди
- острая, сильная боль при глубоком вдохе
Постоянная икота также может быть признаком плеврального выпота.
Некоторые люди узнают, что у них плевральный выпот, только когда проходят тест на другое заболевание.
Также важно отметить, что симптомы плеврального выпота могут напоминать симптомы других заболеваний легких. Человеку требуется срочная медицинская помощь, если он испытывает какие-либо из этих симптомов.
Ниже представлена трехмерная модель плеврального выпота. Он полностью интерактивен.
Изучите модель с помощью коврика для мыши или сенсорного экрана, чтобы узнать больше об этом состоянии.
Диагностировать плевральный выпот может быть сложно, поскольку симптомы могут частично совпадать с симптомами многих других состояний.
Чтобы поставить диагноз, медицинский работник:
- спросит человека об его симптомах
- спросит его об их общем состоянии здоровья и истории болезни
- проведет физический осмотр
- предложит визуализирующие тесты, такие как X- лучевая, ультразвуковая или компьютерная томография
Медицинскому работнику также необходимо определить, является ли выпот транссудатом или экссудатом. В разделах ниже эти типы рассматриваются более подробно.
Выпот транссудата
Выпот транссудата обычно возникает, когда другое состояние вызывает дисбаланс давления в кровеносных сосудах.В результате жидкость просачивается обратно в грудную клетку. Жидкость в выпоте, вероятно, будет состоять из соединений из плазмы крови.
Выпот экссудата
Выпот экссудата обычно возникает в результате:
- воспалительных состояний
- инфекции
- рака
- травматического повреждения
- закупорки кровеносных или лимфатических сосудов в этой области
Медицинский работник может взять образец жидкость из плевральной полости путем введения иглы между ребрами.
Эти образцы могут помочь обнаружить признаки инфекции, уровень белка и раковые клетки. Они также могут помочь определить, есть ли у человека осложненный или неосложненный плевральный выпот.
При осложненном плевральном выпоте в жидкости будут присутствовать признаки воспаления или инфекции. Человеку может потребоваться немедленное лечение, чтобы предотвратить потенциально серьезные осложнения.
При неосложненном выпоте в жидкости не будет никаких признаков инфекции или воспаления.Неосложненный выпот может протекать легче и с меньшей вероятностью приведет к необратимому повреждению легких.
Некоторые другие тесты могут помочь определить причину выпота. К ним относятся:
- функциональные тесты почек
- функциональные тесты печени
- биопсия легкого
- бронхоскопия
- ультразвуковое исследование сердца для оценки сердечной недостаточности
Эти тесты помогают врачу сузить причину плеврального выпота и обеспечить соответствующее лечение.
Лечение будет зависеть от основной причины. Помимо лечения основного заболевания, врачу может потребоваться слить жидкость из груди.
Слив из грудной клетки
Чтобы опорожнить грудную клетку, врач вставит трубку в плевральную полость и позволит жидкости покинуть тело.
Они будут использовать местные анестетики, чтобы обезболить боль в месте проникновения иглы в тело. Когда действие анестетиков прекратится, эта область может болеть.
Им также может потребоваться повторить процесс, если жидкость продолжает скапливаться в плевральной полости.
Существует небольшой риск осложнений, связанных с дренированием грудной клетки. К ним относятся:
- инфекция
- кровотечение
- коллапс легкого
- жидкость, попадающая в легкие
Однако эти осложнения возникают редко.
Другие методы лечения
В некоторых случаях могут потребоваться другие методы лечения.
При плевродезе, например, хирург закрывает промежуток между плеврой легкого и грудной полостью, чтобы предотвратить скопление жидкости между ними.
В более тяжелых случаях хирург может направить жидкость из грудной полости в брюшную полость. В некоторых случаях они могут также удалить часть плевральной оболочки.