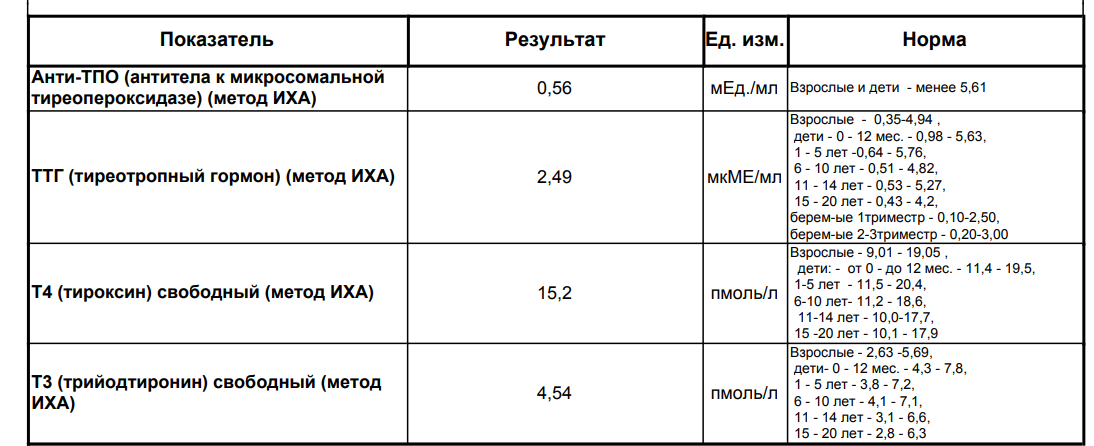
Анализ крови на ДГЭА-С. Гормон дегидроэпиандростерон-сульфат
ДГЭА-С — андроген слабо выраженного действия, образуется преимущественно в коре надпочечников (95%). ДГЭА-С обладает умеренным анаболическим действием, отвечает за развитие половых признаков и поддержание половых функций. Измерение ДГЭА-С в сыворотке крови позволяет оценить синтез андрогенов надпочечниками, особенно у женщин при повышенном уровне тестостерона для уточнения локализации источника андрогенов.
Уровень ДГЭА-С может резко возрастать при андрогенпродуцирующих опухолях (совместно с тестостероном).
Данный тест чаще всего назначают при гиперандрогениях вместе с 17-ОН-прогестероном для исключения врожденной дисфункции коры надпочечников.
ДГЭА-С – это андроген (мужской половой гормон), который присутствует в организме представителей обоих полов. У мальчиков в пубертатном периоде он отвечает за развитие вторичных половых признаков. Гормон способен преобразоваться в эстрадиол, андростендион и тестостерон.
Уровень гормона служит достоверным показателем функционирования надпочечников. При наличии злокачественных или доброкачественных новообразований часто становятся причиной повышения синтеза этого гормона. Также высокие показатели характерны для гиперплазии надпочечников. У мужчин чрезмерное количество гормона во многих случаях никак не проявляется и остается незамеченным. У представительниц женского пола его чрезмерная выработка чревата аменореей и появлением признаков маскулинизации.
Для детей повышение продукции гормона чревато серьезной опасностью. У мальчиков оно вызывает чрезмерно ранее половое созревание. Если ДГЭА-С синтезируется слишком много в организме девочки, возможно нарушение менструального цикла, появление избыточного оволосения. Наружные половые органы приобретают неоднозначный внешний вид.
Результаты анализа крови на ДГЭА-С используются врачом, чтобы оценить функционирование надпочечников.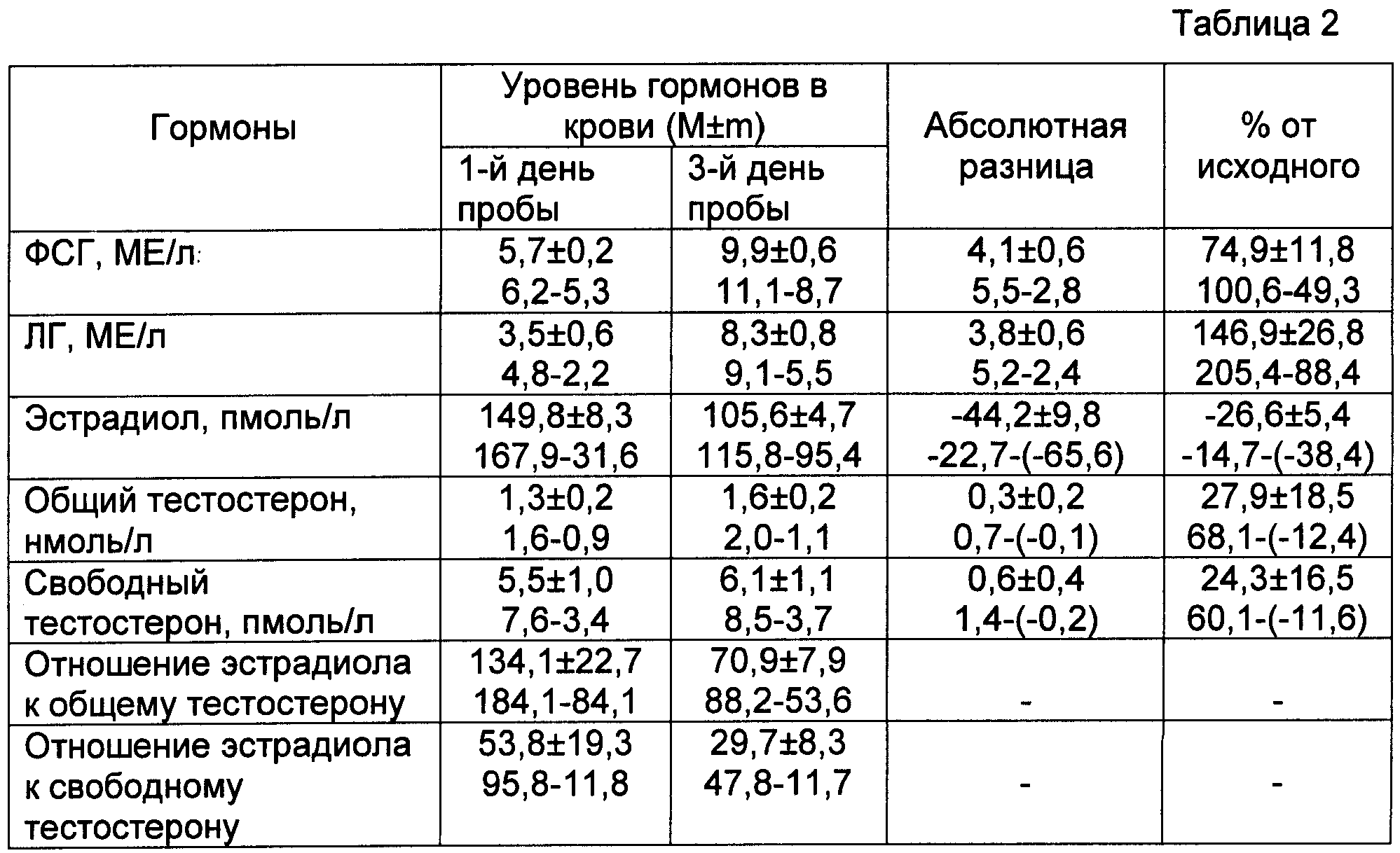 Также тест проводится для дифференциаций заболеваний, которые связаны с надпочечниками, от патологий, вызванных нарушением функционирования тестикул и яичников. В ходе диагностики новообразований коры надпочечников доброкачественного и злокачественного характера, гиперплазии, тест назначают в комплексе с другими анализами и инструментальными тестами. По полученным результатам можно отличить заболевания надпочечников от онкологии яичников и их доброкачественных новообразований. Тест также назначается, чтобы установить причину аменореи, бесплодия, гирсутизма, преждевременного полового созревания у мальчиков и маскулинизации у девочек.
Также тест проводится для дифференциаций заболеваний, которые связаны с надпочечниками, от патологий, вызванных нарушением функционирования тестикул и яичников. В ходе диагностики новообразований коры надпочечников доброкачественного и злокачественного характера, гиперплазии, тест назначают в комплексе с другими анализами и инструментальными тестами. По полученным результатам можно отличить заболевания надпочечников от онкологии яичников и их доброкачественных новообразований. Тест также назначается, чтобы установить причину аменореи, бесплодия, гирсутизма, преждевременного полового созревания у мальчиков и маскулинизации у девочек.
Нормальный уровень андрогенов, как правило, указывает на то, что функционирование надпочечников не нарушено. При наличии новообразований надпочечников концентрация гормона обычно повышена, но иногда она может оставаться в пределах референсных значений. У пациентов с синдромом поликистозных яичников синтез гормона может повышаться или оставаться нормальным.
Повышенные показатели характерны для ряда заболеваний, поставить точный диагноз по результатам одного теста невозможно. При выявлении нарушений проводится комплексное обследование. Недостаток гормона также может указывать на различные патологии (например, он характерен для гипопитуитаризма). Референсные значения зависят от возраста и пола пациент.
Что такое ДГЭА и почему этот гормон надо беречь | Vogue Ukraine
Это, пожалуй, самый важный гормон, о котором мало кто знает и который мало кто контролирует. А зря.
Фото: David Ferrua, архив Vogue«Ой, что-то у меня с кожей в последнее время совсем плохо. Старая стала, сухая, вокруг рта морщинки появились. Может, мне мезо поколоть? Гиалуронки не хватает?» – атакую вопросами косметолога, к которой пришла разобраться, с чего вдруг моя кожа за каких-то полгода достигла состояния крафтовой бумаги. Хотя, по идее, до него у меня должно быть еще лет двадцать в запасе.
Врач внимательно рассматривает мое лицо и вместо инъекций отправляет меня на прием к эндокринологу. Та, в свою очередь, выписывает направление на анализ крови под названием «мультистероидный профиль», куда входит исследование уровня женских и мужских половых гормонов, кортизона и кортизола, а также незнакомого мне дегидроэпиандростерона, он же ДГЭА. Сложное название, впрочем, я быстро запоминаю – его уровень в моем организме критически низкий. При норме 15-65 нмоль/л мой показатель составляет ничтожные 4,3.
Та, в свою очередь, выписывает направление на анализ крови под названием «мультистероидный профиль», куда входит исследование уровня женских и мужских половых гормонов, кортизона и кортизола, а также незнакомого мне дегидроэпиандростерона, он же ДГЭА. Сложное название, впрочем, я быстро запоминаю – его уровень в моем организме критически низкий. При норме 15-65 нмоль/л мой показатель составляет ничтожные 4,3.
По глазам врача видно: такой расклад ее не радует. Неудивительно, ведь ДГЭА – хоть и не общеизвестное вещество вроде витамина С, но крайне важное для здоровья. Медики называют его «прародителем гормонов», так как он стимулирует синтез тестостерона, эстрогена и всех половых и стероидных гормонов.
Уровень ДГЭА в организме довольно быстро начинает снижаться уже после 25 лет. В 50 лет его содержание составляет половину от нормы, а в 70 лет – всего около 20%. Его дефицит грозит снижением иммунитета, ухудшением работы сосудов и сердца, снижением метаболизма и, как следствие, набором веса.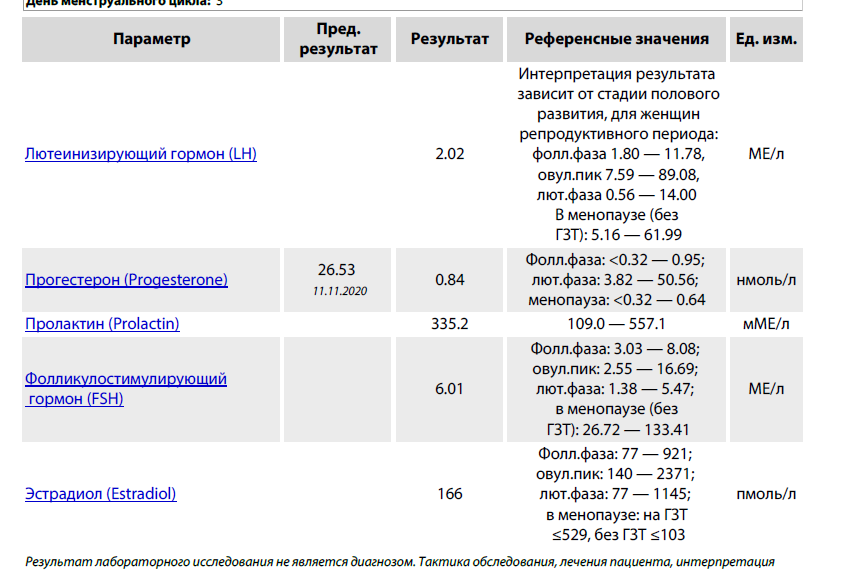 Недостаток ДГЭА может привести также к развитию диабета и остеопороза.
Недостаток ДГЭА может привести также к развитию диабета и остеопороза.
Если вспомнить «половую» функцию дегидроэпиандростерона, станет ясно, что он напрямую влияет на фертильность и либидо. И наконец, от недостатка ДГЭА страдает кожа: теряет влагу, упругость, эластичность. Появляются преждевременные признаки старения, причем не только видимые. Что касается психологических рисков, дефицит ДГЭА провоцирует эмоциональный спад, чувство усталости и угнетенности, вплоть до депрессии.
«Убить» уровень ДГЭА легко. Я, например, со своим расправилась с помощью физической и моральной перегрузки: параллельно основной работе запускала сложный проект, который требовал много сил и времени. Три месяца подряд поспать удавалось 3-4 часа в сутки, поесть – через раз. Сто процентов времени я проводила в состоянии стресса.
В итоге, кроме «старой» кожи у меня появилось еще несколько тревожных симптомов, вообще не характерных для моего возраста: тахикардия, одышка, усталость. Ночью я несколько часов не могла заснуть, а утром – собрать себя в кучу и встать с кровати. На работе отключался мозг, в быту не хватало сил даже помыть посуду. Плюс тревожность, апатия на ровном месте – и да, либидо я тоже уничтожила.
На работе отключался мозг, в быту не хватало сил даже помыть посуду. Плюс тревожность, апатия на ровном месте – и да, либидо я тоже уничтожила.
По совету врача я начала принимать ДГЭА в биодобавке, которую заказала онлайн (название и дозировку здесь не указываю, препарат должен назначать врач по результатам анализа). За год уровень гормона повысился втрое, хотя до нормы так и не дотянул, тормознув на отметке 11.
Тогда на очередном приеме эндокринолог посоветовала мне провести эксперимент: принимать ДГЭА не внутрь, потому что в желудочно-кишечном тракте он может усваиваться недостаточно хорошо, – а наружно. Я купила специальный крем для тела с маркировкой DHEA для поддержания баланса ДГЭА (его обычно назначают, когда надо «подтянуть» уровень ДГЭА, но таблетки-биодобавки на его основе плохо помогают) и начала наносить на кожу рук и ног. Спойлер: кожа там теперь – ммм! Жаль, на лицо мазать нельзя.
Эффект ощутила через месяц: утром я больше не размазня, мозг включился, засыпаю-просыпаюсь нормально, чувствую себя человеком, а не зомби.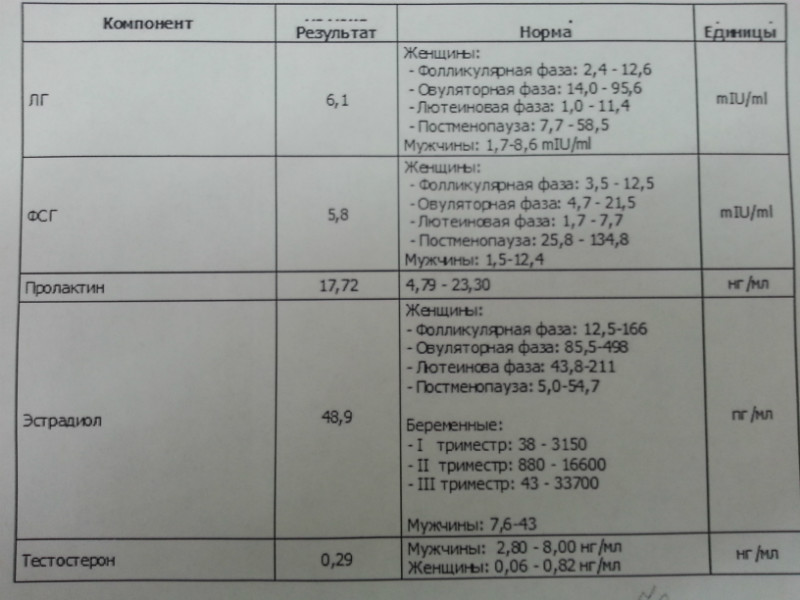 До нормы я таки не дотянула – показатель ДГЭА все еще 13,5. Но все же это победа. И еще одна — в моем графике больше нет работы 24/7.
До нормы я таки не дотянула – показатель ДГЭА все еще 13,5. Но все же это победа. И еще одна — в моем графике больше нет работы 24/7.
Текст: Марина Сютаева
Дегидроэпиандростерон-сульфат (ДЭА-S04, ДЭА-С, Dehydroepiandrosterone sulfate, DHEA-S)
Что такое дегидроэпиандростерон-сульфат (ДЭА-S04, ДЭА-С, Dehydroepiandrosterone sulfate, DHEA-S)?

Дегидроэпиандростерон-сульфат играет роль в развитии вторичных половых признаков у мальчиков в период полового созревания, таких как оволосение по мужскому типу, изменение тембра голоса и т.д.
Для чего определяют уровень дегидроэпиандростерон-сульфата в крови?
Определение уровня дегидроэпиандростерон-сульфата используют для оценки функции надпочечников (к повышению показателя приводят опухоли надпочечников и гиперплазия – увеличение количества клеток; снижение показателя свидетельствует о недостаточной функции надпочечников в отношении выработки половых гормонов), реже – для выявления опухоли яичников, которая также может продуцировать слишком большое количество этого гормона. В этом случае симптомы патологии будут включать в себя избыточный рост волос на лице и теле (гирсутизм), развитие мужских черт (вирилизация, или маскулинизация) и нарушения цикла вплоть до отсутствия менструации (аменореи) и бесплодия.
Как правило, для наиболее точной диагностики тест на концентрацию дегидроэпиандростерон-сульфата выполняют вместе с анализами на уровень половых гормонов (тестостерона, эстрогена).
При каких заболеваниях изменяется уровень дегидроэпиандростерон-сульфата в крови?
Уровень дегидроэпиандростерон-сульфата повышается при гиперплазии или опухоли надпочечников (как доброкачественной, так злокачественной), синдроме поликистозных яичников (СПКЯ – гормональное заболевание женщин детородного возраста, при котором в яичниках появляются множественные полости, заполненные жидкостью – кисты, а симптомы включают нарушение менструального цикла вплоть до аменореи, гирсутизм, склонность к полноте и др.), при болезни Иценко – Кушинга и эктопических (расположенных вне гипофиза) опухолях, продуцирующих АКТГ (адренокортикотропный гормон).
Уровень дегидроэпиандростерон-сульфата снижается при дисфункции и заболеваниях надпочечников (болезни Аддисона, синдроме Иценко – Кушинга и др.), гипопитуитаризме (когда гипофиз не вырабатывает некоторые или все гормоны).
Почему результат анализа может быть некорректным?
На концентрацию дегидроэпиандростерон-сульфата в крови может влиять прием дегидроэпиандростерон-сульфатных добавок или некоторых препаратов, например, содержащих гестагены (аналоги полового гормона прогестерона).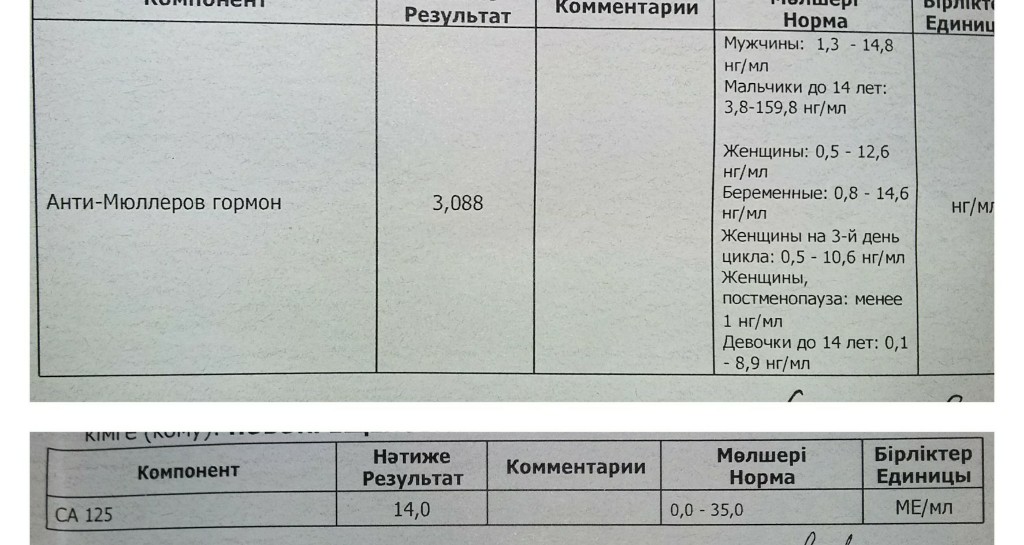
Перед сдачей анализа для наиболее точного результата рекомендуют избегать употребления алкоголя, а также чрезмерных физических и эмоциональных перегрузок накануне и курения за час до выполнения теста.
Пределы обнаружения: 0,08-81,42 мкмоль/л.Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Трактовка результатов определения уровня Дегидроэпиандростерон-сульфата в сыворотке крови
Единицы измерения: мкмоль/л.
Альтернативные единицы: мкг/дл.
Референсные значения
| Возраст | Пол | ДЭА-SO4, мкмоль/л |
| 1-5 лет | оба | <2,48 |
| 5-10 лет | оба | <4,86 |
| 10-14 лет | оба | 0,7-10,32 |
| жен | 1,7-13,4 | |
| муж | 1,2-10,4 | |
| 20-25 лет | жен | 3,6-11,1 |
| муж | 6,5-14,6 | |
| 25-35 лет | жен | 2,6-13,9 |
| муж | 4,6-16,1 | |
| 35-45 лет | жен | 2,0-11,1 |
| муж | 3,8-13,1 | |
| 45-55 лет | жен | 1,5-7,7 |
| муж | 3,7-12,1 | |
| >55 лет | жен | 0,8-4,9 |
| муж | 1,3-9,8 |
Повышение значений
- Адреногенитальный синдром.

- Опухоли коры надпочечников.
- Эктопические АКТГ-продуцирующие опухоли.
- Болезнь Кушинга (гипоталамо-гипофизарный генез).
- Фетоплацентарная недостаточность.
- Гирсутизм женщин (при нормальном показателе заболевание не связано с патологией надпочечников).
- Угроза внутриутробной гибели плода.
Понижение значений
- Гипоплазия надпочечников плода (концентрация в крови беременной женщины).
- Внутриутробная инфекция.
- Приём таких препаратов как гестагены.
Медицинские анализы — ДГЭА сульфат: что это такое, норма у женщин, анализ на гормон сдать в Сочи, лаборатория ELISA
Dehydroepiandrosterone sulfate, DHEA Sulfate
— показатель андрогенсинтетической функции надпочечников (синтез «мужских половых гормонов»). Основные показания к применению: гиперплазия коры надпочечников (адреногенитальный синдром), диагностика гирсутизма, аменорея, опухоли коры надпочечников, недостаточность коры надпочечников, болезнь Кушинга, задержка или преждевременное половое созревание, синдром поликистозных яичников, остеопороз.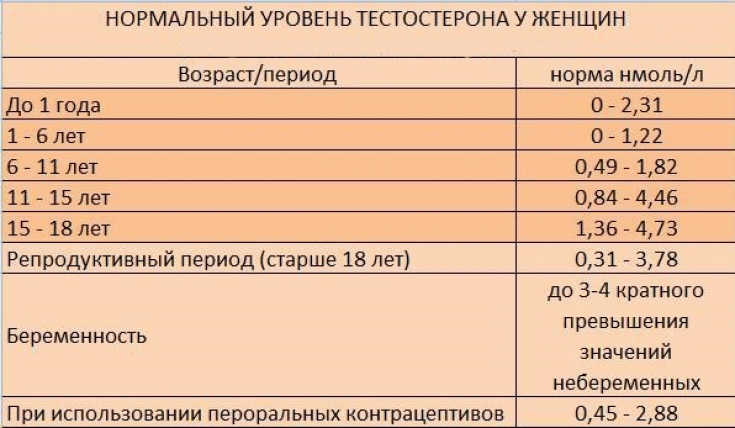
ДГЭА-S — гормон (андроген), вырабатывающийся, в основном, в коре надпочечников (95%) мужчин и женщин, а также яичниками у женщин (5%). Небольшое количество образуется в яичках. ДГЭА-S обладает слабовыраженной андрогенной активностью и не влияет на достижение половой зрелости. В процессе метаболизма выделяется с мочой и составляет основную фракцию 17-кетостероидов. Концентрация этого гормона в крови отражает андрогенсинтетическую функцию надпочечников. Повышение содержания ДГЭА-S указывает на увеличение выработки андрогенов. ДГЭА-S представляет собой фактически прогормон, и только дегидроэпиандростерон (десульфированный ДГЭА-S) способен в ряде периферических тканей превращаться в активные андрогены — тестостерон, дигидротестостерон и андростендиол, связанные с половым развитием. Поскольку ДГЭА-S образуется в основном в коре надпочечников, и лишь небольшая часть в половых железах, то это может быть важным приемом в определении источника андрогенов. Так, при увеличении содержания тестостерона в крови у женщин при определении ДГЭА-S можно сказать, связано ли это увеличение с заболеванием яичников или надпочечников. Повышенное содержание ДГЭА-S свидетельствует о его надпочечниковом происхождении.
Повышенное содержание ДГЭА-S свидетельствует о его надпочечниковом происхождении.
В отличие от других гормонов, например, как у кортизола, у ДГЭА-S не выявлено суточных изменений в содержании. Поэтому его определение в крови считается наиболее стабильным показателем в синтезе андрогенов надпочечниками.
При беременности содержание ДГЭА-S умеренно снижается. Повышение содержания в крови во время беременности может служить признаком угрозы гибели плода.
Развитие остеопороза у женщин в постменопаузе находится в прямой взаимосвязи с низким содержанием ДГЭА-S в крови.
Увеличение содержания
1). Опухоли коры надпочечников, продуцирующих андрогены (андростеромы).
2). Адреногенительный синдром надпочечникового генеза.
3). Опухоли, продуцирующие АКТГ (эктопические опухоли).
4). Синдром Иценко- Кушинга (гипоталамо-гипофизарный).
5). Преждевременное половое созревание.
6). Синдром поликистозных яичников (в 20% случаев).
7). Гирсутизм женщин (при патологии яичников).
Уменьшение содержания
1). Уменьшение концентрации с возрастом (после 50-60 лет).
2). Гипоплазия надпочечников плода.
3). Задержка полового созревания.
4). Остеопороз
Дегидроэпиандростерон сульфат, ДГЭА-сульфат в Москве недорого
Дегидроэпиандростерон-сульфат (ДГЭА-С) — это стероидный гормон. В норме DHEA гормон на протяжении суток стабильно вырабатывается из холестерина яичниками и надпочечниками. Гормон ДЭА также является основой для выработки андростендиона и тестостерона, которые в организме женщин могут провоцировать синдром гиперандрогении. Он проявляется в виде бесплодия, гирсутизма, облысения, сбоев менструального цикла и акне. Именно уровень концентрации ДГЭА-S позволяет установить причину развития этого синдрома, связанную с болезнями яичников или надпочечников.
Рекомендации к сдаче анализа на DHEA S гормон
Врачи назначают прохождение этого исследования при:
- привычном невынашивании беременности;
- адреногенитальном синдроме;
- гипотрофии плода в утробе;
- эктопических опухолях, продуцирующих АКТГ;
- опухолях в коре надпочечников.

Где сдать анализ на ДГЭА-сульфат?
При подготовке к сдаче анализа на DHEA S стоит отказаться от интенсивных физических нагрузок. В наших клиниках есть все необходимые условия для безопасной сдачи крови. Мы гарантируем клиентам доступную цену, безболезненность забора крови и оперативную выдачу расшифровки лабораторного исследования на Dehydroepiandrosterone sulfate.
Интерпретация результатов
Результаты анализа имеют количественное выражение. В них указывается как выявленный в образце крови уровень концентрации дегидроэпиандростерона сульфат, так и референсные значения. Показатели нормы зависят от возраста и пола. Снижение показателей считается маркером дисфункции надпочечников, повышение же характерно для гиперплазии надпочечников, опухолей коры надпочечников.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К АНАЛИЗАМ КРОВИ
Кровь берется из вены. Необходимо соблюдать общие рекомендации:
- кровь сдается утром натощак или не ранее, чем через 2–4 часа после приема пищи;
- допускается употребление воды без газа;
- накануне анализа следует отказаться от алкоголя, исключить физическое и эмоциональное перенапряжение;
- отказаться от курения за 30 минут до исследования;
- не стоит сдавать кровь в период приема медикаментов, если врач не назначил иное.

Кровь рекомендуется сдавать в первой половине дня, через 3–4 часа после пробуждения. Женщинам в репродуктивном возрасте при сохраненном менструальном цикле (28 дней) исследования проводят на 3–5 день цикла, если лечащий врач не назначил иначе.
Дегидроэпиандростерон и адренархе | Гончаров
1. Albright Е, Smith P. Н., Eraser R. // Am. J.Med. Sci. — 1942.- Vol. 204. — P. 625-648.
2. Amid S. A., Caprio S, Sherwin R. S. et al. // J. Clin. Endocrinol. Metab. — 1991. — Vol. 72, N 2. — P. 277-282.
3. Argente J., Barrios V., Pozo J. et al. // J. Clin. Endocrinol. Metab.- 1993. — Vol. 77, N 6. — P. 1522-1528.,
4. Baulieu E. E, Corpechot C, Dray E et al. // Recent Prog. Horm. Res. — 1965. — Vol. 21. — P. 411-500.
Baulieu E. E, Corpechot C, Dray E et al. // Recent Prog. Horm. Res. — 1965. — Vol. 21. — P. 411-500.
5. Burghen G. A., Givens J. R., Kitabchi A. E. // J. Clin. Endocrinol. Metab. — 1980. — Vol. 50, N 1. — P. 113-116.
6. Deneux C, Tardy V., Dib A. et al. // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86, N 1. — P. 207-213.
7. Dunaif A., Graf M. // J. Clin. Invest. — 1989. — Vol. 83, N 1. -P. 23-29.
8. Dunaif A., Green G., Futterweit W., Dobrjansky A. // J. Clin. Endocrinol. Metab. — 1990. — Vol. 70, N 3. — P. 699-704.
9. Dunaif A. // Horm. Res. — 1992. — Vol. 37. — Suppl. 3. — P. 39-44.
— Vol. 37. — Suppl. 3. — P. 39-44.
10. Dunaif A., Scott D., Einegood D. et al. // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81, N 9. — P. 3299-3306.
11. Ehrmann D. A., Sturis J., Byrne M. M. et al. // J. Clin. Invest. -1995. — Vol. 96, N 1. — P. 520-527.
12. Forest M. G. // J. Clin. Endocrinol. Metab. — 1978. — Vol. 47, N5.-P. 931-937.
13. Freemark M., Driscoll P., Maaskant R. et al. // J. Clin. Invest. -1997. — Vol. 99. — P. 1107-1117.
14. Geffner M. E, Kaplan S. A., Bench N. et al. // Fertil. and Steril. — 1986. — Vol. 45, N 3. — P. 327-333./103/103.jpg)
15. Genazzani A., Pintor C, Facchineti F. et al. // Clin. Endocrinol. (Oxford). — 1978. — Vol. 8. — P. 15-25.
16. Genazzani A., Pintor C, Facchineti F. et al. // J. Clin. Endocrinol. Metab. — 1979. — Vol. 57. — P. 56-61.
17. Genazzani A., Pintor C., Facchineti F. et al. // J. Steroid Biochem. — 1979. — Vol. 1. — P. 571-577.
18. Granoff А. В., Chasalow F. L, Blethen S. L. // J. Clin. Endocrinol. Metab. — 1985. — Vol. 60, N 3. — P. 409-415.
19. Haffner S. M., Valdez R. A., Morales P. A. et al. // J. Clin. Endocrinol. Metab. — 1993. — Vol. 77, N 1. — P. 56-60.
— P. 56-60.
20. Holownia P., Owen E. J., Conway G. S. et al. // J. Steroid Biochem. Mol. Biol. — 1992. — Vol. 41, N 3. — P. 875-880.
21. Ibanez L, Virdis R., Potau N. et al. // J. Clin. Endocrinol. Metab. — 1992. — Vol. 74, N 2. — P. 254-257.
22. Ibanez L, Potau N, Zampolli M. et al. // J. Clin. Endocrinol. Metab. — 1994. — Vol. 79, N 6. — P. 1778-1784.
23. Ibanez L, Potau N., Zampolli M. et al. // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81, N 3. — P. 1237-1243.
24. Ibanez L, Potau N., Zampolli M. // J. Clin. Endocrinol. Metab. — 1997. — Vol.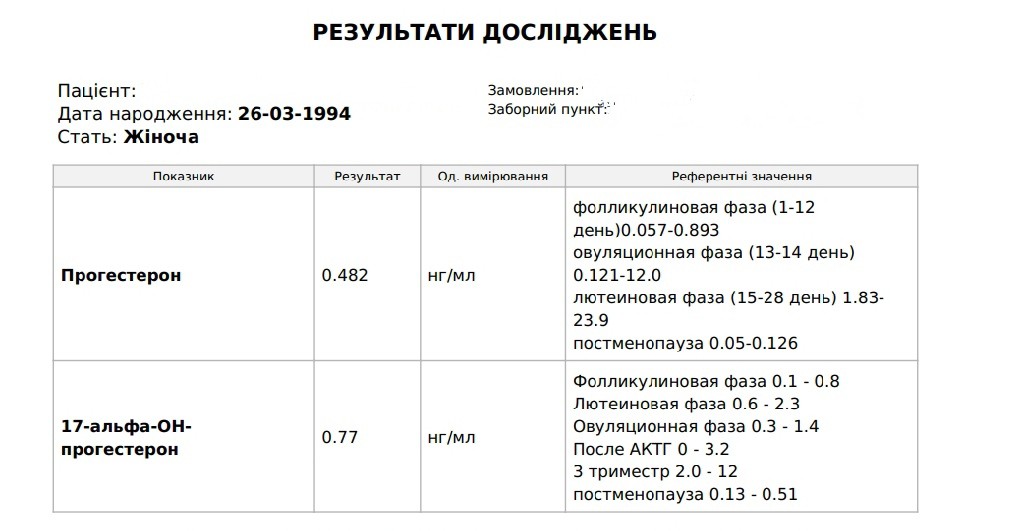 82, N 7. — P. 2283-2288.
82, N 7. — P. 2283-2288.
25. Jabbar M., Pugliese M., Fort P. et al. // J. Am. Coll. Nutr. — 1991. — Vol. 10, N 4. — P. 289-296.
26. Jiang X., Srinivasan S. R., Radhakrishnamurthy B. et al. // Pediatrics. — 1996. — Vol. 97, N 3. — P. 357-360.
27. Kohn В., Levine L S., Pollack M. S. et al. // J. Clin. Endocrinol. Metab. — 1982. — Vol. 55, N 5. — P. 817-827.
28. Korth-Schutz S., Levine L. S., New M. I. // J. Clin. Endocrinol. Metab. — 1976. — Vol. 42, N 6. — P. 1005-1013.
29. Korth-Schutz S., Levine L. S., New M. I. // Acta Endocrinol. (Copenh.). — 1976. — Vol. 82, N 2. — P. 342-352.
— Vol. 82, N 2. — P. 342-352.
30. Lin C. J., Mendonca В. В., Lucon A. M. et al. // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82, N 8. — P. 2671-2676.
31. Liu N, Grumbach M. M., De Napoli R. A., Morishima A. // J. Clin. Endocrinol. Metab. — 1965. — Vol. 25, N 10. — P. 1296-1308.
32. Mellon S. H., Shively J. E, Miller W. L. // J. Clin. Endocrinol. Metab. — 1991. — Vol. 72, N 1. — P. 19-22.
33. Miller W. L. // Endocr. Rev. — 1988. — Vol. 9, N 3. — P. 295-318.
34. Moghetti P., Tosi E, Castello R. et al. // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81, N 3. — P. 952-960.
81, N 3. — P. 952-960.
35. Nestler J. E, Jakubowicz D. J. // N. Engl. J. Med. — 1996. — Vol. 335, N 9. — P. 617-623.
36. New M. I., Lorenzen F., Lerner A. J. et al. // J. Clin. Endocrinol. Metab. — 1983. — Vol. 57, N 2. — P. 320-326.
37. Nobels E, Dewailly D. // Fertil. and Steril. — 1992. — Vol. 58, N 4. — P. 655-666.
38. Connell Y., McKenna T. J., Cunningham S. K. // J. Steroid Biochem. Mol. Biol. — 1994. — Vol. 48, N 2-3. — P. 235- 240.
39. Pang S. // Pediatr. Adolesc. Endocrinol. — 1984. — Vol. 13. -P. 173-184.
40. Peretti E., Forest M. G. // J. Clin. Endocrinol. Metab. — 1978. — Vol. 47, N 3. — P. 572-577.
Peretti E., Forest M. G. // J. Clin. Endocrinol. Metab. — 1978. — Vol. 47, N 3. — P. 572-577.
41. Pere A., Perheentupa J., Peter M., Voutilainen R. // Eur. J. Pediatr. — 1995. — Vol. 154, N 5. — P. 346-352.
42. Potau N., Ibanez L., Rique S., Carrascosa A. // Horm. Res. — 1997. — Vol. 48, N 5. — P. 219-226.
43. Rao J. K., Chihal H. J., Johnson С. М. // J. Reprod. Med. — 1985. — Vol. 30, N 4. — P. 361-365.
44. Robinson P., Bate/nan A., Mulay S. // Endocrinology. — 1991. -Vol. 129, N 2. — P. 859-867.
45. Rosenfield R. L., Rich В. Н., Lucky A. W. // J. Pediatr. — 1982. — Vol. 101, N 6. — P. 1005-1009.
Pediatr. — 1982. — Vol. 101, N 6. — P. 1005-1009.
46. Rosenfield R. L. // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81, N 3. — P. 878-880.
47. Sakkal-Alkaddour H., Zhang L, Yang X. et al. // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81, N 11. — P. 3961-3965.
48. Sklar C. A., Kaplan S. L., Grumbach M. M. // J. Clin. Endocrinol. Metab. — 1980. — Vol. 51, N 3. — P. 548-556.
49. Siegel S. F, Finegold D. N, Urban M. D. et al. // J. Clin. Endocrinol. Metab. — 1992. — Vol. 74, N 2. — P. 239-247.
50. Sigurjonsdottir T. J., Hayles A. B. // Clin. Pediatr. — 1968. — Vol. 7, N 1. — P. 29-33.
— 1968. — Vol. 7, N 1. — P. 29-33.
51. Silverman S. H., Migeon C. J., Rosenberg E., Wilkins L. // Pediatrics. — 1952. — Vol. 10. — P. 426-432.
52. Smith R. G., Pong S. S., Hickey G. et al. //Recent Prog. Horm. Res. — 1996. — Vol. 51. — P. 261-285.
53. Talbot N. В., Butler A. M., Rodriguez P. M., MacLachan E. A.// Am. J. Dis. Child. — 1943. — Vol. 65. — P. 364-375.
54. Temeck J. W., Pang S. Y, Nelson C, New M. L // J. Clin. Endocrinol.. Metab. — 1987. — Vol. 64, N 3. — P. 609-617.
55. Thamdrup E. // Nord. Med. — 1965. — Vol. 74, N 14. — P. 1013-1018.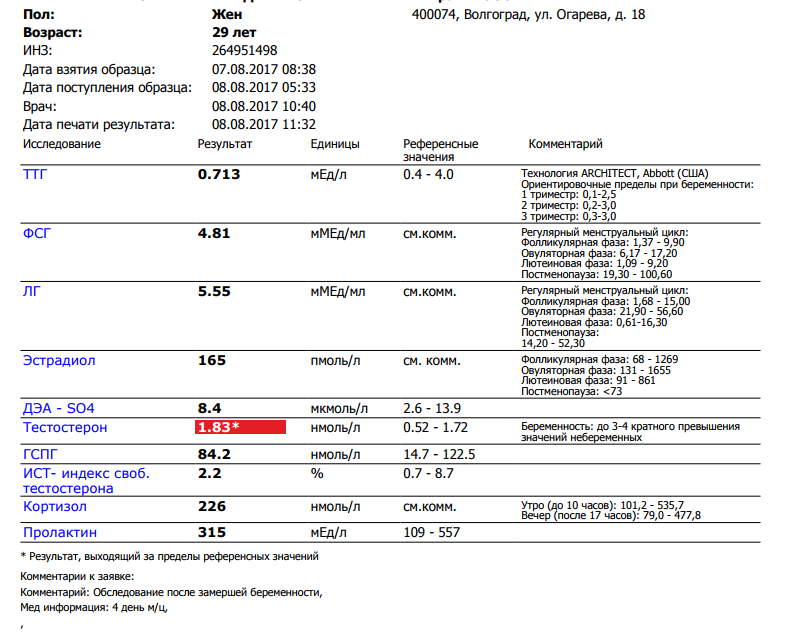
56. Toscano V., Bianchi P., Balducci R. et al. // Clin. Endocrinol. (Oxford). — 1992. — Vol. 36, N 2. — P. 197-202.
57. Urbanek M., Legro R. S., Driscoll D. A. et al. // Proc. Natl. Acad. Sci. USA. — 1999. — Vol. 96, N 15. — P. 8573- 8578.
58. Weber A., Clark A. J., Perry L. A. et al. // Clin. Endocrinol. (Oxford). — 1997. — Vol. 46, N 4. — P. 431-437.
59. White P. C, Curnow К. M., Pascoe L. ff Endocr. Rev. — 1994. — Vol. 15, N 4. — P. 421-438.
60. Willis D., Franks S. // J. Clin. Endocrinol. Metab. — 1995. — Vol. 80, N 12. — P. 788-790.
61. Yamaji Т., Ishibashi M., Takaku F. et al. // Acta Endocrinol. (Copenh.). — 1989. — Vol. 120. — P. 655-660.
Yamaji Т., Ishibashi M., Takaku F. et al. // Acta Endocrinol. (Copenh.). — 1989. — Vol. 120. — P. 655-660.
62. Zogopoulos G., Albrecht S., Pietsch T. et al. // Cancer Res. — 1996. — Vol. 56. — P. 2949-2953.
Дегидроэпиандростерон сульфат (ДГЭА-С, ДГЭА) в медицинском центре «Мать и Дитя»
Дигидротестостерон – считается самым важным половым гормоном для мужчин, особенно спортсменов. Вырабатывается в яичках и в незначительном количестве в надпочечниках. Синтезируется ДГТ из тестостерона и влияет на нормальное развитие предстательной железы, рост половых органов, отвечает за сексуальное влечение, эрекцию и полноценное физическое развитие подростков в пубертатном периоде. У женщин гормональное вещество вырабатывается из андростендиона.
Краткая характеристика дигидротестостеронаМаксимальные показатели гормона для женщины фиксируются в период полового созревания на этапе формирования вторичных признаков. При повышенных значениях ДГТ может развиться гиперандрогения, проявляющаяся в оволосении, акне, увеличении размеров клитора.
При повышенных значениях ДГТ может развиться гиперандрогения, проявляющаяся в оволосении, акне, увеличении размеров клитора.
У мужчин при нормальных показателях гормона отмечается стабильная эрекция, хорошо развитые гениталии, здоровая простата. При повышенных показателях железа увеличивается, развивается патологическое разрастание тканей.
Когда назначается сдача анализаКолебания уровня ДГТ могут указывать на наличие доброкачественного новообразования в простате, синдрома Морриса, возрастное истощение гормона, гипо- или гипергонадизм. Кроме того, прохождение анализа требуется, если имеются:
- проблемы с потенцией;
- признаки развития себореи или акне;
- снижение сексуального влечения;
- низкий показатель андрогенов;
- проблемы при опорожнении мочевого пузыря.
Чтобы получить объективные результаты, рекомендуется подготовиться к сдаче анализа:
- период последнего приема пищи – за 8 ч;
- отказаться от физических нагрузок;
- избегать психоэмоциональных перегрузок и стрессовых ситуаций;
- за неделю до исследования не употреблять жирную пищу и газированные напитки, не курить и не пить алкоголь;
- запрещено приходить на забор крови после проведения массажа, физиопроцедур и ультразвукового или рентгенологического исследования.

- дигидротестостерон отличается особой чувствительностью, поэтому за полчаса до взятия венозной крови следует расслабиться.
Все результаты расшифровываются специалистом и сравниваются с референсными значениями, приведенными в таблице:
| Возраст и пол пациента | Дигидротестостерон в крови (пг/мг) |
| Подростки:
Девочки Мальчики |
От 5 до 25
От 5 до 50 |
| Мужчины | От 250 до 990 |
| Женщины | От 24 до 450
(в менопаузе от 10 до 179) |
Повышенный уровень наблюдается при гирсутизме и гипергонадизме. Пониженный указывает на гипогонадизм, импотенцию, облысение, недостаток 5-α редуктазы.
Цена анализа зависит от выбранной клиники.
Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия дегидроэпиандростерона
DHEA; 3-бета-гидрокси-5-андростен-17-он; синтетические версии — прастера, прастерон, фиделин и флуастерон
Что такое дегидроэпиандростерон?
Дегидроэпиандростерон является гормоном-предшественником, что означает, что он имеет небольшое биологическое действие сам по себе, но имеет сильные эффекты при преобразовании в другие гормоны, такие как тестостерон и эстрадиол. Дегидроэпиандростерон вырабатывается из холестерина главным образом в наружном слое надпочечников, известном как кора надпочечников, хотя в небольших количествах он также вырабатывается семенниками и яичниками. Он циркулирует в крови, в основном связанный с серой в виде сульфата дегидроэпиандростерона, который предотвращает расщепление гормона. У женщин дегидроэпиандростерон является важным источником эстрогенов в организме — он обеспечивает около 75% эстрогенов до менопаузы и 100% эстрогенов в организме после менопаузы.
Дегидроэпиандростерон вырабатывается из холестерина главным образом в наружном слое надпочечников, известном как кора надпочечников, хотя в небольших количествах он также вырабатывается семенниками и яичниками. Он циркулирует в крови, в основном связанный с серой в виде сульфата дегидроэпиандростерона, который предотвращает расщепление гормона. У женщин дегидроэпиандростерон является важным источником эстрогенов в организме — он обеспечивает около 75% эстрогенов до менопаузы и 100% эстрогенов в организме после менопаузы.
Производство дегидроэпиандростерона увеличивается примерно с девяти или десяти лет, достигает пика в 20 лет и постепенно снижается к старости. Дегидроэпиандростерон также в небольших количествах вырабатывается мозгом, хотя его точная роль там не ясна.
Как контролируется дегидроэпиандростерон?
Производство дегидроэпиандростерона контролируется мозгом по цепи отрицательной обратной связи. Это означает, что когда уровень дегидроэпиандростерона в организме падает, система «включается», а при повышении уровня она снова «выключается».
Система «включается» кортикотропин-рилизинг-гормоном, вырабатываемым гипоталамусом. Он перемещается в переднюю долю гипофиза и заставляет его выделять адренокортикотропный гормон в кровоток. Оба эти гормона заставляют надпочечники вырабатывать дегидроэпиандростерон. Когда уровень дегидроэпиандростерона повышается, организм прекращает производство, останавливая выработку кортикотропин-рилизинг-гормона и адренокортикотропного гормона.
Что произойдет, если у меня будет слишком много дегидроэпиандростерона?
Женщины с синдромом поликистозных яичников и гирсутизмом и дети с врожденной гиперплазией надпочечников ‘data-content =’ 1315 ‘> врожденная гиперплазия надпочечников имеют более высокие уровни дегидроэпиандростерона / дегидроэпиандростерона сульфата.Кроме того, уровень может быть повышен у людей с раком надпочечников (карцинома надпочечников).
Согласно некоторым исследованиям, высокий уровень дегидроэпиандростерона также снижает риск депрессии, сердечно-сосудистых заболеваний и даже смерти. Некоторые эксперты предположили, что добавки дегидроэпиандростерона могут преодолеть возрастное снижение (так называемый «эликсир молодости»), но это не подтверждается текущими данными.
Некоторые эксперты предположили, что добавки дегидроэпиандростерона могут преодолеть возрастное снижение (так называемый «эликсир молодости»), но это не подтверждается текущими данными.
Некоторые спортсмены и бодибилдеры также принимают дегидроэпиандростерон (анаболический стероид) для увеличения мышечной массы и силы.Сообщалось о серьезных побочных эффектах от приема производимого дегидроэпиандростерона, и он запрещен Всемирным антидопинговым агентством. Однако было показано, что упражнения и ограничение калорий увеличивают естественный уровень дегидроэпиандростерона в организме и могут продлить жизнь.
С 2000 года добавка дегидроэпиандростерона в сочетании с гонадотропинами используется в репродуктивной медицине как способ лечения женского бесплодия.
Что произойдет, если у меня слишком мало дегидроэпиандростерона?
Низкий уровень дегидроэпиандростерона был связан с более короткой продолжительностью жизни у мужчин, но не у женщин.Однако причина этого до конца не выяснена. Снижение уровня дегидроэпиандростерона связано с повышенным риском сердечно-сосудистых заболеваний у мужчин с сахарным диабетом 2 типа (data-content = ‘1282’> сахарный диабет) и может также привести к сокращению продолжительности жизни, хотя для подтверждения этого необходимы дальнейшие исследования.
У женщин низкие уровни дегидроэпиандростерона связаны с низким либидо, пониженной минеральной плотностью костей и остеопорозом. Однако добавление коммерчески доступного дегидроэпиандростерона не рекомендуется, поскольку есть опасения по поводу множества возможных побочных эффектов.
Последняя проверка: январь 2017 г.
Высокий и низкий уровень ДГЭА у женщин (все, что вам нужно знать)
DHEA — один из десятков гормонов в вашем организме.
У нас есть несколько общих идей о том, как высокие уровни DHEA коррелируют с определенными заболеваниями или расстройствами, а также у нас есть некоторые идеи о том, как низкие уровни DHEA могут способствовать возникновению различных симптомов.
Однако DHEA является чем-то вроде загадки — наука до сих пор не может четко понять, что он делает.
Что мы знаем о ДГЭА у женщин
Есть несколько вещей, которые мы, , знаем об этом малоизученном гормоне:
Поскольку DHEA, по-видимому, участвует в этих функциях организма, и поскольку несколько исследований показывают, что добавки DHEA могут помочь облегчить определенные симптомы у женщин (см. Симптомы низкого уровня DHEA ниже), разумно предположить, что наличие низкого или высокого уровня DHEA может вызвать некоторые симптомы.
С другой стороны, некоторые исследования показывают, что добавление ДГЭА не обязательно дает много пользы.
Это означает, что мы все еще не уверены, может ли один только DHEA быть источником проблемы — другие гормоны могут вызывать ваши симптомы.
Низкий или высокий уровень ДГЭА: возможные симптомы
Следующие симптомы, которые могут быть связаны с низким уровнем ДГЭА:
- Депрессия
- Сексуальная дисфункция (включая эректильную дисфункцию у мужчин и низкое либидо у женщин)
- Болезнь сердца
- Ожирение
- Низкая плотность костей
Многие из этих симптомов возникают из-за низкого уровня тестостерона или эстрогена — одна из причин, по которой проблема низкого уровня ДГЭА так затуманивается.
Многие симптомы высокого уровня ДГЭА очень похожи на высокий уровень тестостерона у женщин или даже на высокий уровень эстрогена.
Вот некоторые из симптомов высокого уровня ДГЭА:
- Гирсутизм (избыточный рост волос и особенности роста волос у мужчин)
- Выпадение волос
- Агрессивное поведение
- Раздражительность
- Проблемы со сном
- Акне и / или жирная кожа
Высокий уровень DHEA может быть очень серьезным индикатором более глубоких проблем:
Вопрос о том, являются ли уровни DHEA причиной ваших симптомов, сложен, потому что DHEA является гормоном-предшественником (или прогормоном).
Это означает, что DHEA обычно не остается в вашем организме как DHEA, а скорее превращается в другие гормоны — тестостерон и эстроген.
На самом деле, DHEA может превращаться в несбалансированное количество одного из этих половых гормонов — слишком много или слишком мало эстрогена или тестостерона может привести к дисбалансу и появлению симптомов .
Другими словами, реальный источник проблемы, скорее всего, не в слишком большом или слишком малом количестве корневого гормона DHEA.
Повышение DHEA — вероятно,
, а не ответПоскольку тестостерон и эстроген происходят из DHEA, на первый взгляд кажется логичным, что увеличение DHEA может помочь восстановить уровень гормонов тем, кто страдает от симптомов низкого уровня эстрогена или низкого тестостерона.
Однако это решение слишком упрощено из-за того, как ваш организм перерабатывает гормоны.
Поскольку ДГЭА может превращаться как в тестостерон, так и в эстроген, невозможно узнать или контролировать, какие гормоны вырабатывает из него ваше тело.
Таким образом, добавление DHEA в ваш организм с непредсказуемыми результатами может ухудшить дисбаланс, который у вас есть в настоящее время, или вывести другие гормоны из равновесия, создав дополнительные проблемы — у нас просто недостаточно убедительной информации, чтобы знать, что этот гормон делает, а что нет.
Многие люди, кажется, сосредотачиваются на этих менее известных гормонах, таких как DHEA, оставляя основные половые гормоны на второй план.
Вместо этого в первую очередь следует рассмотреть и тестостерон, и эстроген.
Лечение гормонального дисбаланса (включая низкий уровень ДГЭА) путем восстановления баланса
На самом деле нет необходимости полагаться на ДГЭА для лечения симптомов.
Тестостерон или эстроген можно вводить напрямую, обеспечивая лучшее и быстрое облегчение симптомов, которые вы чувствуете.
В некоторых случаях это можно сделать, устранив медицинскую причину гормонального дисбаланса.
В других случаях лечения нет, и гормоны необходимо вводить извне с помощью заместительной гормональной терапии (ЗГТ), чтобы вернуть уровень гормонов в норму.
Как правило, проблема не в одном гормоне — ДГЭА не является исключением из этого правила.
Если один из ваших гормонов слишком высокий или слишком низкий по сравнению с другими, у вас, скорее всего, появятся симптомы.
Целью любой заместительной гормональной терапии должно быть восстановление баланса между всеми вашими гормонами .
Вот почему мы хотим внимательно следить за тем, что делает ваше тело.
Важно как можно точнее определить, испытываете ли вы симптомы низкого или высокого уровня ДГЭА, или же ваши симптомы вызваны дисбалансом другого гормона.
Затем мы можем сделать предложения по лечению на основе этих первоначальных тестов.
Наконец, мы хотим увидеть, как реагирует ваше тело, отслеживать любые изменения в вашем здоровье, а затем решить, является ли большее количество одного гормона или меньше другого направлением движения.
Предупреждение о добавках DHEA, отпускаемых без рецепта
Есть много добавок DHEA, которые продаются без рецепта.
Добавки, предназначенные для повышения уровня гормонов, включая ДГЭА, обычно не работают.
На самом деле, такие добавки могут быть очень вредными для вас, поэтому даже если вы думаете, что у вас низкий уровень DHEA, прием добавки DHEA, вероятно, не лучшая идея.
Итак, начнем с уровня тестостерона и эстрогена. Сделайте полный тест на все свои гормоны и позвольте своему врачу определить, какое лечение должно быть подходящим.
Поиск источника гормонального дисбаланса
DHEA — интересный, но плохо изученный гормон, поэтому трудно найти информацию о симптомах высокого уровня DHEA у женщин (или о последствиях добавления или вычитания DHEA из вашего тела).
Самый важный шаг — окончательно выяснить, в чем причина вашей проблемы, прежде чем начинать ЗГТ любого рода.
Testosterone Centres of Texas (TCT) предлагает бесплатную консультацию, чтобы помочь вам понять основные причины ваших симптомов и разработать план лечения.
Мы стремимся к значительному улучшению качества вашей жизни за счет облегчения симптомов и тщательного поддержания безопасности и общего состояния здоровья, при этом делая лечение максимально удобным. Наше обязательство — улучшать ваш уровень здоровья по всем направлениям.
Щелкните, чтобы назначить бесплатную первичную консультацию сегодня.
Закажите бесплатную консультацию
Окончательное правило: отнесение трех стероидов к анаболическим стероидам из Списка III в соответствии с Законом о контролируемых веществах
FR Doc E9-28572 [Федеральный реестр: 4 декабря 2009 г. (том 74, номер 232)] [Правила и положения] [Страница 63603-63610] Из Федерального реестра в Интернете через доступ к GPO [wais.access.gpo.gov] [DOCID: fr04de09-21]
УПРАВЛЕНИЕ ЮСТИЦИИ
Управление по борьбе с наркотиками
21 CFR, часть 1300
[Документ №DEA-285F] RIN 1117-AB17
Классификация трех стероидов как анаболических стероидов Списка III в соответствии с Законом о контролируемых веществах
АГЕНТСТВО : Управление по борьбе с наркотиками (DEA), Министерство юстиции.
ДЕЙСТВИЕ : Окончательное правило.
РЕЗЮМЕ : С принятием этого окончательного правила заместитель администратора Управления по борьбе с наркотиками (DEA) классифицирует следующие три стероида как «анаболические стероиды» в соответствии с Законом о контролируемых веществах (CSA): Болдион, дезоксиметилтестостерон и 19 -нор-4,9 (10) — андростадиендион.Эти стероиды и их соли, сложные эфиры и простые эфиры относятся к контролируемым веществам из Списка III, подпадающим под действие нормативных положений CSA.
ДАТЫ : Дата вступления в силу: 4 января 2010 г.
ДЛЯ ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ ОБРАЩАЙТЕСЬ : Кристин А. Саннеруд, доктор философии, начальник отдела оценки лекарственных и химических веществ, Управление по борьбе с наркотиками, 8701 Morrissette Drive, Springfield, VA 22152, (202) 307-7183.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ:
И.Справочная информация
В Уведомлении о предлагаемом нормотворчестве (NPRM) (73 FR 22294), опубликованном 25 апреля 2008 года, DEA предложило классифицировать три стероида как анаболические стероиды из списка III в соответствии с CSA. Эти три стероида включали болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) — андростадиендион. С публикацией этого окончательного правила DEA классифицирует эти три стероида как анаболические стероиды из списка III. Справочная информация в поддержку этого Окончательного правила представлена ниже.
29 ноября 1990 г. Президент подписал Закон 1990 г. о контроле над анаболическими стероидами (раздел XIX Pub. L. 101-647), который вступил в силу 27 февраля 1991 г. Этот закон установил и отрегулировал анаболические стероиды как класс. лекарств из списка III CSA. В результате новый анаболический стероид не назначается в соответствии с процедурами, изложенными в 21 U.S.C. 811, но может быть административно классифицирован как анаболический стероид в процессе разработки правил путем добавления стероида к нормативному определению анаболического стероида в 21 CFR 1300.01 (б) (4).
22 октября 2004 г. Президент подписал Закон о контроле над анаболическими стероидами 2004 г. (Pub. L. 108-358), который вступил в силу 20 января 2005 г. Раздел 2 (а) Закона о контроле над анаболическими стероидами 2004 г. внесены поправки в 21 USC 802 (41) (A), заменив существующее определение «анаболический стероид». Закон о контроле над анаболическими стероидами 2004 года классифицирует лекарственное средство или гормональное вещество как анаболический стероид, если удовлетворяются следующие четыре критерия: (A) вещество химически связано с тестостероном; (B) вещество фармакологически связано с тестостероном; (C) вещество не является эстрогеном, прогестином или кортикостероидом; и (D) вещество не является дегидроэпиандростероном (DHEA).Любое вещество, отвечающее этим критериям, считается анаболическим стероидом и должно быть внесено в список контролируемых веществ, включенных в Список III. DEA обнаруживает, что болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) — андростадиендион соответствуют этому определению анаболического стероида, и добавляет их в список анаболических стероидов в 21 CFR 1300.01 (b) (4).
Анаболические стероиды — это класс препаратов с основной кольцевой структурой стероидов, которые обладают анаболическим и андрогенным действием. Прототипом анаболического стероида является тестостерон.Анаболические эффекты включают стимулирование роста мышц. Андрогенные эффекты заключаются в стимулировании развития вторичных половых признаков у мужчин, таких как растительность на лице, сгущение голоса и утолщение кожи.
В США только небольшое количество анаболических стероидов одобрено для использования человеком или ветеринаром. Утвержденные медицинские применения анаболических стероидов включают лечение дефицита андрогенов у мужчин с гипогонадизмом, дополнительную терапию для компенсации катаболизма белков, связанного с длительным приемом кортикостероидов, лечение задержки полового созревания у мальчиков, лечение метастатического рака молочной железы у женщин и лечение анемии, связанной со специфическими заболеваниями. болезни (e.г.,
[[Страница 63604]]
анемия хронической почечной недостаточности, анемия Фанкони и приобретенная апластическая анемия). Однако, за исключением лечения мужского гипогонадизма, анаболические стероиды не являются лечением первой линии из-за наличия других предпочтительных вариантов лечения. DEA не известно о каком-либо законном медицинском использовании или заявках на новые лекарства (NDA) трех веществ, которые DEA классифицирует как анаболические стероиды в соответствии с определением, изложенным в разделе 21 U.С.С. 802 (41) (А). Более того, DEA не выявило производителей химических веществ, которые в настоящее время используют эти вещества в качестве промежуточных продуктов в своем производственном процессе (ах).
Побочные эффекты связаны с использованием или злоупотреблением анаболическими стероидами. Эти эффекты зависят от нескольких факторов (например, возраста, пола, используемого анаболического стероида, используемого количества и продолжительности использования). В раннем подростковом возрасте использование тестостерона и других анаболических стероидов, обладающих эстрогенным действием, может вызвать преждевременное закрытие пластинок роста в длинных костях, что приводит к необратимой задержке роста.У мальчиков-подростков употребление анаболических стероидов может вызвать преждевременное половое развитие. Как у девочек, так и у женщин употребление анаболических стероидов вызывает постоянные физические изменения, такие как сгущение голоса, усиление роста волос на лице и теле и удлинение клитора. У мужчин использование анаболических стероидов может вызвать сокращение яичек, уменьшение количества сперматозоидов и бесплодие. Гинекомастия (то есть увеличение мужской груди) может развиться при приеме анаболических стероидов с эстрогенным действием.Как у мужчин, так и у женщин использование анаболических стероидов может повредить печень и вызвать высокий уровень холестерина, что может увеличить риск инсультов и сердечных приступов. Кроме того, предполагается, что употребление анаболических стероидов вызывает психологические эффекты, такие как агрессия, усиление чувства враждебности, психологической зависимости и зависимости. При резком прекращении длительного приема анаболических стероидов может появиться синдром отмены, включая тяжелую депрессию.
II. Оценка обязательных факторов для классификации в качестве анаболического стероида
С выпуском этого окончательного правила DEA классифицирует болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион как анаболические стероиды в соответствии с определением, изложенным в разделе 21 U.С.С. 802 (41) (А). Как отмечалось ранее, лекарственное средство или гормональное вещество классифицируется как анаболический стероид в соответствии со следующими четырьмя требованиями к определению: (A) вещество химически связано с тестостероном; (B) вещество фармакологически связано с тестостероном; (C) вещество не является эстрогеном, прогестином или кортикостероидом; и (D) вещество не является DHEA.
(A) Химически связано с тестостероном
Чтобы классифицировать вещество как анаболический стероид, вещество должно быть химически родственным тестостерону.DEA обсудило свою оценку химического взаимодействия болдиона, дезоксиметилтестостерона и 19-нор-4,9 (10) -андростадиендиона в NPRM, опубликованном 25 апреля 2008 г. (73 FR 22294). При оценке зависимости структуры и активности (SAR) для каждого из веществ химическая структура стероида сравнивалась с химической структурой тестостерона, поскольку предполагается, что вещества со структурой, аналогичной структуре тестостерона, обладают сопоставимой фармакологической и биологической активностью.
Болдион также известен под следующим химическим названием: Андроста-1,4-диен-3,17-дион.DEA определило, что химическая структура болдиона химически связана с таковой тестостерона. Химическая структура болдиона отличается от тестостерона только следующими структурными особенностями: кетонная группа на углероде 17 и двойная связь между углеродом 1 и углеродом 2. Предполагается, что человеческое тело метаболизирует кетоновую группу на углероде 17 в гидроксил. группа, которая присутствует на тестостероне (Payne and Hales, 2004; Peltoketo et al., 1999; Moghrabi and Andersson, 1998).Кроме того, в научной литературе сообщается, что дополнительная двойная связь у углерода 1 в болдионе не снижает значительно анаболическую активность вещества (Vida, 1969). Болдион — предшественник анаболических стероидов, метаболизирующийся в организме в болденон (Galletti and Gardi, 1971; Kim et al., 2006), который является анаболическим стероидом, включенным в график III (21 USC 802 (41) (A) (vi)). .
Дезоксиметилтестостерон (DMT) также известен под следующими названиями: 17α-метил-5α-андрост-2-ен-17β -ол; и мадол.DEA определило, что химическая структура дезоксиметилтестостерона химически связана с тестостероном. Химическая структура дезоксиметилтестостерона отличается от тестостерона следующими четырьмя структурными особенностями: отсутствие кетонной группы у третьего углерода, двойная связь между вторым и третьим углеродом, отсутствие двойной связи между четвертым и пятым углеродом и метильная группа у углерода 17. Каждая из этих четырех химических характеристик, как известно из научной литературы, не устраняет анаболическую и андрогенную активность вещества (Brueggemeir et al., 2002; Вида, 1969).
19-Нор-4,9 (10) -андростадиендион также известен под следующими химическими названиями: 19-Норандроста-4,9 (10) -диен-3,17-дион; и эстра-4,9 (10) -диен-3,17-дион. DEA определило, что химическая структура 19-нор-4,9 (10) -андростадиендиона химически связана с тестостероном. Химическая структура 19-нор-4,9 (10) — андростадиендиона отличается от тестостерона следующими тремя структурными особенностями: кетоновая группа у углерода 17, отсутствие метильной группы у углерода 19 и двойная связь между углеродом. 9 и углерод 10.Предполагается, что человеческое тело метаболизирует кетонную группу у углерода 17 в гидроксильную группу, подобную той, которая присутствует в тестостероне (Payne and Hales, 2004; Peltoketo et al., 1999; Moghrabi and Andersson, 1998). Кроме того, в научной литературе сообщается, что как отсутствие метильной группы у углерода 19, так и дополнительная двойная связь в 19-нор-4,9 (10) -андростадиендионе увеличивают анаболическую активность вещества (Vida, 1969).
(B) Фармакологически связано с тестостероном
Вещество также должно быть фармакологически связано с тестостероном (т.д., производят аналогичные биологические эффекты), чтобы его можно было классифицировать как анаболический стероид из списка III. Фармакология стероида по отношению к тестостерону может быть установлена путем выполнения одного или нескольких из следующих анализов андрогенной и анаболической активности: анализ вентральной простаты, анализ семенных пузырьков, анализ levator ani, тест на атрофию яичек, тест подавления гонадотропина и андроген связывание рецепторов и анализы эффективности. Эти анализы описаны ниже.
Анализ вентральной простаты, анализ семенных пузырьков и анализ Levator Ani : Классическая научная процедура для изучения эффектов стероида по сравнению с тестостероном заключается в выполнении тестов, чувствительных к тестостерону, анализа вентральной простаты, анализа семенных пузырьков и levator ani. проба на крысах.Некоторым дополнительным органам у мужчин (например, брюшной предстательной железе, семенным пузырькам и мышцам, поднимающим задний проход) особенно необходим тестостерон, чтобы расти и оставаться здоровыми. После удаления семенников (т. Е. Кастрации) основной эндогенный источник тестостерона удаляется, вызывая атрофию вентральной простаты, семенных пузырьков и мышцы, поднимающей задний проход (Eisenberg et al., 1949; Nelson et al., 1940; Scow, 1952; Wainman, Shipounoff, 1941). Многочисленные научные исследования продемонстрировали способность экзогенного тестостерона, вводимого крысам после кастрации, поддерживать нормальный вес и размер всех трех
.[[Страница 63605]]
тканей, чувствительных к тестостерону (Бискинд и Мейер, 1941; Дорфман и Дорфман, 1963; Кинкл и Дорфман, 1964; Нельсон и др., 1940; Scow, 1952; Вайнман и Шипунов, 1941). Таким образом, стероид с активностью, подобной тестостерону, также предотвратит атрофию этих трех зависимых от тестостерона тканей у кастрированных крыс.
Тест на атрофию яичек : Введение тестостерона некастрированным крысам вызывает снижение сывороточных уровней гонадотропинов (например, лютеинизирующего гормона [ЛГ] и фолликулостимулирующего гормона [ФСГ]) от нормального уровня. Гонадотропины — это гормоны гипофиза, которые влияют на размер и функцию яичек.Подавление этих гонадотропинов избытком тестостерона приводит к значительному уменьшению размера и веса семенников (Boris et al., 1970; McEuen et al., 1937; Moore and Price, 1938). Соответственно, стероид с активностью, подобной тестостерону, также значительно уменьшит размер и вес яичек.
Анализ подавления гонадотропинов : кастрация крыс вызывает значительное повышение сывороточных уровней гонадотропинов (то есть ЛГ и ФСГ) выше нормальных уровней из-за удаления основного источника эндогенного тестостерона (Gay and Bogdanove, 1969; Swerdloff и другие., 1972, 1973; Свердлов и Уолш, 1973). Введение тестостерона кастрированным животным подавляет повышение уровня гонадотропинов в сыворотке крови (Gay and Bogdanove, 1969; Swerdloff et al., 1972; Swerdloff and Walsh, 1973; Verjans et al., 1974). Введение анаболических стероидов с тестостероноподобной активностью также предотвратит это повышение сывороточных уровней ЛГ и ФСГ.
Анализ связывания и эффективности рецептора андрогена : Тесты связывания и эффективности рецептора андрогена также используются для демонстрации того, что активность стероида аналогична активности тестостерона.Тестостерон оказывает свое анаболическое действие после связывания с рецептором андрогена и его активации. С помощью различных клеточных анализов можно сравнить стероиды-кандидаты с тестостероном на предмет их способности связываться с рецепторами андрогенов и активировать их.
Существует несколько различных типов анализов, используемых для установления связывания и эффективности рецепторов андрогенов. В одном анализе стволовые клетки C3h20T1 / 2 экспрессируют рецепторы андрогенов и используются для оценки способности стероидов связывать и активировать рецепторы андрогенов (Jasuja et al., 2005а, б; Singh et al., 2003). В этих стволовых клетках транслокация рецептора андрогена в ядро клетки в присутствии лиганда (например, тестостерона или его активного метаболита дигидрокситестостерона) подтверждает, что лиганд связывается с рецептором андрогена и активирует нижестоящий сигнальный каскад. При активации стволовые клетки C3h20T1 / 2 дифференцируются в клетки скелетных мышц, что демонстрируется увеличением экспрессии специфичных для мышц белков (т. Е., фактор транскрипции миогенной детерминации [MyoD] и тяжелая цепь миозина [MHC]). В другом анализе используются клетки рака груди человека, генетически измененные, чтобы содержать определенный репортерный ген (например, ген люциферазы), регулируемый активацией рецептора андрогена (Hartig et al., 2002; Wilson et al., 2002). Экспрессия биолюминесцентного белка (например, люциферазы) сигнализирует как о связывании рецептора андрогена, так и об его активации.
Результаты анализов андрогенной и анаболической активности : Как обсуждалось в NPRM, в январе 2006 года DEA провело обзор опубликованной научной литературы на предмет фармакологических данных об анаболической и андрогенной активности болдиона, дезоксиметилтестостерона и 19-нор-4,9 (10) -андростадиендион с использованием анализов, описанных выше.Как обсуждается ниже, в обзорной научной литературе было достаточно информации о фармакологии дезоксиметилтестостерона, чтобы определить, что дезоксиметилтестостерон фармакологически связан с тестостероном (т.е. оказывает биологические эффекты, аналогичные действию тестостерона). Однако в опубликованной литературе не было достаточных фармакологических данных, чтобы определить, связаны ли болдион и 19-нор-4,9 (10) -андростадиендион фармакологически с тестостероном.Следовательно, как обсуждается ниже и в NPRM, DEA спонсировало фармакологические исследования, включающие несколько различных анализов андрогенной и анаболической активности, чтобы получить данные, необходимые для этого определения.
Результаты анализа андрогенной и анаболической активности показывают, что болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) — андростадиендион обладают фармакологической активностью, аналогичной тестостерону.
Болдионе
DEA спонсировало исследование \ 1 \ Администрации ветерана Пьюджет-Саунд Health Care System для определения анаболических и андрогенных эффектов болдиона у интактных и кастрированных крыс (Matsumoto and Marck, 2006).Результаты этих исследований сравнивались с результатами исследования той же лаборатории с использованием аналогичного протокола для характеристики андрогенных и анаболических эффектов тестостерона (Marck et al., 2003). Болдион, вводимый кастрированным самцам крыс с помощью силиконовых капсул, имплантированных под кожу, предотвращал атрофию брюшной простаты, семенных пузырьков, поднимающей задний проход мышцы и повышение уровня гонадотропина (ЛГ и ФСГ) в сыворотке крови, связанное с кастрацией. Введение Болдиона также вызывало атрофию яичек у интактных крыс.В другом исследовании, спонсируемом DEA, в лаборатории Бостонского университета [2] изучали способность болдиона связываться с рецептором андрогенов и вызывать дифференцировку стволовых клеток C3h20T1 / 2 в мышечные клетки (Bhasin, 2005). Все эти эффекты, вызванные болдионом в стволовых клетках C3h20T1 / 2, были сопоставимы с эффектами тестостерона, как было установлено в экспериментах с использованием той же или аналогичной методологии (Singh et al., 2003). В совокупности данные указывают на то, что фармакология болдиона аналогична тестостерону.
————————————————- —————————
\ 1 \ Исследование системы здравоохранения Пьюджет-Саунд при администрации ветеранов можно найти на http://www.regulations.gov в электронном досье, связанном с этим нормотворчеством. \ 2 \ Исследование Бостонского университета можно найти на http://www.regulations.gov в электронном досье, связанном с этим нормотворчеством.
————————————————- —————————
Дезоксиметилтестостерон
Дезоксиметилтестостерон вводили кастрированным крысам подкожно, перорально или внутримышечно (Dorfman and Kincl, 1963; Kincl and Dorfman, 1964; Nutting et al., 1966). При всех трех способах введения дезоксиметилтестостерон предотвращал атрофию вентральной части простаты, семенных пузырьков и мышцы, поднимающей задний проход. Дезоксиметилтестостерон также индуцировал экспрессию биолюминесцентной протеин-люциферазы в клетках рака молочной железы CAMA-1, сигнализируя о связывании и активации андрогенных рецепторов (Ayotte et al., 2006). В совокупности данные указывают на то, что фармакология дезоксиметилтестостерона аналогична тестостерону. 19-нор-4,9 (10) -андростадиендион
Как обсуждалось в NPRM, DEA спонсировало исследование \ 3 \ Администрации ветерана Puget Sound Health Care System для определения анаболических и андрогенных эффектов 19-нор-4,9 (10) — андростадиендиона у интактных и кастрированных крыс (Мацумото и Марк, 2006).Результаты этих исследований сравнивались с результатами исследования той же лаборатории с использованием аналогичного протокола для характеристики андрогенных и анаболических эффектов тестостерона (Marck et al., 2003). 19-Нор-4,9 (10) —
[[Страница 63606]]
андростадиендион, вводимый кастрированным самцам крыс с помощью силиконовых капсул, имплантированных под кожу, предотвращал атрофию брюшной простаты, семенных пузырьков, поднимающей задний проход мышцы и повышение уровня гонадотропинов (ЛГ и ФСГ) в сыворотке крови, связанное с кастрацией.В другом исследовании, спонсируемом DEA, в лаборатории Бостонского университета \ 4 \ изучалась способность 19-нор-4,9 (10) -андростадиендиона связываться с рецептором андрогенов и вызывать дифференцировку стволовых клеток C3h20T1 / 2 в мышечные клетки ( Бхасин, 2005). 19-Нор-4,9 (10) -андростадиендион индуцировал транслокацию рецептора андрогена в ядро стволовых клеток C3h20T1 / 2, демонстрируя аффинность связывания и эффективность в отношении рецептора андрогена. Все эти эффекты, вызванные 19-нор-4,9 (10) — андростадиендионом в стволовых клетках C3h20T1 / 2, были сопоставимы с эффектами тестостерона, установленными в экспериментах с использованием той же или аналогичной методологии (Singh et al., 2003). В совокупности данные указывают на то, что фармакология 19-нор-4,9 (10) -андростадиендиона аналогична тестостерону.
————————————————- —————————
\ 3 \ Исследование системы здравоохранения Пьюджет-Саунд при администрации ветеранов можно найти на http://www.regulations.gov в электронном досье, связанном с этим нормотворчеством. \ 4 \ Исследование Бостонского университета можно найти по адресу http: // www.rules.gov в электронном досье, связанном с этим нормотворчеством.
————————————————- —————————
(C) Не эстрогены, прогестины и кортикостероиды
Как обсуждалось в NPRM, DEA определило, что болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион не связаны с эстрогенами, прогестинами и кортикостероидами. DEA провело оценку SAR для каждого из веществ.Химическая структура каждого вещества сравнивалась со структурой эстрогенов, прогестинов и кортикостероидов, поскольку химическая структура может быть связана с его фармакологической и биологической активностью. DEA обнаружило, что у этих трех веществ отсутствует необходимая химическая структура для обеспечения значительной эстрогенной активности (например, ароматического кольца А) (Duax et al., 1988; Jordan et al., 1985; Williams and Stancel, 1996), прогестагенной активности (например, 17β-алкильная группа) (Williams and Stancel, 1996) или кортикостероидная активность (например,g., 17-кетонную группу или 11β-гидроксильную группу) (Miller et al., 2002).
(D) Не дегидроэпиандростерон
Дегидроэпиандростерон, также известный как DHEA, не подлежит контролю как анаболический стероид по определению (21 U.S.C. 802 (41) (A)). Болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион не относятся к дегидроэпиандростерону и поэтому не освобождаются от контроля на этом основании.
III. Полученных комментариев
25 апреля 2008 г. DEA опубликовало NPRM (73 FR 22294), в котором предлагалось классифицировать болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион как анаболические стероиды из списка III.Предлагаемое правило предоставило возможность всем заинтересованным лицам представить свои комментарии до 24 июня 2008 г. или ранее. В ответ на NPRM DEA получило один комментарий от консалтинговой фирмы, которая описала себя как «помощь компаниям, производящим пищевые добавки, в понимании правительства. правила, способствуя их росту «. Эти комментарии обобщены и даны ответы на них ниже.
Дезоксиметилтестостерон: комментатор указал, что цитируемая в NPRM научная литература, относящаяся к дезоксиметилтестостерону, была достаточной, чтобы соответствовать четырем критериям, которым должен удовлетворять DEA для обозначения стероида в качестве анаболического стероида из списка III.DEA соглашается с этим выводом. Поэтому DEA помещает дезоксиметилтестостерон в список III в качестве анаболического стероида, как это предлагается.
Химическая связь болдиона и 19-нор-4,9 (10) — андростадиендиона с тестостероном: автор сообщения утверждал, что DEA не смог показать, что болдион и 19-нор-4,9 (10) -андростадиендион химически связаны с тестостероном. Комментатор утверждал, что оба стероида заметно отличаются от тестостерона тем, что в каждом отсутствует 17β-гидроксил, который присутствует в тестостероне.Комментатор отметил, что DEA не предоставило никаких оснований для утверждения о том, что «человеческое тело, как ожидается, будет метаболизировать кетонную группу у углерода 17 в гидроксильную группу, которая присутствует в тестостероне».
Ответ DEA: DEA не согласен с этим комментарием. Присутствие кетонной группы у углерода 17 в болдионе и 19-нор-4,9 (10) — андростадиендиона согласуется с тем, что оба стероида химически связаны с тестостероном, который имеет гидроксильную группу вместо кетонной группы у углерода 17.Известно, что фермент 17β-гидроксистероиддегидрогеназа ответственен за катализ превращения 17-кетонной группы в 17β-гидроксильную группу в стероидах, таких как андрогены и эстрогены. Этот фермент в различных изоферментных формах был зарегистрирован во многих тканях организма человека и различных видов животных (Payne and Hales, 2004; Peltoketo et al., 1999; Moghrabi and Andersson, 1998; Melewich et al., 1981). Принимая во внимание широкое распространение этого фермента в тканях людей и животных, ожидается, что этот фермент будет преобразовывать 17-кетоновую группу, содержащуюся в болдионе, и 19-нор-4,9 (10) -андростадиендион в 17β — гидроксильная группа, тем самым продуцируя болденон и 19-нор-4,9 (10) -андростадиен-3-он-17β -ол.Прямые доказательства того, что это преобразование происходит, поступают из двух исследований, показывающих, что болдион превращается в болденон, анаболический стероид, включенный в график III, в организме человека (Galletti and Gardi, 1971; Kim et al., 2006). Следовательно, наличие кетонной группы у углерода 17 в болдионе и 19-нор-4,9 (10) -андростадиендионе согласуется с тем, что оба стероида химически связаны с тестостероном.
исследований фармакологической взаимосвязи, спонсируемых DEA: комментатор утверждал, что двух исследований, спонсируемых DEA, было недостаточно для обоснования определения фармакологической связи болдиона и 19-нор-4,9 (10) -андростадиендиона с тестостероном.
Ответ DEA: DEA не согласен с этим утверждением. Исследование с использованием клеток C3h20T1 / 2 демонстрирует способность обоих стероидов действовать как тестостерон в связывании и активации рецептора андрогенов, что приводит к синтезу белка и образованию мышечной трубки. Второе исследование показывает способность стероидов действовать как тестостерон, обращая вспять эффекты кастрации крысы на размер выбранных андроген-селективных органов (вентральная простата, семенные пузырьки, поднимающая задний проход).Этот конкретный анализ использовался в сотнях исследований в научном и промышленном сообществе для оценки анаболической и андрогенной активности стероидов, аналогичной активности тестостерона (Vida, 1969). Кроме того, эффекты этих двух стероидов на уровни ЛГ и ФСГ и размер яичек у интактных крыс также соответствуют фармакологическим эффектам, аналогичным эффектам тестостерона. В совокупности оба исследования демонстрируют, что болдион и 19-нор-4,9 (10) -андростадиендион фармакологически сходны с тестостероном.
Исследование, спонсируемое DEA в Бостонском университете: комментатор утверждал, что фармакологический анализ болдиона и 19-нор-4,9 (10) — андростадиендиона на андрогенную активность с использованием стволовых клеток C3h20T1 / 2 не показал фармакологической взаимосвязи. По словам комментатора, эта неудача была вызвана: (1) невозможностью получить случайную выборку клеток C3h20T1 / 2; (2) ошибочное предположение, что простая привязка к
[[Страница 63607]]
рецептора андрогена и транслокации в ядро достаточно для проявления андрогенной активности; и (3) более низкая эффективность болдиона и 19-нор-4,9 (10) -андростадиендиона по сравнению с дигидротестостероном в анализе.
Ответ DEA: DEA не соглашается с этими комментариями. Во-первых, для проведения исследования было необходимо, как предусмотрено в протоколе, идентифицировать партии клеток C3h20T1 / 2, которые могли дифференцироваться в миогенные клетки при воздействии анаболических стероидов. Это было сделано и проверено с использованием анаболического стероида дигидротестостерона по схеме III в качестве положительного контроля. Во-вторых, это исследование не просто изучало связывание рецептора андрогена и последующую транслокацию связанного рецептора в ядро.Вместо этого, что касается болдиона, 19-нор-4,9 (10) — андростадиендиона и дигидротестостерона, исследование также продемонстрировало, что это связывание и транслокация в ядро приводят к обязательству этих клеток формировать мышечные клетки, что подтверждается выбранными экспрессия белков и создание мышечных трубок. Эти различные эффекты ранее были вызваны воздействием на клетки C3h20T1 / 2 анаболических стероидов схемы III тестостерона, андростендиона и тетрагидрогестринона (Singh et al., 2003; Jasuja et al., 2005a, b). Тот факт, что болдион и 19-нор-4,9 (10) -андростадиендион были менее эффективны, чем дигидротестостерон, в отношении этих эффектов, не препятствует использованию этой информации для подтверждения фармакологического сходства этих стероидов с тестостероном. Это просто означает, что для достижения эффекта требуется более высокая доза двух стероидов.
Исследование, спонсируемое DEA, проведенное администрацией ветеранов Puget Sound Health Care System: комментатор также утверждал, что DEA не смог показать в исследовании на крысах, что болдион и 19-нор-4,9 (10) -андростадиендион вызывают андрогенные и анаболические эффекты, тем самым неспособность показать фармакологическое отношение к тестостерону.Комментатор указал, что этот вывод основан на ограниченном приросте веса или отсутствии прибавки веса, обнаруженном у животных, получавших эти стероиды, по сравнению с контрольными животными, не подвергавшимися воздействию стероидов. Кроме того, комментатор отметил в качестве доказательства невозможности продемонстрировать андрогенную активность утверждение в отчете об исследовании, которое гласило: «Прямая андрогенная и анаболическая активность 1,4-андростадиен-3,17-диона у крыс с ложной операцией меньше. Чисто.»
Ответ DEA: DEA не согласен с этим комментарием.DEA считает, что с помощью этого анализа было обнаружено, что оба стероида обладают фармакологическими эффектами, подобными действию тестостерона. Хотя в исследовании регистрировалась масса тела, она не использовалась в качестве конечной точки для определения анаболических или андрогенных эффектов. Это произошло из-за того, что регулирование массы тела является сложным и включает, среди прочего, прием пищи, изменения жировой массы и изменения безжировой массы тела. Вместо этого андрогенные и анаболические эффекты обоих стероидов были продемонстрированы их способностью обращать вспять эффекты кастрации самцов крыс на размер брюшной простаты, семенных пузырьков и мышцы, поднимающей задний проход, причем все три являются тканями, чувствительными к андрогенам.Как обсуждалось в NPRM, многочисленные научные исследования показали, что введение экзогенного тестостерона кастрированным крысам может обратить вспять эффекты кастрации на вентральную простату, семенные пузырьки и мышцу, поднимающую задний проход (Biskind and Meyer, 1941; Dorfman and Dorfman, 1963; Kincl. и Dorfman, 1964; Nelson et al., 1940; Scow, 1952; и Wainman and Shipounoff, 1941). Этот конкретный анализ на протяжении многих лет широко использовался научным сообществом, включая фармацевтическую промышленность, для оценки анаболической и андрогенной активности стероидов (Vida, 1969).Авторы исследования, спонсируемого DEA, в частности, заключают, что «Таким образом, мы обнаружили, что 1,4-андростадиен-3,17-дион (A0100) и 4,9-эстрадиен-3,17-дион (E0160) продемонстрировали андрогенные свойства. активность, о чем свидетельствует стимуляция андрогенных тканей (предстательной железы и семенных пузырьков) и анаболическая активность, о чем свидетельствует стимуляция роста мышцы, поднимающей задний проход, у кастрированных самцов крыс ».
Что касается комментария об андрогенной активности, комментатор не предоставил полное заявление из отчета, которое гласит: «Прямая андрогенная и анаболическая активность 1,4-андростадиен-3,17-диона у крыс с ложной операцией менее очевидна из-за измеренное повышение уровня тестостерона в сыворотке, которое может опосредовать андрогенную и анаболическую активность 1,4-андростадиен-3,17-диона.«В этом заявлении в отчете упоминается возможность того, что фармакологические эффекты (снижение уровней ЛГ и ФСГ и размер яичек) 1,4-андростадиен-3,17-диона могут быть косвенно результатом метаболизма активного стероида, такого как тестостерон. Как отмечается в отчете, невозможно определить, действительно ли 1,4-андростадиен-3,17-дион метаболизируется до тестостерона или какого-либо другого вещества, которое перекрестно реагирует в тесте на тестостерон. 3,17-дион действует напрямую или служит пролекарством, но при введении крысам он по-прежнему оказывает фармакологические эффекты, аналогичные действию тестостерона.
DEA проанализировало полученный комментарий и пришло к выводу, что он не дает никаких оснований для оспаривания определения, что болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион являются анаболическими стероидами.
IV. Заключение и влияние окончательного правила
Заключение
Таким образом, на основании вышеизложенного DEA заключает, что болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион соответствуют определению CSA как «анаболический стероид», потому что каждое вещество: (A) химически связано с тестостероном; (B) фармакологически связаны с тестостероном; (C) не эстроген, прогестин или кортикостероид; и (D) не DHEA (21 U.С.С. 802 (41) (А)). Все анаболические стероиды классифицируются как контролируемые вещества из списка III (21 U.S.C.812 (e), список III). Как только определено, что вещество является анаболическим стероидом, DEA не может по своему усмотрению вносить эти вещества в список. Как обсуждается ниже, на дату вступления в силу этого Окончательного правила все требования, относящиеся к регулируемым веществам из Списка III, относятся к этим трем веществам.
Влияние классификации этих веществ как анаболических стероидов
Классификация болдиона, дезоксиметилтестостерона и 19-нор-4,9 (10) -андростадиендиона как анаболических стероидов из Списка III делает эти три вещества подпадающими под действие требований CSA.Любое лицо, которое производит, распространяет, распределяет, импортирует или экспортирует болдион, дезоксиметилтестостерон или 19-нор-4,9 (10) -андростадиендион, или которое занимается исследованиями или ведет учебную деятельность в отношении этих трех веществ, должно получить График III регистрации в соответствии с CSA и его подзаконными актами.
По состоянию на 4 января 2010 г. производство, импорт, экспорт, распространение или продажа болдиона, дезоксиметилтестостерона и 19-нор-4,9 (10) -андростадиендиона, за исключением зарегистрированных в DEA лиц, является нарушением CSA, которое может повлекут за собой тюремное заключение и штраф (21 U.S.C.841 и 960). Владение этими тремя стероидами, если они не получены законным путем, также подлежит уголовному наказанию (21 U.S.C.844). Кроме того, согласно CSA, эти три вещества могут ввозиться только
.[[Страница 63608]]
для медицинского, научного или другого законного использования (21 USC 952 (b)) в соответствии с декларацией на импорт, поданной в DEA (21 CFR 1312.18). Импорт этих веществ будет незаконным, если лицо, импортирующее эти вещества, не будет зарегистрировано в DEA в качестве импортера или исследователя и не подаст необходимую декларацию для каждой партии.Лицо, которое покупает любое из этих веществ напрямую у иностранных компаний и отправляет их в США, считается импортирующим, даже если стероиды предназначены для личного использования. Незаконный ввоз этих веществ является нарушением CSA, что может привести к тюремному заключению и штрафам (21 U.S.C.960).
Требования к обращению с веществами, определяемыми как анаболические стероиды
Начиная с 4 января 2010 г., болдион, дезоксиметилтестостерон и 19-нор-4,9 (10) -андростадиендион подпадают под регулирующий контроль CSA, а также административные, гражданские и уголовные санкции, применимые к производству, распространению, отпуску, импорту и вывоз регулируемого вещества из Списка III, в том числе следующего:
Регистрация .Любое лицо, которое производит, распространяет, распределяет, импортирует, экспортирует или участвует в исследованиях или проводит учебные мероприятия с веществом, определяемым как анаболический стероид, или которое желает участвовать в такой деятельности, должно быть зарегистрировано для проведения такой деятельности с контролируемым списком III. вещества в соответствии с 21 CFR часть 1301.
Безопасность . Вещества, определенные как анаболические стероиды, подпадают под требования безопасности по списку III-V и должны производиться, распространяться и храниться в соответствии с 21 CFR 1301.71, 1301,72 (б), (в) и (г), 1301,73, 1301,74, 1301,75 (б) и (в), 1301,76 и 1301,77.
Этикетка и упаковка . Все этикетки и маркировка коммерческих контейнеров с веществами, определяемыми как анаболические стероиды, которые распространяются 4 января 2010 г. или позднее, должны соответствовать требованиям 21 CFR 1302.03-1302.07.
Опись . Каждый регистрант, от которого требуется вести учет и который обладает любым количеством любого вещества, определяемого как анаболический стероид, должен вести инвентаризацию всех имеющихся запасов веществ в соответствии с 21 CFR 1304.03, 1304.04 и 1304.11. Каждый регистрант, желающий зарегистрировать в Приложении III какое-либо вещество, определяемое как анаболический стероид, должен провести инвентаризацию всех запасов веществ, имеющихся в наличии на момент регистрации.
Записи . Все зарегистрированные лица обязаны вести записи в соответствии с 21 CFR 1304.03, 1304.04, 1304.05, 1304.21, 1304.22, 1304.23. Рецепты. Все рецепты на эти вещества из Списка III или на продукты, содержащие эти вещества из Списка III, должны быть выданы в соответствии с 21 CFR 1306.03-1306.06 и 1306.21-1306.27. Все рецепты на эти соединения из Списка III или на продукты, содержащие эти вещества из Списка III, если разрешено пополнение, ограничены пятью заправками в течение шести месяцев с даты выдачи рецепта.
Импорт и экспорт . Любой импорт и экспорт любого вещества, определяемого как анаболический стероид, должен соответствовать требованиям 21 CFR, часть 1312.
Уголовная ответственность .Любая деятельность с каким-либо веществом, определяемым как анаболический стероид, не разрешенная или нарушающая Закон о контролируемых веществах или Закон об импорте и экспорте контролируемых веществ, имеющая место 4 января 2010 г. или позднее, является незаконной.
Утилизация анаболических стероидов
Лица, обладающие веществами, классифицируемыми как анаболические стероиды, и желающие избавиться от них, вместо того, чтобы регистрироваться для обращения с ними, должны обратиться в местный полевой офис DEA Diversion для получения помощи в законной утилизации этих веществ.Местные отделения DEA Diversion предоставят этому человеку инструкции по утилизации. Список местных отделений DEA Diversion можно найти на http://www.deadiversion.usdoj.gov.
Нормативные сертификаты
Закон о гибкости регулирования
Заместитель администратора настоящим удостоверяет, что это нормотворчество было разработано в соответствии с Законом о гибкости регулирования (5 U.S.C. 601-612). Это регулирование не окажет значительного экономического воздействия на значительное количество малых предприятий.По состоянию на август 2008 года DEA выявило 61 пищевую добавку, предназначенную для наращивания мышечной массы и увеличения силы, которая, как предполагается, содержит болдион, дезоксиметилтестостерон или 19-нор-4,9 (10) -андростадиендион. Предполагается, что семь пищевых добавок содержат болдион; двадцать три пищевые добавки содержат дезоксиметилтестостерон; и тридцать одна пищевая добавка содержит 19-нор-4,9 (10) — андростадиендион. Все 61 биологически активная добавка продается и продается в Интернете.
Производители и дистрибьюторы 61 идентифицированной пищевой добавки, якобы содержащей болдион, дезоксиметилтестостерон или 19-нор-4,9 (10) -андростадиендион, также продают множество других пищевых добавок. DEA выявило значительное количество интернет-дистрибьюторов, которые продают эти пищевые добавки. Однако эти дистрибьюторы также продают множество других пищевых продуктов. DEA не получало никакой информации относительно процента доходов, полученных от этих пищевых добавок.DEA не получало никаких комментариев относительно законного использования этих трех веществ. DEA не выявило производителей химической продукции, которые в настоящее время используют эти вещества в качестве промежуточных продуктов в своем производственном процессе (ах).
По состоянию на август 2008 года DEA выявило 32 производителя и дистрибьютора химических веществ, которые продают хотя бы одно из трех веществ. Большинство компаний находятся в Китае и продают различные стероиды. DEA отмечает, что, поскольку подавляющее большинство организаций, занимающихся этими веществами, работают в Интернете, практически невозможно точно определить количество людей, работающих с этими веществами в любой момент времени.Кроме того, DEA не имеет информации о процентной доле дохода от этих веществ для каждого обработчика.
DEA выявило пять компаний, базирующихся в США, которые зарегистрированы в DEA, которые производят и / или распространяют по крайней мере одно из этих веществ в качестве эталонных продуктов для испытательных лабораторий. DEA отмечает, что при включении в список III эти вещества могут использоваться в аналитических целях. Эти компании зарегистрированы в DEA и уже соблюдают правила реализации CSA и DEA в отношении обращения с веществами из Списка III.
Распоряжение 12866
Заместитель Администратора настоящим удостоверяет, что это нормотворчество было разработано в соответствии с Правительственным Указом 12866, раздел 1 (b). Было определено, что это правило является важным нормативным актом. Таким образом, это действие было рассмотрено Управлением и бюджетом.
Как обсуждалось выше, действие этого правила удаляет продукты, содержащие эти вещества, с внебиржевого рынка. DEA не имеет оснований для оценки размера рынка этих продуктов.Однако DEA отмечает, что практически все вещества импортируются. Согласно данным Комиссии по международной торговле США, стоимость импорта всех анаболических стероидов за первые одиннадцать месяцев 2008 года составила 2,1 миллиона долларов. Эти три вещества —
[[Страница 63609]]
— подмножество этого импорта. Стоимость импорта анаболических стероидов за первые одиннадцать месяцев 2008 года снизилась на 28,1 процента по сравнению с аналогичным периодом 2007 года; количество импортированных в течение первых одиннадцати месяцев уменьшилось на 60.1 процент по сравнению с сопоставимым периодом 2007 года. Таким образом, общий рынок этих продуктов, содержащих эти вещества, вероятно, довольно невелик. Более того, DEA считает, что ввоз этих трех веществ осуществляется в незаконных целях.
Преимущество контроля над этими веществами состоит в том, чтобы удалить с рынка вещества, которые имеют опасные побочные эффекты и не могут использоваться в медицинских целях в США в законных целях. Как подробно обсуждалось выше, эти вещества могут оказывать серьезное воздействие на здоровье подростков и взрослых.Если медицинское использование этих веществ будет разработано и одобрено, лекарства будут доступны как контролируемые вещества из Списка III в соответствии с рецептом, выданным медицинским работником для законных медицинских целей. Однако до этого времени это действие запрещает импорт, экспорт и продажу этих трех веществ, за исключением законных исследовательских или промышленных целей.
Распоряжение 12988
Этот регламент соответствует применимым стандартам, изложенным в разделах 3 (a) и 3 (b) (2) Исполнительного указа 12988 «Реформа гражданской юстиции».
Распоряжение 13132
Это нормотворчество не отменяет и не изменяет какое-либо положение закона штата; он также не налагает ответственности за исполнение на какое-либо государство; при этом это не умаляет возможности любого государства обеспечивать соблюдение своих собственных законов. Соответственно, это нормотворчество не имеет последствий для федерализма, требующих применения Указа Президента 13132.
Закон о сокращении бумажного документооборота
Это правило регулирует действие трех анаболических стероидов, которые не одобрены для медицинского применения у людей и не одобрены для введения крупному рогатому скоту или другим нелюдям.Только производители химикатов, которые могут использовать эти вещества в качестве химических промежуточных продуктов для синтеза других стероидов, должны зарегистрироваться в DEA в соответствии с CSA. Однако DEA не выявило производителей химической продукции, которые в настоящее время используют эти вещества в качестве промежуточных продуктов в своем производственном процессе (ах). Таким образом, DEA не ожидает, что это правило возложит дополнительную нагрузку на регулируемую отрасль по оформлению документов.
Закон о реформе необеспеченных мандатов 1995 г.
Это правило не приведет к расходам государственных, местных и племенных органов власти, в совокупности или со стороны частного сектора, в размере 120000000 долларов США или более (с поправкой на инфляцию) в течение какого-либо одного года и не окажет существенного или однозначного влияния на небольшие правительства.Следовательно, не было сочтено необходимым никаких действий в соответствии с положениями Закона о реформе нефинансируемых мандатов 1995 года.
Закон о пересмотре Конгресса
Это правило не является основным правилом, как это определено в Разделе 804 Закона о справедливости регулирования малого бизнеса от 1996 года (Закон о пересмотре Конгресса). Это правило не приведет к ежегодному эффекту для экономики в размере 100 000 000 долларов и более; значительное увеличение стоимости или цен; или существенное неблагоприятное воздействие на конкуренцию, занятость, инвестиции, производительность, инновации или на способность компаний США конкурировать с иностранными компаниями на внутреннем и внешнем рынках.
Список субъектов 21 CFR Part 1300
Химические вещества, Контроль за оборотом наркотиков.
По причинам, изложенным выше, 21 CFR Часть 1300 изменена следующим образом:
ЧАСТЬ 1300 — ОПРЕДЕЛЕНИЯ
- 1. Официальная ссылка на часть 1300 по-прежнему гласит:
Орган : 21 U.S.C. 802, 821, 829, 871 (б), 951, 958 (ж).
- 2. Раздел 1300.01 изменен в пункте (b) (4) следующим образом:
- A. Изменить обозначение пунктов (b) (4) (xiii) — (b) (4) (lx) на (b) (4) (xiv) — (b) (4) (lxi),
- B. Добавление нового параграфа (b) (4) (xiii),
- C. Дальнейшее изменение обозначения вновь обозначенных параграфов с (b) (4) (xvii) по (b) (4) (lxi) на (b) (4) (xviii) по (b) (4) (lxii),
- D. Добавление нового пункта (b) (4) (xvii),
- E. Дальнейшее изменение обозначения вновь обозначенных параграфов с (b) (4) (xlvii) по (b) (4) (lxii) на (b) (4) (xlviii) по (b) (4) (lxiii) и
- F.Добавить новый пункт (b) (4) (xlvii) следующего содержания:
сек. 1300.01 Определения, касающиеся контролируемых веществ.
* * * * *
(б) * * *
(4) * * *
(xiii) болдион (андроста-1,4-диен-3,17-дион) * * * * *
(xvii) дезоксиметилтестостерон (17α-метил-5α-андрост-2-ен-17β -ол) (он же мадол)
* * * * *
(xlvii) 19-нор-4,9 (10) -андростадиендион (эстра-4,9 (10) -диен-3,17-дион)
* * * * *
Дата: 20 ноября 2009 г.
Мишель М. Леонхарт,
Заместитель администратора.
Список литературы
Ayotte, C., Goudreault, D., Gauthier, J., Ayotte, P., Larochelle, C., and Poirier, D. (2006). Характеристика химических и гормональных свойств нового стероида, связанного с допингом спортсменов. Представлено на Кельнском семинаре по анализу допинга, июнь 2006 г. Бхасин, С. (2005). [Фармакологический анализ болдиона и 19-нор-4,9 (10) -андростадиендиона на андрогенную активность с использованием стволовых клеток C3h20T1 / 2].Неопубликованный отчет.
Бискинд, Г. и Мейер, М.А. (1941). Сравнительная андрогенная активность тестостерона, метилтестостерона и пропионата тестостерона, вводимых в форме гранул. Эндокринология, 28 (2): 217-221.
Борис А., Стивенсон Р. Х. и Трмал — Т. (1970). Сравнительные андрогенные, миотрофические и антигонадотропные свойства некоторых анаболических стероидов. Стероиды, 15 (1): 61-71.
Brueggemeier, R.W., Miller, D.D., and Dalton, J.T. (2002).Эстроген, прогестины и андрогены. В D.A. Уильямс и Т. Лемке (ред.) Принцип медицинской химии Фуа (5-е изд.). Филадельфия, Липпинкотт Уильямс и Уилкинс. Дорфман Р.И., Дорфман А.С. (1963). Анализ подкожно введенных андрогенов у кастрированной крысы. ACTA Endocrinologica, 42: 245-253.
Дорфман, Р.И. и Кинкл, Ф.А. (1963). Относительная эффективность различных стероидов в анаболико-андрогенном анализе с использованием кастрированной крысы. Эндокринология, 72: 259-266.
Duax, W.L., Griffin, J.F., Weeks, C.M., and Wawrzak, Z. (1988). Механизм действия антагонистов стероидов: выводы из кристаллографических исследований. Журнал биохимии стероидов и молекулярной биологии, 31: 481-492.
Эйзенберг, Э., Гордан, Г.С. и Эллиотт, Х.В. (1949). Тестостерон и тканевое дыхание кастрированного самца крысы с возможным тестом на миотрофическую активность. Эндокринология, 45 (2): 113-119.
Галлетти Ф. и Гарди Р. (1971).Метаболизм 1-дегидроандростанов у человека: 1. Метаболизм 17бета-гидроксиандроста 1,4-диен-3-она, 17бета-циклопент-1′-энлоксиандроста-1,4-диен-3-она (хинболон) и андрост- 1,4-диен-3,17-дион. Стероиды, 18 (1): 39-50.
Гей, В.Л. и Богданове, Э.М. (1969). ЛГ и ФСГ в плазме и гипофизе у кастрированных крыс после кратковременного приема стероида
[[Страница 63610]]
обращения. Эндокринология, 84: 1132-1142.
Хартиг, П.К., Бобсейн, К.Л., Бритт, Б.Х., Кардон, М.С., Ламбрайт, К.Р., Уилсон, В.С., и Грей, Л. (2002). Разработка двух анализов рецепторов андрогенов с использованием аденовирусной трансдукции репортера MMTV-Luc и / или hAR для эндокринного скрининга. Токсикологические науки, 66: 82-90.
Ясуджа, Р., Кэтлин, Д.Х., Миллер, А., Чанг, Ю.-К., Хербст, К.Л., Старчевич, Б., Артаза, Д.Н., Синг, Р., Датта, Г., Саркисян, А. , Чандсавангбхувана, К., Бейкер, М., и Бхасин, С. (2005a). Тетрагидрогестринон — это андрогенный стероид, который стимулирует опосредованную андрогенными рецепторами миогенную дифференцировку в мультипотентных мезенхимальных клетках C3h20T1 / 2 и способствует наращиванию мышц у орхидэктомированных самцов крыс.Эндокринология, 146 (10): 4472-4478.
Джасуджа, Р., Рамарадж, П., Мак, Р.П., Сингх, А.Б., Сторер, Т.В., Артаза, Дж., Миллер, А., Синг, Р., Тейлор, В.Е., Ли, М.Л., Дэвидсон, Т. , Синха-Хиким, И., Гонсалес-Кадавид, Н.Ф., и Бхасин, С. (2005b). Дельта-4-андростен-3,17-дион связывает рецепторы андрогенов, способствует миогенезу in vitro и увеличивает уровень тестостерона в сыворотке, обезжиренную массу и мышечную силу у мужчин с гипогонадизмом. Журнал клинической эндокринологии и метаболизма, 90 (2): 855-863.
Джордан, В.С., Миттал, С., Госден, Б., Кох, Р., и Либерман, М.Е. (1985). Взаимосвязь структура-активность эстрогена. Перспективы гигиены окружающей среды, 61: 97-110.
Ким Ю., Джун М. и Ли В. (2006). Характеристика болдиона и его метаболитов в моче человека с помощью жидкостной хроматографии / электрораспылительной ионизации, масс-спектрометрии и газовой хроматографии / масс-спектрометрии. Быстрые коммуникации в масс-спектрометрии, 20: 9-20.
Кинкл, Ф.А. и Дорфман Р.И. (1964). Анаболически-андрогенная активность различных стероидов в тесте на кастрированных крысах. Стероиды, 3: 109-122. Марк, Б.Т., Уолден-Хансон, Т., Толливер, Дж. М., Мацумото, А. (2003). Использование DEXA для оценки анаболического действия андрогенов на относительную безжировую массу тела и минеральную плотность костей у орхидэктомированных крыс препубертатного возраста. Неопубликованная рукопись, Система здравоохранения Пьюджет-Саунд по делам ветеранов, Сиэтл, Вашингтон.
Мацумото, А. и Марк, Б. (2006). Соглашение DEA No.DEA-04- P0007 Заключительный отчет [Анализ андрогенной и анаболической активности 1,4-андростадиен-3,17-диона и 19-нор-4,9 (10) — андростадиендиона у самцов крыс Sprague Dawley]. Неопубликованный отчет.
McEuen, C.S., Selye, H., and Collip, J.B. (1937). Влияние тестостерона на соматический рост. Труды Общества экспериментальной биологии и медицины, 36: 390-394.
Мелевич, Л., Брэдфилд, Д.Дж., Коу, Л.Д., Мастерс, Б.С.С. и MacDonald, P.C. (1981).Метаболизм 1,4-андростадиен-3,17-диона в плацентарных микросомах человека. Ферментные свойства и кинетические параметры образования эстрогенов и 17бета-гидрокси-1,4-андростадиен-3-она. Журнал биохимии стероидов, 14: 1115-1125.
Миллер, Д.Д., Брюггемайер, Р.В., и Далтон, Дж. (2002). Адренокортикоиды. В D.A. Уильямс и Т. Лемке (ред.) Принцип медицинской химии Фуа (5-е изд.). Филадельфия, Липпинкотт Уильямс и Уилкинс.
Мограби, Н.и Андерссон, С. (1998). 17Бета-гидроксистероид дегидрогеназы: физиологическая роль в здоровье и болезнях. Тенденции в эндокринологии и метаболизме, 9 (7): 265-270. Мур, К.Р. и Прайс, Д. (1938). Некоторые эффекты тестостерона и тестостерон-пропионата на крысах. Анатомическая запись, 71 (1): 59-78.
Нельсон Д., Грин Р. Р. и Уэллс Дж. (1940). Вариации эффективности подкожно применяемых андрогенов у крыс. Эндокринология, 26: 651-655.
Nutting, E.Ф., Климстра П.Д., Конселл Р.Э. (1966). Анаболически-андрогенная активность производных андростана, модифицированных по А-кольцу. Часть I: Сравнение парентеральной активности. ACTA Endocrinologica, 53: 627-634.
Пейн А.Х. и Хейлз Д. (2004). Обзор стероидогенных ферментов на пути от холестерина к активным стероидным гормонам. Endocrine Reviews, 25 (6): 947-970.
Пелтокето, Х., Луу-Зе, В., Симард, Дж. И Адамски, Дж. (1999). Семейство 17-бета-гидроксистероиддегидрогеназы (HSD) / 17-кетостероидредуктазы (KSR); номенклатура и основные характеристики ферментов 17HSD / KSR.Журнал молекулярной эндокринологии, 23: 1-11.
Scow, R.O. (1952). Влияние тестостерона на мышцы и другие ткани и на состав туши гипофизэктомированных, тиреоидэктомированных и гонадэктомированных крыс-самцов. Эндокринология, 51: 42-51.
Сингх Р., Артаза Дж. Н., Тейлор У. Э., Гонсалес-Кадавид Н. Ф. и Бхасин С. (2003). Андрогены стимулируют миогенную дифференцировку и ингибируют адипогенез в плюрипотентных клетках C3h20T1 / 2 посредством пути, опосредованного рецепторами андрогенов.Эндокринология, 144 (11): 5081-5088.
Свердлов Р.С., Гровер П.К., Джейкобс Х.С. и Бейн Дж. (1973). Найдите вещество, которое избирательно подавляет ФСГ — Влияние стероидов и простагландинов на уровни ФСГ и ЛГ в сыворотке. Стероиды, 21 (5): 703-722.
Свердлов Р.С. и Уолш П. (1973). Подавление ЛГ и ФСГ тестостероном и эстрадиолом у взрослых самцов крыс: продолжительность кастрации, продолжительность лечения и комбинированное лечение. ACTA Endocrinologica, 73: 11-21.
Swerdloff, R.S., Walsh, P.C., and Odell, W.D. (1972). Контроль секреции ЛГ и ФСГ у мужчин: доказательства того, что ароматизация андрогенов до эстрадиола не требуется для подавления секреции гонадотропинов. Стероиды, 20 (1): 13-22.
Verjans, H.L., Eik-Nes, K.B., Aafjes, J.H., Vels, F.J.M., and van der Molen, H.J. (1974). Влияние пропионата тестостерона, пропионата 5альфа-дигидротестостерона и бензоата эстрадиола на сывороточные уровни ЛГ и ФСГ у кастрированных взрослых самцов крыс.ACTA Endocrinologica, 77: 643-654.
Vida, J.A. (1969). Андрогены и анаболические агенты: химия и фармакология. Нью-Йорк: Academic Press.
Уэйнман П. и Шипунов Г.С. (1941). Влияние кастрации и пропионата тестостерона на поперечно-полосатую мускулатуру промежности у крыс. Эндокринология, 29 (6): 975-978.
Уильямс, C.L. и Стансел, Г. (1996). Эстрогены и прогестины. В J.G. Хардман, Л. Лимбёрд, П. Молинофф, Р.В. Раддон, А. Гудман Гилман (ред.) Гудман и Гилман «Фармакологические основы терапии» (9-е изд.). Нью-Йорк: Макгроу-Хилл, 1411-1440.
Уилсон, В.С., Бобсайн, К., Ламбрайт, К.Р., и Грей, Л. (2002). Новая клеточная линия MDA-kb2, которая стабильно экспрессирует андроген- и глюкокортикоид-зависимый репортер для обнаружения агонистов и антагонистов гормональных рецепторов. Токсикологические науки, 66: 69-81.
[FR Док. E9-28572 подана 12-3-09; 8:45]
КОД СЧЕТА 4410-09-P
ВНИМАНИЕ: Это неофициальная версия.Официальную версию данной публикации можно получить непосредственно в Государственном издательстве (GPO).
Состав рациона влияет на региональное распределение жира в организме и уровни дегидроэпиандростерона сульфата (ДГЭАС) у женщин в постменопаузе с диабетом 2 типа
Цель : Сравнить эффекты диеты с высоким содержанием углеводов (с высоким содержанием СНО) и мононенасыщенных жиров (с высоким содержанием -MUFA) на распределение жира в организме и половые гормоны у женщин в постменопаузе с диабетом 2 типа.
Модель : рандомизированное перекрестное соединение без вымывания.
Окружение : Амбулаторное отделение больницы Джилонга.
Субъекты : Тридцать четыре женщины были набраны, 30 завершили исследование, и представлены данные для 21 женщины, соблюдающей диету с высоким содержанием СНО.
Вмешательства : Женщины следовали диете с высоким содержанием СНО (20% энергии (% E) из жиров, 60% E из углеводов и диеты с высоким содержанием MUFA (40% E из жиров, половина мононенасыщенных жиров, 40% E из углеводов) в произвольном порядке по 12 недель каждая.
Основные критерии оценки результатов : Соблюдение диеты оценивалось по изменению содержания линолевой кислоты (C18: 2, ω-6) в сложных эфирах холестерина в плазме. Состав тела измеряли с помощью двухэнергетической рентгеновской абсорбциометрии. В плазме измеряли концентрацию глюкозы и инсулина натощак. Стероидные гормоны и глобулин, связывающий половые гормоны (ГСПГ), измеряли в сыворотке.
Результаты : На диете с высоким содержанием СНО C18: 2, ω-6 в плазме холестериловых эфиров снизился на 5,4% (95% доверительный интервал (ДИ), -2.От 5% до -8,4%, P = 0,0015). Жир терялся в основном из нижней части тела (потеря нижней части тела -0,71 кг, 95% ДИ, от -0,43 до -1,00 кг, P = 0,001; потеря верхней части тела -0,15 кг, 95% ДИ, от -0,76 до +0,46 кг. , P = 0,6). Тем не менее, на диете с высоким содержанием МНЖК потеря жира в нижней части тела была минимальной (-0,22 кг, 95% ДИ, от +0,11 до -0,55 кг, P = 0,2). Согласно общему линейному моделированию (GLM) различия в потере жира в нижней части тела были значимо связаны с диетой ( P = 0,04). После поправки на возраст, концентрации дегидроэпиандростерона сульфата (ДГЭАС) после диеты с высоким содержанием СНО были связаны с уровнями жира в нижней части тела ( r = 0.394, P = 0,04).
Выводы : У женщин с диабетом 2 типа, соблюдающих диету с высоким содержанием СНО в течение 12 недель, непропорциональная потеря жира в нижней части тела связана со снижением DHEAS.
Спонсорство : Поддерживается грантом 950921 Национального совета Австралии по здравоохранению и медицинским исследованиям.
Причины болезни Аддисона — что приводит к надпочечниковой недостаточности?
Надпочечниковая недостаточность — когда ваши надпочечники не вырабатывают достаточного количества гормона кортизола — может быть вызвана первичным заболеванием надпочечников (это называется болезнью Аддисона или первичной надпочечниковой недостаточностью).
Кроме того, недостаточность надпочечников может быть вызвана дефицитом гормона адренокортикотропина (АКТГ). АКТГ стимулирует надпочечники вырабатывать кортизол, поэтому, если АКТГ слишком мало, у вас может быть низкий уровень кортизола (это называется вторичной надпочечниковой недостаточностью).
Гораздо реже — но все же возможной причиной недостаточности надпочечников — является повреждение гипоталамуса, железы в головном мозге, которая вырабатывает высвобождающие и ингибирующие гормоны (гормоны, которые говорят другим эндокринным железам начать и прекратить производство).Повреждение гипоталамуса может привести к дефициту кортикотропин-рилизинг-гормона (CRH). CRH — это то, что заставляет гипофиз вырабатывать АКТГ, который затем стимулирует выработку кортизола в надпочечниках. Дефицит CRH может привести к дефициту АКТГ, а затем и к недостаточности надпочечников.
Первичная недостаточность надпочечников: болезнь Аддисона
Внешний слой надпочечников называется корой надпочечников. Если кора головного мозга повреждена, она может не вырабатывать достаточное количество кортизола.
Распространенной причиной первичной недостаточности надпочечников является аутоиммунное заболевание, которое заставляет иммунную систему атаковать здоровые ткани. В случае болезни Аддисона иммунная система противостоит надпочечникам. Есть несколько очень редких синдромов (несколько заболеваний, которые возникают вместе), которые могут вызвать аутоиммунную недостаточность надпочечников.
Аутоиммунный полиэндокринный синдром
Аутоиммунный полиэндокринный синдром (APS) — редкая причина болезни Аддисона.APS, иногда называемый синдромом множественной эндокринной недостаточности , далее классифицируется как тип 1 или тип 2.
APS тип 1 . Симптомы появляются в детстве. Практически любой орган может быть поражен аутоиммунным поражением. К счастью, это случается крайне редко — во всем мире зарегистрировано всего несколько сотен случаев. Условия, связанные с APS типа 1, включают:
- Болезнь Аддисона
- Снижение функции паращитовидных желез
- Задержка или замедление полового развития
- Мальабсорбция / недостаточность витамина B12 (злокачественная анемия)
- Кандидоз (хроническая дрожжевая инфекция)
- Гепатит
APS Тип 2 .Симптомы в основном развиваются у взрослых в возрасте от 18 до 30 лет. Состояния, связанные с APS типа 2, включают:
- Болезнь Аддисона
- Сниженная или гиперактивная функция щитовидной железы
- Задержка или замедление полового развития
- Диабет
- Белые пятна на коже (витилиго)
- Целиакия
Когда люди с APS типа 2 страдают болезнью Аддисона и заболеваниями щитовидной железы, это состояние иногда называют синдромом Шмидта.
Другие причины первичной недостаточности надпочечников включают:
- Амилоидоз — накопление белка в органах (очень редко)
- Кровотечение в надпочечники
- Рак, распространяющийся на надпочечники
- Инфекции (бактериальные, грибковые, туберкулезные) надпочечников
- Оперативное удаление надпочечников
Вторичная недостаточность надпочечников: дефицит АКТГ
Вторичная надпочечниковая недостаточность вызвана недостатком гормона адренокортикотропина (АКТГ).АКТГ производится в гипофизе. Это сигнал вашего мозга к надпочечникам, говорящий им о необходимости вырабатывать кортизол.
Наиболее частой причиной этого типа надпочечниковой недостаточности является хроническое употребление стероидов. Когда стероиды (которые обладают тем же действием, что и кортизол) принимаются для лечения других заболеваний, мозг перестает посылать сигнал АКТГ в надпочечники, чтобы вырабатывать собственный кортизол в организме. После прекращения приема стероидов мозгу может потребоваться много времени, чтобы возобновить передачу этого сигнала, что вызывает надпочечниковую недостаточность.
Следующие условия также могут влиять на выработку АКТГ и, следовательно, препятствовать секреции кортизола:
- Нарушение кровотока (кровообращения) в гипофизе
- Опухоль гипофиза или другая опухоль головного мозга, оказывающая давление на гипофиз
- Лучевая терапия опухоли гипофиза
- Хирургическое удаление гипофиза или гипоталамуса
- Тяжелая травма головы
- Тяжелая инфекция
Болезнь Аддисона: когда она перерастает в кризис
Симптомы болезни Аддисона могут медленно развиваться и прогрессировать.Иногда стрессовое событие или болезнь вызывают внезапное развитие или ухудшение симптомов. Кризис надпочечников — или Кризис Аддисона — состояние, которое требует срочной медицинской помощи, поскольку эти симптомы могут быть фатальными.
Симптомы аддисонского криза включают:
- Обезвоживание и / или сильная рвота и диарея
- Колющая боль в животе, пояснице или ногах
- Низкое артериальное давление (шок)
- Низкий уровень сахара в крови
- Потеря сознания
Спасающее жизнь лечение стероидами может быть предоставлено только в том случае, если бригада скорой медицинской помощи знает, что у вас надпочечниковая недостаточность; Симптомы аддисонского криза могут повлиять на ваше мышление и даже вызвать потерю сознания, поэтому очень важно, чтобы все пациенты с надпочечниковой недостаточностью носили браслет или ожерелье с медицинским предупреждением, в котором четко указан их диагноз.
Обновлено: 10.06.14
Диагностика болезни Аддисона
Четыре обвиняемых в сговоре с целью распространения тестостерона и гормонов роста среди несовершеннолетних школьников и профессиональных спортсменов
МАЙАМИ — А. Д. Райт, исполняющий обязанности специального агента, ответственный за борьбу с наркотиками (DEA), Полевой дивизион Майами, и Вифредо А. Феррер, прокурор США в Южном округе Флориды, объявляют о подаче заменяющего обвинительного заключения в отношении Юрия Сукарта , 52, из Майами, Флорида, Хуан Карлос Нуньес, 48, из Форт-Лодердейла, Флорида, Лазаро Даниэль Коллазо, а / к / а «Лазер», «Лазер», 50, из Хайалиа, Флорида, и Пауло Бережук, а / k / a «Пабло Бережук», «Паоло Береджук», 50 лет, из Катлер-Бей, сговорившись распространять тестостерон и гормон роста среди несовершеннолетних школьников и профессиональных спортсменов.Обвинения вытекают из расследования DEA, которое сосредоточено на незаконном распространении тестостерона обвиняемыми в округе Майами-Дейд и в других местах. В августе 2014 года семерым подсудимым, в том числе Сукарту, Нуньесу и Коллазо, были предъявлены обвинения в заговоре с целью распространения тестостерона. Обвиняемые Энтони Публио Бош, Карлос Хавьер Асеведо, Хорхе Августин Веласкес и Кристофер Бенджамин Энгроба признали свою вину и ожидают вынесения приговора в связи с этим заговором.
Обвинения, поданные в августе 2014 года, касались незаконного распространения тестостерона операторами нескольких клиник по борьбе со старением в Майами, Флорида, рекрутерами этих клиник и дистрибьютором тестостерона на черном рынке. Эти антивозрастные клиники были зарегистрированы под несколькими разными корпоративными названиями: Biogenesis of America, LLC; Биокем, ООО; Revive Miami, LLC; и другие — той же группой людей, которые время от времени работали вместе в период с 2008 по 2012 год.Одним из первых основателей этих клиник был Энтони Бош.
В заменяющем обвинительном заключении Суккарту, Коллазо, Нуньесу и Бережуку предъявлено обвинение по одному пункту обвинения в сговоре с целью распространения контролируемого вещества из Списка III, то есть анаболического стероида тестостерона, в нарушение Раздела 21 Кодекса Соединенных Штатов, Раздел 846; и по одному пункту обвинения в сговоре с целью распространения гормона роста человека в нарушение Раздела 21 Свода законов США, разделы 333 (e) (1) (e) (2). Кроме того, Сукарту было предъявлено обвинение в пяти пунктах распространения тестостерона в нарушение Раздела 21 Свода законов США, Раздел 841 (a) (1) и Раздел 18 Кодекса США, Раздел 2; и Коллазо было предъявлено обвинение по одному пункту обвинения в распространении гормона роста человека в нарушение Раздела 21 Свода законов США, разделы 333 (e) (1) (e) (2).
В случае признания виновным обвиняемым грозит максимально возможное наказание в виде 10 лет лишения свободы по каждому пункту обвинения.
Это расследование было проведено DEA. Это дело рассматривается прокуратурой США по Южному округу Флориды.
Обвинительное заключение является только обвинением, и обвиняемый считается невиновным, пока его вина не будет доказана.
грязных дюжин эндокринных разрушителей | Рабочая группа по окружающей среде
ATSDR (Агентство регистрации токсичных веществ и заболеваний).2004. Токсикологический профиль полибромированных дифенилов и полибромированных дифениловых эфиров. http://www.atsdr.cdc.gov/toxprofiles/tp.asp?id=529&tid=94
ATSDR (Агентство регистрации токсичных веществ и заболеваний). 2009. Заявление общественного здравоохранения о перфторалкилах. Агентство регистрации токсичных веществ и заболеваний, Отдел токсикологии и медицины окружающей среды. Май 2009 г. http://www.atsdr.cdc.gov/toxprofiles/tp200-c1-b.pdf
Блаунт, Британская Колумбия, Пиркл Дж. Л., Озерло Дж. Д., Валентин-Блазини Л., Колдуэлл, KL.2006. Уровни перхлоратов и тироидных гормонов в моче у подростков и взрослых мужчин и женщин, живущих в Соединенных Штатах. Перспективы гигиены окружающей среды 114 (12): 1865-71.
Buck Louis GM, Sundaram R, Schisterman EF, Sweeney AM, Lynch CD, Gore-Langton RE et al. 2012. Тяжелые металлы и плодовитость пары, исследование жизни. Chemisphere 87 (11): 1201-7.
Corpas I, Castillo M, Marquina D, Benito MJ. 2002. Отравление свинцом в период гестации и кормления грудью изменяет развитие мужских репродуктивных органов.Экотоксикология и экологическая безопасность 53 (2): 259-66.
Де Костер С., Ван Ларебеке Н. 2012. Химические вещества, нарушающие работу эндокринной системы: связанные нарушения и механизмы действия. Журнал по окружающей среде и общественному здравоохранению, номер статьи 713696. http://www.hindawi.com/journals/jeph/2012/713696/cta/
Департамент здравоохранения и социальных служб, Служба общественного здравоохранения. Сентябрь 2004 г. http://www.atsdr.cdc.gov/toxprofiles/tp.asp?id=529&tid=94
Dearth RK, Hiney JK, Srivastava V, Burdick SB, Bratton GR, Dees WL.2002. Влияние свинца (Pb) во время беременности и кормления грудью на половое развитие самок крыс. Репродуктивная токсикология 16 (4): 343-52.
Du G, Hu J, Huang H, Qin Y, Han X, Wu D и др. 2013. Перфтороктановый сульфонат (ПФОС) влияет на активность рецепторов гормонов, стероидогенез и экспрессию генов, связанных с эндокринной системой, in vitro и in vivo. Экологическая токсикология и химия 32 (2): 353-60.
EPA (Агентство по охране окружающей среды США). 2010. Информационный бюллетень для потребителей: Диоксин.Агентство по охране окружающей среды США. Август 2010 г. http://cfpub.epa.gov/ncea/CFM/nceaQFind.cfm?keyword=Dioxin
EPA (Агентство по охране окружающей среды США). 2012. Информационный бюллетень о новых загрязнителях — перфтороктановый сульфонат (ПФОС) и перфтороктановая кислота (ПФОК). Агентство по охране окружающей среды США. Май 2012 г. http://www.epa.gov/fedfac/pdf/emerging_contaminants_pfos_pfoa.pdf
EPA (Агентство по охране окружающей среды США). 2013. Информационный бюллетень для потребителей: Атразин. Агентство по охране окружающей среды США.Январь 2013 г. http://www.epa.gov/oppsrrd1/reregistration/atrazine/atrazine_update.htm
EPA (Агентство по охране окружающей среды США). 2013. Информационный бюллетень для потребителей: GLYCOL ETHERS. Агентство по охране окружающей среды США. Октябрь 2013 г. http://www.epa.gov/ttnatw01/hlthef/glycolet.html
EWG (Рабочая группа по окружающей среде). 2003. Подозрительные салаты. Фонд токсичного ракетного топлива в образцах зимнего салата. https://www.ewg.org/research/suspect-salads
EWG (Рабочая группа по окружающей среде).2003. ПФУ: глобальные загрязнители.
https://www.ewg.org/research/pfcs-global-contaminants
EWG (Рабочая группа по окружающей среде). 2004. Загрязнение ракетного топлива в Калифорнийском молоке. https://www.ewg.org/research/rocket-fuel-cows-milk-perchlorate
Fan W, Yanase T, Morinaga H, Gondo S, Okabe T, Nomura M и др. 2007. Вызванная атразином экспрессия ароматазы зависит от SF-1: последствия для эндокринных нарушений у диких животных и рака репродуктивной системы у людей. Перспективы гигиены окружающей среды 115 (5): 720-727.
FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов). 2013. Данные исследования по перхлоратам в продуктах питания — общие результаты исследования диеты 2005/2006 гг.
http://www.fda.gov/Food/FoodborneIllnessContaminants/ChemicalContaminants/ucm077615.htm
Джаммона CJ, Sawhney P, Chandrasekaran Y, Richburg JH. 2002. Ответ рецептора смерти в семенниках грызунов после воздействия моно- (2-этилгексил) фталата. Токсикология и прикладная фармакология 185 (2): 119-27.
Гилберт М.Э., Ровет Дж., Чен З., Койбучи Н.2012. Нарушение гормонов щитовидной железы развития: распространенность, загрязнители окружающей среды и последствия для развития нервной системы. Нейротоксикология 33 (4): 842-52.
Грисволд, Мэриленд. 1988. Белковые секреции клеток Сертоли. Международный обзор цитологии 110: 133-56.
Hardin BD, Goad PT, Burg JR. 1986. Токсичность монометилового эфира диэтиленгликоля (diEGME), связанная с развитием. Фундаментальная и прикладная токсикология: Официальный журнал Общества токсикологии 6 (3): 430-9.
Hayes TB, Стюарт А.А., Мендоза М., Коллинз А., Норьега Н., Вонк А.2006. Характеристика индуцированных атразином пороков развития гонад у африканских когтистых лягушек (Xenopus laevis) и сравнение с эффектами антагониста андрогенов (ципротерона ацетат) и экзогенного эстрогена (17β эстрадиол): подтверждение гипотезы демаскулинизации / феминизации. Перспективы гигиены окружающей среды 114 (Дополнение 1): 134-141.
Хейс Т. Б., Хури В., Нараян А., Назир М., Парк А., Браун Т. и др. 2010. Атразин вызывает полную феминизацию и химическую кастрацию у самцов африканских когтистых лягушек (Xenopus laevis).Труды Национальной академии наук Соединенных Штатов Америки 107 (10): 4612-4617.
Iavicoli I, Fontana L, Bergamaschi A. 2009. Влияние металлов как эндокринных разрушителей. Журнал токсикологии и гигиены окружающей среды, часть B, Critical Reviews 12 (3): 206-23.
INSERM (Национальный институт санте и медицинских исследований). 2006. Коллективный экспертный отчет: Гликолевые эфиры: новые токсикологические данные.
Като С., Фудзи-Курияма Ю., Отаке Ф. 2007.Новый сигнальный путь лигандов диоксиновых рецепторов через целенаправленную деградацию белка. Альтернативы испытаниям и экспериментам на животных 14 (специальный выпуск): 487-494.
Китамура С., Сузуки Т., Охта С., Фудзимото Н. 2003. Антиандрогенная активность и метаболизм фосфорорганического пестицида фентиона и родственных соединений. Перспективы гигиены окружающей среды 111 (4): 503-8.
Китамура С., Сугихара К., Фудзимото Н., Ямадзаки, Т. 2011. Органофосфаты как эндокринные разрушители. Пестициды-антихолинэстеразы: метаболизм, нейротоксичность и эпидемиология (ред. Т.Сато и Р. К. Гупта), John Wiley & Sons, Inc., Хобокен, Нью-Джерси, США.
Lacasaña M, López-Flores I, Rodríguez-Barranco M, Aguilar-Garduño C, Blanco-Muñoz J, Pérez-Méndez O et al. 2010. Связь между воздействием фосфорорганических пестицидов и гормонами щитовидной железы у работников цветоводства. Токсикология и прикладная фармакология 243 (1): 19-26.
Лаки DR. 2010. Лютеинизирующий гормон обеспечивает причинный механизм заболеваний, связанных с ртутью. Медицинские гипотезы 74 (4): 698-701.
Ляо Ц., Каннан К.2011. Широкое распространение бисфенола А в бумаге и бумажных изделиях: последствия для воздействия на человека. Environ Sci. Technol. 45 (21): 9372-9.
Lilienthal H, Hack A, Roth-Härer A, Grande SW, Talsness CE. 2006. Влияние воздействия 2,2 ‘, 4,4’, 5-пентабромдифенилового эфира (ПБДЭ-99) на половые стероиды, половое развитие и половое диморфное поведение у крыс. Перспективы гигиены окружающей среды 114 (2): 194-201.
Main KM, Kiviranta H, Virtanen HE, Sundqvist E, Tuomisto JT, Tuomisto J, Vartiainen T, Skakkebaek NE, Toppari J.2007. Антипирены плаценты и грудного молока и крипторхизм у новорожденных мальчиков. Перспективы гигиены окружающей среды 115 (10): 1519-26.
MDH (Министерство здравоохранения Миннесоты). 2006. Информационный бюллетень для потребителей: диоксины. Министерство здравоохранения Миннесоты. Октябрь 2006 г. http://www.health.state.mn.us/divs/eh/risk/chemhazards/dioxins.html
Микер Дж. Д., Фергюсон К. К.. 2011. Взаимосвязь между концентрациями фталата и бисфенола A в моче и показателями щитовидной железы в сыворотке у взрослых и подростков США из Национального исследования здоровья и питания (NHANES) 2007-2008.Перспективы гигиены окружающей среды 119 (10): 1396-402.
Mocarelli P, Gerthoux PM, Needham LL, Patterson DG Jr, Limonta G, Falbo R и др. 2011. Воздействие низких доз диоксина в перинатальном периоде может необратимо ухудшить качество спермы человека. Перспективы гигиены окружающей среды 119 (5): 713-718.
Нагано К., Накаяма Е., Обаяси Х., Нисизава Т., Окуда Х., Ямадзаки К. 1984. Экспериментальные исследования токсичности алкиловых эфиров этиленгликоля в Японии. Перспективы гигиены окружающей среды 57: 75-84.
Patisaul HB, Робертс СК, Мабри Н., Маккаффри К.А., Гир РБ, Браун Дж., Белчер С.М., Стэплтон Х.М. 2013. Накопление и эндокринные разрушающие эффекты огнезащитной смеси firemaster® 550 у крыс: исследовательская оценка. Журнал биохимической и молекулярной токсикологии 27 (2): 124-36.
Post GB, Cohn PD, Cooper KR. 2012. Перфтороктановая кислота (ПФОК), новый загрязнитель питьевой воды: критический обзор недавней литературы. Экологические исследования 116 (24): 93-117.
Ричбург Дж. Х., Наньез А., Гао Х. 1999. Участие системы передачи сигналов fas в инициации апоптоза зародышевых клеток в семенниках молодых крыс после воздействия моно- (2-этилгексил) фталата. Токсикология и прикладная фармакология 160 (3): 271-8.
Rogers JA, Metz L, Yong VW. 2013. Обзор: химические вещества, нарушающие эндокринную систему, и иммунные реакции: основное внимание на бисфенол-А и его потенциальные механизмы. Молекулярная иммунология 53 (4): 421-30.
Росси-Джордж А, Вирголини М.Б., Уэстон Д., Кори-Слехта Д.А.2009. Изменения в отрицательной обратной связи глюкокортикоидов после материнского свинца, пренатального стресса и комбинации: потенциальный биологический объединяющий механизм для соответствующих профилей болезней. Токсикология и прикладная фармакология 234 (1): 117-27.
Рубин Б.С. 2011. Бисфенол а: эндокринный разрушитель с широко распространенным воздействием и множественными эффектами. Журнал биохимии стероидов и молекулярной биологии 127 (1-2): 27-34.
Солдин О.П., Браверман Л.Е., Ламм Ш. 2001. Клиническая фармакология перхлоратов и здоровье человека: обзор.Мониторинг терапевтических лекарственных средств 23 (4): 316-31. Рассмотрение.
Станко Дж. П., Енох Р. Р., Райнер Дж. Л., Дэвис С. К., Вольф, округ Колумбия, Маларки, Делавэр, Фентон, SE. 2010. Влияние пренатального воздействия смеси метаболитов атразина в низких дозах на время полового созревания и развитие простаты самцов крыс Long-Evans. Репродуктивная токсикология 30 (4): 540-9.
Tonacchera M, Pinchera A, Dimida A, Ferrarini E, Agretti P, Vitti P et al. 2004. Относительная эффективность и аддитивность перхлората, тиоцианата, нитрата и йодида в отношении ингибирования захвата радиоактивного йодида симпортером йодида натрия человека.Щитовидная железа: Официальный журнал Американской ассоциации щитовидной железы 14 (12): 1012-9.
Уолтер Х. Уотсон, Джеймс Д. Ягер. 2007. Мышьяк: расширение его потенциала нарушения эндокринной системы до вмешательства в передачу сигналов, опосредованную рецепторами эстрогена. Токсикологические науки 98 (1): 1-4.
Вольф Дж. 1998. Перхлораты и щитовидная железа. Обзор фармакологии 50 (1): 89-105.
Wolstenholme JT, Rissman EF, Connelly JJ. 2011. Роль бисфенола А в формировании мозга, эпигенома и поведения.Гормоны и поведение 59 (3): 296-305.
Я Вэнь Чен, Чинг Яо Ян, Чун Фа Хуанг, Дун Цзун Хун, Юк Ман Люн, Шинг Хва Лю. 2009. Тяжелые металлы, функция островков и развитие диабета. Островки 1 (3): 169-176.
Ямано Т., Нода Т., Шимицу М., Морита С., Нагахама М. 1993. Влияние монометилового эфира диэтиленгликоля на беременность и постнатальное развитие у крыс. Архивы загрязнения окружающей среды и токсикологии 24 (2): 228-35.
Чжу X, Кусака Y, Сато К., Чжан К.2000. Разрушающее действие ртути на эндокринную систему. Гигиена окружающей среды и профилактическая медицина 4 (4): 174-83
Zota AR, Park JS, Wang Y, Petreas M, Zoeller RT, Woodruff TJ. 2011. Полибромированные дифениловые эфиры, гидроксилированные полибромированные дифениловые эфиры и показатели функции щитовидной железы у беременных женщин во втором триместре в Калифорнии.