Аминогликозиды — Википедия
Аминогликозиды — группа органических веществ, общим в химическом строении которых является наличие в молекуле аминосахара, соединённого гликозидной связью с аминоциклическим кольцом. Многие аминогликозиды являются антибиотиками. По химическому строению к аминогликозидам близок также спектиномицин, аминоциклитоловый антибиотик. Основное клиническое значение аминогликозидов заключается в их активности в отношении аэробных грамотрицательных бактерий.
Аминогликозиды образуют связи с бактериальными рибосомами и нарушают биосинтез белков в клетках, вызывая разрыв потока генетической информации в клетке. Гентамицин так же может воздействовать на синтез белка, нарушая функции 50S-субъединицы рибосомы
Аминогликозиды являются бактерицидными антибиотиками, то есть непосредственно убивают чувствительные к ним микроорганизмы (в отличие от бактериостатических антибиотиков, которые лишь тормозят размножение микроорганизмов, а справиться с их уничтожением должен иммунитет организма хозяина). Поэтому аминогликозиды проявляют быстрый эффект при большинстве тяжёлых инфекций, вызванных чувствительными к ним микроорганизмами, и их клиническая эффективность гораздо меньше зависит от состояния иммунитета больного, чем эффективность бактериостатиков. Это делает аминогликозиды одними из препаратов выбора при тяжёлых инфекциях, сопряжённых с глубоким угнетением иммунитета, в частности, при фебрильной нейтропении.
Аминогликозиды оказывают бактерицидное действие независимо от фазы размножения микроорганизмов, в том числе и на микроорганизмы, находящиеся в фазе покоя, в отличие от бета-лактамных антибиотиков, действующих бактерицидно прежде всего на размножающиеся микроорганизмы. Поэтому терапевтическая эффективность аминогликозидов, в отличие от бета-лактамов, не снижается при одновременном назначении бактериостатически действующих антибиотиков.
Для действия аминогликозидов необходимы аэробные условия (наличие кислорода) как внутри бактериальной клетки-мишени, так и в тканях инфекционного очага. Поэтому аминогликозиды не действуют на анаэробные микроорганизмы, а также недостаточно эффективны в плохо кровоснабжаемых, гипоксемичных или некротизированных (омертвевших) тканях, в полостях абсцессов и кавернах.
Бактерицидная активность аминогликозидов также сильно зависит от pH среды: они значительно менее эффективны в кислой или нейтральной среде, чем в слабощелочной (при pH около 7.5 или чуть выше). По этой причине эффективность аминогликозидов при инфекциях почек и мочевых путей увеличивается при подщелачивании мочи и снижается при её кислой реакции. Эффективность аминогликозидов при сепсисе (бактериемии), фебрильной нейтропении также увеличивается при одновременной коррекции метаболического ацидоза. При абсцессах, пневмонии эффективность аминогликозидов бывает недостаточной, поскольку в полости абсцесса и в инфицированной лёгочной ткани pH обычно кислый (6.4-6.5). Активность аминогликозидов также снижается в присутствии двухвалентных катионов, в частности, ионов кальция и магния. Поэтому аминогликозиды недостаточно эффективны при остеомиелите (так как костная ткань богата кальцием) и в очагах, подвергшихся кальцификации (обызвествлению).
Белки и фрагменты ДНК тканевого детрита, образующегося при нагноении и разрушении тканей, также снижают эффективность аминогликозидов, поскольку аминогликозиды относятся к препаратам, сильно связывающимся с белками.
Аминогликозиды не проникают внутрь клеток животных организмов, поэтому не действуют на возбудителей, находящихся внутриклеточно, даже в тех случаях, когда в культуре, in vitro, возбудитель инфекции чувствителен к аминогликозидам. В частности, аминогликозиды неэффективны против шигелл, сальмонелл.
Выделяют четыре поколения аминогликозидов[1]:
Антибиотики группы аминогликозидов следующего поколения: плазомицин.
Исторически первым аминогликозидом был стрептомицин, выделенный в 1944 году из актиномицета Streptomyces griseus. Он также был одним из первых известных антибиотиков вообще, вторым после пенициллина. В 1957 году был выделен канамицин.
На заре эры антибиотикотерапии стрептомицин, наряду с пенициллином, применяли широко и практически бесконтрольно, в том числе и при банальных инфекциях, которые в настоящее время не расцениваются как показания к назначению аминогликозидных антибиотиков. Это способствовало нарастанию устойчивости возбудителей банальных инфекций к стрептомицину и появлению частичной перекрёстной устойчивости к другим аминогликозидам.
Впоследствии стрептомицин из-за высокой ототоксичности и нефротоксичности, а также из-за быстрого развития устойчивости большинства часто встречающихся возбудителей к нему стали применять почти исключительно в составе комбинированных режимов специфической химиотерапии туберкулёза, а также некоторых редких, почти ликвидированных в настоящее время инфекций, таких, как чума, а основным применяемым аминогликозидом в остальных клинических ситуациях на долгое время стал канамицин.
В настоящее время основными, наиболее часто применяемыми, аминогликозидными антибиотиками являются препараты II поколения, в частности, гентамицин. Частота назначения канамицина значительно снизилась в связи с тем, что он обладает более высокой ото- и нефротоксичностью по сравнению с препаратами II поколения, а также в связи с нарастанием устойчивости возбудителей к канамицину.
Аминогликозид III поколения амикацин рассматривается в настоящее время как препарат резерва, который нежелательно назначать широко и часто, чтобы предотвратить распространение устойчивости возбудителей к нему. Устойчивость возбудителей к амикацину пока распространена мало. Перекрёстная устойчивость с другими аминогликозидами неполная, и часто возбудители, устойчивые к аминогликозидам II поколения, остаются чувствительными к амикацину. Характерно также, что устойчивость возбудителей к амикацину нарастает медленнее, чем к препаратам II поколения. Устойчивость возбудителей к препаратам II поколения, в частности гентамицину, также развивается медленнее, чем к препаратам I поколения канамицину и стрептомицину.
Все аминогликозиды в норме плохо всасываются в просвете кишечника и действуют только местно. Это позволяет применять их внутрь без нежелательных проявлений системной токсичности для деконтаминации кишечника перед плановыми хирургическими операциями на кишечнике и органах брюшной полости, для лечения острых кишечных инфекций, вызванных чувствительными к аминогликозидам неинвазивными (то есть не проникающими за пределы кишечника) возбудителями, а также для снижения продукции аммиака кишечными бактериями при острой и хронической печёночной недостаточности, печёночной коме (гепатаргии). Основным аминогликозидом для перорального применения является неомицин.
Аминогликозиды могут всасываться при местном применении для орошения их растворами или смазывании содержащими их мазями ожоговых поверхностей, язв или ран. При этом может проявиться системная токсичность (ото- или нефротоксичность).
Аминогликозиды хорошо всасываются после внутримышечного введения. Пик концентрации аминогликозидного антибиотика в плазме крови достигается через 30-90 мин после в/м введения. Аминогликозиды не метаболизируются в организме. Выводятся все аминогликозиды в неизменённом виде почками. При нормальной функции почек период полувыведения большинства аминогликозидов составляет около 2 ч. При почечной недостаточности период полувыведения значительно увеличивается и может произойти кумуляция (накопление) антибиотика и проявиться нефро- или ототоксическое действие.
В процессе выведения почками создаются очень высокие концентрации аминогликозидов в моче, в 5-10 раз превышающие концентрации в плазме крови и, как правило, многократно превышающие минимальные бактерицидные концентрации для большинства грамотрицательных возбудителей мочевых инфекций. Благодаря этому аминогликозиды высокоактивны при инфекциях мочевых путей (пиелонефритах, циститах, уретритах).
Очень высокие концентрации аминогликозидов создаются в корковом слое почек и в эндолимфе внутреннего уха. Этим объясняется избирательное токсическое действие аминогликозидов на почки и на орган слуха. Вместе с тем именно это свойство делает аминогликозиды препаратами выбора при тяжёлых острых бактериальных нефритах и остром лабиринтите (воспалении внутреннего уха).
Аминогликозиды легко проникают во внеклеточные пространства, а также в плевральную, перитонеальную и синовиальную жидкости. Однако они плохо проникают в спинномозговую жидкость (ликвор) и в жидкие среды глаза, а также в ткани простаты. Поэтому аминогликозиды неэффективны при системном введении при менингитах и энцефалитах, офтальмитах, простатитах, даже вызванных чувствительными к ним микроорганизмами. При менингите и энцефалите, вызванном чувствительными микроорганизмами, может практиковаться эндолюмбальное введение аминогликозидов.
Клиническая эффективность аминогликозидов в большинстве случаев зависит от их пиковой концентрации в плазме крови, а не от поддержания постоянной концентрации, поэтому в большинстве клинических ситуаций их можно вводить 1 раз в сутки, всю суточную дозу сразу. При этом снижается нефротоксичность, а терапевтический эффект не изменяется. Однако при тяжёлых инфекциях, таких, как бактериальный эндокардит, сепсис, тяжёлые пневмонии, такой режим введения недопустим и следует отдавать предпочтение классическому режиму, при котором стрептомицин, канамицин и амикацин вводятся 2 раза в сутки, а гентамицин, тобрамицин и нетилмицин — 2-3 раза в сутки. В некоторых случаях, например, при тяжёлом сепсисе, целесообразна круглосуточная внутривенная инфузия аминогликозида, поддерживающая его постоянный бактерицидный уровень в плазме.
Ототоксичность, нефротоксичность.
Применение при беременности и в период грудного вскармливания[править | править код]
Противопоказаны при беременности (ототоксическое и нефротоксическое действие).
Аминогликозиды
Антимикробный спектр аминогликозидов включает большой спектр аэробных грамотрицательных бактерий, некоторые грамположительные бактерии (главным образом стафилококки) и микобактерии. В инфицированном организме аминогликозиды действуют только на внеклеточно расположенные микроорганизмы.
Аминогликозиды активны в отношении:
- Большинства Entrobacteriaceae:
- Escherichia coli.
- Proteus spp.
- Citrobacter spp.
- Enterobacter spp.
- Klebsiella spp.
- Providencia spp.
- Serratia spp.
- Salmonella spp.
- Shigella spp.
- Acinetobacter spp.
- Pseudomonas spp.
- P. aeruginosa.
- Yersinia pestis.
- Francisella tularensis.
- Brucella spp.
- Staphylococcus aureus (кроме метициллинорезистентных штаммов S.aureus).
- S. Epidermidis.
Стрептомицин и канамицин действуют на M.tuberculosis, в то время как амикацин более активен в отношении M.avium и других атипичных микобактерий.
Стрептомицин и гентамицин действуют на энтерококки.
Стрептомицин активен против возбудителей чумы, туляремии, бруцеллеза.
Степень активности и широта спектра варьируют в зависимости от препарата и свойств штаммов. Отдельные аминогликозиды различаются по активности и спектру действия. Аминогликозиды I поколения (стрептомицин, канамицин) проявляют наибольшую активность в отношении M. tuberculosis и некоторых атипичных микобактерий. Мономицин менее активен по действию на некоторые грамотрицательные аэробы и стафилококки, но активен в отношении некоторых простейших.
Все аминогликозиды II и III поколения (в особенности тобрамицин ), в отличие от аминогликозидов I поколения, активны в отношении Pseudomonas aeruginosa.
Спектр противомикробного действия сизомицина подобен таковому гентамицина, но сизомицин более активен, чем гентамицин, в отношении разных видов Proteus spp., Pseudomonas aeruginosa, Klebsiella spp., Enterobacter spp.
Спектиномицин активен in vitro в отношении многих грамположительных и грамотрицательных микроорганизмов, но клиническое значение имеет его активность в отношении гонококков, включая штаммы, резистентные к пенициллину.
Одним из наиболее эффективных аминогликозидов является амикацин. Амикацин — производное канамицина А с наиболее широким по сравнению с другими аминогликозидами спектром действия, включая аэробные грамотрицательные бактерии (Pseudomonas aeruginosa, Klebsiella spp., Escherichia coli и др.) и Mycobacterium tuberculosis. Амикацин устойчив к действию ферментов, инактивирующих другие аминогликозиды, и может оставаться активным в отношении штаммов Pseudomonas aeruginosa, устойчивых к тобрамицину, гентамицину и нетилмицину . По некоторым данным, при эмпирической терапии ургентных состояний амикацин наиболее предпочтителен, так как к его действию чувствительны более 70% штаммов грамотрицательных и грамположительных бактерий. В то же время применять другие аминогликозиды при тяжелых состояниях следует только после подтверждения чувствительности выделяемых микроорганизмов к гентамицину и другим ЛС этой группы, иначе терапия может быть неэффективной.
К аминогликозидам умеренно чувствительны или устойчивы Streptococcus spp., большинство внутриклеточных микроорганизмов, устойчивы анаэробы: Bacteroides spp., Clostridium spp.
Изепамицин (IV поколение аминогликозидов) дополнительно активен в отношении Aeromonas spp., Citrobacter spp., Listeria spp., Nocardia spp.
Аминогликозиды неактивны в отношении:
- S.pneumoniae.
- S.maltophilia.
- B.cepacia.
- Анаэробов (Bacteroides spp., Clostridium spp. и др.).
Более того, резистентность S.pneumoniae, S.maltophilia и B.cepacia к аминогликозидам может быть использована при идентификации этих микроорганизмов.
Несмотря на то, что аминогликозиды in vitro активны в отношении гемофил, шигелл, сальмонелл, легионелл, клиническая эффективность при лечении инфекций, вызванных этими возбудителями, не была установлена, к тому же имеются другие активные и значительно менее токсичные препараты, эффективные при пероральном введении.
- Табл. Чувствительность микроорганизмов к аминогликозидам
++ — высокочувствительныеМикроорганизмы Гентамицин Нетилмицин Тобрамицин Амикацин Канамицин Стрептомицин Грамотрицательные аэробные бактерии Acinetobacter spp. + + + ++ + + Enterobacter spp. ++ ++ ++ ++ + ++ E. coli ++ ++ ++ ++ + ++ H. influenzae + ++ + ++ ++ ++ K. pneumoniae ++ ++ ++ ++ + ++ K. pneumoniae ++ ++ ++ ++ + ++ M. catarrhalis ++ ++ ++ ++ + + M. morganii + ++ ++ ++ ++ + N. gonorrhoeae + + + + + + N. meningitides + + + + + + P. aeruginosa ++ + ++ ++ — + P. mirabilis ++ ++ ++ ++ ++ ++ P. rettgeri ++ ++ ++ ++ ++ ++ P. stuartii + + + ++ ++ ++ Salmonellaspp. ++ ++ ++ ++ ++ ++ Shigella spp. ++ ++ ++ ++ ++ ++ Serratia marcescens ++ ++ + ++ ++ ++ S. maltophilia + + — + + + Грамположительные аэробные бактерии S. aureus ++ ++ ++ ++ ++ + S. epidermidis ++ ++ ++ ++ + + S. pyogenes — — — — — — S. pneumoniae — — — — — — E. faecalis — — — — — — Nocardia spp. — — — ++ — — Микобактерии M. tuberculosis — — ++ ++ ++ M. avium-intracellulare + + ++ — + Анаэробы, хламидии — устойчивы
+ — чувствительные
± — слабочувствительные
— — устойчивые.
Аминогликозиды: препараты, механизм действия, спектр действия, побочные эффекты, режим дозирования
Использование аминогликозидов является главным образом аддитивным или синергичным с β-лактамами или фторхинолонами. Ранняя комбинированная терапия, включающая аминогликозиды, показала больший процент выживаемости у пациентов с септическим шоком. Аминогликозиды следует назначать один раз в день коротким курсом (5-7 дней) для повышения эффективности и снижения нефротоксичности.
Препараты аминогликозиды
Обычно используемыми препаратами аминогликозидами являются:
- гентамицин,
- тобрамицин,
- амикацин.
Механизм действия
Аминогликозиды представляют собой катионы, которые пассивно связываются с отрицательно заряженными частями наружных мембран грамотрицательных бацилл и конкурентно вытесняют Mg2+ и Ca2+ клеточных стенок, которые участвуют в связывании липополисахаридов. Внутри клетки аминогликозиды связываются с 16S рРНК 30S субъединицы рибосомы, вызывая ошибки и прекращение синтеза белка. В грамположительньтх бактериях поглощение аминогликозидов меньше в связи с более толстыми мембранами наружных клеточных стенок; соответственно, MIC увеличивается.
Спектр действия
Аминогликозиды активны в основном против грамотрицательных бактерий и стафилококков. Гентамицин является мощным средством против бактерий семейства Enterobacteriaceae. Тобрамицин обладает несколько более высокой активностью, чем гентамицин против Р. aeruginosa и Acinetobacter spp. Амикацин обычно предназначен для грамотрицательных патогенов, устойчивых к гентамицину и тобрамицину. Аминогликозиды активны против MSSA. Для терапии инфекций MRSA, Streptococcus spp. и Enterococcus spp., аминогликозиды используются для обеспечения синергетической активности с β-лактамными антибиотиками. Бактериальная устойчивость к аминогликозидам обусловлена модификациями точек связывания, снижением поглощения антибиотиков и их эффлюксом.
Фармакокинетика и фармакодинамика
Все аминогликозиды имеют сходные фармакокинетические свойства. Распространение препарата из сосудистого в экстраваскулярное пространство происходит быстро, в течение 15-30 минут после инфузии. Аминогликозиды в основном выделяются при помощи клубочковой фильтрации и требуют корректировки дозы при почечной недостаточности. У пациентов с нормальной функцией почек период полураспада всех аминогликозидов составляет от 1,5 до 3,5 часов. Более 90% парентерально вводимой дозы элиминируется с мочой без изменений в течение первых 24 часов. Остаток медленно диффундирует в просвет трубочек, где накапливается, обуславливая нефротоксичность. Концентрации аминогликозидов в инфицированных секретах и тканях обычно невысоки. Ингаляционный путь введения используются при вентилятор-ассоциированных пневмониях, вызванных резистентными организмами.Фармакодинамические принципы, связанные с аминогликозидами, включают концентрационно-зависимую бактерицидную активность, постантибиотический эффект (РАЕ) и синергизм с другими антибиотиками, действующими на клеточную стенку. Быстрое уничтожение Enterobacteriaceae коррелирует лучше всего с 24-часовым соотношением AUC/MIC, тогда как отношение пик/MIC лучше для Р. aeruginosa. РАЕ может достигать 10,2 для Р. aeruginosa часов и даже дольше для Enterobacteriaceae. Синергетический эффект наиболее выражен при комбинации с антибиотиками, воздействующими на клеточную стенку (например β-лактам). Таким образом, режим дозирования аминогликозидов один раз в день в высокой дозе способствует развитию быстрого клинического эффекта и снижению вероятности побочных эффектов.
Побочные эффекты
Нефротоксичность
Наиболее распространенным нежелательным эффектом аминогликозидов является нефротоксичность определяемая в 5-25 % случаев.
Факторы риска нефротоксичности:
- пожилой возраст,
- уже имеющиеся явления почечной недостаточности,
- диабет,
- одновременное применение ванкомицина,
- длительность терапии > 4 дня,
- нестабильность гемодинамики.
Ототоксичность
Аминогликозиды обладают ототоксичностью — слуховая (кохлеарная) и вестибулярная токсичность.
Факторы риска ототоксичности включают:
- возраст пациента,
- длительность терапии более 10 дней,
- дисфункцию почек,
- аддитивные эффекты других ототоксических агентов (например петлевые диуретики).
Нервно-мышечная блокада
Наиболее опасная для жизни неблагоприятная реакция на аминогликозиды, хотя и очень редко встречаемая, представляет собой нервно-мышечную блокаду. Блокада является результатом ингибирования пресинаптического высвобождения ацетилхолина и блокирования постсинаптических ацетилхолиновых рецепторов.
Факторы риска:
- внутривенно вводимый аминогликозид пациентам с почечной недостаточностью,
- сопутствующие введением миорексантов или анестетиков.
Режим дозирования
Аминогликозиды вводят один или несколько раз в день, в зависимости от почечной функции пациента. Дозировка один раз в день проявляет наилучшую клиническую эффективность и меньшую частоту развития нефротоксичности при непродолжительном курсе лечения. Концентрация аминогликозидов в сыворотке важна как для эффективности, так и для токсичности. Для схемы приема несколько раз в день, концентрации пика и плато следует проверять через 1 час после начала инфузии и непосредственно перед введением следующей дозы. Также необходимо определять концентрацию устойчивого состояния (примерно после третьей дозы). Частота последующего определяется состоянием функции почек. Для инфекций нижних дыхательных путей целевая пиковая концентрация должна составлять от 8 до 12 мг/л для гентамицина и тобрамицина и от 25 до 30 мг/л для амикацина. Концентрация плато должна быть менее 2 мг/л, хотя предпочтительнее менее 1 мг/л. Для одноразовой дозировки целевая пиковая концентрация должна составлять 20 мг/л или Cmax/MIC 10, а концентрация плато должна быть необнаруживаемой (< 0,5 мг/л) в течение примерно 4 часов в конце интервала дозирования. При грамположительных инфекциях, таких как инфекционный эндокардит, максимальный эффект достигается при использовании гентамицина несколько раз в день для достижения максимальной концентрации 3 мкг/мл и концентрации плато менее 0,5 мкг/мл.
Похожие медицинские статьи
Антибиотики группы аминогликозидов. Классификация. Спектр и механизм действия препаратов. Побочные эффекты.
⇐ ПредыдущаяСтр 16 из 28Следующая ⇒V. Аминогликозиды и аминоциклотиолы
I поколение
Ø Канамицин
Ø Неомицин
Ø Стрептомицин
II поколение
Ø Гентамицин
Ø Нетилмицин
Ø Тобрамицин
III поколение
Ø Амикацин
Аминоциклотолы – Спектиномицин (Кирин)
Аминогликозиды. Механизм действия.
Вызывают присоединение неподходящего тРНК‐АК‐комплекса, что приводит к синтезу аномального белка. Бактерицидны.
Аминогликозиды. Спектр действия.
Активны в отношении:
· Гр «‐» микроорганизмов семейства Enterobacteriaceae (E.coli, Proteus spp., Klebsiella spp.,
· Enterobacter spp., Serratia spp. и др.),
· Неферментирующих Гр «‐» палочек (P.aeruginosa, Acinetobacter spp.), стафилококков, кроме MRSA
· Стрептомицин и канамицин действуют на M.tuberculosis, Амикацин более активен в отношении M.avium и других атипичных микобактерий.
· Стрептомицин и Гентамицин действуют на энтерококки.
· Стрептомицин активен против возбудителей чумы, туляремии, бруцеллеза
Умеренно активны в отношении: Гемофильной палочки, нейссерий, стрептококков
Резистентны к ним:
Большинство внутриклеточных м/о
Анаэробы: бактероиды, клостридии
Пневмококки, энтерококки (кроме Гентамицина, Стрептомицина)
Аминогликозиды. Резистентность.
Развитие приобретенной устойчивости м/о – середина 70‐х годов ХХ века – обусловлено широким применением
Механизмы резистентности:
Ферментативная инактивации энзимами, модифицирующими АБ: ацетилтрансферазы, аденилтрансферазы, фосфотрансферазы
Изменение мишени АБ (30Sсубъединица рибосом)
Нарушение проницаемости клеток – нарушение связывания с рибосомами и подавлению синтеза белка
Аминогликозиды. Фармакокинетика.
Практически не всасываются в кишечнике (внутрь назначают Неомицин, Канамицин – по особым показаниям)
Плохо проникают через ГЭБ, в желчь, предстательную железу, костную ткань
Недостаточно высокие концентрации в плевральной, перикардиальной, асцитической жидкостях, бронхиальном секрете, мокроте
Проникает через плаценту
Высокая концентрация в корковом слое почек, накапливаются в мозговом слое почек
Антибактериальная активность снижается в кислой среде (рН<7.4), в месте некроза, в полости абсцесса
Характерен небольшой терапевтический диапазон
Выводятся почками путем клубочковой фильтрации
Т1/2 около 2 – 2.5 часов
Аминогликозиды. Показания к применению.
Эмпирическая терапия в случае тяжелых, внутрибольничных инфекций (в сочетании с ß‐лактамами, гликопептидами, антианаэробными препаратами): сепсис, инфекционный эндокардит, посттравматические или постоперационные менингиты, нозокомиальная пневмания, интраабдомиальные инфекции и др.
Препараты выбора (в комбинации с «антисинегнойными» пенициллинами) при лечении инфекции, вызванной синегнойной палочкой
Специфическая терапия: чума (стрептомицин), туляремия (стрептомицин,гентамицин), бруцеллез (стрептомицин), туберкулез (стрептомицин, канамицин)
Деконтаминация кишечника перед плановыми операциями на толстой кишке (неомицин, канамицин в сочетании с эритромицином)
Аминогликозиды. Побочные эффекты.
· Нефротоксичность: от олигоурии до почечной недостаточности
· Ототоксичность: снижение слуха, шум в ушах, необратимая глухота
· Вестибулотоксичность: нарушения координации движения, головокружение
· Нейротоксичность: головныя боль, общая слабость, парестезии, подергивание мышц, судороги
· Нарушения нервно‐мышечной проводимости: угнетение дыхания вплоть до полного паралича дыхательных мышц
· Дисбактериоз
· Гематотоксичность: анемия, лейкопения, тромбоцитопения, агранулоцитоз
· Аллергические реакции: сыпь, сывороточная болезнь, отек Квинке
Токсичность в ряду ‐
Неомицин > Канамицин >Стрептомицин >Гентамицин >Тобрамицин >Амикацин > Нетилмицин
‐ уменьшается
Билет 15
1. Противоаритмические препараты(блок К и Ca-каналов,В-адреноблоктаров)
| Блокада бета-адренорецепторов, увеличение ЭРП в АВ-узле | (β1,β2) Пропранолол, Пиндолол (β1) Талинолол, Атенолол, Метопролол, Эсмолол В основном — суправентрикулярные аритмии |
| Блокада калиевых каналов: удлинение реполяризации и увеличение длительности потенциала действия, увеличение ЭРП | Амиодарон Соталол Наджелудочковые и желудочковые аритмии (резерв) |
| Блокада кальциевых каналов, увеличение ЭРП | Верапамил Дилтиазем Наджелудочковые аритмии |
2 КЛАСС (В-АДРЕНОЛИТИКИ)
Предупреждают синусовую тахикардию и формирование эктопических ритмоводителей вследствие повышения симпатическогго тонуса.
Удлиняют рефрактерность АВ узла, предупреждая возвратные ре-ентри аритмии с вовлечением этого узла.
Многие бета-блокаторы имеют мембраностабилизирующее действие (как у класса 1).
Антиадренергический эффект
Замедление фазы 4——- Уменьшение автоматизма эктопических очагов (из-за удлинения ПД)
Замедление фазы 0—— Замедление проводимости
Уменьшение выходящих токов калия
Замедление реполяризации, удлинение ПД——————— Увеличение ЭРП
————— Уменьшение автоматизма
эктопических очагов (из-за удлинения ПД)
Блокируют в1-адренорецепторы миокрада, снимают аритмогенное влияние катехоламинов.
Бета-блокаторы :снижают кислородный запрос миокарда, выраженность гипоксии и связанных с ней изменений электролитного баланса, энергетического обмена и нарушений функциональных свойств клеточных мембран.
На процесс реполяризации существенно не влияют,
Но препятствуют ускорению спонтанной диастолической деполяризации (фаза 4), которое вызывается катехоламинами.
В результате подавляется автоматизм СА узла и активность эктопических очагов возбуждения.
Снижение проводимости вызывают преимущественно в АВ узле.
Это обусловлено адреноблокирующим эффектом и преобладанием тормозных влияний холинергической иннервации.
Показания к применению
-наджелудочковые и желудочковые тахиаритмии, обусловленные высоким симпатоадреналовым тонусом
(нейрогенные, гормональные нарушения ритма, начальный период инфаркта миокарда).
Однако снижают сократительную способность миокарда вплоть до острой недостаточности.
Замедляют проводимость до атриовентрикулярной блокады
Препараты некардиоселективные вызывают побочные эффекты, связанные с блокадой в2-адренорецепторов.
в-Адреноблокаторы ослабляют стимулирующее влияние симпатической иннервации на сердце и в связи с этим:
-снижение автоматизма синоатриального узла
-снижение автоматизма и проводимости атриовентрикулярного узла
-снижение автоматизма волокон Пуркинье
Применение:
— наджелудочковые тахиаритмии и экстрисистолия;
— желудочковые экстрасистолы, связанные с повышенным автоматизмом
Побочные эффекты:
— ослабление и урежение сокращений сердца;
— нарушение атриовентрикулярной проводимости;
— повышение тонуса бронхов;
— повышение тонуса периферических сосудов;
— снижение толерантности к глюкозе.
3-Й КЛАСС-ПРЕПАРАТЫ, ЗАМЕДЛЯЮЩИЕ РЕПОЛЯРИЗАЦИЮ.
АМИОДАРОН
Широкий спектр противоаритмической активности.
Замедление реполяризации волокна за счет торможения фазы 3, видимо за счет блокады калиевых каналов.
Удлинение потенциала действия и увеличение продолжительности эффективного рефрактерного периода.
Умеренное блокирующее действие на натриевые каналы.
Блокирует в1-адренорецепторы миокарда.
Слабая блокада кальциевых каналов.
Антиангинальное действие.
Альфа-блокирующее действие.
Понижение АД.
Вводят внутривенно и перорально.
Длительно действие (до 24 часов)
Не влияет на сократимость и проводимость сердца.
При приеме внутрь эффект развивается через 1-2 недели, сохраняется 15-20 дней после отмены.
Побочные эффекты при длительном приеме
-желтовато-коричневый микроосадок в роговице глаза (медленно рассасывается после окончания приема)
-парестезии
-атаксия (неврологические расстройства)
-гипо- или гипертиреоз
-нарушение функции печени
-воспаление и фиброз легких
— ослабление и урежение сокращений сердца;
— затруднение атриовентрикулярной проводимости;
— тремор, атаксия, парестезии;
— нарушение функции щитовидной железы;
— фиброзные изменения в легких;
— нарушения функции печени;
— отложения препарата в роговице, коже;
— фотосенсибилизация и др.
В связи с выраженным побочным действием амиодарона не рекомендуют длительное лечение этим препаратом.
Орнид
Применение
-тяжелые желудочковые тахиаритмии (фибрилляция желудочков, резистентных к другим противоаритмическим препаратам).
Побочные эффекты
-опасная гипотензия
4-Й КЛАСС – БЛОКАТОРЫ КАЛЬЦИЕВЫХ КАНАЛОВ
Механизм действия связан с блокадой «медленных» кальциевых каналов и угнетением входа кальция в клетку, вследствие чего замедляется кальцийзависимая деполяризация (фаза 4, отчасти фаза 0) в СА узле и АВ узле.
Подавляется автоматизм СА и АВ узлов, замедляется АВ проводимость.
Препараты понижают АД.
Антиангинальная активность.
Показания к применению
-препараты выбора для купирования наджелудочковых тахиаритмий
-пароксизмальной наджелудочковой тахикардии
-фибрилляции предсердий
Парентерально и внутрь
Побочные эффекты
-Высокие дозы – снижение сократительной способности миокарда, сильно подавляют активность СА узла, вызывают АВ блокаду.
-отеки ног
-утомляемость
Препараты этой группы, применяемые в клинике, блокируют, в основном, потенциалозависимые кальциевые каналы L-типа. Каналы L-типа обнаруживают в мембранах клеток разных тканей, но наибольшее функциональное значение они имеют для сердца и артериальных сосудов. Поэтому применяемые блокаторы кальциевых каналов действуют, в основном, на сердце и артериальные сосуды.
При этом, одни препараты, в частности верапамил, действуют преимущественно на сердце, а другие, в частности нифедипин ,- на артериальные сосуды.
На волокна Пуркинье верапамил оказывает незначительное влияние, несколько снижая их автоматизм.
Применение:
— наджелудочковые тахиаритмии и экстрасистолия.
Препарат назначают внутрь и внутривенно.
Побочные эффекты:
— ослабление и урежение сокращений
— затруднение атриовентрикулярной проводимости
— артериальная гипотензия
Лекция 1. Антибиотики аминогликозиды : Farmf
Антибиотики аминогликозиды.
Группа аминогликозидов объединяет родственные по химическому строению и антимикробному спектру антибиотики олигосахаридной природы – стрептомицины, гентамицины, неомицины, канамицины, мономицины, тобрамицин и др., а также полусинтетический аминогликозид – амикацин.
Антибиотики аминогликозиды получили свое название в связи с наличием в молекуле аминосахаридов, соединенных гликозидной связью с агликоновым фрагментом. По механизму действия аминогликозиды являются ингибиторами синтеза белка. Аминогликозиды характеризуются широким спектром антимикробного действия.
Первый антибиотик этой группы – стрептомицин – был открыт С.Ваксманом (США) в 1942 г.; применяется в медицинской практике с 1946 г.
В 1955 г. японскими учеными был выделен канамицин. Мономицин выделен в нашей стране Г.Ф.Гаузе в 1962 г. Гентамицин выделен и описан в США в 1962 г.; в нашей стране в медицинской практике применяется с 1976 г.
Аминогликозиды получают методом микробиологического синтеза. Продуцентом стрептомицина является Streptomyces globisporus streptomycini; канамицина — Streptomyces kanamyceticus; гентамицина — Microspora purpurea. Амикацин получают полусинтетическим способом.
Многие аминогликозиды обладают ото- и нефротоксичностью.
По химическому строению антибиотики-аминогликозиды являются гликозидами, состоящими из агликона и сахаров, боль-шинство из которых является аминосахарами.
Агликон аминогликозидов представляет собой циклогексановое кольцо с основными группами при С1 и С3 и гидроксильными группами при С4, С5 и С6
По характеру агликона аминогликозиды делят на 2 группы: стрептидинсодержащие и дезоксистрептаминосодержащие. К 1-й группе относятся стрептомицин, дигидрострептомицин, агликоном у которых является стрептидин; ко 2-й группе — канамицины, гентамицины, неомицины, мономицины, амикацин; агликоном у них является 2-дезоксистрептамин, который отличается от стрептиди-на наличием аминогрупп вместо остатков гуанидина и отсутствием оксигруппы при С2.
Аминогликозиды применяются в медицинской практике в виде солей — сульфатов.
Несколько особняком в этой группе стоит стрептомицин, так как по сути он является антибиотиком-гликозидом т.к. сахарные фрагменты не содержат аминогрупп.
Стрептомицина сульфат-Streptomycini sulfas
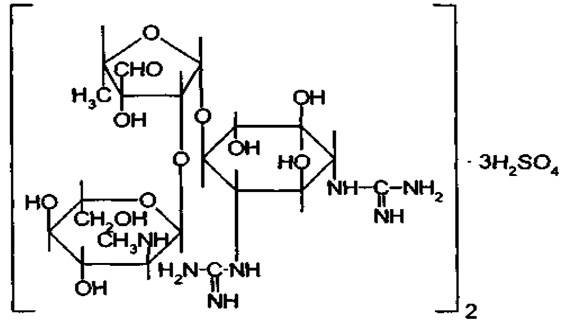
Химическое нзвание. Streptomycin sulphate – bis[N,N ‘-bis (aminoiminomethyl) -4-O-[5-deoxy-2-O-[2-deoxy-2-(methylamino)-α-L-glucopyranosyl]-3-C-formyl-α-L-lyxofuranosyl]-D-streptamine] trisulphate.
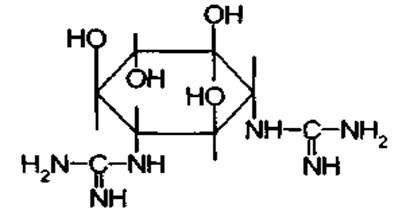
Агликон стрептомицина- стрептидин представляет собой 1.3-дигуанидино-2,4,5,6-тетраоксициклогексан или спирт инозит, в котором две оксигруппы заменены остатками гуанидина:
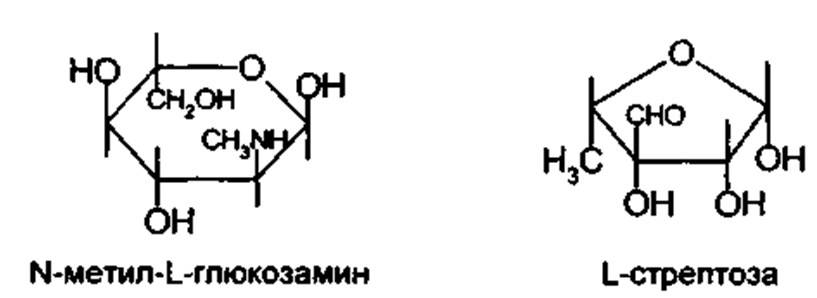
Сахарная часть стрептомицина представляет дисахарид стрептобиозамин, построенный из связанных между собой остатков N-метил-L-глюкозамина и L-стрептозы:
Свойства. Порошок белого или почти белого цвета, без запаха. Легко растворим в воде, практически нерастворим в этиловом или метиловом спирте. Гигроскопичен. Оптическое вращение от –78 до -83° (35 водный раствор).
Получение. Промышленными продуцентами стрептомицина служат штаммы актиномицетов Actinomyces streptomycini, Streptomyces griseus и др. Процессы ферментации осуществляют из наиболее активных штаммов, оптимизированных сред и других условий, обеспечивающих максимальный выход антибиотика. Затем из культуральной жидкости сорбируют стрептомицин, многократно пропуская через катиониты и затем очищают оксидом алюминия.
Химические свойства. Стрептомицин проявляет основные свойства ввиду наличия в молекуле азотсодержащих (двух гуаниди-новых и одной N-метильной) групп. Поэтому он легко образует со-ли (сульфат, гидрохлорид) и комплексы с ионами некоторых двухзарядных металлов. Применяют в медицине стрептоми-цина сульфат.
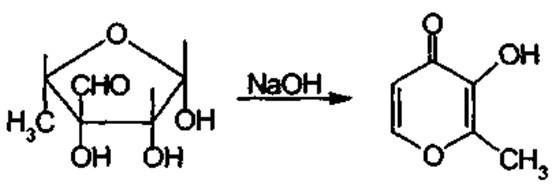
В слабокислой среде растворы стрептомицина устойчивы. Подобно другим гликозидам, он легко гидролизуется под действием сильных кислот с образованием стрептидина и стреп-тобиозамина. Стрептобиозамин затем распадается на N-метил-L-глюкозамин и L-стрептозу. Еще быстрее инактивируется стрепто-мицин в щелочной среде (на 50% в течение 3 ч под действием 0,1 М раствора гидроксида натрия). Однако при этом потеря активности обусловлена дегидратацией и изомеризацией L-стрептозы, которая превращается в мальтол (α-метил-β-окси-γ-пирон):
Подлинность. 1.ТСХ на силикагеле, содержащем поли-мер карбомер в сравнении с ГСО стрептомицина. Для сравне-ния используют растворы ГСО канамицина, ГСО неомицина.
2.Взаимодействие с хлоридом железа после щелочного гидролиза. В этом случае мальтол образуется значительно быстрее (в течение 4 мин), если стрептомицин нагревать с 0,5 М раствором гидроксида натрия на кипящей водяной бане. При взаимодействии с ионами железа (II!) в кислой среде мальтол превращается в соединение, имеющее фиолетовую окраску. Эту цветную реакцию используют для испытания подлинности стрептомицина. Она может быть применена и для его фотометрического определения. Мальтольная проба обусловлена наличием альдегидной группы в молекуле стрептомицина. Тест используется в Британской фармакопее (В).
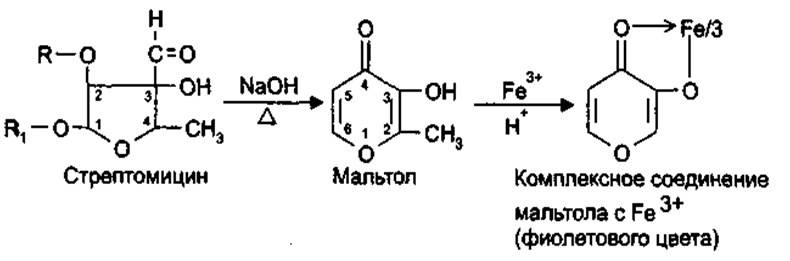
3.Гуанидиновый фрагмент идентифицируется по реакции с альфа-нафтолом в присутствии гипобромида (или гипохлорита) натрия. В этом случае происходит окислительное бромирование (или хлорирование) и образуется соединение хиноидного типа, окрашенное в красно-фиолетовый цвет:
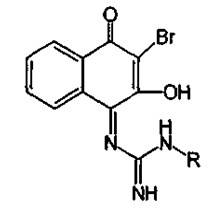
4. При кислотном гидролизе стрептомицина образуются агликон стрептидин и сахарная часть в виде биозы – стрептобиозамина:
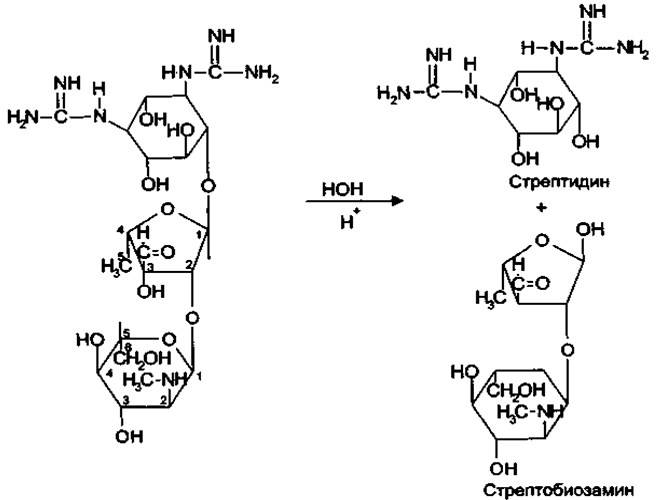
Альдегидная группа проявляет восстановительные свойства, обуславливая тем самым взаимодействие с реактивом Несслера с образованием металлической ртути (бурый осадок) и реактивом Фелинга, с образованием красного осадка оксида меди (1).
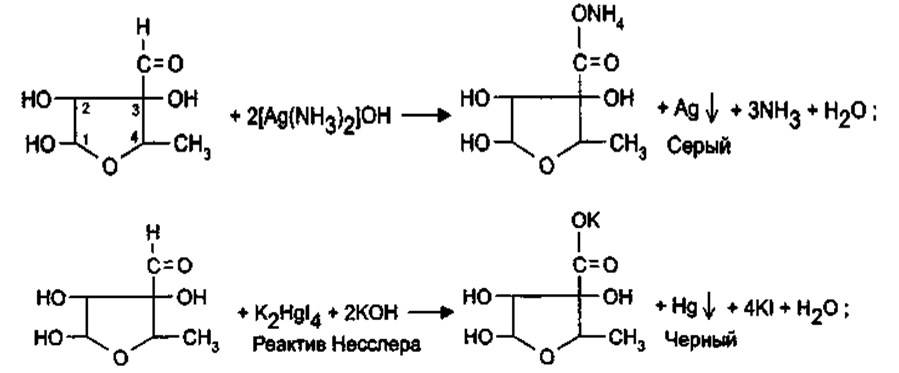
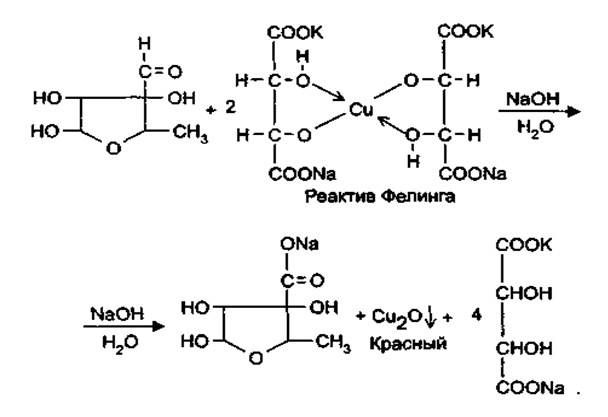
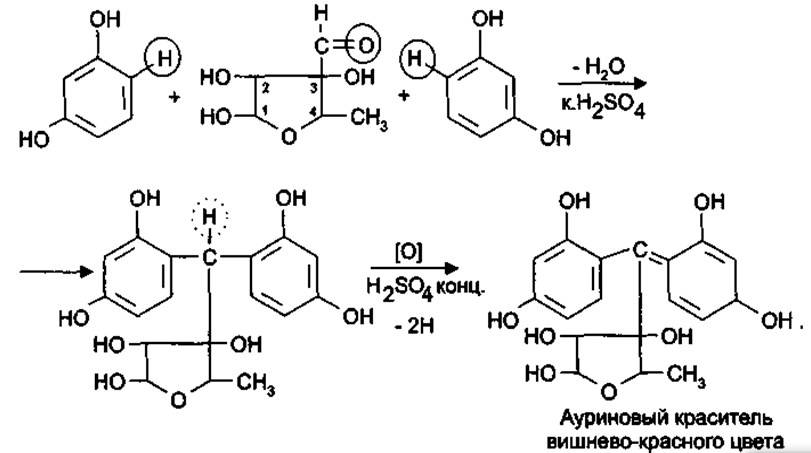
5.При конденсации альдегидной группы с фенолами, после нагревания стрептомицина с минеральной кислотой с резорцином образуется вишнево-красное окрашивание, с альфа-нафтолом (Британская фармакопея) – желтое окрашивание.
6.Гуанидиновый фрагмент может быть обнаружен также при щелочном гидролизе. Стрептидин представляет собой двухосновное соединение; при действии щелочью он превращается сначала в производное мочевины, а затем — в стрептамин:
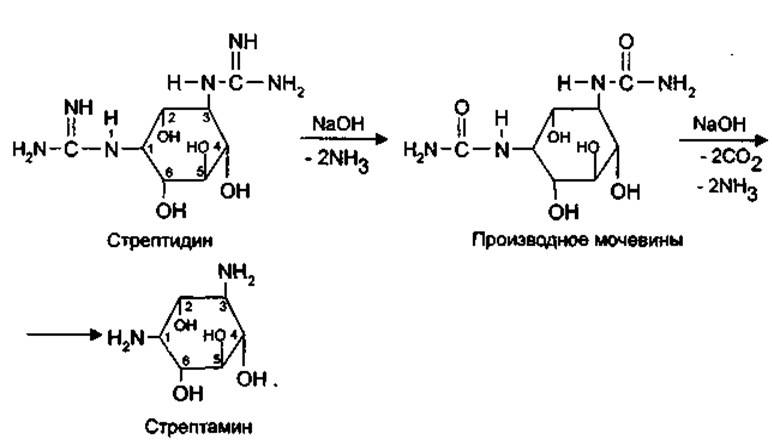
При нагревании со щелочью выделяется аммиак.
7.Реакция по сульфат-иону.
8.По реакции образования пикрата стрептидина с т.пл. 283-284°C.
9.Для установления подлинности стандартного образца стрептомицина, используемого для биологического теста и ТСХ используют ЯМР спектроскопию.
Примеси НД не нормируются.
Количественное определение. 1.Фотоколориметрический метод с хлорным железом по мальтолу. Сравнивают оптическую плотность стандартного образца и высушенной субстанции.
2.Биологический метод определение активности методом диффузии в агар. Он должен быть не менее 730 МЕ/мг в пересчете на сухое вещество. 1 мкг химически чистого стрептомицина дол-жен соответствовать 1МЕ.
3.Трилонометрическим методом определяют количество сульфатов по связанному объему бария хлорида. Индикатор металлофталеин.
Применение. Антибиотик широкого спектра действия. Применяют, главным образом для лечения туберкулеза, редко бруцеллеза, чумы, сапа, мелиоидоза и др. Ототоксичен и нефротоксичен.
Форма выпуска. Стерильная рассыпка во флаконах по 250000, 500000, 1000000 МЕ для приготовления раствора для парентерального введения.
Хранение. В сухом помещении при температуре не выше 25°C.
Дигидрострептомицин, который вместо альдегидной группы в остатке L-стрептозы содержит оксиметильную группу, не образует мальтола, что отличает его от стрептомицина.
Антибиотики-аминогликозиды.
Канамицина сульфат – kanamycini monosulfas
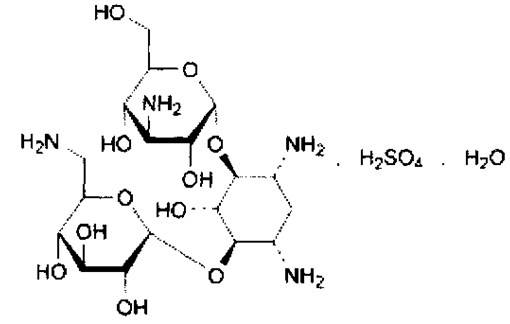
Группа антибиотиков – канамицинов, продуцируемых лучистым грибом – Streptomyces kanamiceticus, включает три близких по структуре препарата: Канамицин А, канамицин В, канамицин С. Наименьшую токсичность проявляет канамицин А, его содержание составляет 94%. В его структуру входит агликон мезо-1.3-диамино-4.5.6 триоксициклогексан и два остатка сахаров: 6-амино-6-дезокси-D-глюкоза и 3-амино-3-дезокси- D-глюкоза.
Название. Kanamycin monosulphate это 6-O-(3-amino-3-deoxy-α-D-glucopyranosyl) -4-O-(6-amino-6-deoxy-α-D-glucopyranosyl)-2-deoxy-D-streptamine sulphate.
Свойства. Белый кристаллический порошок без запаха и вкуса. Устойчив к воздействию воздуха. Легко растворим в воде. Показатель оптического вращения плоскости поляризованного света от +112 до +123 (1% раствор в воде, не содержащей СО2).
Получение. Биосинтез. Химочистка включает выделение антибиотика из культуральной жидкости с помощью ионообмен-ных смол, десорбцию, очистку углем и переосаждение метанолом из водного раствора.
Подлинность. 1.ТСХ в сравнении со стандартным образцом канамицина А.
2.рН раствора от 6.5 до 8,5.
3. Канамицина моносульфат как гликозид способен гидролизо-ваться в кислой среде; при кипячении с кислотами он подвергается гидролитическому расщеплению с полной потерей активности. В отличие от стрептомицина, канамицин устойчив в растворах щелочей. После кислотного гидролиза канамицин дает реакции на сахара (с реактивами Фелинга, Несслера, аммиачным раствором серебра нитрата).
4. При взаимодействии сахарных компонентов канамицина (например, 6-глюкозамина) с концентрированной соляной кислотой образуется 5-аминофурфурол, который можно обнаружить с орцином в присутствии железа (III) хлорида. Предполагают, что реакция протекает следующим образом:
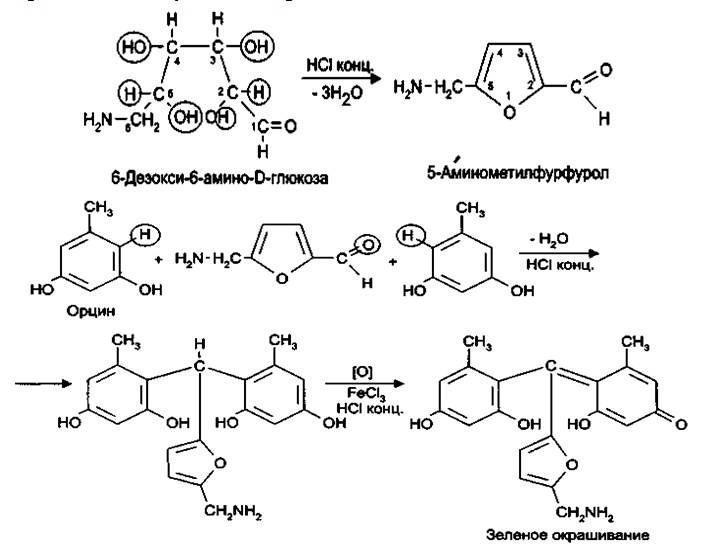
5.Испытания на токсичность. Данное испытание обусловлено высокой токсичностью примеси – канамицина В.
Примеси. Регламентируемыми примесями являются изомеры канамицина: канамицин В (не выше 5%) и канамицин С. Определяют ТСХ в сравнении со стандартными образцами. Количественно определяют примеси по интенсивности пятна в сравнении со стандартом.
Количественное определение. 1.Микробиологический метод диффузии в агар.
2.Поляриметрический метод. Метод находит применение в процессе получения антибиотика, в том числе и в культуральной жидкости.
3.Фотоколориметрический по образованию окрашенного продукта с орцином или нафтолом.
Применение. Антибиотик широкого спектра действия. Применяется главным образом для лечения туберкулеза. Ототоксичен, действует на глазной нерв.
Форма выпуска. В форме моносульфата канамицин выпускается в виде таблеток 0,25 г. канамицин дисульфат порошок 0,5 и 1,0 г для приготовления раствора для парентерального введения или внутривенного капельного введения.
Хранение. Список Б.
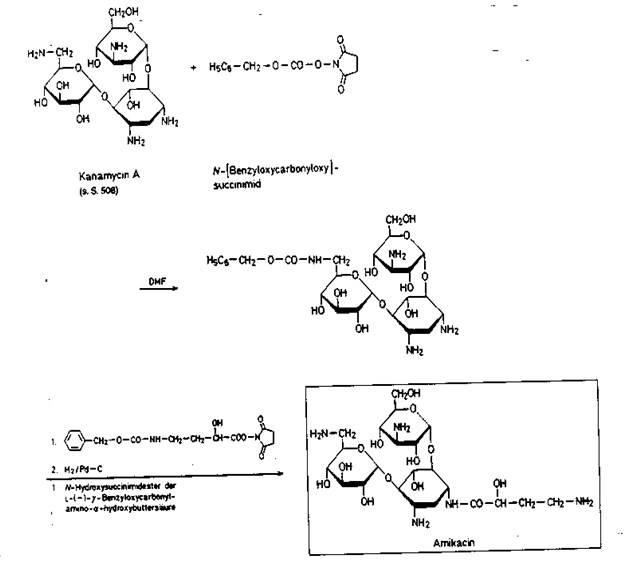
Амикацина сульфат – Amicacini sulfas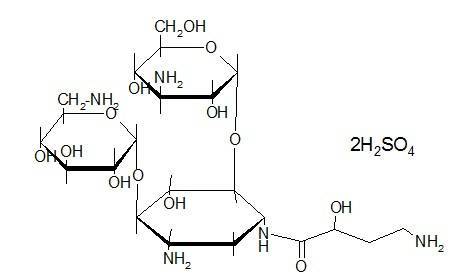
Свойства. Аморфный порошок белого или белого с желто-ватым оттенком цвета. Легко растворим в воде. Гигроскопичен. Удельное вращение от + 76 до +84° (5% водный раствор).
Получение. Полусинтетический аминогликозидный анти-биотик. Получают из канамицина А. Первоначально защищают аминогруппу в положении 6 аминогликозидного фрагмента и затем вводят ацильный остаток в аминогруппу агликонового фрагмента. Восстановлением снимают защиту и получают амикацин.
Подлинность. 1.ИК спектроскопия в сравнении со стандартным образцом.
2.ТСХ в сравнении со стандартными образцами амикацина и канамицина.
3.ВЭЖХ.
Химические методы. 4.Амикацин, как гликозид подвергает-ся гидролитическому расщеплению с полной потерей активности. После кислотного гидролиза амикацин дает реакции на сахара ( с реактивами Фелинга, Несслера, аммиачным раствором серебра и др.).
5.При нагревании с концентрированными минеральными кислотами амикацин образует 5-аминометилфурфурол, который определяют по цветной реакции с антроном:
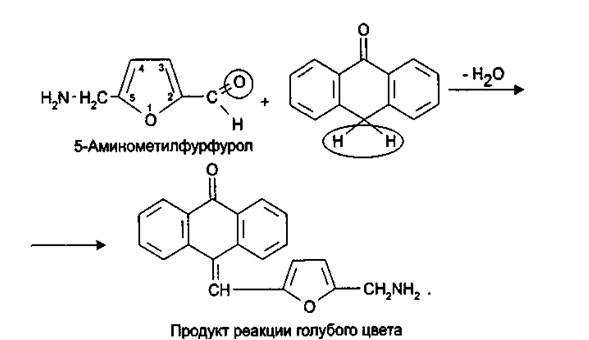
6.В отличие от канамицина, амикацин за счет амидной груп-пы образует окрашенные комплексы с солями тяжелый металлов. Для идентификации амикацина применяется реакция с кобальта нитратом после нейтрализации раствором натрия гидроксида (фио-летовое окрашивание).
Примеси. Нормируются 4 различных производных по аминогруппам агликона. Все они хорошо проявляются на ВЭЖХ при наличии стандартных образцов. Типичная хроматограмма приведена на рисунке (из ВР):
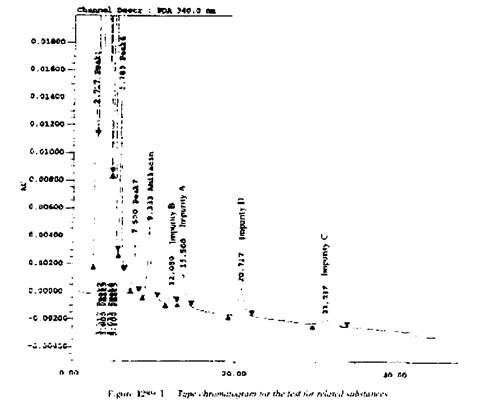
Общая формула для примесей приведена ниже. Все они являются побочными продуктами синтеза амикацина:
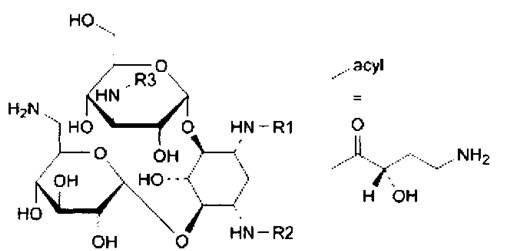
A. R1 = R3 = Н, R2 = acyl: 4-O-(3-amino-3-deoxy-α-D-glucopyra-nosyl)-6-O-(6-amino-6-deoxy-α-D-glucopyranosyl)-1-N-[(2S)-4-amino-2-hydroxybutanoyl]-2-deoxy-L-streptamine,
B. R1 = R2 = acyl, R3 = H: 4-O-(3-amino-3-deoxy-α-D-glucopyra-nosyl)-6-0-(6-amino-6-deoxy-α-D-glucopyranosyl)-1,3-N-bis[(2S)-4-amino-2-hydroxybutanoyl]-2-deoxy-L-streptamine,
C. R1 = R2 = H, R3 = acyl: 4-0-(6-amino-6-deoxy-α-D-glucopyra-nosyl)-6-O-[3-[[(2S)-4-amino-2-hydroxybutanoyl]amino]-3-deoxy-α-D-glucopyranosyl]-2-deoxy-D-streptamine,
D. R1 = R2 = R3 = H: kanamycin.
Количественное определение. 1. ВЭЖХ. 2.Биологитческий тест методом диффузии в агар.
Применение. Антибиотик широкого спектра действия. Тяжелые инфекции, вызванные как грамположительными , так и грамотрицательными микроорганизмами: остеомиелдит, менингит, сепсис, реже некоторые формы туберкулеза, активен в отношении псевдомонад.
Форма выпуска. Раствор для инъекций 100 мг в 2 мл и 500 мг в 2 мл.
Хранение. Список Б.
Генатмицина сульфат – Gentamycini sulfas
Комплекс антибиотиков, продуцируемых Micromonospora purpurea n. sp., – Гентамицин С1, Гентамицин С2, Гентамицин С1А, Гентамици С2а и Гентамицин С2b (в виде сульфата):
Свойства. Белый порошок или пористая масса с кремоватым оттенком. Легко растворим в воде. Гигроскопичен. Удельное вращение от + 107 до + 121°.
Получение. Получают микробиологическим путем. Очистка через ионообменные смолы.
Подлинность. 1.ТСХ в сравнении со стандартным образцом. 2.ВЭЖХ
Примеси. ВЭЖХ нормируются в качестве примесей сизомицин, гарамин, гентамицин В1 и еще два продукта деструкции препарата.
Количественное определение. 1. ВЭЖХ.
2.Микробиологический метод диффузии в агар.
Применение. Антибиотик широкого спектра действия. Ототоксичен, нефротоксичен.
Форма выпуска. Раствор для инъекций 20 мг/ 2 мл; 40 мг/2 мл; 80 мг/2 мл; 120 мг/мл. Раствор для инъекций 0,3%; мазь для 0,1%.
Хранение. Список Б.
Тобрамицин
Свойства. Белый или почти белый кристаллический поро-шок. Легко растворим в воде, очень мало в спирте. РН от 9,0 до 11,0. Оптическое вращение от +138 до +148° 4% раствор в воде.
Получение. Биосинтез. Продуцент Streptomyces tenebrarius. Химочистка – ионообменные смолы.
Подлинность. 1. ЯМР в тяжелой воде. 2.ТСХ. 3.С нингидрином на водяной бане дает фиолетово-голубюое окрашивание.
Примеси. ВЭЖХ. Нормируются 3 примеси, в т.ч. канамицин В.
Количественное определение. 1. ВЭЖХ.
Применение. Высокоэффективный антибиотик резерва.
Форма выпуска. Раствор для инъекций 20мг/2 мл; 40 мг/2 мл; 80 мг/2 мл.
Хранение. Список Б.
Ансамицины. Ансамицины – группа антибиотиков, образу-емых лучистым грибком Streptomyces mediterranei. Получают обычно с частичным изменением структуры синтезом как рифам-пицин, так и полусинтетический антибиотик рифабутин.
Рифампицин-Rifampicin
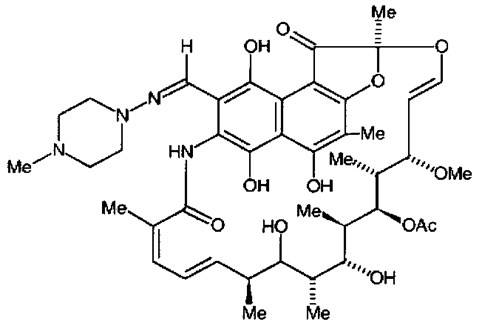
Название. Rifampicin is (2S,12Z,14E,16S,17S,18R,19R,20R, 21S,22R,23S,24Е)-5,6,9,17, 19-pentahydroxy-23-methoxy-2,4,12,16, 18,20,22-heptamethyl-8-[[(4-methylpiperazin-1 -yl) imino]methyl]-1,11 -dioxo-1,2-dihydro-2,7-(epoxypentadeca[1,11,13]trienimino)naphtho[2,1 –b] furan-21-yl acetate.
Свойства. Красно-коричневый или коричнево-красный крис-таллический порошок, мало растворим в воде, растворим в метаноле, мало растворим в ацетоне и спирте этиловом.
Получение. Полусинтетический антибиотик. Получают из природного кето-производного взаимодействием с 1-амино-4-метилпиперазином.
Подлинность. 1. ИК спектр. См. рисунок.
2.УФ спектрофотометрия. Раствор в метаноле дает 4 максиму-ма при 237 нм, 254 нм, 334 нм и 475 нм.
3.ТСХ и ВЭЖХ.
4.При перемешивании раствора рифампицина с персульфатом аамония происходит изменение окраски с оранжево-красной до красно-фиолетовой.
Примеси. Нормируется две основные примеси: рифампицина хинон (примесь А) и рифампицина N-оксид. Метод определения ВЭЖХ.
Количественное определение. 1.УФ спектрофотолметрия.
2.ВЭЖХ.
Применение. Антибиотик широкого спектра действия. Преимущественно используют для лечения туберкулеза. Активен в отношении грамотрицательных микроорганизмов, малочувстви-тельных к другим антибиотикам.
Форма выпуска. Капсулы по 150 и 300 мг. Оральная суспензия.
Хранение. Список Б.
Рифабутин

Свойства. Красно-фиолетовый аморфный порошок. Мало растворим в воде, растворим в метаноле, мало растворим в этаноле.
Получение. Полусинтетический антибиотик.
Подлинность. 1. ИК спектр.
2.ТСХ.
3. ВЭЖХ.
Химические методы не описаны.
Примеси. Контролируются ВЭЖХ 4 примеси.
Количественное определение. 1. УФ спектрофотометрия.
2.ВЭЖХ.
Применение. Антибиотик широкого спектра действия. В основном используется в лечении туберкулеза.
Форма выпуска. Капсулы по 150 мг.
Хранение. Список Б.
Гликопептидные антибиотики. Эта группа немногочислен-ных антибиотиков нового поколения – высокомолекулярные углеводсодержащие вещества.
Ванкомицин

Свойства. Белый или почти белый кристаллический поро-шок. Гигроскопичен. Легко расвторим в воде, мало – в этаноле.
Получение. Биосинтез. Продуцент Amycolatopsis orietalis.
Подлинность. 1.УФ спектрофотометрия. 2.ВЭЖХ.
Примеси. Нормируются 3 примеси. Метод ВЭЖХ.
Количественное определение. 1. Метод диффузии в агар.
Применение. Лечение тяжелых инфекций различной этиологии.
Форма выпуска. Порошок для инъекций 0.5 г и 1,0 г.
Антибиотики макролиды и азалиды.
Основу антибиотиков макролидов составляет макроциклическое лактонное кольцо с 12-17 атомами углерода в цикле. Из этой группы антибиотиков в медицинской практике применяют эритромицин, азитромицин, олеандомицин, кларитромицин, рокситромицин, спирамицин и некоторые другие.
Особенностью строения эритромицина и азитромицина является наличие в цикле агликона Эритронолида, к которому присоединены аминосахар и нейтральнгый сахар.
Эритромицин-Erythromycin
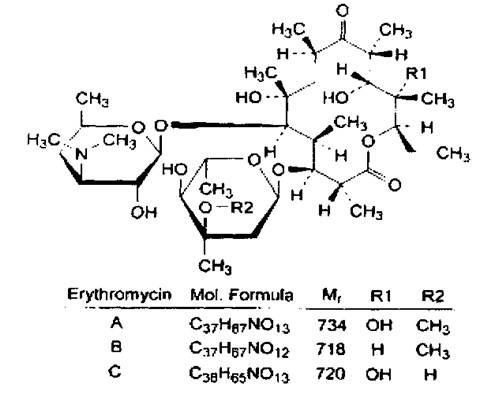
Название. Смесь макролидных антибиотиков, преимущес-твенно содержится эритромицин А – (3R,4S,5S,6R,7R,QR, 11R, 12R, 13S, 14R)-4-[(2,6-dideoxy-3-C-methyl-3-O-methyl-α-l-ribo-hexopy-ranosyl)oxy]-14-ethyl-7,12,13-trihydroxy-3,5, 7,9,11,13-hexamethyl-6-[(3,4,6-trideoxy-3-dimethylamino-β-d-xylo-hexopyranosyl)-oxy] oxacyclotetradecane-2,10-dione (erythromycin A).
Химический состав эритромицинов.
| Антибиотики | Агликон | Сахарная часть | |
| Аминосахар | Нейтральный сахар | ||
| Эритромицин А | Эритронолид А | Дезозамин | Кладиноза |
| Эритромицин В | Эритронолид В | Дезозамин | Кладиноза |
| Эритромицин С | Эритронолид С | Дезозамин | Микароза |
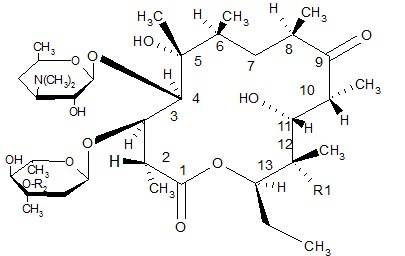
Эритронолид по химическому строению представляет собой циклическую систему, состоящую из 13 углеродных атомов и включающие лактонные кольца:
Аминосахара в эритромицинах одинаковые – дезозамин:
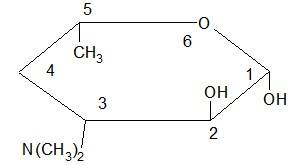
ДЕЗОЗАМИН
Нейтральные сахара – кладиноза и микароза:

кладиноза микароза
Свойства. Кристаллы или порошок белого или белого с желтоватым оттенком цвета. Гигроскопичен. Содержание эритромицина В не более 5% и эритромицина С – не более 5%. Удельное вращение от –71 до -78° (2% раствор в этаноле ВР). Мало растворим в воде, растворимость уменьшается с увеличением температуры. Легко растворим в этаноле, растворим в метаноле.
Получение. Биосинтез. Продуцент Streptomyces erythreus. Химочистка включает экстракцию из культуральной жидкости с последующей очисткой.
Подлинность. 1. ИК спектр (см. рисунок) в сравнении со стандартным образцом эритромицина..
2.ТСХ
3.ВЭЖХ.
Химические реакции. 4.При нагревании на водяной бане с ксангидролом появляется красное окрашивание.
5.При растворении в ацетоне и концентрированной соляной кислоте раствор приобретает оранжевое окрашивание, переходящее в красное.
Примеси. Нормируется содержание основных примесей – эритромицина В и эритромицина С ( не более 5% каждой). Кроме того определяют ВЭЖХ минорные притмеси: эритромицин F, эритромицин Е, ангидроэритромицин А, и др. всего 6 примесей.
Количественное определение. 1. Диффузией в агар на культуре Bacillus cereus.
2.ВЭЖХ.
Применение. Антибиотик широкого спектра действия.
Форма выпуска. Капсулы и таблетки, в т.ч. покрытые кишенчнорастворимой оболочкой по 0,25 г. Эритромицин фосфат используется для внутривенного введения.
Хранение. Список б в защищенном от света месте.
Азитромицин – Azithromycin
Аглюкон азитромицина отличается наличием N-метильной группы в положении 10 лактонного макроцикла.
Свойства. Белый или почти белый кристаллический поро-шок. Практически нерастворим в воде, легко растворим в этаноле и метиленхлориде. Оптическое вращение от –45 до -49° (1% раствор в этаноле).
Получение. Полусинтетический антибиотик. Синтез описан в патентной литературе.
Подлинность. 1. ИК спектр в сравнении со стандартным образцом.
2.ТСХ и ВЭЖХ.
Примеси. Нормируется более 10 различных примесей.
Количественное определение. 1. ВЭЖХ.
2.Биологический метод диффузии в агар.
Применение. Высокоэффективный антибиотик широкого спектра действия. Эффективен при урогенитальных инфекциях.
Форма выпуска. Таблетки и капсулы 125 мг, 500 мг, 250 мг. Порошок для приготовления оральных суспензий по 100 мг и 200 мг.
Хранение. Список Б.
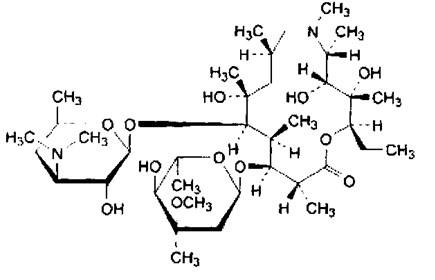
Олеандомицин-
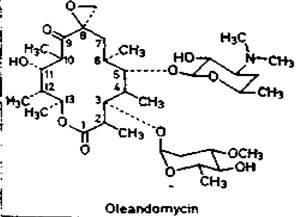
Свойства. Белый или желтоватый кристаллический порошок.
Получение. Биосинтез. Продуцент Streptomyces antibioticus.
Подлинность. ИК спектр и хроматография.
Количественное определение. Метод диффузии в агар.
Форма выпуска. Таблетки, в т.ч. композитные – олететрин.
Аминогликозиды — это… Что такое Аминогликозиды?
ряд природных и полусинтетических антибиотиков (аминоциклитолов) широкого спектра действия с близкой химической структурой, фармакокинетикой и характером побочных явлений.
Наряду с так называемыми классическими, или старыми, аминогликозидами (стрептомицином, неомицином, мономицином, канамицином) к группе А. относят новые препараты (гентамицин, сизомицин, тобрамицин, нетилмицин, амикацин), обладающие существенными преимуществами при клиническом применении.
Стрептомицин активен против микобактерий туберкулеза и многих других возбудителей. Однако ввиду быстрого развития устойчивости, высокой ототоксичности и создания более эффективных препаратов этой группы применение стрептомицина ограничивается и его используют главным образом в комбинированной терапии туберкулеза. В сочетании с пенициллином стрептомицин применяют также при септическом эндокардите, вызванном зеленящим стрептококком, энтерококком. При бруцеллезе, чуме, туляремии, мелиоидозе стрептомицин можно назначать в комбинации с тетрациклинами.
Противопоказаниями к назначению стрептомицина являются аллергия, поражения VIII пары черепных нервов, тяжелые нарушения выделительной функции почек, беременность; стрептомицин не применяют у новорожденных и детей раннего возраста. Дигидрострептомицин не применяют, он более токсичен, чем стрептомицин. Пантотенат стрептомицина, предложенный в качестве менее токсичного производного, по современным представлениям, не отличается от стрептомицина. Неомицин эффективен главным образом при инфекциях, вызванных грамотрицательными возбудителями, а также стафилококками, мало эффективен против синегнойных палочек, стрептококков, энтерококков. Антибиотик применяют лишь внутрь и местно (мази, присыпки, аэрозоли, в комбинации с другими препаратами — бацитрацином, полимиксином и кортикостероидами). Мономицин (паромомицин) по спектру антимикробного действия близок к неомицину и канамицину. В связи с отсутствием преимуществ применение мономицина ограничено лишь одним показанием: лечение кожного лейшманиоза, при котором препарат дает некоторый эффект (внутримышечно по 0,25 г 3 раза в сутки). Мономицин можно применять внутрь в качестве кишечного антисептика (по 0,25 г 4—6 раз в сутки, детям по 10—25 мг/кг в сутки). Канамицин широко применяли как препарат, обладающий существенными преимуществами перед стрептомицином и другими классическими А. Широкий спектр действия канамицина охватывает большое число бактерий, включая протеи, клебсиеллы и другие энтеробактерии, а также стафилококки. Подобно стрептомицину канамицин отличается от других А. активностью против микобактерий туберкулеза, однако он не активен при синегнойной инфекции. Канамицин используют в комбинированной химиотерапии туберкулеза. В качестве кишечного антисептика используют канамицина моносульфат, который назначают внутрь (в таблетках). Гентамицин — наиболее широко применяемый из современных А., обладающий широким спектром антимикробного действия; к нему высокочувствительны кишечные палочки, клебсиеллы, гемофильные палочки, индол-положительные протеи, синегнойные палочки, шигеллы, серрации, грамположительные кокки, в т. ч. стафилококки. Относительно устойчивы к гентамицину энтерококки, менингококки и клостридии.Гентамицин практически не всасывается при введении внутрь, слабо проникает через клеточные мембраны, не проникает внутрь клеток. В небольшой степени гентамицин связывается с белками сыворотки крови. Он почти полностью выделяется почками в неизмененном виде.
Основными показаниями к применению гентамицина служат тяжелые септические процессы, инфекции почек и мочевых путей, вызванные чувствительными к нему штаммами. Возможно сочетанное применение гентамицина с синергидно действующими полусинтетическими пенициллинами широкого спектра (ампициллином, карбенициллином, азлоциллином) или цефалоспоринами.
На основе гентамицина выпускают различные лекарственные формы для местного применения (мази, аэрозоли, инстилляции и др.), высокоэффективные при тяжелых инфекциях кожи и мягких тканей и ожогах, в т.ч. и при синегнойной инфекции. Основным методом использования гентамицина является внутримышечное введение в виде гентамицина сульфата в средних суточных дозах для взрослых 2—3 мг/кг. Обычно суточную дозу делят на 3 введения. Курс лечения не должен превышать 7—10 дней, повторные курсы возможны также через 7—10 дней.Сизомицин — природный антибиотик из группы гентамицина, по спектру действия близкий к гентаминину и тобрамицину. Сизомицин превосходит гентамицин в отношении антимикробного действия на протеи, серрации, клебсиеллы, энтеробактеры, псевдомонады, активен против стафилококков. Сизомицин обладает устойчивостью к большинству ферментов, образуемых гентамицинрезистентными микроорганизмами поэтому он эффективен при вызванных ими инфекциях. В сочетании с полусинтетическими пенициллинами широкого спектра и цефалоспоринами антимикробный эффект сизомицина усиливается.
Сизомицин назначают при лечении сепсиса, септического эндокардита, перитонита, инфекций мочевых и желчных путей, органов дыхания, кожи и мягких тканей, инфицированных ожогов. Сизомицин в меньшей степени, чем другие А., влияет на иммунную систему, что является основаниям для преимущественного его применения (в сравнении с другими А.) в педиатрии, в т.ч. новорожденных.
Сизомицин применяют внутримышечно или внутривенно в виде сизомицина сульфата. При инфекциях почек и мочевых путей разовая доза сизомицина составляет 1 мг/кг, суточная — 2 мг/кг. В отличие от других А. сизомицин можно вводить не 3, а 2 раза в сутки. При сепсисе, перитоните, деструктивной пневмонии суточную дозу увеличивают до 3 мг/кг. При угрожающих жизни состояниях в первые 2—3 дня суточная доза может быть увеличена до максимальной — 4 мг/кг с последующим уменьшением до 3 мг/кг. Тобрамицин — природный аминогликозид, выделенный из так называемого небрамицинового комплекса. По спектру антимикробного действия он близок к гентамицину, однако более активен против синегнойных палочек. Показания к применению в целом те же, что при назначении гентамицина и сизомицина, дозы и интервалы между введениями также соответствуют принятым для гентамицина.Нетилмицин — полусинтетическое производное сизомицина. По спектру действия близок к гентамицину, но активен в отношении некоторых гентамицинрезистентных возбудителей. При этом некоторые штаммы остаются устойчивыми к нетилмицину, они чувствительны лишь к амикацину. Нетилмицин, как и гентамицин, активен в отношении большинства грамотрицательных бактерий.
Наиболее важным свойством нетилмицина является активность при инфекциях, вызванных энтеробактериями (протеи, энтеробактеры, клебсиеллы) и синегнойными палочками, в т.ч. устойчивыми к гентамицину и тобрамицину. Нетилмицин высокоэффективен при лечении перитонита, инфекций почек, мочевых и желчных путей, легких и плевры. Устойчивые к гентамицину протеи, морганеллы и провиденции обычно устойчивы и к нетилмицину. К нетилмицину чувствительны множественно-устойчивые стафилококки. При сочетании нетилмицина с пенициллинами и цефалоспоринами наблюдается усиление антимикробного эффекта. Вводят нетилмицин внутримышечно или внутривенно. Как и другие А., нетилмицин выделяется почками в неизмененном виде. Он плохо связывается с белками сыворотки крови, проникает в ткани и жидкости, кроме цереброспинальной жидкости. Амикацин — полусинтетическое производное канамицина. Молекула амикацина в отличие от других А. наиболее защищена от воздействия инактивирующих ферментов, образуемых устойчивыми к антибиотикам возбудителями. По спектру антимикробного действия амикацин шире гентамицина и тобрамицина: эффективен против большинства устойчивых к А. микроорганизмов. Спектр амикацина охватывает большое число условно-патогенных возбудителей (синегнойные и кишечные палочки, протеи, клебсиеллы, энтеробактеры, серрации, провиденции, гемофильные палочки), а также менингококков и гонококков Устойчивость к амикацину, даже на фоне широкого применения этого антибиотика, наблюдается крайне редко. Стафилококки, в т.ч. устойчивые к пенициллину и гентамицину, как правило, чувствительны к амикацину.Амикацин в сочетании с пенициллинами (карбенициллином, мезлоциллином, азлоциллином) и цефалоспоринами (цефотаксимом, цефалотином, цефазолином, цефтазидимом, моксалактамом, азтреонамом и др.) обладает синергидным действием. Имеются данные о синергидности амикацина и триметоприма в отношении клебсиелл, серрации, кишечных (но не синегнойных) палочек. Основными показаниями к введению амикацина являются тяжелые инфекции, вызванные устойчивыми к другим аминогликозидам возбудителями.
Амикацин почти полностью выделяется почками в неизмененном виде, слабо связывается с белками сыворотки крови, не проникает через гематоэнцефалический барьер. А. обладают ото- и нефротоксическим действием, более выраженным у неомицина, канамицина, стрептомицина и в меньшей степени — у амикацина, сизомицина и тобрамицина. Нецелесообразно комбинированное применение отдельных А. с потенциально ото- и нефротоксическими препаратами. Аминогликозиды усиливают действие курареподобных средств. Возможна перекрестная аллергия для препаратов данной группы.12. Клинико-фармакологическая характеристика антибиотиков группы аминогликозидов
Аминогликозиды – бактерицидные антибиотики широкого спектра действия,группа антибиотиков c общим в химическом строении наличием в молекуле аминосахара, соединенного гликозидной связью с аминоциклическим кольцом. Основное клиническое значение заключается в активности в отношении аэробных грамотрицательных бактерий (кишечной палочки, сальмонелл, шигелл, протея, клебсиелл, энтеробактеров, серраций) и стафилококков (в том числе
метициллинрезистентных). Они обладают более быстрым, чем бета-лактамы действием, очень редко вызывают аллергические реакции, но вместе с тем более токсичны. Анаэробная флора и большая часть грамположительной микрофлоры устойчивы к аминогликозидам.
Первым аминогликозидов был стрептомицин, выделенный в 1944 г. с актиномицеты Streptomyces griseus. В 1957 г. выделен канамицин. На заре эры антибиотикотерапии стрептомицин, вместе с пенициллином, применяли практически бесконтрольно, что способствовало нарастанию устойчивости возбудителей банальных инфекций к нему и появлению частичной перекрестной устойчивости к другим аминогликозидам.
Впоследствии стрептомицин из-за высокой ототоксичности и нефротоксичности, быстрого развития устойчивости к нему большинства возбудителей стали применять почти исключительно в составе комбинированных режимов специфической химиотерапии туберкулёза, а также некоторых редких, почти ликвидированных в настоящее время инфекций, таких, как чума, а основным применяемым аминогликозидом в остальных клинических ситуациях на долгое время стал канамицин.
Класифицируются аминогликозиды по поколениям (табл. 1).
Таблиця 1
I поколение | II поколение | III поколение |
Стрептомицин | Гентамицин | Амикацин |
Неомицин | Тобрамицин | |
Сизомицин | ||
Фрамицетин | ||
Канамицин | Нетилмицин |
Фармакокинетика
При приеме внутрь аминогликозиды практически не всасываются в желудочно-кишечном тракте (ЖКТ), поэтому применяются парентерально (кроме неомицина) – внутримышечно, внутривенно, интраперитонеально и интраплеврально. У новорожденных в связи с повышенной проницаемостью слизистых оболочек могут всасываться в ЖКТ. По сравнению с бета-лактамами и фторхинолонами хуже проходят через тканевые барьеры (гематоэнцефалический и т. д.), проходят через плаценту.
Аминогликозиды распределяются во внеклеточной жидкости, включая сыворотку крови, экссудат абсцессов, асцитическую, перикардиальную, плевральную, синовиальную, лимфатическую и перитонеальную жидкости, создают более низкие концентрации в бронхиальном секрете, желчи, грудном молоке. Высокие уровни наблюдаются в органах с хорошим кровоснабжением: печени, легких, почках (где они накапливаются в корковом веществе).
После введения всасываются быстро и полностью. Средняя терапевтическая концентрация сохраняется на протяжении 8 часов.
В печени не метаболизируются. Выводятся в неизмененном виде почками. При нормальной функции почек период полувыведения большинства аминогликозидов составляет около 2 ч. У новорожденных в связи с незрелостью почек Т1/2возрастает до 5–8 ч. В процессе выведения почками создаются очень высокие концентрации аминогликозидов в моче, в 5–10 раз превышающие концентрации в плазме крови и, как правило, многократно превышающие минимальные бактерицидные концентрации для большинства грамотрицательных возбудителей мочевых инфекций.
Благодаря этому аминогликозиды высокоактивны при инфекциях мочевых путей (пиелонефритах, циститах, уретритах). При почечной недостаточности период полувыведения значительно увеличивается и может произойти кумуляция (накопление) антибиотика.
Также достаточно высокие концентрации аминогликозидов создаются в эндолимфе внутреннего уха, чем объясняется их избирательное токсическое действие на почки и орган слуха. Вместе с тем именно это свойство делает аминогликозиды препаратами выбора при тяжелом остром бактериальном нефрите и остром лабиринтите (воспалении внутреннего уха).
Аминогликозиды могут всасываться при местном применении на ожоговых поверхностях, язвах или ранах (растворы или мази), при этом может проявиться системная токсичность (ото- или нефротоксичность).